Норэтистерон
 | |
 | |
| Клинические данные | |
|---|---|
| Торговые названия | Много |
| Другие имена | СЕТЬ; Норэтиндрон; НСК-9564; ЛГ-202; этинилнортестостерон; норпрегненинолон; Ангидрогидроксинорпрогестерон; этинилэстренолон; 17α-этинил-19-нортестостерон; 17α-этилестра-4-ен-17β-ол-3-он; 17α-Гидрокси-19-норпрегн-4-ен-20-ин-3-он |
| AHFS / Drugs.com | Монография |
| Медлайн Плюс | а604034 |
| Данные лицензии |
|
| Маршруты администрация | Внутрь , внутримышечные инъекции (как NETE ) |
| Класс препарата | Прогестаген (лекарство) ; Прогестин |
| код АТС | |
| Юридический статус | |
| Юридический статус | |
| Фармакокинетические данные | |
| Биодоступность | 47–73% (в среднем 64%) [2] [3] |
| Связывание с белками | 97%: [4] Альбумин : 61%; [4] SHBG : 36% [4] |
| Метаболизм | В основном CYP3A4 ( печень ); [5] также 5α- / 5β-редуктаза , 3α- / 3β-HSD и ароматаза |
| Период полувыведения | 5,2–12,8 часов (в среднем 8,0 часов) [2] |
| Идентификаторы | |
| Номер CAS | |
| ПабХим CID | |
| ИЮФАР/БПС | |
| Лекарственный Банк | |
| ХимическийПаук | |
| НЕКОТОРЫЙ | |
| КЕГГ | |
| ЧЭБИ | |
| ЧЕМБЛ | |
| Панель управления CompTox ( EPA ) | |
| Информационная карта ECHA | 100.000.619 |
| Химические и физические данные | |
| Формула | С 20 Н 26 О 2 |
| Молярная масса | 298.426 g·mol −1 |
| 3D model ( JSmol ) | |
| Температура плавления | От 203 до 204 ° C (от 397 до 399 ° F) |
| (проверять) | |
Норэтистерон , также известный как норэтиндрон и продаваемый под многими торговыми марками, представляет собой прогестиновый препарат, используемый в противозачаточных таблетках , менопаузальной гормональной терапии и для лечения гинекологических заболеваний . [4] [6] Лекарство доступно как в низких, так и в высоких дозах, как отдельно, так и в сочетании с эстрогеном . [6] [7] Его применяют внутрь или, как норэтистерона энантат , путем инъекции в мышцу . [4] [6] [8]
Побочные эффекты норэтистерона включают нарушения менструального цикла , головные боли , тошноту , болезненность молочных желез , изменения настроения , прыщи , усиленный рост волос . [9] [10] Норэтистерон представляет собой прогестин или синтетический прогестаген и, следовательно, является агонистом рецептора прогестерона , биологической мишени прогестагенов, таких как прогестерон . [4] [6] Он обладает слабой андрогенной и эстрогенной активностью, преимущественно в высоких дозах, и не имеет другой важной гормональной активности. [4] [11]
Норэтистерон был открыт в 1951 году и стал одним из первых разработанных прогестинов. [12] [13] [14] Впервые он был представлен для медицинского применения отдельно в 1957 году, а в 1963 году — в сочетании с эстрогеном для использования в качестве противозачаточных таблеток. [14] [15] Его иногда называют прогестином «первого поколения». [16] [17] Наряду с дезогестрелом , это один из немногих прогестинов, который широко доступен в виде «мини-таблеток», содержащих только прогестаген, для контроля над рождаемостью. [18] [19] Норэтистерон широко продается во всем мире. [20] Он доступен в виде непатентованного лекарства . [21] В 2021 году это было 140-е место среди наиболее часто назначаемых лекарств в США: на него было выписано более 4 миллионов рецептов. [22] [23] Он включен в Список основных лекарственных средств Всемирной организации здравоохранения . [24]
Медицинское использование
Норэтистерон используется в качестве гормонального контрацептива в сочетании с эстрогеном – обычно этинилэстрадиолом (EE) – в комбинированных пероральных контрацептивах и отдельно в таблетках, содержащих только прогестаген .
Другое медицинское применение норэтистерона – облегчение боли, связанной с эндометриозом . Фактически, 50% пациенток, получивших медикаментозное или хирургическое лечение боли в области таза, связанной с эндометриозом, получили пользу от терапии прогестином . Это может быть связано с тем, что норэтистерон индуцирует пролиферацию эндометрия во время секреторной фазы, что, как было показано, облегчает жалобы на боль в эндометрии. Другой способ, которым норэтистерон может уменьшать боль в эндометрии, — это подавление овуляции . Боль и дискомфорт при эндометриозе усиливаются во время овуляции. [25]
| Состав | Доза | Названия брендов | Использовать |
|---|---|---|---|
| только NET | Низкая (например, 0,35 мг) | Несколько [а] | Пероральный контрацептив, содержащий только прогестаген. |
| NET или только NETA | Высокая (например, 5 мг, 10 мг) | Несколько [б] | Гинекологические расстройства и другие применения |
| только NETE | Инъекция (например, 200 мг) | Несколько [с] | Инъекционный контрацептив, содержащий только прогестаген. |
| NET или NETA с этинилэстрадиолом | Низкая (например, 0,4 мг, 0,5 мг, 0,75 мг, 1 мг, 1,5 мг) | Несколько [д] | Комбинированный оральный контрацептив |
| NET с местранолом | Низкая (например, 1 мг, 2 мг) | Несколько [и] | Комбинированный оральный контрацептив |
| НЕТА с эстрадиолом | Низкий (например, 0,1 мг, 0,5 мг) | Несколько [ф] | Комбинированная менопаузальная гормональная терапия |
| НЭТЕ с валератом эстрадиола | Инъекция (например, 50 мг) | Несколько [г] | Комбинированный инъекционный контрацептив |
| Сокращения: NET = норэтистерон. НЕТА = норэтистерона ацетат . NETE = норэтистерона энантат . Источники: [26] [27] [28] [29] Примечания: | |||
Противопоказания [ править ]
Высокие дозы (10 мг/день) норэтистерона были связаны с веноокклюзионным заболеванием печени , и из-за этого побочного эффекта норэтистерон не следует назначать пациентам, перенесшим аллогенную трансплантацию костного мозга , поскольку он связан со значительно более низким уровнем вено-окклюзионной болезни печени. год выживаемости после трансплантации. [30] : 217 [31]
Побочные эффекты [ править ]
В противозачаточных и гормонально-заместительных дозах (от 0,35 до 1 мг/день) норэтистерон оказывает только существенно прогестагенное побочное действие . В большинстве клинических исследований норэтистерона для контрацепции или менопаузальной гормональной терапии препарат комбинировался с эстрогеном, и по этой причине трудно определить, какие из побочных эффектов были вызваны норэтистероном, а какие из них были вызваны эстрогеном. такое исследование. Однако NETE, пролекарство норэтистерона, вводимое внутримышечно и используемое в качестве контрацептива длительного действия, используется без эстрогена и, следовательно, может использоваться в качестве заменителя норэтистерона с точки зрения понимания его эффектов и переносимости . В клинических исследованиях наиболее частым побочным эффектом NETE были нарушения менструального цикла , в том числе длительные кровотечения или кровянистые выделения и аменорея . [30] : 253 Другие побочные эффекты включают периодическое вздутие живота и болезненность молочных желез , оба из которых, как полагают, вызваны задержкой жидкости и могут быть уменьшены с помощью диуретиков . [30] : 253 не выявлено Никакой связи с увеличением веса , артериальное давление , свертываемость крови и толерантность к глюкозе остались нормальными. [30] : 253 снижение уровня ЛПВП . холестерина Однако наблюдалось [30] : 253
В высоких дозах (от 5 до 60 мг/день), например, при лечении гинекологических заболеваний, норэтистерон может вызывать гипогонадизм из-за его антигонадотропного действия и может иметь эстрогенные и слабые андрогенные побочные эффекты.
Высокие дозы НЕТА (10 мг/день) были связаны с отклонениями показателей функции печени , включая значительное повышение уровня печеночных ферментов . [32] [33] [34] Эти ферменты печени включали лактатдегидрогеназу и глутаматпируваттрансаминазу . [34] Хотя они были описаны как не имеющие клинического значения, [34] повышенный уровень ферментов печени, связанный с НЕТА, возможно, препятствовал его дальнейшему использованию в качестве мужской гормональной контрацепции. [32] [33]
Андрогенный [ править ]
Из-за своей слабой андрогенной активности норэтистерон при высоких дозах (например, от 10 до 40 мг/день) может вызывать андрогенные побочные эффекты , такие как прыщи , гирсутизм и изменения голоса небольшой степени тяжести у некоторых женщин. [10] Однако это особенно не относится к комбинированным пероральным контрацептивам , содержащим норэтистерон и ЭЭ. [11] Такие составы содержат низкие дозы норэтистерона (от 0,35 до 1 мг/день). [11] в сочетании с эстрогеном и фактически связаны с улучшением симптомов прыщей. [35] [36] В соответствии с этим они фактически одобрены FDA для лечения прыщей у женщин в Соединенных Штатах. [35] [36] Считается, что улучшение симптомов акне происходит за счет 2-3-кратного увеличения уровня глобулина, связывающего половые гормоны (ГСПГ), и последующего снижения уровня свободного тестостерона, вызванного ЭЭ, что приводит к общему снижению передачи андрогенных сигналов. в теле. [37]
Сальные железы высокочувствительны к андрогенам, а их размер и активность являются потенциальными маркерами андрогенного эффекта. [38] Было обнаружено, что высокие дозы норэтистерона или НЕТА в дозе 20 мг/день или НЭТА значительно стимулируют сальные железы, тогда как более низкие дозы норэтистерона и НЭТА в дозе 5 мг/день и 2,5 мг/день, соответственно, не оказывают существенного стимулирования выработки кожного сала и, следовательно, считаются как лишенный значительной андрогенности. [38] И наоборот, было обнаружено, что дозы норэтистерона от 0,5 до 3 мг/день дозозависимо снижают уровень ГСПГ (и, следовательно, подавляют выработку ГСПГ в печени), что является еще одним высокочувствительным маркером андрогенности. [39]
Крупное клиническое исследование высоких и очень высоких доз норэтистерона перорально (от 10 до 40 мг/день), вводимых в течение длительных периодов времени (от 4 до 35 недель) для предотвращения выкидыша у беременных , показало, что у 5,5% женщин наблюдались легкие андрогенные побочные эффекты. такие эффекты, как легкие изменения голоса ( хрипота ), прыщи и гирсутизм то, что у 18,3% младенцев женского пола, рожденных от матерей, наблюдалась, в большинстве случаев лишь незначительная, вирилизация гениталий , а также . [10] Материнские андрогенные симптомы чаще всего возникали у женщин, получавших норэтистерон в дозе 30 мг/день или более в течение 15 недель или дольше. [10] У девочек женского пола, перенесших вирилизацию половых органов, единственным проявлением в 86,7% случаев было разнообразное, но почти всегда незначительное увеличение клитора. [10] В остальных 13,3% больных наблюдалось выраженное увеличение клитора и частичное сращение губно-мошоночных складок . [10] Дозировки, используемые в этих случаях, составляли от 20 до 40 мг/день. [10]
В письме редактору по поводу вирилизации, вызванной высокими дозами НЕТА у женщин, врач заявил, что они не наблюдали «ни малейших признаков вирилизации» и что «определенно не было ни гирсутизма, ни каких-либо изменений голоса» у женщин. 55 женщин с распространенным раком молочной железы, которых лечили норэтистероном в дозе 30–60 мг/день в течение шести месяцев. [40]
Высокие дозы норэтистерона использовались для подавления менструации у женщин с тяжелой умственной отсталостью , которые были неспособны справиться с собственными менструациями. [41] [42] Исследование с участием 118 нерожавших женщин, получавших норэтистерон в дозе 5 мг/день в течение периода от 2 до 30 месяцев, показало, что препарат эффективен в возникновении аменореи у 86% женщин, при этом прорывные кровотечения . у остальных 14% наблюдаются [41] Побочные эффекты, включая увеличение веса , гирсутизм , прыщи , головную боль , тошноту и рвоту, не увеличились в частоте, и ни у одной из женщин не было отмечено никаких «тревожных побочных эффектов». [41] [42] Другое исследование норэтистерона в дозе 5 мг/день у 132 женщин также не выявило андрогенных побочных эффектов. [43] Эти данные свидетельствуют о незначительном или полном отсутствии риска андрогенных побочных эффектов при приеме норэтистерона в дозе 5 мг/день. [41] [42] Исследование 194 женщин, принимавших НЭТА в дозе 5–15 мг/день в течение средней продолжительности терапии 13 месяцев для подавления симптомов эндометриоза, не выявило побочных эффектов у 55,2% пациенток, увеличения веса у 16,1%, прыщей у 9,9%, ухудшения настроения. лабильность - у 8,9%, приливы - у 8,3%, огрубление голоса - у двух женщин (1,0%). [44]
Эстрогенный [ править ]
Норэтистерон обладает слабым эстрогенным действием (за счет превращения в его метаболит ЭЭ), и по этой причине было обнаружено, что в высоких дозах он связан с высокой частотой эстрогенных побочных эффектов, таких как увеличение груди у женщин и гинекомастия у мужчин, а также с улучшением состояния. менопаузы у женщин Симптомы в постменопаузе. [45] Было высказано предположение, что очень высокие дозы (например, 40 мг/день, которые иногда используются в клинической практике по различным показаниям) НЭТА (и, как следствие, норэтистерона) могут привести к повышенному риску венозной тромбоэмболии (ВТЭ), аналогично высоким дозы (более 50 мкг/день) ЭЭ, и что даже дозы НЕТА от 10 до 20 мг, которые соответствуют дозам ЭЭ примерно от 20 до 30 мкг/день, могут у некоторых женщин быть связаны с повышенным риском. [46] [47] Исследование также показало, что этинилэстрадиол и норэтистерон оказывали большее влияние на факторы свертывания крови, когда доза норэтистерона составляла 3 или 4 мг, чем когда она составляла 1 мг. [48] Это могло быть связано с добавлением этинилэстрадиола, вырабатываемого более высокими дозами норэтистерона. [48]
Передозировка [ править ]
не поступало , даже у маленьких детей. Сообщений о серьезных побочных эффектах при передозировке норэтистерона [49] Таким образом, передозировка обычно не требует лечения. [49] Высокие дозы норэтистерона (до 60 мг/день) изучались при длительном лечении без описаний серьезных побочных эффектов. [40]
Взаимодействие [ править ]
5α-редуктаза играет важную роль в метаболизме норэтистерона, а ингибиторы 5α-редуктазы, такие как финастерид и дутастерид, могут ингибировать его метаболизм. [ нужна ссылка ] Норэтистерон частично метаболизируется посредством гидроксилирования CYP3A4 ингибиторы , а и CYP3A4 могут значительно изменять индукторы уровни норэтистерона в крови. [5] Например, было обнаружено, что индукторы CYP3A4 рифампицин и бозентан снижают воздействие норэтистерона на 42% и 23% соответственно, а индукторы CYP3A4 карбамазепин и зверобой также ускоряют клиренс норэтистерона. [5]
Фармакология [ править ]
Фармакодинамика [ править ]
Норэтистерон является мощным прогестагеном и слабым андрогеном и эстрогеном . [4] То есть это мощный агонист рецептора прогестерона (PR) и слабый агонист рецептора андрогена (AR) и рецептора эстрогена (ER). [4] Сам норэтистерон имеет незначительное сродство к ER; его эстрогенная активность обусловлена активным метаболитом , который образуется в очень небольших количествах, этинилэстрадиолом (ЭЭ), который является очень мощным эстрогеном. [4] Норэтистерон и его метаболиты имеют незначительное сродство к глюкокортикоидным рецепторам (GR) и минералокортикоидным рецепторам (MR) и, следовательно, не обладают глюкокортикоидной , антиглюкокортикоидной , минералокортикоидной или антиминералокортикоидной активностью. [4]
Прогестагенная активность [ править ]
Норэтистерон является мощным прогестагеном и связывается с PR примерно со 150 сродством прогестерона % . [4] Напротив, его исходные соединения, тестостерон , нандролон (19-нортестостерон) и этистерон (17α-этинилтестостерон), имеют 2%, 22% и 44% относительной аффинности связывания прогестерона с PR. [50] , что в отличие от норэтистерона его основной активный метаболит 5α-дигидронорэтистерон (5α-DHNET), образующийся при трансформации посредством 5α-редуктазы Установлено , обладает как прогестагенной, так и выраженной антипрогестагенной активностью. [51] хотя его сродство к PR значительно снижено по сравнению с норэтистероном и составляет всего 25% от сродства прогестерона. [4] Норэтистерон вызывает аналогичные изменения в эндометрии и влагалище , такие как трансформация эндометрия , и обладает аналогичным антигонадотропным , ингибирующим овуляцию и термогенным действием у женщин по сравнению с прогестероном, что соответствует его прогестагенной активности. [52] [50] [53]
Андрогенная активность [ править ]
Норэтистерон имеет примерно 15% сродства анаболически-андрогенного стероида (ААС) метриболона (R-1881) к АР и, соответственно, является слабоандрогенным. [4] В отличие от норэтистерона, 5α-DHNET, основной метаболит норэтистерона, демонстрирует более высокое сродство к АР, примерно 27% от сродства метриболона. [4] на грызунах он значительно снижает и фактически почти полностью устраняет андрогенную активность по сравнению с норэтистероном Однако, хотя 5α-DHNET имеет более высокое сродство к AR, чем норэтистерон, в биоанализах . [54] [55] Аналогичные результаты наблюдались для этистерона (17α-этинилтестостерона) и его 5α-восстановленного метаболита, тогда как 5α-восстановление увеличивало как сродство к AR, так и андрогенную активность тестостерона и нандролона (19-нортестостерона) в биоанализах на грызунах. [55] Таким образом, очевидно, что этинильная группа норэтистерона в положении C17α ответственна за его потерю андрогенности при 5α-восстановлении. [55]
Было обнаружено, что норэтистерон (0,5–3 мг/день) дозозависимо снижает уровень циркулирующего ГСПГ, что является общим свойством андрогенов и обусловлено АР-опосредованным подавлением выработки ГСПГ в печени. [39] Препарат также обладает эстрогенной активностью, а эстрогены, как известно, увеличивают выработку ГСПГ в печени и уровень циркулирующей крови, поэтому может показаться, что андрогенная активность норэтистерона в этом отношении превосходит его эстрогенную активность. [39]
Норэтистерон в значительной степени (36%) связывается с ГСПГ в кровотоке. [4] Хотя он имеет более низкое сродство к ГСПГ, чем эндогенные андрогены и эстрогены, [56] Норэтистерон может вытеснять тестостерон из ГСПГ и тем самым повышать уровень свободного тестостерона, и это действие может способствовать его слабому андрогенному эффекту. [57]
активность Эстрогенная

Норэтистерон связывается с ER, ERα и ERβ с относительной аффинностью связывания эстрадиола 0,07 % и 0,01% . [58] Из-за этого очень низкого относительного сродства он сам по себе практически неактивен в качестве лиганда ER в клинических концентрациях. [4] Однако было обнаружено, что норэтистерон является субстратом ароматазы . превращается в печени и в небольшой степени (0,35%) в высокоактивный эстроген этинилэстрадиол (ЭЭ), и по этой причине, в отличие от большинства других прогестинов, норэтистерон обладает некоторой эстрогенной активностью активность. [4] Однако при типичных дозах норэтистерона, используемых в пероральных контрацептивах (от 0,5 до 1 мг), уровни вырабатываемого ЭЭ низкие, и считается, что они, вероятно, не имеют клинического значения. [4] И наоборот, дозы норэтистерона 5 и 10 мг, которые используются при лечении гинекологических заболеваний , конвертируются со скоростью 0,7% и 1,0% и производят уровни ЭЭ, которые соответствуют уровням, производимым дозами ЭЭ 30 и 60 мкг. соответственно. [2] [4] Уровни ЭЭ, образующиеся при приеме 0,5 и 1 мг норэтистерона, были оценены на основе более высоких дозировок, соответствующих дозам ЭЭ 2 и 10 мкг соответственно. [2] В высоких дозах норэтистерон может увеличить риск венозной тромбоэмболии из-за метаболизма в ЭЭ. [59]
активность Нейростероидная
Подобно прогестерону и тестостерону , норэтистерон метаболизируется до 3,5- тетрагидрометаболитов . [60] Взаимодействуют ли эти метаболиты норэтистерона с ГАМК А рецептором так же, как 3,5-тетрагидро метаболиты прогестерона и тестостерона, такие как аллопрегнанолон и 3α-андростандиол соответственно, является темой, которая, по-видимому, не изучена и, следовательно, требует разъяснения. [60]
стероидогенеза Ингибирование
Норэтистерон является субстратом и, как известно, является ингибитором с 5α-редуктазы ингибированием 4,4% и 20,1% при 0,1 и 1 мкМ соответственно. [4] Однако терапевтические концентрации норэтистерона находятся в низком наномолярном диапазоне, поэтому это действие может не иметь клинического значения при обычных дозах. [4]
Было обнаружено, что норэтистерон и его основной активный метаболит 5α-DHNET действуют как необратимые ингибиторы ароматазы (K i = 1,7 мкМ и 9,0 мкМ соответственно). [61] Однако, как и в случае с 5α-редуктазой, необходимые концентрации, вероятно, слишком высоки, чтобы быть клинически значимыми при типичных дозировках. [4] 5α-DHNET был специально оценен и оказался селективным в ингибировании ароматазы и не влияет на фермент расщепления боковой цепи холестерина (P450scc), 17α-гидроксилазу / 17,20-лиазу , 21-гидроксилазу или 11β-гидроксилазу. . [61] Поскольку он не ароматизируется (и, следовательно, не может трансформироваться в эстрогенный метаболит), в отличие от норэтистерона, 5α-DHNET был предложен в качестве потенциального терапевтического агента при лечении ER-положительного рака молочной железы . [61]
Другая деятельность [ править ]
Норэтистерон является очень слабым ингибитором CYP2C9 и CYP3A4 ( IC 50 = 46 мкМ и 51 мкМ соответственно), но эти действия требуют очень высоких концентраций норэтистерона, которые намного превышают терапевтические уровни циркулирующей крови (которые находятся в наномолярном диапазоне) и, следовательно, вероятно, не имеет клинического значения. [4]
Было обнаружено, что норэтистерон и некоторые его 5α-восстановленные метаболиты оказывают сосудорасширяющее действие у животных, которое не зависит от рецепторов половых стероидов и, следовательно, по-видимому, имеет негеномный механизм. [62]
Норэтистерон стимулирует пролиферацию клеток MCF-7 рака молочной железы мембранный компонент - in vitro , действие, которое не зависит от классических PR и вместо этого опосредуется через 1 рецептора прогестерона (PGRMC1). [63] Некоторые другие прогестины действуют в этом анализе аналогичным образом, тогда как прогестерон действует нейтрально. [63] Неясно, могут ли эти результаты объяснить различные риски рака молочной железы, наблюдаемые при применении прогестерона и прогестинов в клинических исследованиях . [64]
эффекты Антигонадотропные
Благодаря своей прогестагенной активности норэтистерон подавляет ось гипоталамус-гипофиз-гонады (ось HPG) и, следовательно, оказывает антигонадотропное действие. [4] [50] Ожидается, что эстрогенная активность норэтистерона в высоких дозах также будет способствовать его антигонадотропному эффекту. [65] Благодаря своему антигонадотропному действию норэтистерон подавляет железами половых гормонов половыми выработку , подавляет овуляцию у женщин и подавляет сперматогенез у мужчин. [4] [50] [66]
доза Ингибирующая овуляцию как перорального норэтистерона, так и перорального НЕТА составляет около 0,5 мг/день для женщин. [4] [67] [68] Однако существуют некоторые противоречивые данные, позволяющие предположить, что для полного подавления овуляции могут потребоваться более высокие дозы. [69] Было обнаружено, что внутримышечная инъекция 200 мг NETE предотвращает овуляцию и подавляет уровни эстрадиола , прогестерона , лютеинизирующего гормона (ЛГ) и фолликулостимулирующего гормона (ФСГ) у женщин. [70] [71] [72] [73]
Ранние исследования перорального применения норэтистерона у мужчин, применявших дозы от 20 до 50 мг/день, выявили подавление 17-кетостероидов экскреции , повышенную экскрецию эстрогена (из-за превращения в этинилэстрадиол ), подавление сперматогенеза, либидо и эректильной функции , а также частоту гинекомастии . [74] [75] [76] [45] [77] Сообщалось, что пероральный прием норэтистерона 25 мг/день в течение 3 недель у мужчин подавляет уровень тестостерона примерно на 70%, до 100–200 нг/дл, в течение 4–5 дней, а также подавляет количество сперматозоидов и не оказывают влияния на либидо или эректильную функцию в течение этого короткого периода времени. [78] [79] У здоровых молодых мужчин НЭТА в дозе от 5 до 10 мг/день перорально в течение 2 недель подавлял уровень тестостерона с ~527 нг/дл до ~231 нг/дл (–56%). [80]

однократная внутримышечная инъекция NETE в дозе 200 мг отдельно или в сочетании с валератом эстрадиола в дозе 2 мг вызывает быстрое, сильное и устойчивое снижение уровней гонадотропина и тестостерона на срок до одного месяца у мужчин. Было обнаружено, что [66] [82] [83] Также было обнаружено, что внутримышечные инъекции 200 мг NETE один раз в 3 недели подавляют сперматогенез у мужчин. [74] [84] Аналогично, было обнаружено, что однократная внутримышечная инъекция 50 мг NETE в сочетании с 5 мг валерата эстрадиола сильно подавляет уровень тестостерона у мужчин. [81] Уровни тестостерона снизились с ~503 нг/дл исходно до ~30 нг/дл в самой низкой точке (–94%), которая произошла на 7-й день после инъекции. [81]
Фармакокинетика [ править ]
Фармакокинетика норэтистерона была рассмотрена. [4] [85]
Поглощение [ править ]
Биодоступность . % норэтистерона при пероральном приеме составляет от 47 до 73%, при этом средняя биодоступность при пероральном приеме составляет 64 [2] [3] микронизация Было обнаружено, что значительно улучшает биодоступность норэтистерона при пероральном приеме за счет увеличения кишечной абсорбции и снижения кишечного метаболизма . [4] [86] Было обнаружено, что однократная пероральная доза норэтистерона 2 мг приводит к пиковым уровням препарата в крови 12 нг/мл (40 нмоль/л), тогда как однократная пероральная доза норэтистерона 1 мг в сочетании с 2 мг эстрадиола приводит к пиковому уровню препарата в крови. уровень норэтистерона 8,5 нг/мл (29 нмоль/л) через час после введения. [4]
Распространение [ править ]
Связывание норэтистерона с белками плазмы составляет 97%. [4] На 61% он связан с альбумином и на 36% — с ГСПГ. [4]
Метаболизм [ править ]
Метаболизм норэтистерона и его пролекарств у человека |
норэтистерона составляет Период полувыведения от 5,2 до 12,8 часов, средний период полувыведения составляет 8,0 часов. [2] Метаболизм норэтистерона очень похож на метаболизм тестостерона (и нандролона) и происходит главным образом за счет снижения Δ 4 двойная связь до 5α- и 5β-дигидронорэтистерона, после чего происходит восстановление кетогруппы С3 до четырех изомеров 3,5 -тетрагидронорэтистерона. [4] Эти превращения катализируются 5α- и 5β-редуктазой и 3α- и 3β-гидроксистероиддегидрогеназой как в печени , так и во внепеченочных тканях, таких как гипофиз , матка , предстательная железа , влагалище и молочная железа . [96] За исключением 3α,5α- и 3β,5α-тетрагидронорэтистерона, которые обладают значительным сродством к ЭР и в некоторой степени эстрогенными, 3,5-тетрагидрометаболиты норэтистерона неактивны с точки зрения сродства к рецепторам половых стероидов (в частности, к рецепторам половых стероидов). , PR, AR и ER). [97] [98] [99] Небольшое количество норэтистерона также преобразуется ароматазой в ЭЭ. [2] [4] [46] метаболизируется в печени посредством гидроксилирования Норэтистерон также , главным образом с помощью CYP3A4 . [5] Некоторая конъюгация (включая глюкуронидацию и сульфатирование ) [96] [100] норэтистерона и его метаболитов происходит, несмотря на стерические препятствия со стороны этинильной группы при C17α. [4] Этинильная группа норэтистерона сохраняется примерно в 90% всех его метаболитов. [4]
Норэтистерон используется в противозачаточных таблетках, в отличие от самого прогестерона, поскольку при пероральном приеме он не метаболизируется так быстро, как прогестерон. При пероральном приеме прогестерон быстро метаболизируется в желудочно-кишечном тракте и печени и расщепляется на множество различных метаболитов. Принимая во внимание, что норэтистерон не так быстро метаболизируется, что позволяет норэтистерону присутствовать в более высоких количествах, что позволяет ему более эффективно конкурировать за сайты связывания рецепторов прогестерона. [4]
Ликвидация [ править ]
Норэтистерон выводится от 33 до 81% с мочой и от 35 до 43% с калом . [101]
Химия [ править ]
Норэтистерон, также известный как 17α-этинил-19-нортестостерон или как 17α-этинилестра-4-ен-17β-ол-3-он, представляет синтетический эстран стероид и производное тестостерона собой . [102] [28] В частности, это производное тестостерона, в котором этинильная группа была добавлена в положении C17α, а метильная группа в положении C19 удалена; следовательно, это комбинированное производное этистерона (17α-этинилтестостерон) и нандролона (19-нортестостерон). [102] [28] Эти модификации приводят к увеличению прогестагенной активности и при пероральном приеме биодоступности , а также к снижению андрогенной / анаболической активности. [103]
Производные [ править ]
Норэтистерон (NET) является исходным соединением большой группы прогестинов, в которую входит большинство прогестинов, известных как производные 19-нортестостерона. [104] Эта группа делится по химической структуре на эстраны (производные норэтистерона) и гонаны (18-метилгонаны или 13β-этилэстраны; производные левоноргестрела ) и включает следующие имеющиеся в продаже препараты: [105]
|
|
Некоторые из них действуют как пролекарства норэтистерона, включая НЕТА, NETE, диацетат этинодиола , линестренол и ацетат квингестанола . [106] [107] [108] Норэтинодрел также может быть пролекарством норэтистерона. [4] [2] НЕТА принимается внутрь так же, как норэтистерон, а НЕТЕ вводится путем инъекции в мышцу . [11]
Не- этинилированный - 17α
19-нортестостероновые (19-NT) прогестины, которые технически не являются производными норэтистерона (поскольку они не имеют этинильной группы C17α ), но все же тесно связаны (с другими заменами в положениях C17α и/или C16β), включают следующие имеющиеся в продаже лекарства. : [102] [28]
- C17α Виниловые (этенильные) производные норгестерона (17α-винил-δ 5(10) -19-NT) и норвинистерон (17α-винил-19-NT)
- C17α Аллильные производные аллилэстренол (3-декето-17α-аллил-19-NT) и альтреногест (17α-аллил-δ 9,11 -19-НТ)
- C17α- алкильное производное норметандрона (17α-метил-19-NT)
- C17α Цианометильное производное диеногест (17α-цианометил-δ 9 -19-НТ)
- Этильное производное C16β оксендолона (16β-этил-19-NT)
Многие анаболические стероиды семейства 19-нортестостерона, такие как норэтандролон и этилэстренол , также являются мощными прогестагенами, но никогда не продавались как таковые.
Синтез [ править ]
химического синтеза норэтистерона. Опубликованы результаты [102] [85]
Синтез 1 [ править ]

3-метиловый эфир эстрадиола ( 1 , EME) частично восстанавливается до 1,5-диена ( 2 ), что также происходит на первой стадии синтеза нандролона. Затем окисление Оппенауэра преобразует гидроксильную группу C17β в кетоновую функциональную группу ( 3 ). Затем его подвергают реакции с ацетилидом металла с образованием соответствующего этинильного соединения C17α ( 4 ). Гидролиз эфира енола в мягких условиях приводит непосредственно к ( 5 ), [109] который, по-видимому, представляет собой норэтинодрел (хотя Леднисер в своей книге утверждает, что это «этинодрел» (который может быть синонимом этинодиола ); этинодрел имеет присоединенный атом хлора ), перорально активный прогестин. Это прогестагенный компонент первого орального контрацептива , поступившего в продажу (т.е. Эновида). Обработка эфира этиниленола сильной кислотой приводит к образованию норэтистерона ( 6 ). [12]
На практике эти и все другие комбинированные пероральные контрацептивы представляют собой смеси 1–2% ЭЭ или местранола и перорального прогестина . Было высказано предположение, что открытие необходимости использования эстрогена в дополнение к прогестину для обеспечения контрацептивной эффективности связано с наличием небольшого количества невосстановленного ЭМЕ ( 1 ) в ранних партиях из 2 препаратов . При окислении и этинилировании это , конечно, приведет к образованию местранола ( 3 ). В любом случае необходимость присутствия эстрогена в смеси в настоящее время хорошо установлена экспериментально.
Синтез 2 [ править ]
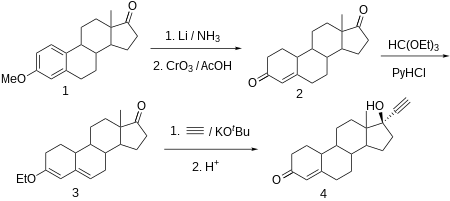
Норэтистерон производится из эстр-4-ен-3,17-диона (боландиона), который, в свою очередь, синтезируется путем частичного восстановления ароматической области 3-О-метилового эфира эстрона литием в жидком аммиаке и одновременно кетогруппа при C17α превращается в гидроксильную группу, которая затем снова окисляется до кетогруппы триоксидом хрома в уксусной кислоте . Сопряженный олефин C4-C5 и карбонильную группу при C3 затем преобразуют в этиловый эфир диенола с использованием этилортоформиата . Полученный продукт этинилируют ацетиленом в присутствии трет-бутоксида калия . После гидрохлоридного гидролиза образовавшегося О-производного калия, в ходе которого гидролизуется и еноловый эфир, а оставшаяся двойная связь сдвигается, получается искомый норэтистерон.
История [ править ]
Норэтистерон был впервые синтезирован химиками Луисом Мирамонтесом , Карлом Джерасси и Джорджем Розенкранцем в компании Syntex в Мехико в 1951 году. [12] Он был получен из этистерона и, как было обнаружено, обладал примерно в 20 раз большей эффективностью в качестве прогестагена по сравнению с ним. [ нужна ссылка ] Норэтистерон был первым высокоактивным пероральным прогестагеном , который был синтезирован, и ему предшествовали (как прогестаген) прогестерон (1934 г.), этистерон (1938 г.), 19-норпрогестерон (1944 г.) и 17α-метилпрогестерон (1949 г.), а также нандролон. (1950), тогда как норэтинодрел (1952) и норэтандролон (1953) следовали за синтезом норэтистерона. [13] [14] Препарат был представлен под названием Норлютин в США в 1957 году. [15] Впоследствии норэтистерон был объединен с местранолом и поступил на рынок под названием Ortho-Novum в США в 1963 году. Это был второй прогестин после норетинодрела в 1960 году, который использовался в составе пероральных контрацептивов . [14] дополнительные противозачаточные препараты, содержащие норэтистерон в сочетании с местранолом или ЭЭ, такие как норлестрин и норинил . В 1964 году в США появились [14]
и Общество культура
Общие имена [ править ]
Норэтистерон — это INN Tooltip и BAN препарата Tooltip, а норэтиндрон — его название, принятое в USAN . [102] [28]
Названия брендов [ править ]
Норэтистерон доступен в Бангладеш под торговыми марками Menogia (ACI), Normens (Renata) и т. д. Норэтистерон (NET), в том числе как NETA и NETE, продается под многими торговыми марками по всему миру. [28] [20]
Наличие [ править ]
США [ править ]
Ранее норэтистерон был доступен в США отдельно в таблетках по 5 мг под торговой маркой Норлютин, но с тех пор этот препарат был снят с производства в этой стране. [27] Тем не менее, НЕТА по-прежнему доступен в США в виде таблеток по 5 мг под торговой маркой Айгестин. [27] Это один из немногих неконтрацептивных лекарственных форм, содержащих только прогестаген, который по-прежнему доступен в Соединенных Штатах. [27] Другие включают прогестерон , медроксипрогестерона ацетат , мегестрола ацетат и гидроксипрогестерона капроат , а также атипичный агент даназол . [27]
И норэтистерон, и НЕТА также доступны в США в качестве противозачаточных средств. [27] Норэтистерон доступен как отдельно (торговые марки Camila, Errin, Heather, Micronor, Nor-QD и другие), так и в сочетании с ЭЭ (Norinyl, Ortho-Novum, другие) или местранолом (Norinyl, Ortho-Novum, другие), в то время как НЕТА доступен только в сочетании с ЭЭ (Норлестрином и др.). [27] NETE не доступен в США ни в какой форме. [27] [115] [116]
Исследования [ править ]
Норэтистерон, как NETA и NETE, изучался на предмет использования в качестве потенциального мужского гормонального контрацептива в сочетании с тестостероном у мужчин. [117] [118]
норэтистерона длительного действия Микросферы для внутримышечных инъекций изучались на предмет потенциального использования в качестве противозачаточных средств. [119]
Ссылки [ править ]
- ^ «Обновления о безопасности бренда в монографии о продукции» . Здоровье Канады . 6 июня 2024 г. Проверено 8 июня 2024 г.
- ↑ Перейти обратно: Перейти обратно: а б с д и ж г час Станчик ФЗ (сентябрь 2002 г.). «Фармакокинетика и эффективность прогестинов, используемых для заместительной гормональной терапии и контрацепции». Обзоры по эндокринным и метаболическим расстройствам . 3 (3): 211–24. дои : 10.1023/А:1020072325818 . ПМИД 12215716 . S2CID 27018468 .
- ↑ Перейти обратно: Перейти обратно: а б Фотерби К. (август 1996 г.). «Биодоступность пероральных половых стероидов, используемых в оральной контрацепции и заместительной гормональной терапии». Контрацепция . 54 (2): 59–69. дои : 10.1016/0010-7824(96)00136-9 . ПМИД 8842581 .
- ↑ Перейти обратно: Перейти обратно: а б с д и ж г час я дж к л м н тот п д р с т в v В х и С аа аб и объявление но из в ах есть также и аль являюсь а Куль Х. (август 2005 г.). «Фармакология эстрогенов и прогестагенов: влияние различных путей введения» (PDF) . Климактерический . 8 (Приложение 1): 3–63. дои : 10.1080/13697130500148875 . ПМИД 16112947 . S2CID 24616324 . Архивировано (PDF) из оригинала 22 августа 2016 года . Проверено 6 сентября 2018 г.
- ↑ Перейти обратно: Перейти обратно: а б с д Корхонен Т., Турпейнен М., Толонен А., Лайне К., Пелконен О. (май 2008 г.). «Идентификация ферментов цитохрома P450 человека, участвующих в биотрансформации линэстренола и норэтиндрона in vitro». Журнал биохимии стероидов и молекулярной биологии . 110 (1–2): 56–66. дои : 10.1016/j.jsbmb.2007.09.025 . ПМИД 18356043 . S2CID 10809537 .
- ↑ Перейти обратно: Перейти обратно: а б с д Тайтель Х.Ф., Кафриссен М.Е. (1995). «Норэтиндрон - обзор терапевтического применения». Международный журнал исследований фертильности и менопаузы . 40 (4): 207–23. ПМИД 8520623 .
- ^ Олден К.Р., Lowdermilk DL, Cashion MC, Perry SE (27 декабря 2013 г.). Охрана материнства и женского здоровья - Электронная книга . Elsevier Науки о здоровье. стр. 135–. ISBN 978-0-323-29368-6 . Архивировано из оригинала 9 марта 2023 года . Проверено 8 января 2018 г.
- ↑ Перейти обратно: Перейти обратно: а б Куль Х. (сентябрь 1990 г.). «Фармакокинетика эстрогенов и прогестагенов». Матуритас . 12 (3): 171–197. дои : 10.1016/0378-5122(90)90003-о . ПМИД 2170822 .
- ^ https://www.accessdata.fda.gov/drugsatfda_docs/label/2007/018405s023lbl.pdf . Архивировано 10 февраля 2017 г. в Wayback Machine. [ пустой URL PDF ]
- ↑ Перейти обратно: Перейти обратно: а б с д и ж г Джейкобсон Б.Д. (октябрь 1962 г.). «Опасности терапии норэтиндроном во время беременности». Американский журнал акушерства и гинекологии . 84 (7): 962–8. дои : 10.1016/0002-9378(62)90075-3 . ПМИД 14450719 .
- ↑ Перейти обратно: Перейти обратно: а б с д Рабочая группа МАИР по оценке канцерогенных рисков для человека; Всемирная организация здравоохранения; Международное агентство по исследованию рака (2007). Комбинированные эстроген-прогестагенные контрацептивы и комбинированная эстроген-прогестагенная менопаузальная терапия . Всемирная организация здравоохранения. стр. 417–. ISBN 978-92-832-1291-1 . Архивировано из оригинала 10 января 2023 года . Проверено 12 октября 2016 г.
Норэтистерон и его ацетатные и энантатные эфиры являются прогестагенами, обладающими слабыми эстрогенными и андрогенными свойствами.
- ↑ Перейти обратно: Перейти обратно: а б с д Джерасси К., Мирамонтес Л., Розенкранц Г., Сондхаймер Ф., Лонго Л.Д. (январь 2006 г.). «Стероиды LIV. Синтез 19-нор-17-альфа-этинилтестостерона и 19-нор-17-альфа-метилтестостерона. 1954». Американский журнал акушерства и гинекологии . 194 (1): 289, обсуждение 290. doi : 10.1021/ja01645a010 . ПМИД 16389045 .
- ↑ Перейти обратно: Перейти обратно: а б Шупе Д (7 ноября 2007 г.). Справочник по контрацепции: Руководство по практическому управлению . Springer Science & Business Media. стр. 15–. ISBN 978-1-59745-150-5 .
- ↑ Перейти обратно: Перейти обратно: а б с д и Маркс Л (2010). Сексуальная химия: история противозачаточных таблеток . Издательство Йельского университета. стр. 74, 76. ISBN. 978-0-300-16791-7 .
- ↑ Перейти обратно: Перейти обратно: а б Издательство Уильяма Эндрю (22 октября 2013 г.). Энциклопедия фармацевтического производства, 3-е издание . Эльзевир. стр. 2935–. ISBN 978-0-8155-1856-3 .
- ^ Хэтчер Р.А., Нельсон А.Л. (2007). Контрацептивные технологии . Яркие Медиа. стр. 195–. ISBN 978-1-59708-001-9 . Архивировано из оригинала 10 января 2023 года . Проверено 8 января 2018 г.
- ^ Гунашила С. (14 марта 2011 г.). Практическое решение гинекологических проблем . JP Medical Ltd., стр. 31–. ISBN 978-93-5025-240-6 . Архивировано из оригинала 9 марта 2023 года . Проверено 8 января 2018 г.
- ^ Граймс Д.А., Лопес Л.М., О'Брайен П.А., Раймонд Э.Г. (ноябрь 2013 г.). «Прогестиновые таблетки для контрацепции». Кокрейновская база данных систематических обзоров (11): CD007541. дои : 10.1002/14651858.CD007541.pub3 . ПМИД 24226383 .
- ^ Хуссейн С.Ф. (февраль 2004 г.). «Таблетки, содержащие только прогестаген, и высокое кровяное давление: есть ли связь? Обзор литературы». Контрацепция . 69 (2): 89–97. doi : 10.1016/j.contraception.2003.09.002 . ПМИД 14759612 .
- ↑ Перейти обратно: Перейти обратно: а б «Норетистерон» . Архивировано из оригинала 15 сентября 2018 года . Проверено 8 января 2018 г.
- ^ «Доступность генерика Айгестина» . Архивировано из оригинала 24 августа 2018 года . Проверено 8 января 2018 г.
- ^ «Топ-300 2021 года» . КлинКальк . Архивировано из оригинала 15 января 2024 года . Проверено 14 января 2024 г.
- ^ «Норэтиндрон – Статистика употребления лекарств» . КлинКальк . Проверено 14 января 2024 г.
- ^ Всемирная организация здравоохранения (2021 г.). Примерный список основных лекарственных средств Всемирной организации здравоохранения: 22-й список (2021 г.) . Женева: Всемирная организация здравоохранения. hdl : 10665/345533 . ВОЗ/MHP/HPS/EML/2021.02.
- ^ Ким Джей-Джей, Курита Т., Булун С.Э. (февраль 2013 г.). «Действие прогестерона при раке эндометрия, эндометриозе, миоме матки и раке молочной железы» . Эндокринные обзоры . 34 (1): 130–62. дои : 10.1210/er.2012-1043 . ПМК 3565104 . ПМИД 23303565 .
- ^ «Норетистерон» . Наркотики.com .
- ↑ Перейти обратно: Перейти обратно: а б с д и ж г час «Drugs@FDA: Лекарственные препараты, одобренные FDA» . Управление по контролю за продуктами и лекарствами США. Архивировано из оригинала 16 ноября 2016 года . Проверено 27 ноября 2016 г.
- ↑ Перейти обратно: Перейти обратно: а б с д и ж Index Nominum 2000: Международный каталог лекарств . Тейлор и Фрэнсис. Январь 2000 г., стр. 749–. ISBN 978-3-88763-075-1 .
- ^ Рабочая группа МАИР по оценке канцерогенных рисков для человека; Международное агентство по исследованию рака (1 января 1999 г.). Гормональная контрацепция и гормональная терапия в постменопаузе (PDF) . МАИР. п. 65. ИСБН 978-92-832-1272-0 .
- ↑ Перейти обратно: Перейти обратно: а б с д и Аронсон Дж. К. (21 февраля 2009 г.). Побочные эффекты эндокринных и метаболических препаратов Мейлера . Эльзевир. стр. 217, 253, 275. ISBN. 978-0-08-093292-7 .
- ^ Хэгглунд Х., Рембергер М., Клаессон С., Леннквист Б., Юнгман П., Рингден О. (декабрь 1998 г.). «Лечение норэтистероном, основной фактор риска веноокклюзионного заболевания печени после аллогенной трансплантации костного мозга». Кровь . 92 (12): 4568–72. дои : 10.1182/blood.V92.12.4568 . ПМИД 9845522 .
- ↑ Перейти обратно: Перейти обратно: а б Корниа П.Б., Анавальт Б.Д. (ноябрь 2004 г.). «Мужская гормональная контрацепция». Мнение экспертов о новых лекарствах . 9 (2): 335–344. дои : 10.1517/14728214.9.2.335 . ПМИД 15571489 . S2CID 26886374 .
- ↑ Перейти обратно: Перейти обратно: а б Корниа П.Б., Анавальт Б.Д. (2005). «Мужские гормональные контрацептивы: потенциально патентоспособный и прибыльный продукт». Экспертное заключение о терапевтических патентах . 15 (12): 1727–1737. дои : 10.1517/13543776.15.12.1727 . ISSN 1354-3776 . S2CID 83941717 .
- ↑ Перейти обратно: Перейти обратно: а б с Камишке А., Хойерманн Т., Крюгер К., фон Эккардштейн С., Шеллшмидт И., Рюбиг А., Нишлаг Е. (февраль 2002 г.). «Эффективный гормональный мужской контрацептив, использующий ундеканоат тестостерона с пероральными или инъекционными препаратами норэтистерона» . Журнал клинической эндокринологии и метаболизма . 87 (2): 530–539. дои : 10.1210/jcem.87.2.8218 . ПМИД 11836281 .
- ↑ Перейти обратно: Перейти обратно: а б Джанкинс-Хопкинс Дж. М. (март 2010 г.). «Гормональная терапия прыщей». Журнал Американской академии дерматологии . 62 (3): 486–8. дои : 10.1016/j.jaad.2009.12.002 . ПМИД 20159314 .
- ↑ Перейти обратно: Перейти обратно: а б Аровохолу А.О., Галло М.Ф., Лопес Л.М., Граймс Д.А. (июль 2012 г.). Аровохолу А.О. (ред.). «Комбинированные оральные контрацептивы для лечения акне». Кокрейновская база данных систематических обзоров (7): CD004425. дои : 10.1002/14651858.CD004425.pub6 . ПМИД 22786490 .
- ^ ван Влотен В.А., Сигурдссон В. (2004). «Выбор орального контрацептива для лечения акне у женщин». Американский журнал клинической дерматологии . 5 (6): 435–41. дои : 10.2165/00128071-200405060-00008 . ПМИД 15663340 . S2CID 9947402 .
- ↑ Перейти обратно: Перейти обратно: а б Почи П.Е., Штраус Дж.С. (декабрь 1965 г.). «Отсутствие андрогенного воздействия на сальные железы человека при приеме норэтиндрона в низких дозах». Американский журнал акушерства и гинекологии . 93 (7): 1002–4. дои : 10.1016/0002-9378(65)90162-6 . ПМИД 5843402 .
- ↑ Перейти обратно: Перейти обратно: а б с д Кунц В., Хойнер А., Хюмпель М., Зайферт В., Михаэлис К. (декабрь 1997 г.). «Превращение норэтистерона и норэтистерона ацетата in vivo в этинилэтрадиол у женщин в постменопаузе». Контрацепция . 56 (6): 379–85. дои : 10.1016/s0010-7824(97)00174-1 . ПМИД 9494772 .
- ↑ Перейти обратно: Перейти обратно: а б Карвен С. (1962). «Вирилизация норэтистероном» . БМЖ . 1 (5289): 1415. doi : 10.1136/bmj.1.5289.1415-a . ISSN 0959-8138 . ЧВК 1958463 .
- ↑ Перейти обратно: Перейти обратно: а б с д Роксбург Д.Р., Западный MJ (август 1973 г.). «Использование норэтистерона для подавления менструации у женщин с серьезной умственной отсталостью» . Медицинский журнал Австралии . 2 (7): 310–3. дои : 10.5694/j.1326-5377.1973.tb128175.x . ПМИД 4746398 . S2CID 204094551 . Архивировано из оригинала 20 декабря 2016 года . Проверено 6 декабря 2016 г.
- ↑ Перейти обратно: Перейти обратно: а б с Роксбург Д.Р., Западный MJ (август 1973 г.). «Использование норэтистерона для подавления менструации у женщин с серьезной умственной отсталостью». Медицинский журнал Австралии . 2 (7): 310–3. дои : 10.1097/00006254-197408000-00021 . ПМИД 4746398 .
- ^ Совет JA (апрель 1965 г.). «Клиническая оценка применения пероральных контрацептивов норэтиндрона 5 мг плюс местранола 0,075 мг» . Журнал Канадской медицинской ассоциации . 92 (15): 814–7. ЧВК 1927985 . ПМИД 14272499 .
- ^ Касер DJ, Миссмер С.А., Берри К.Ф., Лауфер М.Р. (апрель 2012 г.). «Использование только норэтиндрона ацетата для послеоперационного подавления симптомов эндометриоза». Журнал детской и подростковой гинекологии . 25 (2): 105–108. дои : 10.1016/j.jpag.2011.09.013 . ПМИД 22154396 .
- ↑ Перейти обратно: Перейти обратно: а б Полсен К.А., Лич Р.Б., Ланман Дж., Голдстон Н., Мэддок В.О., Хеллер К.Г. (октябрь 1962 г.). «Природная эстрогенность норэтиндрона и норэтинодрела: сравнение с другими синтетическими прогестинами и прогестероном». Журнал клинической эндокринологии и метаболизма . 22 (10): 1033–9. doi : 10.1210/jcem-22-10-1033 . ПМИД 13942007 .
- ↑ Перейти обратно: Перейти обратно: а б Чу MC, Чжан X, Генцшайн Э, Станчик ФЗ, Лобо Р.А. (июнь 2007 г.). «Образование этинилэстрадиола у женщин при лечении норэтиндрона ацетатом» . Журнал клинической эндокринологии и метаболизма . 92 (6): 2205–7. дои : 10.1210/jc.2007-0044 . ПМИД 17341557 .
- ^ Коннолли А., Britton AG (31 марта 2017 г.). Женское здоровье в первичной медико-санитарной помощи . Издательство Кембриджского университета. стр. 153–. ISBN 978-1-108-16595-2 .
- ↑ Перейти обратно: Перейти обратно: а б Фаррис М., Бастианелли С., Розато Е., Бросенс И., Бенаджано Дж. (октябрь 2017 г.). «Фармакодинамика комбинированных эстроген-гестагенных пероральных контрацептивов: 2. Влияние на гемостаз». Экспертное обозрение клинической фармакологии . 10 (10): 1129–1144. дои : 10.1080/17512433.2017.1356718 . ПМИД 28712325 . S2CID 205931204 .
- ↑ Перейти обратно: Перейти обратно: а б https://www.accessdata.fda.gov/drugsatfda_docs/label/2014/016954s106lbl.pdf Архивировано 10 февраля 2017 г. в Wayback Machine. [ пустой URL PDF ]
- ↑ Перейти обратно: Перейти обратно: а б с д и Куль Х (2011). «Фармакология прогестагенов» (PDF) . J Репродукциимед Эндокринол . 8 (1): 157–177. Архивировано (PDF) из оригинала 11 октября 2016 г. Проверено 10 октября 2016 г.
- ^ Чу Ю. Х., Ли QA, Чжао З. Ф., Чжоу Ю. П., Цао, округ Колумбия (июнь 1985 г.). «[Антипрогестагенное действие 5-альфа-дигидронорэтистерона]». Чжунго Яо Ли Сюэ Бао = Acta Pharmacologica Sinica (на китайском языке). 6 (2): 125–9. ПМИД 2934946 .
- ^ Маккуистион Л.Е., Ки Дж.Л., Хейс Э.Р. (25 марта 2014 г.). Фармакология: подход к сестринскому процессу, ориентированный на пациента . Elsevier Науки о здоровье. стр. 846–. ISBN 978-0-323-29348-8 .
- ^ Гринблатт РБ (июль 1956 г.). «Прогестагенная активность 17-альфа-этинил-19-нортестостерона». Журнал клинической эндокринологии и метаболизма . 16 (7): 869–75. doi : 10.1210/jcem-16-7-869 . ПМИД 13332050 .
- ^ Фрагкаки А.Г., Анжелис Ю.С., Куппарис М., Цантили-Какулиду А., Кокотос Г., Георгакопулос С. (февраль 2009 г.). «Структурные характеристики анаболических андрогенных стероидов, способствующие связыванию с андрогенными рецепторами и их анаболической и андрогенной активности. Применяемые модификации структуры стероидов». Стероиды . 74 (2): 172–97. doi : 10.1016/j.steroids.2008.10.016 . ПМИД 19028512 . S2CID 41356223 .
Многие синтетические стероиды с высокой миотрофической активностью проявляют миотрофно-андрогенную диссоциацию, поскольку из-за изменений, вносимых в структуру кольца А, они, вероятно, не будут субстратами для 5α-редуктаз [85]. 5α-редукция не всегда усиливает андрогенную активность, несмотря на высокую степень RBA андрогенов к АР. Так обстоит дело с норэтистероном (рис. 1, 34), синтетическим производным 19-нор-17α-этинилтестостерона, который также подвергается ферментативно-опосредованному 5α-восстановлению и оказывает мощное андрогенное действие на органы-мишени. 5α-восстановленный норэтистерон демонстрирует более высокое связывание AR, но демонстрирует значительно более низкую андрогенную активность, чем неизмененный норэтистерон [102,103].
- ↑ Перейти обратно: Перейти обратно: а б с Лемус А.Е., Энрикес Х., Гарсия Г.А., Грильаска И., Перес-Паласиос Г. (январь 1997 г.). «5-альфа-восстановление норэтистерона повышает его аффинность связывания с рецепторами андрогенов, но снижает его андрогенную активность». Журнал биохимии стероидов и молекулярной биологии . 60 (1–2): 121–9. дои : 10.1016/s0960-0760(96)00172-0 . ПМИД 9182866 . S2CID 33771349 .
- ^ Филши М., Гийбо Дж. (22 октября 2013 г.). Контрацепция: наука и практика . Эльзевир Наука. стр. 26–. ISBN 978-1-4831-6366-6 .
Норэтистерон связывается с ГСПГ с меньшим сродством, чем эндогенные андрогены и эстрогены [...]
- ^ Аззиз Р. (8 ноября 2007 г.). Расстройства избытка андрогенов у женщин . Springer Science & Business Media. стр. 124–. ISBN 978-1-59745-179-6 .
- ^ Койпер Г.Г., Карлссон Б., Грандьен К., Энмарк Е., Хэггблад Дж., Нильссон С., Густафссон Дж.А. (март 1997 г.). «Сравнение специфичности связывания лигандов и распределения транскриптов в тканях альфа- и бета-рецепторов эстрогена» . Эндокринология . 138 (3): 863–70. дои : 10.1210/endo.138.3.4979 . ПМИД 9048584 .
- ^ Виграц I, Куль Х (сентябрь 2006 г.). «Метаболические и клинические эффекты прогестагенов». Европейский журнал контрацепции и репродуктивного здоровья . 11 (3): 153–61. дои : 10.1080/13625180600772741 . ПМИД 17056444 . S2CID 27088428 .
- ↑ Перейти обратно: Перейти обратно: а б Джатти С., Мелканги Р.К., Песарези М. (август 2016 г.). «Обратная сторона прогестинов: влияние на мозг» . Журнал молекулярной эндокринологии . 57 (2): Р109-26. doi : 10.1530/JME-16-0061 . ПМИД 27339142 .
- ↑ Перейти обратно: Перейти обратно: а б с Ямамото Т., Тамура Т., Китаваки Дж., Осава Ю., Окада Х. (июнь 1994 г.). «Самоубийственная инактивация ароматазы в плаценте человека и лейомиоме матки 5-альфа-дигидронорэтиндроном, метаболитом норэтиндрона, и его влияние на ферменты, продуцирующие стероиды». Европейский журнал эндокринологии . 130 (6): 634–40. дои : 10.1530/eje.0.1300634 . ПМИД 8205267 .
- ^ Перускиа М., Вильялон К.М., Наваррете Э., Гарсия Г.А., Перес-Паласиос Г., Лемус А.Е. (август 2003 г.). «Сосудорасширяющий эффект норэтистерона и его 5-альфа-метаболитов: новое негеномное действие». Европейский журнал фармакологии . 475 (1–3): 161–9. дои : 10.1016/s0014-2999(03)02106-x . ПМИД 12954372 .
- ↑ Перейти обратно: Перейти обратно: а б Нойбауэр Х., Ма К., Чжоу Дж., Ю К., Руан Х., Сигер Х. и др. (октябрь 2013 г.). «Возможная роль PGRMC1 в развитии рака молочной железы». Климактерический . 16 (5): 509–13. дои : 10.3109/13697137.2013.800038 . ПМИД 23758160 . S2CID 29808177 .
- ^ Траберт Б., Шерман М.Э., Каннан Н., Станчик Ф.З. (апрель 2020 г.). «Прогестерон и рак молочной железы» . Эндокринные обзоры . 41 (2): 320–344. дои : 10.1210/endrev/bnz001 . ПМК 7156851 . ПМИД 31512725 .
- ^ Андерсон Р.А., Бэрд Д.Т. (декабрь 2002 г.). «Мужская контрацепция» (PDF) . Эндокринные обзоры . 23 (6): 735–62. дои : 10.1210/er.2002-0002 . ПМИД 12466187 . Архивировано (PDF) из оригинала 28 августа 2021 года . Проверено 11 декабря 2019 г.
- ↑ Перейти обратно: Перейти обратно: а б Камишке А., Нишлаг Е (январь 2004 г.). «Прогресс на пути к гормональной мужской контрацепции». Тенденции в фармакологических науках . 25 (1): 49–57. дои : 10.1016/j.tips.2003.11.009 . ПМИД 14723979 .
- ^ Рудель HW (сентябрь 1968 г.). «Фармакология оральных контрацептивов». Клиническая акушерство и гинекология . 11 (3): 632–44. дои : 10.1097/00003081-196811030-00002 . ПМИД 4878826 .
- ^ Станчик ФЗ (ноябрь 2003 г.). «Не все прогестины одинаковы». Стероиды . 68 (10–13): 879–90. doi : 10.1016/j.steroids.2003.08.003 . ПМИД 14667980 . S2CID 44601264 .
- ^ Эндрикат Дж., Герлингер С., Ричард С., Розенбаум П., Дюстерберг Б. (декабрь 2011 г.). «Дозы прогестинов для ингибирования овуляции: систематический обзор доступной литературы и препаратов, продаваемых во всем мире». Контрацепция . 84 (6): 549–57. doi : 10.1016/j.contraception.2011.04.009 . ПМИД 22078182 .
- ^ Шупе Д (1993). «Инъекционные контрацептивы и противозачаточные вагинальные кольца». Контрацепция . Клинические перспективы в акушерстве и гинекологии. Спрингер. стр. 144–157. дои : 10.1007/978-1-4612-2730-4_13 . ISBN 978-1-4612-7645-6 . ISSN 0178-0328 .
- ^ Вайнер Э., Йоханссон Э.Д. (апрель 1975 г.). «Уровень норэтиндрона в плазме после внутримышечной инъекции 200 мг норэтиндрона энантата». Контрацепция . 11 (4): 419–25. дои : 10.1016/0010-7824(75)90004-9 . ПМИД 1122756 .
- ^ Фотерби К., Ховард Дж., Шриманкер К., Элдер М., Пока П.Г. (декабрь 1977 г.). «Влияние норэтистерона энантата на уровни гонадотропинов в сыворотке». Контрацепция . 16 (6): 591–604. дои : 10.1016/0010-7824(77)90060-9 . ПМИД 606499 .
- ^ Гебельсманн Ю, Станчик ФЗ, Бреннер П.Ф., Гебельсманн А.Э., Генцшайн Е.К., Мишелл Д.Р. (март 1979 г.). «Концентрация норэтиндрона (NET) в сыворотке после внутримышечной инъекции NET энантата. Влияние на сывороточный ЛГ, ФСГ, эстрадиол и прогестерон». Контрацепция . 19 (3): 283–313. дои : 10.1016/0010-7824(79)90022-2 . ПМИД 572279 .
- ↑ Перейти обратно: Перейти обратно: а б Нойманн Ф., Диалло Ф.А., Хасан С.Х., Шенк Б., Траоре I (1976). «Влияние фармацевтических соединений на мужскую фертильность» . Андрология . 8 (3): 203–235. дои : 10.1111/j.1439-0272.1976.tb02137.x . ПМИД 793446 . S2CID 24859886 .
- ^ Хеллер К.Г., Лэйдлоу В.М., Харви Х.Т., Нельсон В.О. (июль 1958 г.). «Влияние гестагенных соединений на репродуктивные процессы мужчины». Анналы Нью-Йоркской академии наук . 71 (5): 649–65. дои : 10.1111/j.1749-6632.1958.tb54641.x . ПМИД 13583821 . S2CID 32637425 .
- ^ Хеллер К.Г., Мур Д.Д., Полсен К.А., Нельсон В.О., Лэйдлоу В.М. (декабрь 1959 г.). «Влияние прогестерона и синтетических прогестинов на репродуктивную физиологию нормальных мужчин» . Труды Федерации . 18 : 1057–65. ПМИД 14400846 . Архивировано из оригинала 18 декабря 2018 года . Проверено 11 декабря 2019 г.
- ^ Полсен, Калифорния (март 1965 г.). «Метаболизм прогестина: особое внимание к эстрогенным путям». Метаболизм . 14 (3): SUPPL: 313–9. дои : 10.1016/0026-0495(65)90018-1 . ПМИД 14261416 .
- ^ Мудгал Н.Р., Суреш Р. (1995). «Некоторые мысли о разработке химических противозачаточных средств для мужчин» (PDF) . Современная наука (Бангалор) . 68 (4): 470–474. ISSN 0011-3891 . Архивировано из оригинала (PDF) 11 декабря 2019 года . Проверено 11 декабря 2019 г.
- ^ Йохонсон Э.Д., Нюгрен К.Г. (1973). «Депрессия уровня тестостерона в плазме у мужчин с норэтиндроном». Контрацепция . 8 (3): 219–226. дои : 10.1016/0010-7824(73)90032-2 . ISSN 0010-7824 .
- ^ Зицманн М., Рохайем Дж., Райдт Дж., Клиш С., Кумар Н., Ситрук-Уэр Р., Нишлаг Э. (май 2017 г.). «Влияние различных прогестинов с трансдермальным тестостероном или без него на уровни гонадотропинов для неинвазивной гормональной мужской контрацепции: рандомизированное клиническое исследование» . Андрология . 5 (3): 516–526. дои : 10.1111/andr.12328 . ПМИД 28189123 . S2CID 41502711 .
- ↑ Перейти обратно: Перейти обратно: а б с д Альварес Б.Д. (11 мая 2011 г.). 50 мг норэтистерона энантата и 5 мг валерата эстрадиола на общий уровень тестостерона у Влияние дозы здоровых мексиканских мужчин ] (MSc). Национальный политехнический институт Мексики. Архивировано из оригинала 16 сентября 2022 года . Проверено 12 сентября 2022 г.
- ^ Эмори Дж.К. (2003). «Андрогены и мужская контрацепция». Андрогены в здоровье и болезни . Современная эндокринология. Хумана Пресс. стр. 405–417. дои : 10.1007/978-1-59259-388-0_21 . ISBN 978-1-61737-314-5 .
- ^ Камишке А., Дибеккер Дж., Нишлаг Э. (сентябрь 2000 г.). «Потенциал норэтистерона энантата для мужской контрацепции: фармакокинетика и подавление функции гипофиза и половых желез». Клиническая эндокринология . 53 (3): 351–358. дои : 10.1046/j.1365-2265.2000.01097.x . ПМИД 10971453 . S2CID 70515136 .
- ^ Петри Р., Мосс Дж., Сенге Т., Рауш-Штрооман Дж.Г. (1970). «Влияние ацетата ципротерона, энантата норэтистерона и капроата гестонорона на ось гипофиз-гонады у мужчин». , норэтистерона-энантата и гестонорона-капроата на гипофизарно-гонадную ось мужчин Влияние ципротерон-ацетата у Симпозиум Немецкого общества эндокринологии в Ульме с 26 по 28 числа. Февраль 1970 года. Спрингер. стр. 428–430. дои : 10.1007/978-3-642-80591-2_118 . ISBN 9783642805912 .
{{cite book}}:|journal=игнорируется ( помогите ) - ↑ Перейти обратно: Перейти обратно: а б Гестагены . Издательство Спрингер. 27 ноября 2013 г., стр. 13–14, 283–284. ISBN 978-3-642-99941-3 . Архивировано из оригинала 10 января 2023 года . Проверено 19 сентября 2018 г.
- ^ Саперштейн С., Эдгрен Р.А., Юнг Д., Мрощак Э.Дж., Ли Г.Дж., Дорр А., Притчард Р., Кушинский С., Фонг Дж.К., Комбс Д.Л. (декабрь 1989 г.). «Фармакокинетика норэтиндрона: влияние размера частиц». Контрацепция . 40 (6): 731–40. дои : 10.1016/0010-7824(89)90075-9 . ПМИД 2620531 .
- ^ Фридрих С., Берсе М., Кляйн С., Роде Б., Хёхель Дж. (июнь 2018 г.). «Образование этинилэстрадиола in vivo после внутримышечного введения норэтистерона энантата». Журнал клинической фармакологии . 58 (6): 781–789. дои : 10.1002/jcph.1079 . ПМИД 29522253 . S2CID 3813229 .
- ^ Тийссен Дж. Х. (сентябрь 1972 г.). «Метаболизм перорально активных синтетических гестагенных соединений». В Тауске М (ред.). Фармакология эндокринной системы и родственных препаратов: прогестерон, гестагенные препараты и средства против бесплодия . Том. II. Пергамон Пресс. стр. 217–273. ISBN 978-0080168128 . OCLC 278011135 .
- ^ Окада Х (2010). «Рецепторы и механизм действия синтетических прогестагенов». Азиатско-Океанский журнал акушерства и гинекологии . 7 (1): 15–27. дои : 10.1111/j.1447-0756.1981.tb00511.x . ISSN 0389-2328 .
- ^ Бриггс М.Х. (1980). «Сравнительная фармакодинамика и фармакокинетика противозачаточных стероидов у животных и человека: выборочный обзор». Клиническая фармакология и терапия . Пэлгрейв Макмиллан, Великобритания. стр. 493–518. дои : 10.1007/978-1-349-05952-2_57 . ISBN 978-1-349-05954-6 .
- ^ Томас Дж. А., Кинан Э. Дж. (1986). «Прогестины и оральные контрацептивы». Принципы эндокринной фармакологии . Спрингер. стр. 167–196. дои : 10.1007/978-1-4684-5036-1_8 . ISBN 978-1-4684-5036-1 .
- ^ Орм М.Л., Бэк-ди-джей, Брекенридж AM (1983). «Клиническая фармакокинетика пероральных контрацептивных стероидов». Клиническая фармакокинетика . 8 (2): 95–136. дои : 10.2165/00003088-198308020-00001 . ПМИД 6342899 . S2CID 43298472 .
- ^ Фотерби К. (1974). «Метаболизм синтетических стероидов животными и человеком». Акта Эндокринологика. Дополнение . 185 : 119–147. дои : 10.1530/acta.0.075s119 . ПМИД 4206183 .
- ^ Куль Х., Виграц I (август 2007 г.). «Могут ли производные 19-нортестостерона ароматизироваться в печени взрослых людей? Есть ли клинические последствия?». Климактерический . 10 (4): 344–353. дои : 10.1080/13697130701380434 . ПМИД 17653961 . S2CID 20759583 .
- ^ Станчик Ф.З., Рой С. (июль 1990 г.). «Метаболизм левоноргестрела, норэтиндрона и структурно родственных противозачаточных стероидов». Контрацепция . 42 (1): 67–96. дои : 10.1016/0010-7824(90)90093-Б . ПМИД 2143719 .
- ↑ Перейти обратно: Перейти обратно: а б Шунен В.Г., Декерс Г.Х., де Гуйер М.Е., де Рис Р., Клоостербур Х.Дж. (ноябрь 2000 г.). «Гормональные свойства норэтистерона, 7-альфа-метилнорэтистерона и их производных». Журнал биохимии стероидов и молекулярной биологии . 74 (4): 213–22. дои : 10.1016/s0960-0760(00)00125-4 . ПМИД 11162927 . S2CID 19797254 .
[...] несколько моно- и дисульфатированных, а также моно- и диглюкуронидированных метаболитов НЭТ были обнаружены в моче женщин, получавших НЭТ [16,17]. В неконъюгированной форме эти метаболиты NET (или MeNET) представлены 5α- и 5β-восстановленными NET (5α-NET или 5β-NET), а также 3α- и 3β-гидрированными 5α-NET и 5β-NET, что приводит к 3α,5α -NET, 3β,5α-NET, 3α,5β-NET и 3β,5β-NET или их соответствующие метаболиты MeNET (рис. 1 и 2). Эти стероидные преобразования NET или MeNET могут происходить в печени, а также в гипофизе, эндометрии, предстательной железе, влагалище и молочной железе. Ферментами, участвующими в этих метаболических процессах, являются 5α- и 5β-редуктаза, а также 3α- и 3β-гидроксистероиддегидрогеназа (HSD).
- ^ Чавес Б.А., Вилчис Ф., Перес А.Е., Гарсия Г.А., Грилласка И., Перес-Паласиос Г. (январь 1985 г.). «Стереоспецифичность внутриклеточного связывания норэтистерона и его метаболитов, восстанавливающих А-кольцо» . Журнал биохимии стероидов . 22 (1): 121–6. дои : 10.1016/0022-4731(85) 90151-7 ПМИД 3871879 .
- ^ Гарса-Флорес Х., Вильчис Ф., Гарсиа Г.А., Менхивар М., Перес-Паласиос Г. (июнь 1986 г.). «Уменьшение А-кольца усиливает антигонадотропную активность норэтистерона». Акта Эндокринологика . 112 (2): 278–83. дои : 10.1530/acta.0.1120278 . ПМИД 3090814 .
- ^ Лемус А.Е., Энрикес Дж., Эрнандес А., Сантильян Р., Перес-Паласиос Г. (февраль 2009 г.). «Биоконверсия норэтистерона, агониста рецептора прогестерона, в агонисты рецепторов эстрогена в остеобластных клетках» . Журнал эндокринологии . 200 (2): 199–206. дои : 10.1677/JOE-08-0166 . ПМИД 19008332 .
- ^ Скарси К.К., Дарин К.М., Чаппелл К.А., Нитц С.М., Ламорд М. (ноябрь 2016 г.). «Лекарственное взаимодействие, эффективность и безопасность гормональных контрацептивов у женщин, живущих с ВИЧ» . Безопасность лекарств . 39 (11): 1053–1072. дои : 10.1007/s40264-016-0452-7 . ПМК 5048570 . ПМИД 27562873 .
- ^ ДеГрут ЖЖ (2001). Эндокринология . Компания WB Saunders. п. 2617. ИСБН 978-0-7216-7843-6 .
- ↑ Перейти обратно: Перейти обратно: а б с д и Элкс Дж. (14 ноября 2014 г.). Словарь лекарств: Химические данные: Химические данные, структуры и библиография . Спрингер. стр. 886–. ISBN 978-1-4757-2085-3 . Архивировано из оригинала 10 января 2023 года . Проверено 5 октября 2016 г.
- ^ Хвалиш К., Суррей Э., Станчик Ф.З. (июнь 2012 г.). «Гормональный профиль ацетата норэтиндрона: обоснование дополнительной терапии агонистами гонадотропин-рилизинг-гормона у женщин с эндометриозом». Репродуктивные науки . 19 (6): 563–71. дои : 10.1177/1933719112438061 . ПМИД 22457429 . S2CID 2882899 .
- ^ Шупе Д., Хазелтин Ф.П. (6 декабря 2012 г.). Контрацепция . Springer Science & Business Media. стр. 112–. ISBN 978-1-4612-2730-4 .
- ^ Райан К.Дж. (1999). Гинекология Кистнера и женское здоровье . Мосби. п. 292. ИСБН 978-0-323-00201-1 .
- ^ Хаммерштейн Дж. (декабрь 1990 г.). «Пролекарства: преимущество или недостаток?». Американский журнал акушерства и гинекологии . 163 (6, часть 2): 2198–203. дои : 10.1016/0002-9378(90)90561-К . ПМИД 2256526 .
- ^ Эдельман А.Б., Черала Г., Станчик Ф.З. (октябрь 2010 г.). «Метаболизм и фармакокинетика противозачаточных стероидов у женщин с ожирением: обзор». Контрацепция . 82 (4): 314–23. doi : 10.1016/j.contraception.2010.04.016 . ПМИД 20851224 .
- ^ Рейно Дж.П., Оджасу Т. (ноябрь 1986 г.). «Разработка и использование антагонистов половых стероидов». Журнал биохимии стероидов . 25 (5Б): 811–33. дои : 10.1016/0022-4731(86)90313-4 . ПМИД 3543501 .
Аналогичным андрогенным потенциалом обладает норэтистерон и его пролекарства (норэтистерона ацетат, этинодиола диацетат, линестренол, норэтинодрел, квингестанол [ацетат]).
- ↑ Перейти обратно: Перейти обратно: а б Фрэнк Б. Колтон, патент США 2 655 518 (1952 г., компания Searle & Co).
- ^ Ринголд Х.Дж., Розенкранц Г., Сондхаймер Ф. (1956). «Стероиды. LXXX.11-Метил-19-нортестостерон и 1-Метил-17α-этинил-19-нортестостерон». Журнал Американского химического общества . 78 (11): 2477–2479. дои : 10.1021/ja01592a037 .
- ^ Юбервассер Х, Хойслер К, Кальвода Дж, Мейстре С, Виланд П, Аннер Г, Веттштейн А (1963). «19-норстероид II. Простой процесс получения производных 19-норандростана. О стероидах, 193-е сообщение». Helvetica Chimica Acta . 46 :344-352. дои : 10.1002/hlca.19630460135 .
- ^ Онкен Д., Хойблен Д. (январь 1970 г.). «[Этинилированные стероиды]». Аптека . 25 (1): 3–9. ПМИД 4914401 .
- ^ Патент США 2744122.
- ^ Патент США 2774777.
- ^ Буллоу В.Л. (2001). Энциклопедия контроля над рождаемостью . АВС-КЛИО. стр. 145–. ISBN 978-1-57607-181-6 . Архивировано из оригинала 10 января 2023 года . Проверено 27 ноября 2016 г.
- ^ Московиц Э.Х., Дженнингс Б. (13 сентября 1996 г.). Принудительная контрацепция?: Моральные и политические проблемы контроля над рождаемостью длительного действия . Издательство Джорджтаунского университета. стр. 40–. ISBN 978-1-58901-807-5 .
- ^ Нишлаг Э (ноябрь 2010 г.). «Клинические испытания мужской гормональной контрацепции» (PDF) . Контрацепция . 82 (5): 457–70. doi : 10.1016/j.contraception.2010.03.020 . ПМИД 20933120 . Архивировано (PDF) из оригинала 5 декабря 2020 года . Проверено 28 декабря 2018 г.
- ^ Нишлаг Э., Бере Х.М., Нишлаг Э., Бере Х.М., Нишлаг С. (2012). Нишлаг Э., Бере Х.М., Нишлаг С. (ред.). «Основная роль тестостерона в гормональной мужской контрацепции». Тестостерон : 470–493. дои : 10.1017/CBO9781139003353.023 . ISBN 9781139003353 .
- ^ Бенаджиано Дж., Primiero FM (июнь 1983 г.). «Контрацептивы длительного действия. Современное состояние». Наркотики . 25 (6): 570–609. дои : 10.2165/00003495-198325060-00003 . ПМИД 6223801 . S2CID 45898359 .
Дальнейшее чтение [ править ]
- Брогден Р.Н., Спейт Т.М., Эйвери Г.С. (1973). «Оральные контрацептивы, содержащие только прогестаген: предварительный отчет о действии и клиническом использовании норгестрела и норэтистерона». Наркотики . 6 (3): 169–81. дои : 10.2165/00003495-197306030-00004 . ПМИД 4130566 . S2CID 42295736 .
- «Норетистерон и норэтистерона ацетат». Монографии МАИР по оценке канцерогенного риска химических веществ для человека . 21 : 441–60. Декабрь 1979 г. PMID 120838 .
- Станчик Ф.З., Рой С. (июль 1990 г.). «Метаболизм левоноргестрела, норэтиндрона и структурно родственных противозачаточных стероидов». Контрацепция . 42 (1): 67–96. дои : 10.1016/0010-7824(90)90093-б . ПМИД 2143719 .
- Уайзман Л.Р., Мактавиш Д. (март 1994 г.). «Трансдермальный эстрадиол/норэтистерон. Обзор его фармакологических свойств и клинического применения у женщин в постменопаузе». Наркотики и старение . 4 (3): 238–56. дои : 10.2165/00002512-199404030-00006 . ПМИД 8199397 . S2CID 68007924 .
- Тайтель Х.Ф., Кафриссен М.Е. (1995). «Норэтиндрон - обзор терапевтического применения». Международный журнал исследований фертильности и менопаузы . 40 (4): 207–23. ПМИД 8520623 .
- Майер В.Е., Герман-младший (август 2001 г.). «Фармакология и токсикология этинилэстрадиола и ацетата норэтиндрона у экспериментальных животных». Нормативная токсикология и фармакология . 34 (1): 53–61. дои : 10.1006/rtph.2001.1483 . ПМИД 11502156 .
- Риис Б.Дж., Леманн Х.Дж., Кристиансен К. (октябрь 2002 г.). «Норэтистерона ацетат в сочетании с эстрогенами: влияние на скелет и другие органы. Обзор». Американский журнал акушерства и гинекологии . 187 (4): 1101–16. дои : 10.1067/моб.2002.122852 . ПМИД 12389012 .
- Дрейпер Б.Х., Моррони С., Хоффман М., Смит Дж., Бексинска М., Хэпгуд Дж., Ван дер Мерве Л. (июль 2006 г.). «Депо-медроксипрогестерон по сравнению с норэтистерона энантатом для прогестагенной контрацепции длительного действия». Кокрейновская база данных систематических обзоров (3): CD005214. дои : 10.1002/14651858.CD005214.pub2 . ПМИД 16856087 .
- Куль Х., Виграц I (август 2007 г.). «Могут ли производные 19-нортестостерона ароматизироваться в печени взрослых людей? Есть ли клинические последствия?». Климактерический . 10 (4): 344–53. дои : 10.1080/13697130701380434 . ПМИД 17653961 . S2CID 20759583 .
- Кейси CL, Мюррей, Калифорния (2008). «Обновление HT: внимание к комбинированной терапии эстрадиола и норэтиндронацетата» . Клинические вмешательства в старение . 3 (1): 9–16. дои : 10.2147/cia.s1663 . ПМЦ 2544373 . ПМИД 18488874 .
- Паулен М.Е., Кертис К.М. (октябрь 2009 г.). «Когда женщина может повторять инъекции только прогестагена — депо-медроксипрогестерона ацетат или норэтистерона энантат?». Контрацепция . 80 (4): 391–408. doi : 10.1016/j.contraception.2009.03.023 . ПМИД 19751863 .
- Хвалиш К., Суррей Э., Станчик Ф.З. (июнь 2012 г.). «Гормональный профиль ацетата норэтиндрона: обоснование дополнительной терапии агонистами гонадотропин-рилизинг-гормона у женщин с эндометриозом». Репродуктивные науки . 19 (6): 563–71. дои : 10.1177/1933719112438061 . ПМИД 22457429 . S2CID 2882899 .
![Уровни норэтистерона и этинилэстрадиола в течение 24 часов после однократного перорального приема 10 мг НЭТА у женщин в постменопаузе.[39]](http://upload.wikimedia.org/wikipedia/commons/thumb/e/e5/Norethisterone_and_ethinylestradiol_levels_after_a_single_oral_dose_of_10_mg_norethisterone_acetate_in_postmenopausal_women.png/450px-Norethisterone_and_ethinylestradiol_levels_after_a_single_oral_dose_of_10_mg_norethisterone_acetate_in_postmenopausal_women.png)

