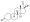Прогестаген (лекарство)
| Прогестаген (лекарство) | |
|---|---|
| Класс препарата | |
 Прогестерон , естественный прогестаген в организме и один из наиболее широко используемых прогестагенных препаратов. | |
| Идентификаторы классов | |
| Синонимы | прогестаген, гестаген, гестаген; прогестин (синтетический прогестаген); агонист рецепторов прогестерона |
| Использовать | Гормональный контроль над рождаемостью , гормональная терапия , гинекологические заболевания , медицина бесплодия и поддержка беременности , подавление половых гормонов и другие. |
| ATC code | G03 |
| Biological target | Progesterone receptors (PR-A, PR-B, PR-C); membrane progesterone receptors (mPRα, mPRβ, mPRγ, mPRδ, mPRε); progesterone receptor membrane components (PGRMC1, PGRMC2) |
| Chemical class | Steroids (pregnanes, norpregnanes, retropregnanes, androstanes, estranes) |
| Clinical data | |
| Drugs.com | Drug Classes |
| External links | |
| MeSH | D011372 |
| Legal status | |
| In Wikidata | |
Прогестаген гестагеном , также называемый прогестагеном , эффекты , или гестагеном , представляет собой тип лекарства аналогичные эффектам естественного женского полового гормона прогестерона . , которое оказывает на организм [ 1 ] Прогестин – это синтетический прогестаген. [ 1 ] Прогестагены чаще всего используются в гормональной контрацепции и гормональной терапии в менопаузе . [ 1 ] Их также можно использовать при лечении гинекологических заболеваний , для поддержки фертильности и беременности , для снижения уровня половых гормонов с различными целями и по другим показаниям. [ 1 ] Прогестагены используются отдельно или в сочетании с эстрогенами . [ 1 ] Они доступны в широком разнообразии форм и для применения различными путями введения . [ 1 ] Примеры прогестагенов включают природный или биоидентичный прогестерон , а также прогестины, такие как медроксипрогестерона ацетат и норэтистерон . [ 1 ]
Побочные эффекты прогестагенов включают нарушения менструального цикла , головные боли , тошноту , болезненность молочных желез , изменения настроения , прыщи , повышенный рост волос и изменения в выработке белка печенью . , среди прочего, [ 1 ] [ 2 ] Other side effects of progestogens may include an increased risk of breast cancer, cardiovascular disease, and blood clots.[2] At high doses, progestogens can cause low sex hormone levels and associated side effects like sexual dysfunction and an increased risk of bone fractures.[3]
Progestogens are agonists of the progesterone receptors (PRs) and produce progestogenic, or progestational, effects.[1] They have important effects in the female reproductive system (uterus, cervix, and vagina), the breasts, and the brain.[1] In addition, many progestogens also have other hormonal activities, such as androgenic, antiandrogenic, estrogenic, glucocorticoid, or antimineralocorticoid activity.[1] They also have antigonadotropic effects and at high doses can strongly suppress sex hormone production.[1] Progestogens mediate their contraceptive effects both by inhibiting ovulation and by thickening cervical mucus, thereby preventing fertilization.[4][5] They have functional antiestrogenic effects in certain tissues like the endometrium, and this underlies their use in menopausal hormone therapy.[1]
Progesterone was first introduced for medical use in 1934 and the first progestin, ethisterone, was introduced for medical use in 1939.[6][7][8] More potent progestins, such as norethisterone, were developed and started to be used in birth control in the 1950s.[6] Around 60 progestins have been marketed for clinical use in humans or use in veterinary medicine.[9][10][11][12][13] These progestins can be grouped into different classes and generations.[1][14][15] Progestogens are available widely throughout the world and are used in all forms of hormonal birth control and in most menopausal hormone therapy regimens.[1][9][10][12][11]
Medical uses
[edit]Available forms
[edit]Progestogens are available in many different forms for use by many different routes of administration. These include oral tablets and capsules, oil and aqueous solutions and suspensions for intramuscular or subcutaneous injection, and various others (e.g., transdermal patches, vaginal rings, intrauterine devices, subcutaneous implants).
Dozens of different progestogens have been marketed for clinical and/or veterinary use.
Birth control
[edit]Progestogens are used in a variety of different forms of hormonal birth control for females, including combined estrogen and progestogen forms like combined oral contraceptive pills, combined contraceptive patches, combined contraceptive vaginal rings, and combined injectable contraceptives; and progestogen-only forms like progestogen-only contraceptive pills ("mini-pills"), progestogen-only emergency contraceptive pills ("day-after pills"), progestogen-only contraceptive implants, progestogen-only intrauterine devices, progestogen-only contraceptive vaginal rings, and progestogen-only injectable contraceptives.[16][17][18][19]
Progestogens mediate their contraceptive effects by multiple mechanisms, including prevention of ovulation via their antigonadotropic effects; thickening of cervical mucus, making the cervix largely impenetrable to sperm; preventing capacitation of sperm due to changes in cervical fluid, thereby making sperm unable to penetrate the ovum; and atrophic changes in the endometrium, making the endometrium unsuitable for implantation.[20][21][22][23] They may also decrease tubal motility and ciliary action.[23]
Hormone therapy
[edit]Menopause and hypogonadism
[edit]Progestogens are used in combination with estrogens in menopausal hormone therapy in women. They are also used in combination with estrogens in hormone therapy for hypogonadism and delayed puberty in girls and women. They are used mainly to prevent endometrial hyperplasia and increased risk of endometrial cancer from unopposed estrogen therapy.
Transgender hormone therapy
[edit]Progestogens are used as a component of hormone therapy for transgender women and transgender men. They are used in transgender women in combination with estrogens to help suppress and block testosterone. Progestogens might also have other beneficial effects in transgender women, but these are controversial and unsupported at present. Examples of progestogens used in hormone therapy for transgender women include cyproterone acetate, medroxyprogesterone acetate, and progesterone. Progestogens, such as medroxyprogesterone and lynestrenol, are used in transgender men to help suppress menses. Progestogens have also been used to delay puberty in transgender boys and girls.
Other uses
[edit]Certain progestogens, including megestrol acetate, medroxyprogesterone acetate, cyproterone acetate, and chlormadinone acetate, have been used at high doses to reduce hot flashes in men undergoing androgen deprivation therapy, for instance to treat prostate cancer.[24][25][26]
Gynecological disorders
[edit]Menstrual disorders
[edit]Progestogens are used to treat menstrual disorders such as secondary amenorrhea and dysfunctional uterine bleeding.[17][18] In a normal menstrual cycle, declining levels of progesterone trigger menstruation. Progestogens such as norethisterone acetate and medroxyprogesterone acetate may be used to artificially induce progesterone-associated breakthrough bleeding.[27]
The progestogen challenge test or progestogen withdrawal test is used to diagnose amenorrhea. Due to the availability of assays to measure estrogen levels, it is now rarely used.
Uterine disorders
[edit]Progestogens are used in the prevention and treatment of uterine disorders such as endometrial hyperplasia, endometriosis, uterine fibroids, and uterine hypoplasia.
Breast disorders
[edit]Progestogens are used to treat benign breast disorders.[28][29] They are associated not only with a reduction in breast pain, but also a decrease in breast cell proliferation, a decrease in breast gland size, and a disappearance of breast nodularity.[28][29][30] Progestogens that have been used for such purposes include topical progesterone, dydrogesterone, promegestone, lynestrenol, medroxyprogesterone acetate, dienogest, and medrogestone.[28][29][31][30]
Progestogens are used in the treatment of breast hypoplasia and lactation insufficiency. This is because they induce lobuloalveolar development of the breasts, which is required for lactation and breastfeeding.
Enlarged prostate
[edit]Progestogens have been used at high doses to treat benign prostatic hyperplasia (BPH). They act by suppressing gonadal testosterone production and hence circulating testosterone levels. Androgens like testosterone stimulate the growth of the prostate gland.
Hormone-sensitive cancers
[edit]Endometrial cancer
[edit]Progestogens were first found to be effective at high doses in the treatment of endometrial hyperplasia and endometrial cancer in 1959.[32][33][34] Subsequently, high-dose gestonorone caproate, hydroxyprogesterone caproate, medroxyprogesterone acetate, and megestrol acetate were approved for the treatment of endometrial cancer.[35][36][37]
Breast cancer
[edit]Progestogens, such as megestrol acetate and medroxyprogesterone acetate, are effective at high doses in the treatment of advanced postmenopausal breast cancer.[38][39] They have been extensively evaluated as a second-line therapy for this indication.[38] However, they produce various side effects, such as dyspnea, weight gain, vaginal bleeding, nausea, fluid retention, hypertension, thrombophlebitis, and thromboembolic complications.[38][39] In addition, megestrol acetate has been found to be significantly inferior to aromatase inhibitors in the treatment of breast cancer, and in relation to this, progestogens have been moved down in the sequential therapy of the disease.[38] Megestrol acetate is the only Food and Drug Administration-approved progestogen for breast cancer.[38] The mechanism of action of progestogens in the treatment of breast cancer is unknown, but may be related to their functional antiestrogenic and/or antigonadotropic effects.[38]
Prostate cancer
[edit]Certain progestogens, particularly those with antiandrogenic properties, have been used at high doses in the treatment of prostate cancer.[40][41] These include cyproterone acetate, chlormadinone acetate, and megestrol acetate.[40][41] Other progestogens such as medroxyprogesterone acetate, hydroxyprogesterone caproate, and gestonorone caproate have also been studied, but have inadequate effectiveness. They act by suppressing gonadal testosterone production and hence circulating testosterone levels. Androgens like testosterone stimulate the growth of prostate tumors.
Fertility and pregnancy
[edit]Progestogens are used in fertility medicine for women. For example, progesterone (or sometimes dydrogesterone or hydroxyprogesterone caproate) is used for luteal support in in-vitro fertilization protocols.[42]
Certain progestogens are used to support pregnancy, including progesterone, hydroxyprogesterone caproate, dydrogesterone, and allylestrenol. They are used questionably for treatment of recurrent pregnancy loss and for prevention of preterm birth in pregnant women with a history of at least one spontaneous preterm birth.[42]
Puberty suppression
[edit]Progestogens have been used to treat precocious puberty in both boys and girls. They have also been used to delay puberty in transgender youth.
Sexual deviance
[edit]Certain progestogens, such as cyproterone acetate and medroxyprogesterone acetate, are used as a form of chemical castration to treat sexual deviance in men, particularly sex offenders. They are specifically used to treat paraphilias and hypersexuality. They work by suppressing gonadal testosterone production and hence circulating testosterone levels. This results in decreased libido and interference with erectile function and ability to attain orgasm.
Skin and hair conditions
[edit]Progestogens are used to treat androgen-dependent skin and hair conditions in women. These include oily skin, acne, seborrhea, hirsutism, scalp hair loss, and hidradenitis suppurativa. They act by suppressing testosterone levels and, in the case of antiandrogenic progestogens, by directly blocking the actions of androgens.
Androgen excess
[edit]Progestogens are used to treat hyperandrogenism, such as due to polycystic ovary syndrome and congenital adrenal hyperplasia, in women. Examples include cyproterone acetate and chlormadinone acetate.
Appetite stimulation
[edit]Certain progestins can be used at very high doses to increase appetite in conditions like cachexia, anorexia, and wasting syndromes. In general, they are used in combination with certain other steroid medications such as dexamethasone. Their effects take several weeks to become apparent, but are relatively long-lived when compared to those of corticosteroids. Furthermore, they are recognized as being the only medications to increase lean body mass. Megestrol acetate is the lead drug of this class for the management of cachexia, and medroxyprogesterone acetate is also used.[43][44] The mechanism of action of the appetite-related effects of these two medications is unknown and may not be related to their progestogenic activity. Very high doses of other progestogens, like cyproterone acetate, have minimal or no influence on appetite and weight.
Contraindications
[edit]Contraindications of progestogens may include breast cancer and a history of venous thromboembolism among others.[45][citation needed]
Side effects
[edit]Progestogens have relatively few side effects at typical dosages.[46] Side effects of progestogens may include tiredness, dysphoria, depression, mood changes, menstrual irregularities, hypomenorrhea, edema, vaginal dryness, vaginal atrophy, headaches, nausea, breast tenderness, decreased libido.[1][2][46] Progestins with androgenic activity, namely 19-nortestosterone derivatives, can also cause acne, hirsutism, seborrhea, voice deepening, changes in liver protein production (e.g., decreased HDL cholesterol, sex hormone-binding globulin), increased appetite, and weight gain, among others.[1][46] Other side effects of progestogens may include an increased risk of breast cancer, cardiovascular disease, and blood clots, among others.[2] Some of the side effects of progestogens are due not to their progestogenic activity but rather due to off-target activities (e.g., androgenic activity, glucocorticoid activity, antimineralocorticoid activity).[1][47] At high doses, due to their antigonadotropic effects, progestogens can cause low sex hormone levels and associated side effects like diminished secondary sexual characteristics, sexual dysfunction (e.g., reduced sex drive and erectile dysfunction), reversible infertility, reduced bone mineral density, and an increased risk of bone fractures, both in men and in premenopausal women.[3]
Mood changes
[edit]Birth control
[edit]The available evidence on the risk of mood changes and depression with progestogens in hormonal birth control is limited.[48][49] As of 2019, there is no consistent evidence for adverse effects on mood of hormonal birth control, including progestogen-only birth control and combined birth control, in the general population.[50][51] Most women taking combined birth control experience no influence or a beneficial effect on mood.[48][51][49] Adverse effects on mood appear to be infrequent, occurring only in a small percentage of women.[48][51][49] About 5 to 10% of women experience negative mood changes with combined birth control pills, and about 5% of women discontinue birth control pills due to such changes.[52][48] A study of about 4,000 women found that progestogen-only birth control with depot medroxyprogesterone acetate had an incidence of depression of 1.5% and discontinuation due to depression of 0.5%.[51][53][54] Beneficial effects of hormonal birth control such as decreased menstrual pain and bleeding may positively influence mood.[48]
A 2018 systematic review of 26 studies, including 5 randomized controlled trials and 21 observational studies, found that the overall evidence showed no association between progestogen-only birth control and depression.[51] The progestins assessed included depot medroxyprogesterone acetate, levonorgestrel-containing contraceptive implants and intrauterine devices, and progestogen-only birth control pills.[51] Findings of large observational studies are mixed due to prominent confounding factors, but overall show no association of hormonal birth control with depression.[50][51] Randomized controlled trials typically do not find clinically significant influences of hormonal birth control on mood.[50][51] Reviews from before 1980 reported a high incidence of adverse mood effects with combined birth control pills.[48] However, doses of estrogens and progestogens in birth control pills before 1980 were considerably higher than those used today, and these doses frequently caused unpleasant side effects that may have unfavorably influenced mood.[48][55]
Mood with birth control pills may be better with monophasic and continuous formulations than with triphasic and cyclic formulations.[48][52] Limited and inconsistent evidence supports differences in mood with hormonal birth control using different doses of ethinylestradiol or different routes of administration, such as birth control pills versus contraceptive vaginal rings and contraceptive patches.[48][52] Combined birth control with less androgenic or antiandrogenic progestins like desogestrel, gestodene, and drospirenone may have a more favorable influence on mood than birth control with more androgenic progestins like levonorgestrel.[48][52] However, androgen supplementation with hormonal birth control has also been reported to improve mood.[48]
Hormonal birth control that suppresses ovulation is effective in the treatment of premenstrual dysphoric disorder (PMDD).[50][56] Combined birth control pills containing drospirenone are approved for the treatment of PMDD and may be particularly beneficial due to the antimineralocorticoid activity of drospirenone.[50][57][58] Studies on the influence of hormonal birth control on mood in women with existing mood disorders or polycystic ovary syndrome are limited and mixed.[50][48] Women with underlying mood disorders may be more likely to experience mood changes with hormonal birth control.[48][50][59] A 2016 systematic review found based on limited evidence from 6 studies that hormonal birth control, including combined birth control pills, depot medroxyprogesterone acetate, and levonorgestrel-containing intrauterine devices, was not associated with worse outcomes compared to non-use in women with depressive or bipolar disorders.[60] A 2008 Cochrane review found a greater likelihood of postpartum depression in women given norethisterone enanthate as a form of progestogen-only injectable birth control, and recommended caution on the use of progestogen-only birth control in the postpartum period.[61]
Studies suggest a negativity bias in emotion recognition and reactivity with hormonal birth control.[59] Some data suggests blunted reward responses and potential dysregulation of the stress response with hormonal birth control in some women.[59][50]
Hormone therapy
[edit]Estrogen therapy appears to have a beneficial influence on mood in depressed and euthymic perimenopausal women.[62][63][64] Conversely, research on combined estrogen and progestogen therapy for depressive symptoms in menopausal women is scarce and inconclusive.[62][63] Some researchers contend that progestogens have an adverse influence on mood and reduce the benefits of estrogens on mood,[65][66][2] whereas other researchers maintain that progestogens have no adverse influence on mood.[67][68] Progesterone differs from progestins in terms of effects in the brain and might have different effects on mood in comparison.[2][69][1] The available evidence, although limited, suggests no adverse influence of progesterone on mood when used in menopausal hormone therapy.[70]
Sexual function
[edit]In most women, sexual desire is unchanged or increased with combined birth control pills.[71] This is despite an increase in sex hormone-binding globulin (SHBG) levels and a decrease in total and free testosterone levels.[71][72] However, findings are conflicting, and more research is needed.[73]
Blood clots
[edit]Venous thromboembolism (VTE) consists of deep vein thrombosis (DVT) and pulmonary embolism (PE).[74] DVT is a blood clot in a deep vein, most commonly in the legs, while PE occurs when a clot breaks free and blocks an artery in the lungs.[74] VTE is a rare but potentially fatal cardiovascular event.[74] Estrogens and progestogens can increase coagulation by modulating synthesis of coagulation factors.[1][75][76][77] As a result, they increase the risk of VTE, especially during pregnancy when estrogen and progesterone levels are very high as well as during the postpartum period.[75][76][78] Physiological levels of estrogen and/or progesterone may also influence risk of VTE—with late menopause (≥55 years) being associated with greater risk than early menopause (≤45 years).[79][80]
Progestogen monotherapy
[edit]Progestogens when used by themselves at typical clinical dosages, for instance in progestogen-only birth control, do not affect coagulation[81][82][83][84][75][77] and are not generally associated with a higher risk of venous thromboembolism (VTE).[85][86][87][88] An exception is medroxyprogesterone acetate as a progestogen-only injectable contraceptive, which has been associated with a 2- to 4-fold increase in risk of VTE relative to other progestogens and non-use.[89][90][91][92][93][94][88] The reasons for this are unknown, but the observations might be a statistical artifact of preferential prescription of depot medroxyprogesterone acetate to women at risk for VTE.[90] Alternatively, medroxyprogesterone acetate may be an exception among progestogens in terms of influence on VTE risk,[88][92][81][94] possibly due to its partial glucocorticoid activity.[1][6][81] In contrast to depot medroxyprogesterone acetate, no increase in VTE risk has been observed with moderately high doses of the related progestin chlormadinone acetate (10 mg/day for 18–20 days/cycle), though based on limited data.[94][95]
Very-high-dose progestogen therapy, including with medroxyprogesterone acetate, megestrol acetate, and cyproterone acetate, has been associated with activation of coagulation and a dose-dependent increased risk of VTE.[82][87][96][97][98][99] In studies with high-dose cyproterone acetate specifically, the increase in VTE risk has ranged from 3- to 5-fold.[96][98][99] The incidence of VTE in studies with very-high-dose progestogen therapy has been found to range from 2 to 8%.[82][100][101] However, the relevant patient populations, namely aged individuals with cancer, are already predisposed to VTE, and this greatly amplifies the risk.[82][87][102]
Estrogen plus progestogen therapy
[edit]In contrast to progestogen-only birth control, the addition of progestins to oral estrogen therapy, including in combined birth control pills and menopausal hormone therapy, is associated with a higher risk of VTE than with oral estrogen therapy alone.[103][104][105][106][107] The risk of VTE is increased by about 2-fold or less with such regimens in menopausal hormone therapy and by 2- to 4-fold with combined birth control pills containing ethinylestradiol, both relative to non-use.[103][76][106][107] In contrast to oral estrogen therapy, parenteral estradiol, such as with transdermal estradiol, is not associated with a higher risk of VTE.[103][92][106] This is likely due to its lack of first-pass effect in the liver.[1][89] Research is mixed on whether addition of progestins to transdermal estradiol is associated with a greater risk of VTE, with some studies finding no increase in risk and others finding higher risk.[103][92][106] Unlike the case of transdermal estradiol, VTE risk is not lower with ethinylestradiol-containing contraceptive vaginal rings and contraceptive patches compared to combined birth control pills with ethinylestradiol.[76][108][81] This is thought to be due to the resistance of ethinylestradiol to hepatic metabolism.[1][109][89][81]
The type of progestin in combined birth control may modulate the risk of VTE.[104][105][94] Studies have found that combined birth control pills containing newer-generation progestins such as desogestrel, gestodene, norgestimate, drospirenone, and cyproterone acetate are associated with a 1.5- to 3-fold higher risk of VTE than birth control pills containing first-generation progestins such as levonorgestrel and norethisterone.[104][105][107][94][110][111] However, although this has been apparent in retrospective cohort and nested case–control studies, no greater risk of VTE has been observed in prospective cohort and case–control studies.[104][105][112][113][107] These kinds of observational studies have certain advantages over the aforementioned types of studies, such as better ability to control for confounding factors like new-user bias.[113][81] As such, it is unclear whether the higher risk of VTE with newer-generation birth control pills is a real finding or a statistical artifact.[113] Androgenic progestins have been found to antagonize to some degree the effect of estrogens on coagulation.[83][84][75][114][81] First-generation progestins are more androgenic, while newer-generation progestins are weakly androgenic or antiandrogenic, and this might explain the observed differences in risk of VTE.[104][115][75][114] The type of estrogen also influences VTE risk.[109][116][117] Birth control pills containing estradiol valerate are associated with about half the VTE risk of birth control pills with ethinylestradiol.[116][117]
The type of progestogen in combined menopausal hormone therapy may also modulate VTE risk.[118][119] Oral estrogens plus dydrogesterone appears to have lower VTE risk relative to inclusion of other progestins.[120][121][106] Norpregnane derivatives such as nomegestrol acetate and promegestone have been associated with a significantly greater risk of VTE than pregnane derivatives such as medroxyprogesterone acetate and dydrogesterone and nortestosterone derivatives such as norethisterone and levonorgestrel.[118][119] However, these findings may just be statistical artifacts.[119] In contrast to progestins, the addition of oral progesterone to either oral or transdermal estrogen therapy is not associated with a higher risk of VTE.[92][122] However, oral progesterone achieves very low progesterone levels and has relatively weak progestogenic effects, which might be responsible for the absence of increase in VTE risk.[122] Parenteral progesterone, such as vaginal or injectable progesterone, which can achieve luteal-phase levels of progesterone and associated progestogenic effects, has not been characterized in terms of VTE risk.[122]
A 2012 meta-analysis estimated that the absolute risk of VTE is 2 per 10,000 women for non-use, 8 per 10,000 women for ethinylestradiol and levonorgestrel-containing birth control pills, and 10 to 15 per 10,000 women for birth control pills containing ethinylestradiol and a newer-generation progestin.[76] For comparison, the absolute risk of VTE is generally estimated as 1 to 5 per 10,000 woman-years for non-use, 5 to 20 per 10,000 woman-years for pregnancy, and 40 to 65 per 10,000 woman-years for the postpartum period.[76] Risk of VTE with estrogen and progestogen therapy is highest at the start of treatment, particularly during the first year, and decreases over time.[89][123] Older age, higher body weight, lower physical activity, and smoking are all associated with a higher risk of VTE with oral estrogen and progestogen therapy.[89][122][123][124] Women with thrombophilia have a dramatically higher risk of VTE with estrogen and progestogen therapy than women without thrombophilia.[76][108] Depending on the condition, risk of VTE can be increased as much as 50-fold in such women relative to non-use.[76][108]
Estrogens induce the production of sex hormone-binding globulin (SHBG) in the liver.[1][81] As such, SHBG levels indicate hepatic estrogenic exposure and may be a reliable surrogate marker for coagulation and VTE risk with estrogen therapy.[125][126][127] Combined birth control pills containing different progestins result in SHBG levels that are increased 1.5- to 2-fold with levonorgestrel, 2.5- to 4-fold with desogestrel and gestodene, 3.5- to 4-fold with drospirenone and dienogest, and 4- to 5-fold with cyproterone acetate.[125] SHBG levels differ depending on the progestin because androgenic progestins oppose the effect of ethinylestradiol on hepatic SHBG production as with its procoagulatory effects.[1][81] Contraceptive vaginal rings and contraceptive patches likewise have been found to increase SHBG levels by 2.5-fold and 3.5-fold, respectively.[125][81] Birth control pills containing high doses of ethinylestradiol (>50 μg) can increase SHBG levels by 5- to 10-fold, which is similar to the increase that occurs during pregnancy.[128] Conversely, increases in SHBG levels are much lower with estradiol, especially when it is used parenterally.[129][130][131][132][133] Estradiol-containing combined birth control pills, like estradiol valerate/dienogest and estradiol/nomegestrol acetate, and high-dose parenteral polyestradiol phosphate therapy have both been found to increase SHBG levels by about 1.5-fold.[81][134][132][131]
Hormone therapy with high-dose ethinylestradiol and cyproterone acetate in transgender women has been associated with a 20- to 45-fold higher risk of VTE relative to non-use.[102][123] The absolute incidence was about 6%.[102][123] Conversely, the risk of VTE in transgender women is much lower with oral or transdermal estradiol plus high-dose cyproterone acetate.[102][123] Ethinylestradiol is thought to have been primarily responsible for the VTE risk, but cyproterone acetate may have contributed as well.[102] Ethinylestradiol is no longer used in transgender hormone therapy,[135][136][137] and doses of cyproterone acetate have been reduced.[138][139]
Cardiovascular health
[edit]Progestogens may influence the risk of cardiovascular disease in women.[118] In the women's Health Initiative (WHI), the risk of coronary heart disease was greater with the combination of estrogen plus a progestin (specifically medroxyprogesterone acetate) than with estrogen alone.[140][141][142] However, progestogens have varying activities and may differ in terms of cardiovascular risk.[118][143][144][145][146][147] A 2015 Cochrane review provided strong evidence that the treatment of post-menopausal women with hormone therapy for cardiovascular disease had little if any effect and increased the risk of stroke and venous thromboembolic events.[148] It is thought that androgenic progestins like medroxyprogesterone acetate and norethisterone may antagonize the beneficial effects of estrogens on biomarkers of cardiovascular health (e.g., favorable lipid profile changes).[118][149] However, these findings are mixed and controversial.[149] Differences of progestogens on cardiovascular health and risk have been reviewed and summarized:[118]
- "Unfortunately, there are few long-term clinical studies comparing different progestogens used in [hormone therapy] with respect to cardiovascular outcomes. However, some aspects of potential cardiovascular risk have been examined, namely effects on lipids, vascular function/blood pressure, inflammation, thrombosis, and carbohydrate metabolism. [...] Although progestins have differing effects on aspects of cardiovascular risk, in general, those more similar to progesterone have been associated with a lower impact than the more androgenic progestins on the beneficial effects of concomitant estrogen therapy. However, the limited number of long-term clinical studies makes it difficult to extrapolate the short-term effects on various markers of cardiovascular risk to long-term cardiovascular morbidity."[118]
Route of administration might also influence the cardiovascular health effects of progestogens, but more research is needed similarly.[150]
Breast cancer
[edit]Estrogen alone, progestogen alone, and combined estrogen and progestogen therapy are all associated with increased risks of breast cancer when used in menopausal hormone therapy for peri- and postmenopausal women relative to non-use.[151][152][153] These risks are higher for combined estrogen and progestogen therapy than with estrogen alone or progestogen alone.[151][153] In addition to breast cancer risk, estrogen alone and estrogen plus progestogen therapy are associated with higher breast cancer mortality.[154] With 20 years of use, breast cancer incidence is about 1.5-fold higher with estrogen alone and about 2.5-fold higher with estrogen plus progestogen therapy relative to non-use.[151] The increase in breast cancer risk with estrogen and progestogen therapy was shown to be causal with conjugated estrogens plus medroxyprogesterone acetate in the Women's Health Initiative randomized controlled trials.[122][155]
Breast cancer risk with combined estrogen and progestogen therapy may differ depending on the progestogen used.[152][151][118][156] Progestins including chlormadinone acetate, cyproterone acetate, medrogestone, medroxyprogesterone acetate, nomegestrol acetate, norethisterone acetate, promegestone, and tibolone have all been associated with similarly increased risk of breast cancer.[156][152][151] Some research has found that oral progesterone and dydrogesterone with short-term use (<5 years) may be associated with lower risk of breast cancer relative to other progestins.[152][151][118][156] In the long-term however (>5 years), oral progesterone and dydrogesterone have been associated with significantly increased breast cancer risk similarly to other progestogens.[151][157] The lower risk of breast cancer with oral progesterone than with other progestogens may be related to the very low progesterone levels and relatively weak progestogenic effects it produces.[158][122][6]
The risk of breast cancer with estrogen and progestogen therapy in peri- and postmenopausal women is dependent on the duration of treatment, with more than 5 years of use being associated with significantly greater risk than less than five years of use.[151][152] In addition, continuous estrogen and progestogen therapy is associated with a higher risk of breast cancer than cyclic use.[151][152]
A nationwide observational study found that transfeminine hormone therapy with estrogen plus high-dose cyproterone acetate was associated with a 46-fold increased risk of breast cancer in transgender women relative to the expected incidence for cisgender men.[159][160][161][162] However, the risk of breast cancer was still lower than that in cisgender women.[159][160][161][162] The extent to which the increase in breast cancer risk was related to estrogen versus cyproterone acetate is unknown.[159][160][161][162]
Overdose
[edit]Progestogens are relatively safe in acute overdose.[citation needed]
Interactions
[edit]Inhibitors and inducers of cytochrome P450 enzymes and other enzymes such as 5α-reductase may interact with progestogens.[citation needed]
Pharmacology
[edit]Pharmacodynamics
[edit]Progestogens act by binding to and activating the progesterone receptors (PRs), including the PR-A, PR-B, and PR-C.[1][163][164] Major tissues affected by progestogens include the uterus, cervix, vagina, breasts, and brain.[1] By activating PRs in the hypothalamus and pituitary gland, progestogens suppress the secretion of gonadotropins and thereby function as antigonadotropins at sufficiently high doses.[1] Progesterone interacts with membrane progesterone receptors, but interaction of progestins with these receptors is less clear.[165][166] In addition to their progestogenic activity, many progestogens have off-target activities such as androgenic, antiandrogenic, estrogenic, glucocorticoid, and antimineralocorticoid activity.[1][2][47]
Progestogens mediate their contraceptive effects in women both by inhibiting ovulation (via their antigonadotropic effects) and by thickening cervical mucus, thereby preventing the possibility of fertilization of the ovum by sperm.[4][5] Progestogens have functional antiestrogenic effects in various tissues like the endometrium via activation of the PR, and this underlies their use in menopausal hormone therapy (to prevent unopposed estrogen-induced endometrial hyperplasia and endometrial cancer).[1] The PRs are induced in the breasts by estrogens, and for this reason, it is assumed that progestogens cannot mediate breast changes in the absence of estrogens.[167] The off-target activities of progestogens can contribute both to their beneficial effects and to their adverse effects.[1][2][58]
| Progestogen | Class | Off-target activities | Relative binding affinities (%) | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ES | AN | AA | GC | AM | PR | AR | ER | GR | MR | SHBG | CBG | |||
| Allylestrenola | Estrane | – | ± | – | – | – | 1 | 0 | 0 | 0 | ? | 0 | ? | |
| Chlormadinone acetate | Pregnane | – | – | + | + | – | 67 | 5 | 0 | 8 | 0 | 0 | 0 | |
| Cyproterone acetate | Pregnane | – | – | ++ | + | – | 90 | 6 | 0 | 6 | 8 | 0 | 0 | |
| Demegestone | Norpregnane | – | – | – | – | – | 115 | 1 | 0 | 5 | 1–2 | ? | ? | |
| Desogestrela | Gonane | – | + | – | ± | – | 1 | 0 | 0 | 0 | 0 | 0 | 0 | |
| Dienogest | Gonane | – | – | + | – | – | 5 | 10 | 0 | 1 | 0 | 0 | 0 | |
| Drospirenone | Spirolactone | – | – | + | – | + | 35 | 65 | 0 | 6 | 230 | 0 | 0 | |
| Dydrogesteronea | Pregnane | – | – | – | – | ± | 75 | 0 | ? | ? | ? | ? | ? | |
| Ethisterone | Androstane | – | + | – | – | – | 18 | 0 | 0 | 0 | 0 | ? | ? | |
| Etonogestrel | Gonane | – | + | – | ± | – | 150 | 20 | 0 | 14 | 0 | 15 | 0 | |
| Etynodiola,b | Estrane | + | + | – | – | – | 1 | 0 | 11–18 | 0 | ? | ? | ? | |
| Etynodiol diacetatea | Estrane | + | + | – | – | – | 1 | 0 | 0 | 0 | 0 | ? | ? | |
| Gestodene | Gonane | – | + | – | + | + | 90–432 | 85 | 0 | 27–38 | 97–290 | 40 | 0 | |
| Gestonorone caproate | Pregnane | – | – | – | – | – | ? | ? | ? | ? | ? | ? | ? | |
| Hydroxyprogesterone caproate | Pregnane | – | – | – | – | ± | ? | ? | ? | ? | ? | ? | ? | |
| Levonorgestrel | Gonane | – | + | – | – | – | 150–162 | 45 | 0 | 1–8 | 17–75 | 50 | 0 | |
| Lynestrenola | Estrane | + | + | – | – | – | 1 | 1 | 3 | 0 | 0 | ? | ? | |
| Medrogestone | Pregnane | – | – | ± | – | – | ? | ? | ? | ? | ? | ? | ? | |
| Medroxyprogesterone acetate | Pregnane | – | ± | – | + | – | 115–149 | 5 | 0 | 29–58 | 3–160 | 0 | 0 | |
| Megestrol acetate | Pregnane | – | ± | + | + | – | 65 | 5 | 0 | 30 | 0 | 0 | 0 | |
| Nomegestrol acetate | Norpregnane | – | – | + | – | – | 125 | 42 | 0 | 6 | 0 | 0 | 0 | |
| Norelgestromin | Gonane | – | ± | – | – | – | 10 | 0 | ? | ? | ? | 0 | ? | |
| Norethisterone | Estrane | + | + | – | – | – | 67–75 | 15 | 0 | 0–1 | 0–3 | 16 | 0 | |
| Norethisterone acetatea | Estrane | + | + | – | – | – | 20 | 5 | 1 | 0 | 0 | ? | ? | |
| Norethisterone enanthatea | Estrane | + | + | – | – | – | ? | ? | ? | ? | ? | ? | ? | |
| Noretynodrela | Estrane | + | ± | – | – | – | 6 | 0 | 2 | 0 | 0 | 0 | 0 | |
| Norgestimatea | Gonane | – | + | – | – | – | 15 | 0 | 0 | 1 | 0 | 0 | 0 | |
| Progesterone | Pregnane | – | – | ± | + | + | 50 | 0 | 0 | 10 | 100 | 0 | 36 | |
| Promegestonea | Norpregnane | – | – | – | + | – | 100 | 0 | 0 | 5 | 53 | 0 | 0 | |
| Segesterone acetate | Norpregnane | – | – | – | – | – | 136 | 0 | 0 | 38 | ? | 0 | ? | |
| Tibolonea | Estrane | + | ++ | – | – | – | 6 | 6 | 1 | ? | ? | ? | ||
| Δ4-Tiboloneb | Estrane | – | ++ | – | – | – | 90 | 35 | 1 | 0 | 2 | 1 | 0 | |
| Trimegestone | Norpregnane | – | – | ± | – | ± | 294–330 | 1 | 0 | 9–13 | 42–120 | ? | ? | |
| Footnotes: a = Prodrug. b = Metabolite (non-marketed). Class: Pregnane = Progesterone derivative. Norpregnane = 19-Norprogesterone derivative. Androstane = Testosterone derivative. Estrane = 19-Nortestosterone derivative. Gonane = 13β-Ethylgonane = 18-Methyl-19-nortestosterone derivative. Spirolactone = Spirolactone derivative. Magnitude: ++ = High. + = Moderate. ± = Low. – = None. Activity: ES = Estrogenic. AN = Androgenic. AA = Antiandrogenic. GC = Glucocorticoid. AM = Antimineralocorticoid. Binding: PR: Promegestone = 100%. AR: Metribolone = 100%. ER: Estradiol = 100%. GR: Dexamethasone = 100%. MR: Aldosterone = 100%. SHBG: DHT = 100%. CBG: Cortisol = 100%. Sources: See template. | ||||||||||||||
| Compound | Doses for specific uses (mg/day)[a] | |||||||
|---|---|---|---|---|---|---|---|---|
| OID | TFD | MDT | BCPD | ECD | ||||
| Cycle | Daily | |||||||
| Allylestrenol | 25 | 150–300 | - | 30 | – | - | ||
| Bromoketoprogesterone[b] | - | - | 100–160 | - | – | - | ||
| Chlormadinone acetate | 1.5–4.0 | 20–30 | 3–10 | 1.0–4.0 | 2.0 | 5–10 | ||
| Cyproterone acetate | 1.0 | 20–30 | 1.0–3.0 | 1.0–4.0 | 2.0 | 1.0 | ||
| Desogestrel | 0.06 | 0.4–2.5 | 0.15 | 0.25 | 0.15 | 0.15 | ||
| Dienogest | 1.0 | 6.0–6.3 | - | - | 2.0–3.0 | 2.0 | ||
| Drospirenone | 2.0 | 40–80 | - | - | 3.0 | 2.0 | ||
| Dydrogesterone | >30 | 140–200 | 10–20 | 20 | – | 10 | ||
| Ethisterone | - | 200–700 | 50–250 | - | – | - | ||
| Etynodiol diacetate | 2.0 | 10–15 | - | 1.0 | 1.0–20 | - | ||
| Gestodene | 0.03 | 2.0–3.0 | - | - | 0.06–0.075 | 0.20 | ||
| Hydroxyprogest. acetate | - | - | 70–125 | - | 100 | - | ||
| Hydroxyprogest. caproate | - | 700–1400 | 70 | - | – | - | ||
| Levonorgestrel | 0.05 | 2.5–6.0 | 0.15–0.25 | 0.5 | 0.1–0.15 | 0.075 | ||
| Lynestrenol | 2.0 | 35–150 | 5.0 | 10 | - | - | ||
| Medrogestone | 10 | 50–100 | 10 | 15 | – | 10 | ||
| Medroxyprogest. acetate | 10 | 40–120 | 2.5–10 | 20–30 | 5–10 | 5.0 | ||
| Megestrol acetate | >5[c] | 30–70 | - | 5–10 | 1.0–5.0 | 5.0 | ||
| Nomegestrol acetate | 1.25–5.0 | 100 | 5.0 | - | 2.5 | 3.75–5.0 | ||
| Norethandrolone[b] | - | - | 10 | - | – | - | ||
| Norethisterone | 0.4–0.5 | 100–150 | 5–10 | 10–15 | 0.5 | 0.7–1.0 | ||
| Norethisterone acetate | 0.5 | 30–60 | 2.5–5.0 | 7.5 | 0.6 | 1.0 | ||
| Norethist. acetate (micron.) | - | 12–14 | - | - | – | - | ||
| Noretynodrel | 4.0 | 150–200 | - | 14 | 2.5–10 | - | ||
| Norgestimate | 0.2 | 2.0–10 | - | - | 0.25 | 0.09 | ||
| Norgestrel | 0.1 | 12 | - | 0.5–2.0 | - | - | ||
| Normethandrone | - | 150 | 10 | - | – | - | ||
| Progesterone (non-micron.) | >300[d] | - | - | - | - | - | ||
| Progesterone (micronized) | - | 4200 | 200–300 | 1000 | – | 200 | ||
| Promegestone | 0.5 | 10 | 0.5 | - | – | 0.5 | ||
| Tibolone | 2.5 | - | - | - | – | - | ||
| Trengestone | - | 50–70 | - | - | – | - | ||
| Trimegestone | 0.5 | - | 0.25–0.5 | - | – | 0.0625–0.5 | ||
Notes and sources | ||||||||
| Compound | Form | Dose for specific uses (mg)[c] | DOA[d] | |||
|---|---|---|---|---|---|---|
| TFD[e] | POICD[f] | CICD[g] | ||||
| Algestone acetophenide | Oil soln. | - | – | 75–150 | 14–32 d | |
| Gestonorone caproate | Oil soln. | 25–50 | – | – | 8–13 d | |
| Hydroxyprogest. acetate[h] | Aq. susp. | 350 | – | – | 9–16 d | |
| Hydroxyprogest. caproate | Oil soln. | 250–500[i] | – | 250–500 | 5–21 d | |
| Medroxyprog. acetate | Aq. susp. | 50–100 | 150 | 25 | 14–50+ d | |
| Megestrol acetate | Aq. susp. | - | – | 25 | >14 d | |
| Norethisterone enanthate | Oil soln. | 100–200 | 200 | 50 | 11–52 d | |
| Progesterone | Oil soln. | 200[i] | – | – | 2–6 d | |
| Aq. soln. | ? | – | – | 1–2 d | ||
| Aq. susp. | 50–200 | – | – | 7–14 d | ||
|
Notes and sources: | ||||||
Antigonadotropic effects
[edit]Progestogens, similarly to the androgens and estrogens through their own respective receptors, inhibit the secretion of the gonadotropins follicle-stimulating hormone (FSH) and luteinizing hormone (LH) via activation of the PR in the pituitary gland. This effect is a form of negative feedback on the hypothalamic–pituitary–gonadal axis (HPG axis) and takes advantage of the mechanism that the body uses to prevent sex hormone levels from becoming too high.[215][216][217] Accordingly, progestogens, both endogenous and exogenous (i.e., progestins), have antigonadotropic effects,[218] and progestogens in sufficiently high amounts can markedly suppress the body's normal production of progestogens, androgens, and estrogens as well as inhibit fertility (ovulation in women and spermatogenesis in men).[217]
Progestogens have been found to maximally suppress circulating testosterone levels in men by up to 70 to 80% at sufficiently high doses.[219][220] This is notably less than that achieved by GnRH analogues, which can effectively abolish gonadal production of testosterone and suppress circulating testosterone levels by as much as 95%.[221] It is also less than that achieved by high-dose estrogen therapy, which can suppress testosterone levels into the castrate range similarly to GnRH analogues.[222]
The retroprogesterone derivatives dydrogesterone and trengestone are atypical progestogens and unlike all other clinically used progestogens do not have antigonadotropic effects nor inhibit ovulation even at very high doses.[1][223] In fact, trengestone may have progonadotropic effects, and is actually able to induce ovulation, with about a 50% success rate on average.[223] These progestins also show other atypical properties relative to other progestogens, such as a lack of a hyperthermic effect.[1][223]
Androgenic activity
[edit]Some progestins have androgenic activity and can produce androgenic side effects such as increased sebum production (oilier skin), acne, and hirsutism (excessive facial/body hair growth), as well as changes in liver protein production.[224][225][226] Only certain progestins are androgenic however, these being the testosterone derivatives and, to a lesser extent, the 17α-hydroxyprogesterone derivatives medroxyprogesterone acetate and megestrol acetate.[227][225][228] No other progestins have such activity (though some, conversely, possess antiandrogenic activity).[225][228] Moreover, the androgenic activity of progestins within the testosterone derivatives also varies, and while some may have high or moderate androgenic activity, others have only low or no such activity.[21][229]
The androgenic activity of androgenic progestins is mediated by two mechanisms: 1) direct binding to and activation of the androgen receptor; and 2) displacement of testosterone from sex hormone-binding globulin (SHBG), thereby increasing free (and thus bioactive) testosterone levels.[230] The androgenic activity of many androgenic progestins is offset by combination with ethinylestradiol, which robustly increases SHBG levels, and most oral contraceptives in fact markedly reduce free testosterone levels and can treat or improve acne and hirsutism.[230] An exception is progestin-only contraceptives, which do not also contain an estrogen.[230]
The relative androgenic activity of testosterone-derivative progestins and other progestins that have androgenic activity can be roughly ranked as follows:
- Very high: danazol, ethisterone, gestrinone, normethandrone, norvinisterone[231][232][233][234]
- High: levonorgestrel, norgestrel, norgestrienone, tibolone[21][229][231][7][235][236][1]
- Moderate: norethisterone and its prodrugs (norethisterone acetate, norethisterone enanthate, etynodiol diacetate, lynestrenol, quingestanol acetate)[237][21][229][235][238]
- Low: desogestrel, etonogestrel, gestodene, norgestimate[235][238][239]
- Very low or negligible: allylestrenol, dimethisterone, medroxyprogesterone acetate, megestrol acetate, norelgestromin, noretynodrel, norgesterone[1][240][241][242][243][244][245][246]
- Antiandrogenic: dienogest, oxendolone[247][1]
The clinical androgenic and anabolic activity of the androgenic progestins listed above is still far lower than that of conventional androgens and anabolic steroids like testosterone and nandrolone esters. As such, they are only generally associated with such effects in women and often only at high doses. In men, due to their concomitant progestogenic activity and by extension antigonadotropic effects, these progestins can have potent functional antiandrogenic effects via suppression of testosterone production and levels.
Antiandrogenic activity
[edit]Some progestogens have antiandrogenic activity in addition to their progestogenic activity.[248] These progestogens, with varying degrees of potency as antiandrogens, include chlormadinone acetate, cyproterone acetate, dienogest, drospirenone, medrogestone, megestrol acetate, nomegestrol acetate, osaterone acetate (veterinary), and oxendolone.[248][247][249][250] The relative antiandrogenic activity in animals of some of these progestogens has been ranked as follows: cyproterone acetate (100%) > nomegestrol acetate (90%) > dienogest (30–40%) ≥ chlormadinone acetate (30%) = drospirenone (30%).[1][83] Antiandrogenic activity in certain progestogens may help to improve symptoms of acne, seborrhea, hirsutism, and other androgen-dependent conditions in women.[1][248]
Estrogenic activity
[edit]A few progestins have weak estrogenic activity.[1] These include the 19-nortestosterone derivatives norethisterone, noretynodrel, and tibolone, as well as the norethisterone prodrugs[251] norethisterone acetate, norethisterone enanthate, lynestrenol, and etynodiol diacetate.[1] The estrogenic activity of norethisterone and its prodrugs are due to metabolism into ethinylestradiol.[1] High doses of norethisterone and noretynodrel have been associated with estrogenic side effects such as breast enlargement in women and gynecomastia in men, but also with alleviation of menopausal symptoms in postmenopausal women.[252] In contrast, non-estrogenic progestins were not found to be associated with such effects.[252]
Glucocorticoid activity
[edit]Some progestogens, mainly certain 17α-hydroxyprogesterone derivatives, have weak glucocorticoid activity.[253] This can result, at sufficiently high doses, in side effects such as symptoms of Cushing's syndrome, steroid diabetes, adrenal suppression and insufficiency, and neuropsychiatric symptoms like depression, anxiety, irritability, and cognitive impairment.[253][254][255] Progestogens with the potential for clinically relevant glucocorticoid effects include the 17α-hydroxyprogesterone derivatives chlormadinone acetate, cyproterone acetate, medroxyprogesterone acetate, megestrol acetate, promegestone, and segesterone acetate and the testosterone derivatives desogestrel, etonogestrel, and gestodene.[1][254][256][257] Conversely, hydroxyprogesterone caproate possesses no such activity, while progesterone itself has very weak glucocorticoid activity.[258][1]
| Steroid | Class | TR (↑)a | GR (%)b |
|---|---|---|---|
| Dexamethasone | Corticosteroid | ++ | 100 |
| Ethinylestradiol | Estrogen | – | 0 |
| Etonogestrel | Progestin | + | 14 |
| Gestodene | Progestin | + | 27 |
| Levonorgestrel | Progestin | – | 1 |
| Medroxyprogesterone acetate | Progestin | + | 29 |
| Norethisterone | Progestin | – | 0 |
| Norgestimate | Progestin | – | 1 |
| Progesterone | Progestogen | + | 10 |
| Footnotes: a = Thrombin receptor (TR) upregulation (↑) in vascular smooth muscle cells (VSMCs). b = RBA (%) for the glucocorticoid receptor (GR). Strength: – = No effect. + = Pronounced effect. ++ = Strong effect. Sources: [259] | |||
Antimineralocorticoid activity
[edit]Certain progestogens, including progesterone, drospirenone, and gestodene, as well as to a lesser extent dydrogesterone and trimegestone, have varying degrees of antimineralocorticoid activity.[1][58] Other progestins might also have significant antimineralocorticoid activity.[260] Progesterone itself has potent antimineralocorticoid activity.[1] No clinically used progestogens are known to have mineralocorticoid activity.[1]
Progestins with potent antimineralocorticoid activity like drospirenone may have properties more similar to those of natural progesterone, such as counteraction of cyclical estrogen-induced sodium and fluid retention, edema, and associated weight gain; lowered blood pressure; and possibly improved cardiovascular health.[261][262][263][264]
Neurosteroid activity
[edit]Progesterone has neurosteroid activity via metabolism into allopregnanolone and pregnanolone, potent positive allosteric modulators of the GABAA receptor.[1] As a result, it has associated effects such as sedation, somnolence, and cognitive impairment.[1] No progestin is known to have similar such neurosteroid activity or effects.[1] However, promegestone has been found to act as a non-competitive antagonist of the nicotinic acetylcholine receptor similarly to progesterone.[265]
Other activities
[edit]Certain progestins have been found to stimulate the proliferation of MCF-7 breast cancer cells in vitro, an action that is independent of the classical PRs and is instead mediated via the progesterone receptor membrane component-1 (PGRMC1).[266] Norethisterone, desogestrel, levonorgestrel, and drospirenone strongly stimulate proliferation and medroxyprogesterone acetate, dienogest, and dydrogesterone weakly stimulate proliferation, whereas progesterone, nomegestrol acetate, and chlormadinone acetate act neutrally in the assay and do not stimulate proliferation.[266][267] It is unclear whether these findings may explain the different risks of breast cancer observed with progesterone, dydrogesterone, and other progestins such as medroxyprogesterone acetate and norethisterone in clinical studies.[268]
Pharmacokinetics
[edit]Oral progesterone has very low bioavailability and potency.[1][6][158][122][269] Micronization and dissolution in oil-filled capsules, a formulation known as oral micronized progesterone (OMP), increases the bioavailability of progesterone by several-fold.[269][270] However, the bioavailability of oral micronized progesterone nonetheless remains very low at less than 2.4%.[1][6][158][122][271] Progesterone also has a very short elimination half-life in the circulation of no more than 1.5 hours.[272][1][269] Due to the poor oral activity of oral micronized progesterone, it has relatively weak progestogenic effects.[6][158][122] Administration of progesterone in oil solution by intramuscular injection has a duration of about 2 or 3 days, necessitating frequent injections.[1][273][274][275][276][277] Transdermal administration of progesterone in the form of creams or gels achieves only very low levels of progesterone and weak progestogenic effects.[278][279]
Due to the poor oral activity of progesterone and its short duration with intramuscular injection, progestins were developed in its place both for oral use and for parenteral administration.[280] Orally active progestins have high oral bioavailability in comparison to oral micronized progesterone.[1] Their bioavailability is generally in the range of 60 to 100%.[1] Their elimination half-lives are also much longer than that of progesterone, in the range of 8 to 80 hours.[1] Due mainly to their pharmacokinetic improvements, progestins have oral potency that is up to several orders of magnitude greater than that of oral micronized progesterone.[1] For example, the oral potency of medroxyprogesterone acetate is at least 30-fold that of oral micronized progesterone, while the oral potency of gestodene is at least 10,000-fold that of oral micronized progesterone.[1] Parenterally administered progestins, such as hydroxyprogesterone caproate in oil solution, norethisterone enanthate in oil solution, and medroxyprogesterone acetate in microcrystalline aqueous suspension, have durations in the range of weeks to months.[273][274][275][276][277]
Chemistry
[edit]All currently available progestogens are steroidal in terms of chemical structure.[1] Progestogens include the naturally occurring progesterone and the synthetic progestogens (otherwise known as progestins).[1] Progestins can be broadly grouped into two structural classes—chemical derivatives of progesterone and chemical derivatives of testosterone.[1] Progesterone derivatives can be classified into subgroups including pregnanes, retropregnanes, norpregnanes, and spirolactones.[1] Examples of progestins of each of these subgroups include medroxyprogesterone acetate, dydrogesterone, nomegestrol acetate, and drospirenone, respectively.[1] Testosterone derivatives can be classified into subgroups including androstanes, estranes (19-norandrostanes), and gonanes (18-methylestranes).[1][281] Examples of progestins of each of these subgroups include ethisterone, norethisterone, and levonorgestrel, respectively.[1] Many progestins have ester and/or ether substitutions (see progestogen ester) which result in greater lipophilicity and in some cases cause the progestins in question to act as prodrugs in the body.[1]
History
[edit]| Generic name | Class[a] | Brand name | Route[b] | Intr. | |
|---|---|---|---|---|---|
| Anagestone acetate | P[i][ii] | Anatropin | PO | 1968 | |
| Chlormethenmadinone acetate | P[i][ii] | Biogest[c] | PO | 1960s | |
| Demegestone | P[iii] | Lutionex | PO | 1974 | |
| Dimethisterone | T[iv] | Lutagan[c] | PO | 1959 | |
| Ethisterone | T[iv] | Pranone[c] | PO, SL | 1939 | |
| Flumedroxone acetate | P[i][ii] | Demigran[c] | PO | 1960s | |
| Haloprogesterone | P[v] | Prohalone | PO | 1961 | |
| Hydroxyprogesterone acetate | P[i][ii] | Prodox | PO | 1957 | |
| Hydroxyprogesterone heptanoate | P[i][ii] | H.O.P.[c] | IM | 1950s | |
| Methenmadinone acetate | P[i][ii] | Superlutin[c] | PO | 1960s | |
| Noretynodrel | T[vi][iv] | Enovid | PO | 1957 | |
| Norgesterone | T[vi][iv] | Vestalin | PO | 1960s | |
| Norgestrienone | T[vi][iv] | Ogyline[c] | PO | 1960s | |
| Norvinisterone | T[vi][iv] | Neoprogestin[c] | PO | 1960s | |
| Pentagestrone acetate | P[i][ii] | Gestovis[c] | PO | 1961 | |
| Quingestanol acetate | T[vi][vii][ii][viii] | Demovis[c] | PO | 1972 | |
| Quingestrone | P[viii] | Enol-Luteovis | PO | 1962 | |
| Trengestone | RP | Retrone | PO | 1974 | |
Legend for class of molecule | |||||
| |||||
The recognition of progesterone's ability to suppress ovulation during pregnancy spawned a search for a similar hormone that could bypass the problems associated with administering progesterone (e.g. low bioavailability when administered orally and local irritation and pain when continually administered parenterally) and, at the same time, serve the purpose of controlling ovulation. The many synthetic hormones that resulted are known as progestins.
The first orally active progestin, ethisterone (pregneninolone, 17α-ethynyltestosterone), the C17α ethynyl analogue of testosterone, was synthesized in 1938 from dehydroandrosterone by ethynylation, either before or after oxidation of the C3 hydroxyl group, followed by rearrangement of the C5(6) double bond to the C4(5) position. The synthesis was designed by chemists Hans Herloff Inhoffen, Willy Logemann, Walter Hohlweg and Arthur Serini at Schering AG in Berlin and was marketed in Germany in 1939 as Proluton C and by Schering in the U.S. in 1945 as Pranone.[282][283][284][285][286]
A more potent orally active progestin, norethisterone (norethindrone, 19-nor-17α-ethynyltestosterone), the C19 nor analogue of ethisterone, synthesized in 1951 by Carl Djerassi, Luis Miramontes, and George Rosenkranz at Syntex in Mexico City, was marketed by Parke-Davis in the U.S. in 1957 as Norlutin, and was used as the progestin in some of the first oral contraceptives (Ortho-Novum, Norinyl, etc.) in the early 1960s.[283][284][285][286][287]
Noretynodrel, an isomer of norethisterone, was synthesized in 1952 by Frank B. Colton at Searle in Skokie, Illinois and used as the progestin in Enovid, marketed in the U.S. in 1957 and approved as the first oral contraceptive in 1960.[283][284][285][286][288]
Society and culture
[edit]Generations
[edit]Progestins used in birth control are sometimes grouped, somewhat arbitrarily and inconsistently, into generations. One categorization of these generations is as follows:[14]
- First generation: Approved for marketing before 1973. Examples: noretynodrel, norethisterone (norethindrone), lynestrenol, levonorgestrel.
- Second generation: Approved for marketing between 1973 and 1989. Examples: desogestrel, nomegestrol acetate, norgestimate.
- Third generation: Approved for marketing between 1990 and 2000. Examples: dienogest, etonogestrel.
- Fourth generation: Approved for marketing after 2000. Examples: drospirenone, norelgestromin, segesterone acetate.
Alternatively, estranes such as noretynodrel and norethisterone are classified as first-generation while gonanes such as norgestrel and levonorgestrel are classified as second-generation, with less androgenic gonanes such as desogestrel, norgestimate, and gestodene classified as third-generation and newer progestins like drospirenone classified as fourth-generation.[15] Yet another classification system considers there to be only first- and second-generation progestins.[citation needed]
Classification of progestins by generation has been criticized and it has been argued that the classification scheme should be abandoned.[289]
Availability
[edit]Progestogens are available widely throughout the world in many different forms. They are present in all birth control pills.
Etymology
[edit]Progestogens, also termed progestagens, progestogens, or gestagens, are compounds which act as agonists of the progesterone receptors.[118][1][143] Progestogens include progesterone—which is the main natural and endogenous progestogen—and progestins, which are synthetic progestogens.[1] Progestins include the 17α-hydroxyprogesterone derivative medroxyprogesterone acetate and the 19-nortestosterone derivative norethisterone, among many other synthetic progestogens.[118][1] As progesterone is a single compound and has no plural form, the term "progesterones" does not exist and is grammatically incorrect.[143] The terms describing progestogens are often confused.[118][143] However, progestogens have differing activities and effects and it is inappropriate to interchange them.[118][1][143]
Research
[edit]A variety of progestins have been studied for use as potential male hormonal contraceptives in combination with androgens in men.[290] These include the pregnanes medroxyprogesterone acetate, megestrol acetate, and cyproterone acetate, the norpregnane segesterone acetate, and the estranes norethisterone acetate, norethisterone enanthate, levonorgestrel, levonorgestrel butanoate, desogestrel, and etonogestrel.[290][291][292][293] The androgens that have been used in combination with these progestins include testosterone, testosterone esters, androstanolone (dihydrotestosterone), and nandrolone esters.[290] Dual androgens and progestogens such as trestolone and dimethandrolone undecanoate have also been developed and studied as male contraceptives.[294][295] Doses of progestins used in male hormonal contraception have been noted to be in the range of 5 to 12 times the doses used in female hormonal contraception.[296]
See also
[edit]References
[edit]- ^ Jump up to: a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag ah ai aj ak al am an ao ap aq ar as at au av aw ax ay az ba bb bc bd be bf bg bh bi bj bk bl bm bn bo bp bq br Kuhl H (2005). "Pharmacology of estrogens and progestogens: influence of different routes of administration" (PDF). Climacteric. 8 (Suppl 1): 3–63. doi:10.1080/13697130500148875. PMID 16112947. S2CID 24616324.
- ^ Jump up to: a b c d e f g h Wiegratz I, Kuhl H (August 2004). "Progestogen therapies: differences in clinical effects?". Trends Endocrinol. Metab. 15 (6): 277–85. doi:10.1016/j.tem.2004.06.006. PMID 15358281. S2CID 35891204.
- ^ Jump up to: a b Thibaut F, De La Barra F, Gordon H, Cosyns P, Bradford JM (2010). "The World Federation of Societies of Biological Psychiatry (WFSBP) guidelines for the biological treatment of paraphilias". World J. Biol. Psychiatry. 11 (4): 604–55. doi:10.3109/15622971003671628. PMID 20459370. S2CID 14949511.
- ^ Jump up to: a b Glasier A (March 20, 2015). "Chapter 134. Contraception". In Jameson JL, De Groot LJ, de Krester D, Giudice LC, Grossman A, Melmed S, Potts Jr JT, Weir GC (eds.). Endocrinology: Adult and Pediatric (7th ed.). Philadelphia: Saunders Elsevier. p. 2306. ISBN 978-0-323-18907-1.
- ^ Jump up to: a b Pattman R, Sankar KN, Elewad B, Handy P, Price DA, eds. (November 19, 2010). "Chapter 33. Contraception including contraception in HIV infection and infection reduction". Oxford Handbook of Genitourinary Medicine, HIV, and Sexual Health (2nd ed.). Oxford: Oxford University Press. p. 360. ISBN 978-0-19-957166-6.
Ovulation may be suppressed in 15–40% of cycles by POPs containing levonorgestrel, norethisterone, or etynodiol diacetate, but in 97–99% by those containing desogestrel.
- ^ Jump up to: a b c d e f g Kuhl H (2011). "Pharmacology of Progestogens" (PDF). J Reproduktionsmed Endokrinol. 8 (1): 157–177.
- ^ Jump up to: a b Christian Lauritzen, John W. W. Studd (22 June 2005). Current Management of the Menopause. CRC Press. p. 45. ISBN 978-0-203-48612-2.
Ethisterone, the first orally effective progestagen, was synthesized by Inhoffen and Hohlweg in 1938. Norethisterone, a progestogen still used worldwide, was synthesized by Djerassi in 1951. But this progestogen was not used immediately and in 1953 Colton discovered norethynodrel, used by Pincus in the first oral contraceptive. Numerous other progestogens were subsequently synthesized, e.g., lynestrenol and ethynodiol diacetate, which were, in fact, prhormones converted in vivo to norethisterone. All these progestogens were also able to induce androgenic effects when high doses were used. More potent progestogens were synthesized in the 1960s, e.g. norgestrel, norgestrienone. These progestogens were also more androgenic.
- ^ Klaus Roth (2014). Chemische Leckerbissen. John Wiley & Sons. p. 69. ISBN 978-3-527-33739-2.
Im Prinzip hatten Hohlweg und Inhoffen die Lösung schon 1938 in der Hand, denn ihr Ethinyltestosteron (11) war eine oral wirksame gestagene Verbindung und Schering hatte daraus bereits 1939 ein Medikament (Proluton C®) entwickelt.
- ^ Jump up to: a b "IBM Watson Health Products: Please Login".
- ^ Jump up to: a b Sweetman, Sean C., ed. (2009). "Sex hormones and their modulators". Martindale: The Complete Drug Reference (36th ed.). London: Pharmaceutical Press. ISBN 978-0-85369-840-1.
- ^ Jump up to: a b "List of Progestins".
- ^ Jump up to: a b Index Nominum 2000: International Drug Directory. Taylor & Francis. January 2000. ISBN 978-3-88763-075-1.
- ^ J. Elks (14 November 2014). The Dictionary of Drugs: Chemical Data: Chemical Data, Structures and Bibliographies. Springer. ISBN 978-1-4757-2085-3.
- ^ Jump up to: a b John David Gordon, Jan Rydfors, Maurice Druzin, Yasser El-Sayed, Yona Tadir (2007). Obstetrics, Gynecology & Infertility: Handbook for Clinicians. Scrub Hill Press, Inc. pp. 229–. ISBN 978-0-9645467-7-6.
- ^ Jump up to: a b Ronald S. Gibbs (2008). Danforth's Obstetrics and Gynecology. Lippincott Williams & Wilkins. pp. 568–. ISBN 978-0-7817-6937-2.
- ^ J. Larry Jameson, Leslie J. De Groot (25 February 2015). Endocrinology: Adult and Pediatric E-Book. Elsevier Health Sciences. pp. 2304–. ISBN 978-0-323-32195-2.
- ^ Jump up to: a b Michelle A. Clark, Richard A. Harvey, Richard Finkel, Jose A. Rey, Karen Whalen (15 December 2011). Pharmacology. Lippincott Williams & Wilkins. p. 322. ISBN 978-1-4511-1314-3.
- ^ Jump up to: a b Bhattacharya (1 January 2003). Pharmacology, 2/e. Elsevier India. p. 378. ISBN 978-81-8147-009-6.
- ^ Rick D. Kellerman, Edward T. Bope (10 November 2017). Conn's Current Therapy 2018 E-Book. Elsevier Health Sciences. pp. 1124–. ISBN 978-0-323-52961-7.
- ^ Helen Varney, Jan M. Kriebs, Carolyn L. Gegor (2004). Varney's Midwifery. Jones & Bartlett Learning. pp. 513–. ISBN 978-0-7637-1856-5.
- ^ Jump up to: a b c d David E. Golan (2008). Principles of Pharmacology: The Pathophysiologic Basis of Drug Therapy. Lippincott Williams & Wilkins. pp. 520–521. ISBN 978-0-7817-8355-2.
- ^ Pamela S. Miles, William F. Rayburn, J.Christopher Carey (6 December 2012). Obstetrics and Gynecology. Springer Science & Business Media. pp. 109–. ISBN 978-1-4684-0220-9.
- ^ Jump up to: a b Erkkola R, Landgren BM (March 2005). "Role of progestins in contraception". Acta Obstet Gynecol Scand. 84 (3): 207–16. doi:10.1111/j.0001-6349.2005.00759.x. PMID 15715527. S2CID 6887415.
- ^ Guise TA, Oefelein MG, Eastham JA, Cookson MS, Higano CS, Smith MR (2007). "Estrogenic side effects of androgen deprivation therapy". Rev Urol. 9 (4): 163–80. PMC 2213888. PMID 18231613.
- ^ Frisk J (2010). "Managing hot flushes in men after prostate cancer--a systematic review". Maturitas. 65 (1): 15–22. doi:10.1016/j.maturitas.2009.10.017. PMID 19962840.
- ^ Koike H, Morikawa Y, Matsui H, Shibata Y, Ito K, Suzuki K (2013). "Chlormadinone acetate is effective for hot flush during androgen deprivation therapy". Prostate Int. 1 (3): 113–6. doi:10.12954/PI.12010. PMC 3814123. PMID 24223412.
- ^ Hickey M, Fraser IS (August 2000). "A functional model for progestogen-induced breakthrough bleeding". Hum. Reprod. 15 (Suppl 3): 1–6. doi:10.1093/humrep/15.suppl_3.1. PMID 11041215.
- ^ Jump up to: a b c Schindler AE (February 2011). "Dydrogesterone and other progestins in benign breast disease: an overview". Archives of Gynecology and Obstetrics. 283 (2): 369–371. doi:10.1007/s00404-010-1456-7. PMID 20383772. S2CID 9125889.
- ^ Jump up to: a b c Winkler UH, Schindler AE, Brinkmann US, Ebert C, Oberhoff C (December 2001). "Cyclic progestin therapy for the management of mastopathy and mastodynia". Gynecological Endocrinology. 15 (Suppl 6): 37–43. doi:10.1080/gye.15.s6.37.43. PMID 12227885. S2CID 27589741.
- ^ Jump up to: a b Ruan X, Mueck AO (November 2014). "Systemic progesterone therapy--oral, vaginal, injections and even transdermal?". Maturitas. 79 (3): 248–255. doi:10.1016/j.maturitas.2014.07.009. PMID 25113944.
- ^ Bińkowska M, Woroń J (June 2015). "Progestogens in menopausal hormone therapy". Przeglad Menopauzalny = Menopause Review. 14 (2): 134–143. doi:10.5114/pm.2015.52154. PMC 4498031. PMID 26327902.
- ^ Kistner RW (1959). "Histological effects of progestins on hyperplasia and carcinoma in situ of the endometrium". Cancer. 12 (6): 1106–22. doi:10.1002/1097-0142(195911/12)12:6<1106::aid-cncr2820120607>3.0.co;2-m. PMID 14409476.
- ^ Regulatory Mechanisms in Transcriptional Signaling. Academic Press. 25 July 2009. pp. 62–. ISBN 978-0-08-091198-4.
- ^ Loren K. Mell, MD (20 December 2011). Gynecologic Cancer. Demos Medical Publishing. pp. 393–. ISBN 978-1-61705-095-4.
- ^ Robert G. McKinnell (13 March 1998). The Biological Basis of Cancer. Cambridge University Press. pp. 262–. ISBN 978-0-521-59695-4.
- ^ Jacqueline Burchum, Laura Rosenthal (2 December 2014). Lehne's Pharmacology for Nursing Care - E-Book. Elsevier Health Sciences. pp. 740–. ISBN 978-0-323-34026-7.
- ^ H. John Smith, Hywel Williams (10 October 2005). Smith and Williams' Introduction to the Principles of Drug Design and Action, Fourth Edition. CRC Press. pp. 493–. ISBN 978-0-203-30415-0.
- ^ Jump up to: a b c d e f David J. Winchester (2006). Breast Cancer. PMPH-USA. pp. 333–. ISBN 978-1-55009-272-1.
- ^ Jump up to: a b Gadducci A, Genazzani AR (December 1999). "Endocrine therapy for gynecological cancer". Gynecol. Endocrinol. 13 (6): 441–56. doi:10.3109/09513599909167590. PMID 10685337.
- ^ Jump up to: a b Lam JS, Leppert JT, Vemulapalli SN, Shvarts O, Belldegrun AS (January 2006). "Secondary hormonal therapy for advanced prostate cancer". J. Urol. 175 (1): 27–34. doi:10.1016/S0022-5347(05)00034-0. PMID 16406864.
- ^ Jump up to: a b Fourcade RO, Chatelain C (July 1998). "Androgen deprivation for prostatic carcinoma: a rationale for choosing components". Int. J. Urol. 5 (4): 303–11. doi:10.1111/j.1442-2042.1998.tb00356.x. PMID 9712436. S2CID 25107178.
- ^ Jump up to: a b Loose, Davis S., Stancel, George M. (2006). "Estrogens and Progestins". In Brunton, Laurence L., Lazo, John S., Parker, Keith L. (eds.). Goodman & Gilman's The Pharmacological Basis of Therapeutics (11th ed.). New York: McGraw-Hill. pp. 1541–71. ISBN 978-0-07-142280-2.
- ^ Maltoni M, Nanni O, Scarpi E, Rossi D, Serra P, Amadori D (March 2001). "High-dose progestins for the treatment of cancer anorexia-cachexia syndrome: a systematic review of randomised clinical trials". Ann. Oncol. 12 (3): 289–300. doi:10.1023/a:1011156811739. PMID 11332139.
- ^ Lelli G, Montanari M, Gilli G, Scapoli D, Antonietti C, Scapoli D (June 2003). "Treatment of the cancer anorexia-cachexia syndrome: a critical reappraisal". J Chemother. 15 (3): 220–5. doi:10.1179/joc.2003.15.3.220. PMID 12868546. S2CID 29442148.
- ^ "IS IT TRUE THAT BIRTH CONTROL PILLS CAUSE BLOOD CLOTS?". National Blood Clot Alliance. Archived from the original on 15 April 2019. Retrieved 15 April 2019.
- ^ Jump up to: a b c Lauritzen C (September 1990). "Clinical use of oestrogens and progestogens". Maturitas. 12 (3): 199–214. doi:10.1016/0378-5122(90)90004-P. PMID 2215269.
- ^ Jump up to: a b Africander D, Verhoog N, Hapgood JP (June 2011). "Molecular mechanisms of steroid receptor-mediated actions by synthetic progestins used in HRT and contraception". Steroids. 76 (7): 636–52. doi:10.1016/j.steroids.2011.03.001. PMID 21414337. S2CID 23630452.
- ^ Jump up to: a b c d e f g h i j k l m Schaffir J, Worly BL, Gur TL (October 2016). "Combined hormonal contraception and its effects on mood: a critical review". Eur J Contracept Reprod Health Care. 21 (5): 347–55. doi:10.1080/13625187.2016.1217327. PMID 27636867. S2CID 11959163.
- ^ Jump up to: a b c Böttcher B, Radenbach K, Wildt L, Hinney B (July 2012). "Hormonal contraception and depression: a survey of the present state of knowledge". Arch. Gynecol. Obstet. 286 (1): 231–6. doi:10.1007/s00404-012-2298-2. PMID 22467147. S2CID 26204975.
- ^ Jump up to: a b c d e f g h Robakis T, Williams KE, Nutkiewicz L, Rasgon NL (June 2019). "Hormonal Contraceptives and Mood: Review of the Literature and Implications for Future Research". Curr Psychiatry Rep. 21 (7): 57. doi:10.1007/s11920-019-1034-z. PMID 31172309. S2CID 174818119.
- ^ Jump up to: a b c d e f g h Worly BL, Gur TL, Schaffir J (June 2018). "The relationship between progestin hormonal contraception and depression: a systematic review". Contraception. 97 (6): 478–489. doi:10.1016/j.contraception.2018.01.010. PMID 29496297. S2CID 3644828.
- ^ Jump up to: a b c d Poromaa IS, Segebladh B (April 2012). "Adverse mood symptoms with oral contraceptives". Acta Obstet Gynecol Scand. 91 (4): 420–7. doi:10.1111/j.1600-0412.2011.01333.x. PMID 22136510. S2CID 43671664.
- ^ Bakry S, Merhi ZO, Scalise TJ, Mahmoud MS, Fadiel A, Naftolin F (July 2008). "Depot-medroxyprogesterone acetate: an update". Arch. Gynecol. Obstet. 278 (1): 1–12. doi:10.1007/s00404-007-0497-z. PMID 18470526. S2CID 11340062.
- ^ Westhoff C, Truman C, Kalmuss D, Cushman L, Davidson A, Rulin M, Heartwell S (April 1998). "Depressive symptoms and Depo-Provera". Contraception. 57 (4): 237–40. doi:10.1016/s0010-7824(98)00024-9. PMID 9649914.
- ^ Kahn LS, Halbreich U (September 2001). "Oral contraceptives and mood". Expert Opin Pharmacother. 2 (9): 1367–82. doi:10.1517/14656566.2.9.1367. PMID 11585017. S2CID 45061663.
- ^ Lanza di Scalea T, Pearlstein T (July 2019). "Premenstrual Dysphoric Disorder". The Medical Clinics of North America. 103 (4): 613–628. doi:10.1016/j.mcna.2019.02.007. PMID 31078196. S2CID 153307984.
- ^ Ma S, Song SJ (June 2023). "Oral contraceptives containing drospirenone for premenstrual syndrome". The Cochrane Database of Systematic Reviews. 2023 (6): CD006586. doi:10.1002/14651858.CD006586.pub5. PMC 10289136. PMID 37365881.
- ^ Jump up to: a b c Regidor PA, Schindler AE (October 2017). "Antiandrogenic and antimineralocorticoid health benefits of COC containing newer progestogens: dienogest and drospirenone". Oncotarget. 8 (47): 83334–83342. doi:10.18632/oncotarget.19833. PMC 5669973. PMID 29137347.
- ^ Jump up to: a b c Lewis CA, Kimmig AS, Zsido RG, Jank A, Derntl B, Sacher J (November 2019). "Effects of Hormonal Contraceptives on Mood: A Focus on Emotion Recognition and Reactivity, Reward Processing, and Stress Response". Current Psychiatry Reports. 21 (11): 115. doi:10.1007/s11920-019-1095-z. PMC 6838021. PMID 31701260.
- ^ Pagano HP, Zapata LB, Berry-Bibee EN, Nanda K, Curtis KM (December 2016). "Safety of hormonal contraception and intrauterine devices among women with depressive and bipolar disorders: a systematic review". Contraception. 94 (6): 641–649. doi:10.1016/j.contraception.2016.06.012. PMC 10994544. PMID 27364100.
- ^ Dennis CL, Ross LE, Herxheimer A (October 2008). "Oestrogens and progestins for preventing and treating postpartum depression". The Cochrane Database of Systematic Reviews. 2008 (4): CD001690. doi:10.1002/14651858.CD001690.pub2. PMC 7061327. PMID 18843619.
- ^ Jump up to: a b Maki PM, Kornstein SG, Joffe H, Bromberger JT, Freeman EW, Athappilly G, Bobo WV, Rubin LH, Koleva HK, Cohen LS, Soares CN (February 2019). "Guidelines for the Evaluation and Treatment of Perimenopausal Depression: Summary and Recommendations". J Womens Health (Larchmt). 28 (2): 117–134. doi:10.1089/jwh.2018.27099.mensocrec. PMID 30182804.
- ^ Jump up to: a b Stute P, Spyropoulou A, Karageorgiou V, Cano A, Bitzer J, Ceausu I, Chedraui P, Durmusoglu F, Erkkola R, Goulis DG, Lindén Hirschberg A, Kiesel L, Lopes P, Pines A, Rees M, van Trotsenburg M, Zervas I, Lambrinoudaki I (January 2020). "Management of depressive symptoms in peri- and postmenopausal women: EMAS position statement". Maturitas. 131: 91–101. doi:10.1016/j.maturitas.2019.11.002. PMID 31740049.
- ^ Gava G, Orsili I, Alvisi S, Mancini I, Seracchioli R, Meriggiola MC (October 2019). "Cognition, Mood and Sleep in Menopausal Transition: The Role of Menopause Hormone Therapy". Medicina. 55 (10): 668. doi:10.3390/medicina55100668. PMC 6843314. PMID 31581598.
- ^ Тоффол Э., Хейкинхеймо О., Партонен Т. (май 2015 г.). «Гормональная терапия и настроение у женщин в перименопаузе и постменопаузе: обзор повествования». Менопауза . 22 (5): 564–78. doi : 10.1097/GME.0000000000000323 . ПМИД 25203891 . S2CID 5830652 .
- ^ Цвайфель Дж. Э., О'Брайен WH (апрель 1997 г.). «Метаанализ влияния заместительной гормональной терапии на депрессивное настроение». Психонейроэндокринология . 22 (3): 189–212. дои : 10.1016/s0306-4530(96)00034-0 . ПМИД 9203229 . S2CID 44630030 .
- ^ Роджерио А. Лобо (5 июня 2007 г.). Лечение женщин в постменопаузе: основные и клинические аспекты . Эльзевир. стр. 211–. ISBN 978-0-08-055309-2 .
- ^ Гордон Дж.Л., Гирдлер СС (декабрь 2014 г.). «Заместительная гормональная терапия в лечении перименопаузальной депрессии». Представитель Curr психиатрии . 16 (12): 517. doi : 10.1007/s11920-014-0517-1 . ПМИД 25308388 . S2CID 23794180 .
- ^ Фишер Б., Глисон С., Астана С. (апрель 2014 г.). «Влияние гормональной терапии на когнитивные функции и настроение» . Плодородный. Стерильный . 101 (4): 898–904. doi : 10.1016/j.fertnstert.2014.02.025 . ПМК 4330961 . ПМИД 24680649 .
- ^ Приор JC (август 2018 г.). «Прогестерон для лечения женщин с симптомами менопаузы» . Климактерический . 21 (4): 358–365. дои : 10.1080/13697137.2018.1472567 . ПМИД 29962247 .
- ^ Jump up to: а б Пастор З., Холла К., Чмель Р. (февраль 2013 г.). «Влияние комбинированных пероральных контрацептивов на женское сексуальное желание: систематический обзор». Eur J Contracept Reprod Health Care . 18 (1): 27–43. дои : 10.3109/13625187.2012.728643 . ПМИД 23320933 . S2CID 34748865 .
- ^ Циммерман Ю., Эйкеманс М.Дж., Коелинг Беннинк Х.Дж., Бланкенштейн М.А., Фаузер Б.С. (2014). «Влияние комбинированных пероральных контрацептивов на уровень тестостерона у здоровых женщин: систематический обзор и метаанализ» . Хм. Репродукция. Обновлять . 20 (1): 76–105. дои : 10.1093/humupd/dmt038 . ПМЦ 3845679 . ПМИД 24082040 .
- ^ Касадо-Эспада, Нью-Мексико, де Аларкон Р., де ла Иглесиа-Ларрад Х.И., Ботэ-Бонаечеа Б., Монтехо А.Л. (июнь 2019 г.). «Гормональные контрацептивы, женская сексуальная дисфункция и стратегии управления: обзор» . Журнал клинической медицины . 8 (6): 908. дои : 10.3390/jcm8060908 . ПМК 6617135 . ПМИД 31242625 .
- ^ Jump up to: а б с "Тромбоз глубоких вен" . НХЛБИ, НИЗ . Проверено 28 декабря 2019 г.
- ^ Jump up to: а б с д и Ситрук-Уэр Р., Нат А. (февраль 2013 г.). «Характеристики и метаболические эффекты эстрогенов и прогестинов, содержащихся в пероральных противозачаточных таблетках». Лучшие практики и исследования. Клиническая эндокринология и обмен веществ . 27 (1): 13–24. дои : 10.1016/j.beem.2012.09.004 . ПМИД 23384742 .
- ^ Jump up to: а б с д и ж г час Пфайфер С, Баттс С, Думесич Д, Фоссум Г, Грасиа С, Ла Барбера А, Мерсеро Дж, Одем Р, Пензиас А, Писарска М, Ребар Р, Рейндоллар Р, Розен М, Сэндлоу Дж, Сокол Р, Вернон М, Видра Е (январь 2017 г.). «Комбинированная гормональная контрацепция и риск венозной тромбоэмболии: рекомендации» . Фертильность и бесплодие . 107 (1): 43–51. doi : 10.1016/j.fertnstert.2016.09.027 . ПМИД 27793376 .
- ^ Jump up to: а б Скоуби С.О., Сидельманн Дж.Дж. (ноябрь 2018 г.). «Влияние прогестагенов на гемостаз». Гормональная молекулярная биология и клинические исследования . 37 (2). doi : 10.1515/hmbci-2018-0041 . ПМИД 30447140 . S2CID 53875910 .
- ^ Барко С., Нейкейтер М., Мидделдорп С. (июль 2013 г.). «Беременность и венозная тромбоэмболия». Семинары по тромбозам и гемостазу . 39 (5): 549–558. дои : 10.1055/s-0033-1343893 . ПМИД 23633191 . S2CID 5521763 .
- ^ Саймон Т., Бо Йон де Жонаж-Канонико М., Огер Э., Валь Д., Конард Дж., Мейер Дж., Эммерих Дж., Баррелье М.Т., Гиро А., Скарабин П.Ю. (январь 2006 г.). «Показатели пожизненного воздействия эндогенного эстрогена и риска венозной тромбоэмболии» . Журнал тромбозов и гемостаза . 4 (1): 71–76. дои : 10.1111/j.1538-7836.2005.01693.x . ПМИД 16409454 . S2CID 24161765 .
- ^ Canonico M, Plu-Bureau G, О'Салливан MJ, Стефаник ML, Кокрейн Б, Скарабин П.Ю., Мэнсон Дж.Е. (март 2014 г.). «Возраст менопаузы, репродуктивный анамнез и риск венозной тромбоэмболии среди женщин в постменопаузе: клинические испытания гормональной терапии Инициативы по здоровью женщин» . Менопауза . 21 (3): 214–220. дои : 10.1097/GME.0b013e31829752e0 . ПМЦ 3815514 . ПМИД 23760439 .
- ^ Jump up to: а б с д и ж г час я дж к Ситрук-Уэр Р., Нат А. (июнь 2011 г.). «Метаболические эффекты противозачаточных стероидов». Обзоры по эндокринным и метаболическим расстройствам . 12 (2): 63–75. дои : 10.1007/s11154-011-9182-4 . ПМИД 21538049 . S2CID 23760705 .
- ^ Jump up to: а б с д Шиндлер А.Е. (декабрь 2003 г.). «Дифференциальное влияние прогестинов на гемостаз». Матуритас . 46 (Приложение 1): S31–7. дои : 10.1016/j.maturitas.2003.09.016 . ПМИД 14670643 .
- ^ Jump up to: а б с Виграц I, Куль Х (сентябрь 2006 г.). «Метаболические и клинические эффекты прогестагенов». Европейский журнал контрацепции и репродуктивного здоровья . 11 (3): 153–161. дои : 10.1080/13625180600772741 . ПМИД 17056444 . S2CID 27088428 .
- ^ Jump up to: а б Куль Х. (май 1996 г.). «Влияние прогестагенов на гемостаз». Зрелость . 24 (1–2): 1–19. дои : 10.1016/0378-5122(96)00994-2 . ПМИД 8794429 .
- ^ Теппер Н.К., Уайтман М.К., Марчбэнкс П.А., Джеймс А.Х., Кертис К.М. (декабрь 2016 г.). «Прогестиновая контрацепция и тромбоэмболия: систематический обзор» . Контрацепция . 94 (6): 678–700. doi : 10.1016/j.contraception.2016.04.014 . ПМЦ 11034842 . ПМИД 27153743 .
- ^ Манта С., Карп Р., Рагхаван В., Террин Н., Бауэр К.А., Цвикер Дж.И. (август 2012 г.). «Оценка риска венозных тромбоэмболических осложнений у женщин, принимающих только прогестиновую контрацепцию: метаанализ» . БМЖ . 345 : е4944. дои : 10.1136/bmj.e4944 . ПМЦ 3413580 . ПМИД 22872710 .
- ^ Jump up to: а б с Бланко-Молина М.А., Лозано М., Кано А., Кристобаль I, Паллардо Л.П., Лете I (май 2012 г.). «Только прогестиновая контрацепция и венозная тромбоэмболия». Исследование тромбоза . 129 (5): e257–e262. doi : 10.1016/j.thromres.2012.02.042 . ПМИД 22425318 . S2CID 261804433 .
- ^ Jump up to: а б с Ротт Х (февраль 2019 г.). «Противозачаточные таблетки и тромботические риски: различия методов контрацепции с эстрогеном и без него». Хамостазология . 39 (1): 42–48. дои : 10.1055/s-0039-1677806 . ПМИД 30669160 . S2CID 58947063 .
- ^ Jump up to: а б с д и Бейер-Вестендорф Дж., Бауэрсакс Р., Хач-Вундерле В., Зотц Р.Б., Ротт Х. (октябрь 2018 г.). «Половые гормоны и венозная тромбоэмболия – от контрацепции до заместительной гормональной терапии». ВАСА. Журнал сосудистых заболеваний . 47 (6): 441–450. дои : 10.1024/0301-1526/a000726 . ПМИД 30008249 . S2CID 51628832 .
- ^ Jump up to: а б ДеЛогери Т.Г. (июнь 2011 г.). «Эстроген и тромбоз: противоречия и здравый смысл». Обзоры по эндокринным и метаболическим расстройствам . 12 (2): 77–84. дои : 10.1007/s11154-011-9178-0 . ПМИД 21559819 . S2CID 28053690 .
- ^ Манта С., Карп Р., Рагхаван В., Террин Н., Бауэр К.А., Цвикер Дж.И. (август 2012 г.). «Оценка риска венозных тромбоэмболических осложнений у женщин, принимающих только прогестиновую контрацепцию: метаанализ» . БМЖ . 345 (2 августа 2007 г.): e4944. дои : 10.1136/bmj.e4944 . ПМЦ 3413580 . ПМИД 22872710 .
- ^ Jump up to: а б с д и Скарабин П.Я. (август 2018 г.). «Прогестагены и венозная тромбоэмболия у женщин в менопаузе: обновленный метаанализ пероральных и трансдермальных эстрогенов». Климактерический . 21 (4): 341–345. дои : 10.1080/13697137.2018.1446931 . ПМИД 29570359 . S2CID 4229701 .
- ^ Теппер Н.К., Дженг Дж., Кертис К.М., Буто М.Э., Буле С.Л., Уайтман М.К. (март 2019 г.). «Венозная тромбоэмболия у женщин, начавших лечение депо медроксипрогестерона ацетатом сразу после родов» . Акушерство и гинекология . 133 (3): 533–540. дои : 10.1097/AOG.0000000000003135 . ПМЦ 10983016 . ПМИД 30741807 .
- ^ Jump up to: а б с д и Гурди П., Башло А, Катто-Жонар С., Шаббер-Бюффе Н., Кристин-Мэтр С., Конар Дж., Фреденрих А., Гомпель А., Ламиш-Лоренцини Ф., Моро С., Плю-Бюро Г., Вамберг А., Вержес Б., Керлан. В. (ноябрь 2012 г.). «Гормональная контрацепция у женщин с риском сосудистых и метаболических нарушений: рекомендации Французского общества эндокринологии». Анналы эндокринологии . 73 (5): 469–487. дои : 10.1016/j.ando.2012.09.001 . ПМИД 23078975 .
- ^ Конард Дж., Плю-Бюро Дж., Бахи Н., Хореллу М.Х., Пелисье К., Талабард Дж.К. (декабрь 2004 г.). «Прогестагенная контрацепция у женщин с высоким риском венозной тромбоэмболии». Контрацепция . 70 (6): 437–441. doi : 10.1016/j.contraception.2004.07.009 . ПМИД 15541404 .
- ^ Jump up to: а б Бейер-Вестендорф Дж., Верт С., Халбриттер К., Вайс Н. (апрель 2010 г.). «Рак у мужчин и риск венозной тромбоэмболии». Тромб. Рез . 125 (Приложение 2): С155–9. дои : 10.1016/S0049-3848(10)70035-9 . ПМИД 20433997 .
- ^ Гуай ДР (декабрь 2008 г.). «Неуместное сексуальное поведение у пожилых людей с когнитивными нарушениями». Ам Дж Гериатр Фармакотер . 6 (5): 269–88. doi : 10.1016/j.amjopharm.2008.12.004 . ПМИД 19161930 .
- ^ Jump up to: а б Моряк HE, Langley SE, Farmer RD, de Vries CS (июнь 2007 г.). «Венозная тромбоэмболия и ацетат ципротерона у мужчин с раком простаты: исследование с использованием базы данных исследований общей практики» . БЖУ Междунар . 99 (6): 1398–403. дои : 10.1111/j.1464-410X.2007.06859.x . ПМИД 17537215 . S2CID 21350686 .
- ^ Jump up to: а б Ван Хемельрик М., Адольфссон Дж., Гармо Х., Билл-Аксельсон А., Брэтт О., Ингельссон Е., Ламбе М., Статтин П., Холмберг Л. (май 2010 г.). «Риск тромбоэмболических заболеваний у мужчин с раком простаты: результаты популяционного исследования PCBaSe в Швеции» . Ланцет Онкол . 11 (5): 450–8. дои : 10.1016/S1470-2045(10)70038-3 . ПМЦ 2861771 . ПМИД 20395174 .
- ^ Шредер Ф.Х., Радлмайер А. (2009). «Стероидные антиандрогены». В Jordan VC, Ферр Би Джей (ред.). Гормональная терапия при раке молочной железы и простаты . Хумана Пресс. стр. 325–346. дои : 10.1007/978-1-59259-152-7_15 . ISBN 978-1-60761-471-5 .
- ^ Намер М. (октябрь 1988 г.). «Клиническое применение антиандрогенов». Дж. Стероидная биохимия . 31 (4Б): 719–29. дои : 10.1016/0022-4731(88)90023-4 . ПМИД 2462132 .
- ^ Jump up to: а б с д и Ашеман Х., Т'Шен Г., Лемэр А., Мас М., Мериджиола М.С., Мюллер А., Кун А., Дейн С., Морель-Журнель Н., Гурен Л.Дж. (сентябрь 2014 г.). «Венозная тромбоэмболия как осложнение гормональной терапии транссексуалов от мужчины к женщине: обзор» . Андрология . 46 (7): 791–5. дои : 10.1111/and.12150 . hdl : 11585/413984 . ПМИД 23944849 . S2CID 5363824 .
- ^ Jump up to: а б с д Ровинский Д., Рамос Р.Б., Фигера Т.М., Казанова Г.К., Спритцер П.М. (август 2018 г.). «Риск событий венозной тромбоэмболии у женщин в постменопаузе, использующих пероральную или непероральную гормональную терапию: систематический обзор и метаанализ». Тромб. Рез . 168 : 83–95. doi : 10.1016/j.thromres.2018.06.014 . ПМИД 29936403 . S2CID 49421543 .
- ^ Jump up to: а б с д и Хан Л., Дженсен Дж.Т. (декабрь 2015 г.). «Влияет ли прогестаген, используемый в комбинированной гормональной контрацепции, на риск венозного тромбоза?» . Обстет. Гинекол. Клин. Северный Ам . 42 (4): 683–98. дои : 10.1016/j.ogc.2015.07.007 . ПМИД 26598309 .
- ^ Jump up to: а б с д Бейтсон Д., Батчер Б.Е., Донован С., Фаррелл Л., Ковач Дж., Меццини Т., Рейнс-Гринов С., Пекораро Г., Рид С., Бабер Р. (2016). «Риск венозной тромбоэмболии у женщин, принимающих комбинированные пероральные контрацептивы: систематический обзор и метаанализ» . Ауст Фам Врач . 45 (1): 59–64. ПМИД 27051991 .
- ^ Jump up to: а б с д и Виноградова Ю., Коупленд С., Хипписли-Кокс Дж. (январь 2019 г.). «Использование заместительной гормональной терапии и риск венозной тромбоэмболии: вложенные исследования случай-контроль с использованием баз данных QResearch и CPRD» . БМЖ . 364 :к4810. дои : 10.1136/bmj.k4810 . ПМК 6326068 . ПМИД 30626577 .
- ^ Jump up to: а б с д Виноградова Ю., Коупленд С., Хипписли-Кокс Дж. (май 2015 г.). «Использование комбинированных пероральных контрацептивов и риск венозной тромбоэмболии: вложенные исследования случай-контроль с использованием баз данных QResearch и CPRD» . БМЖ . 350 : h2135. дои : 10.1136/bmj.h2135 . ПМЦ 4444976 . ПМИД 26013557 .
- ^ Jump up to: а б с Плю-Бюро Дж., Майтро-Мантеле Л., Хьюгон-Роден Дж., Канонико М. (февраль 2013 г.). «Гормональные контрацептивы и венозная тромбоэмболия: эпидемиологические новости». Лучшая практика. Рез. Клин. Эндокринол. Метаб . 27 (1): 25–34. дои : 10.1016/j.beem.2012.11.002 . ПМИД 23384743 .
- ^ Jump up to: а б Коннорс Дж. М., Мидделдорп С. (ноябрь 2019 г.). «Пациенты-трансгендеры и роль врача-коагулятора». Дж. Тромб. Гемост . 17 (11): 1790–1797. дои : 10.1111/jth.14626 . ПМИД 31465627 . S2CID 201673648 .
- ^ Эдинген С., Шольц С., Разум О. (май 2018 г.). «Систематический обзор и метаанализ влияния комбинированных пероральных контрацептивов на риск венозной тромбоэмболии: роль типа прогестагена и дозы эстрогена». Тромб. Рез . 165 : 68–78. doi : 10.1016/j.thromres.2018.03.005 . ПМИД 29573722 .
- ^ Драгоман М.В., Теппер Н.К., Фу Р., Кертис К.М., Чоу Р., Гаффилд М.Э. (июнь 2018 г.). «Систематический обзор и метаанализ риска венозного тромбоза среди пользователей комбинированных пероральных контрацептивов» . Int J Gynaecol Obstet . 141 (3): 287–294. дои : 10.1002/ijgo.12455 . ПМЦ 5969307 . ПМИД 29388678 .
- ^ Батур П., Кейси П.М. (февраль 2017 г.). «Судебный процесс по поводу дроспиренона: соответствует ли наказание преступлению?» . J Женское здоровье (Larchmt) . 26 (2): 99–102. дои : 10.1089/jwh.2016.6092 . ПМИД 27854556 .
- ^ Jump up to: а б с Sitruk-Ware R (ноябрь 2016 г.). «Гормональная контрацепция и тромбозы» . Плодородный. Стерильный . 106 (6): 1289–1294. doi : 10.1016/j.fertnstert.2016.08.039 . ПМИД 27678035 .
- ^ Jump up to: а б Нельсон А.Л. (2015). «Обновленная информация о новых пероральных контрацептивах для женщин». Эксперт Опин Фармакотер . 16 (18): 2759–72. дои : 10.1517/14656566.2015.1100173 . ПМИД 26512437 . S2CID 207481206 .
- ^ Фаррис М., Бастианелли С., Розато Е., Бросенс И., Бенаджано Дж. (октябрь 2017 г.). «Фармакодинамика комбинированных эстроген-гестагенных пероральных контрацептивов: 2. Влияние на гемостаз». Эксперт преподобный Клин Фармакол . 10 (10): 1129–1144. дои : 10.1080/17512433.2017.1356718 . ПМИД 28712325 . S2CID 205931204 .
- ^ Jump up to: а б Фруццетти Ф, Каньяччи А (2018). «Венозный тромбоз и гормональная контрацепция: что нового в гормональных контрацептивах на основе эстрадиола?» . Открытый доступ J Контрацепт . 9 : 75–79. дои : 10.2147/OAJC.S179673 . ПМК 6239102 . ПМИД 30519125 .
- ^ Jump up to: а б Гранди Дж., Факкинетти Ф., Битцер Дж. (август 2017 г.). «Эстрадиол в гормональной контрацепции: реальная эволюция или все то же старое вино в новой бутылке?» . Eur J Contracept Reprod Health Care . 22 (4): 245–246. дои : 10.1080/13625187.2017.1372571 . hdl : 11380/1153791 . ПМИД 28902531 .
- ^ Jump up to: а б с д и ж г час я дж к л м Станчик Ф.З., Хэпгуд Дж.П., Винер С., Мишелл Д.Р. (апрель 2013 г.). «Прогестагены, используемые в гормональной терапии в постменопаузе: различия в их фармакологических свойствах, внутриклеточном действии и клинических эффектах» . Эндокринные обзоры . 34 (2): 171–208. дои : 10.1210/er.2012-1008 . ПМК 3610676 . ПМИД 23238854 .
- ^ Jump up to: а б с Canonico M, Plu-Bureau G, Scarabin PY (декабрь 2011 г.). «Прогестагены и венозная тромбоэмболия у женщин в постменопаузе, использующих гормональную терапию» (PDF) . Матуритас . 70 (4): 354–60. дои : 10.1016/j.maturitas.2011.10.002 . ПМИД 22024394 .
- ^ Стивенсон Дж. К., Панай Н., Пексман-Фит К. (сентябрь 2013 г.). «Комбинированная терапия пероральным эстрадиолом и дидрогестероном у женщин в постменопаузе: обзор эффективности и безопасности». Матуритас . 76 (1): 10–21. дои : 10.1016/j.maturitas.2013.05.018 . ПМИД 23835005 .
Дидрогестерон не увеличивал риск ВТЭ, связанной с пероральным приемом эстрогенов (отношение шансов (ОШ) 0,9, 95% ДИ 0,4–2,3). Было обнаружено, что другие прогестагены (ОШ 3,9, 95% ДИ 1,5–10,0) дополнительно повышают риск ВТЭ, связанной с пероральным приемом эстрогенов (ОШ 4,2, 95% ДИ 1,5–11,6).
- ^ Шнайдер С., Джик С.С., Мейер Ч.Р. (октябрь 2009 г.). «Риск сердечно-сосудистых исходов у пользователей эстрадиола / дидрогестерона или других препаратов ЗГТ». Климактерический . 12 (5): 445–53. дои : 10.1080/13697130902780853 . ПМИД 19565370 . S2CID 45890629 .
- ^ Jump up to: а б с д и ж г час я Дэйви Д.А. (март 2018 г.). «Менопаузальная гормональная терапия: лучшее и безопасное будущее». Климактерический . 21 (5): 454–461. дои : 10.1080/13697137.2018.1439915 . ПМИД 29526116 . S2CID 3850275 .
- ^ Jump up to: а б с д и Гольдштейн З., Хан М., Райсман Т., Сафер Дж.Д. (2019). «Управление риском венозной тромбоэмболии у взрослых трансгендеров, проходящих гормональную терапию» . Джей Блад Мед . 10 : 209–216. дои : 10.2147/JBM.S166780 . ПМК 6628137 . ПМИД 31372078 .
- ^ Роуч Р.Э., Лийферинг В.М., Хельмерхорст Ф.М., Каннегитер СК, Розендаль Ф.Р., ван Хилкама Флиг А (январь 2013 г.). «Риск венозного тромбоза у женщин старше 50 лет, применяющих оральные контрацептивы или гормональную терапию в постменопаузе» . Дж. Тромб. Гемост . 11 (1): 124–31. дои : 10.1111/jth.12060 . ПМИД 23136837 . S2CID 22306721 .
- ^ Jump up to: а б с Одлинд В., Милсом I, Перссон I, Виктор А (июнь 2002 г.). «Могут ли изменения в глобулине, связывающем половые гормоны, предсказать риск венозной тромбоэмболии при приеме комбинированных пероральных контрацептивов?» . Acta Obstet Gynecol Scand . 81 (6): 482–90. дои : 10.1034/j.1600-0412.2002.810603.x . ПМИД 12047300 . S2CID 26054257 .
- ^ Рапс М., Хельмерхорст Ф., Флейшер К., Томассен С., Розендал Ф., Розинг Дж., Балье Б., ВАН Влит Х. (июнь 2012 г.). «Глобулин, связывающий половые гормоны, как маркер тромботического риска гормональных контрацептивов» . Дж. Тромб. Гемост . 10 (6): 992–7. дои : 10.1111/j.1538-7836.2012.04720.x . ПМИД 22469296 . S2CID 20803995 .
- ^ Кристин-Мэтр С (2016). «Кардиовакулярный риск гормональной контрацепции у женщин» . Вестник Национальной Медицинской Академии . 200 (7): 1485–1496. дои : 10.1016/S0001-4079(19)30619-3 . ISSN 0001-4079 .
- ^ Стивен Дж. Уинтерс, Илпо Т. Хухтаниеми (25 апреля 2017 г.). Мужской гипогонадизм: основные, клинические и терапевтические принципы . Хумана Пресс. стр. 307–. ISBN 978-3-319-53298-1 .
- ^ Нотеловиц М. (март 2006 г.). «Клиническое мнение: биологические и фармакологические принципы терапии эстрогенами при симптоматической менопаузе» . МедГенМед . 8 (1): 85. ПМК 1682006 . ПМИД 16915215 .
- ^ Гудман, член парламента (февраль 2012 г.). «Все ли эстрогены одинаковы? Обзор пероральной и трансдермальной терапии». J Женское здоровье (Larchmt) . 21 (2): 161–9. дои : 10.1089/jwh.2011.2839 . ПМИД 22011208 .
- ^ Jump up to: а б Стеге Р., Карлстрем К., Коллсте Л., Эрикссон А., Хенрикссон П., Пусетт А. (1988). «Терапия одним препаратом полиэстрадиолфосфата при раке предстательной железы». Являюсь. Дж. Клин. Онкол . 11 (Приложение 2): S101–3. дои : 10.1097/00000421-198801102-00024 . ПМИД 3242384 . S2CID 32650111 .
- ^ Jump up to: а б фон Шульц Б, Карлстрем К, Коллсте Л, Эрикссон А, Хенрикссон П, Пусетт А, Стеге Р (1989). «Эстрогенная терапия и функция печени - метаболические эффекты перорального и парентерального введения». Простата . 14 (4): 389–95. дои : 10.1002/pros.2990140410 . ПМИД 2664738 . S2CID 21510744 .
- ^ Оттоссон У.Б., Карлстрем К., Йоханссон Б.Г., фон Шульц Б. (1986). «Эстрогенная индукция белков печени и холестерина липопротеинов высокой плотности: сравнение валерата эстрадиола и этинилэстрадиола». Гинекол. Обстет. Инвестируйте . 22 (4): 198–205. дои : 10.1159/000298914 . ПМИД 3817605 .
- ^ Фруццетти Ф, Тремольер Ф, Битцер Дж (май 2012 г.). «Обзор разработки комбинированных пероральных контрацептивов, содержащих эстрадиол: акцент на валерат эстрадиола/диеногест» . Гинекол. Эндокринол . 28 (5): 400–8. дои : 10.3109/09513590.2012.662547 . ПМК 3399636 . ПМИД 22468839 .
- ^ Тангприча В., ден Хейер М. (апрель 2017 г.). «Эстрогенная и антиандрогенная терапия для трансгендерных женщин» . «Ланцет». Диабет и эндокринология . 5 (4): 291–300. дои : 10.1016/S2213-8587(16)30319-9 . ПМК 5366074 . ПМИД 27916515 .
- ^ Вейнанд Дж.Д., Сафер Дж.Д. (июнь 2015 г.). «Гормональная терапия у взрослых трансгендеров безопасна под наблюдением врача; обзор последствий гормональной терапии для трансгендеров» . Журнал клинической и трансляционной эндокринологии . 2 (2): 55–60. дои : 10.1016/j.jcte.2015.02.003 . ПМК 5226129 . ПМИД 28090436 .
- ^ Прайс С., Макманус Дж., Барретт Дж. (2019). «Трансгендерное население: повышение осведомленности гинекологов и их роли в оказании помощи» . Акушер-гинеколог . 21 (1): 11–20. дои : 10.1111/тог.12521 . ISSN 1467-2561 .
- ^ Ашеман Х., Гурен Л.Дж. (1993). «Гормональное лечение у транссексуалов». Журнал психологии и сексуальности человека . 5 (4): 39–54. дои : 10.1300/J056v05n04_03 . ISSN 0890-7064 . S2CID 144580633 .
- ^ Хембри В.К., Коэн-Кеттенис П.Т., Гурен Л., Ханнема С.Е., Мейер В.Дж., Мурад М.Х., Розенталь С.М., Сафер Дж.Д., Тангприча В., Т'Шоен Г.Г. (декабрь 2017 г.). «Эндокринное лечение лиц с гендерной дисфорией / гендерно неконгруэнтным поведением: Руководство по клинической практике эндокринного общества». Эндокринная практика . 23 (12): 1437. doi : 10.4158/1934-2403-23.12.1437 . ПМИД 29320642 . S2CID 3639218 .
- ^ Прентис Р.Л., Андерсон Г.Л. (2008). «Инициатива по женскому здоровью: извлеченные уроки» . Ежегодный обзор общественного здравоохранения . 29 : 131–150. doi : 10.1146/annurev.publhealth.29.020907.090947 . ПМИД 18348708 .
- ^ Прентис Р.Л. (ноябрь 2014 г.). «Гормональная терапия в постменопаузе и риски ишемической болезни сердца, рака молочной железы и инсульта» . Семинары по репродуктивной медицине . 32 (6): 419–425. дои : 10.1055/s-0034-1384624 . ПМК 4212810 . ПМИД 25321418 .
- ^ Бассук СС, Мэнсон Дж.Э. (2008). «Испытания гормональной терапии Инициативы по женскому здоровью». Энциклопедия клинических испытаний Wiley . стр. 1–10. дои : 10.1002/9780471462422.eoct391 . ISBN 978-0-471-46242-2 .
- ^ Jump up to: а б с д и Херсмайер Р.К., Томпсон Т.Л., Похост ГМ, Каски Дж.К. (июль 2008 г.). «Сердечно-сосудистые эффекты медроксипрогестерона ацетата и прогестерона: случай ошибочной идентификации?». Природная клиническая практика. Сердечно-сосудистая медицина . 5 (7): 387–395. doi : 10.1038/ncpcardio1234 . ПМИД 18521110 . S2CID 39945411 .
- ^ Ситрук-Уэр Р., Эль-Этр М (август 2013 г.). «Прогестерон и родственные прогестины: новые потенциальные преимущества для здоровья». Климактерический . 16 (Приложение 1): 69–78. дои : 10.3109/13697137.2013.802556 . ПМИД 23647429 . S2CID 25447915 .
- ^ Нат А., Ситрук-Вэр Р. (2009). «Различные сердечно-сосудистые эффекты прогестинов в зависимости от структуры и активности». Климактерический . 12 (Приложение 1): 96–101. дои : 10.1080/13697130902905757 . ПМИД 19811251 . S2CID 2987558 .
- ^ Ситрук-Вэр Р (октябрь 2005 г.). «Фармакология различных прогестагенов: особый случай дроспиренона». Климактерический . 8 (Приложение 3): 4–12. дои : 10.1080/13697130500330382 . ПМИД 16203650 . S2CID 24205704 .
- ^ Sitruk-Ware RL (октябрь 2003 г.). «Гормональная терапия и сердечно-сосудистая система: решающая роль прогестинов». Климактерический . 6 (Приложение 3): 21–28. ПМИД 15018245 .
- ^ Бордман Х.М., Хартли Л., Эйсинга А., Мейн С., Роке и Фигульс М., Бонфилл Косп Х., Габриэль Санчес Р., Найт Б. (март 2015 г.). «Гормональная терапия для профилактики сердечно-сосудистых заболеваний у женщин в постменопаузе» . Кокрановская база данных систематических обзоров . 2015 (3): CD002229. дои : 10.1002/14651858.CD002229.pub4 . hdl : 20.500.12105/9999 . ПМЦ 10183715 . ПМИД 25754617 .
- ^ Jump up to: а б Цзян Ю, Тянь В (ноябрь 2017 г.). «Влияние прогестеронов на липиды крови при заместительной гормональной терапии» . Липиды в здоровье и болезни . 16 (1): 219. дои : 10.1186/s12944-017-0612-5 . ПМК 5697110 . ПМИД 29157280 .
- ^ Нат А., Ситрук-Уэр Р. (апрель 2009 г.). «Парентеральное введение прогестинов для заместительной гормональной терапии». Eur J Contracept Reprod Health Care . 14 (2): 88–96. дои : 10.1080/13625180902747425 . ПМИД 19340703 . S2CID 43025098 .
- ^ Jump up to: а б с д и ж г час я Совместная группа по гормональным факторам рака молочной железы (сентябрь 2019 г.). «Тип и сроки менопаузальной гормональной терапии и риск рака молочной железы: метаанализ индивидуальных участников мировых эпидемиологических данных» . Ланцет . 394 (10204): 1159–1168. дои : 10.1016/S0140-6736(19)31709-X . ПМК 6891893 . ПМИД 31474332 .
- ^ Jump up to: а б с д и ж Ян З, Ху Ю, Чжан Дж, Сюй Л, Цзэн Р, Кан Д (2017). «Терапия эстрадиолом и риск рака молочной железы у женщин в перименопаузе и постменопаузе: систематический обзор и метаанализ». Гинекол. Эндокринол . 33 (2): 87–92. дои : 10.1080/09513590.2016.1248932 . ПМИД 27898258 . S2CID 205631264 .
- ^ Jump up to: а б Ламбриноудаки I (2014). «Прогестагены в постменопаузальной гормональной терапии и риск рака молочной железы». Матуритас . 77 (4): 311–7. дои : 10.1016/j.maturitas.2014.01.001 . ПМИД 24485796 .
- ^ Берал В., Пето Р., Пири К., Ривз Дж. (сентябрь 2019 г.). «Менопаузальная гормональная терапия и 20-летняя смертность от рака молочной железы» . Ланцет . 394 (10204): 1139. doi : 10.1016/S0140-6736(19)32033-1 . ПМИД 31474331 .
- ^ Станчик Ф.З., Бхавнани Б.Р. (июль 2014 г.). «Использование медроксипрогестерона ацетата для гормональной терапии у женщин в постменопаузе: безопасно ли это?». J. Стероидная биохимия. Мол. Биол . 142 : 30–8. дои : 10.1016/j.jsbmb.2013.11.011 . ПМИД 24291402 . S2CID 22731802 .
- ^ Jump up to: а б с Стерди Д.В. (август 2013 г.). «Действительно ли прогестины необходимы в рамках комбинированной схемы ЗГТ?». Климактерический . 16 (Приложение 1): 79–84. дои : 10.3109/13697137.2013.803311 . ПМИД 23651281 . S2CID 21894200 .
- ^ Миркин С. (август 2018 г.). «Доказательства использования прогестерона в менопаузальной гормональной терапии» . Климактерический . 21 (4): 346–354. дои : 10.1080/13697137.2018.1455657 . ПМИД 29630427 .
- ^ Jump up to: а б с д Куль Х., Шнайдер Х.П. (август 2013 г.). «Прогестерон – стимулятор или ингибитор рака молочной железы». Климактерический . 16 (Приложение 1): 54–68. дои : 10.3109/13697137.2013.768806 . ПМИД 23336704 . S2CID 20808536 .
- ^ Jump up to: а б с де Блок С.Дж., Вепьес С.М., Нота Н.М., ван Энгелен К., Аданк М.А., Драйеринк К.М., Барбе Э., Конингс И.Р., ден Хейер М. (май 2019 г.). «Риск рака молочной железы у трансгендеров, получающих гормональное лечение: общенациональное когортное исследование в Нидерландах» . БМЖ . 365 :11652. дои : 10.1136/bmj.l1652 . ПМК 6515308 . ПМИД 31088823 .
- ^ Jump up to: а б с де Блок CJ, Драйеринк К.М., ден Хейер М. (июнь 2019 г.). «Риск рака у трансгендеров». Эндокринол. Метаб. Клин. Северный Ам . 48 (2): 441–452. doi : 10.1016/j.ecl.2019.02.005 . ПМИД 31027551 . S2CID 135382400 .
- ^ Jump up to: а б с Фейнгольд К.Р., Анавалт Б., Бойс А., Хрусос Г., Дунган К., Гроссман А., Хершман Дж.М., Кальцас Г., Кох С., Копп П., Корбониц М., Маклахлан Р., Морли Дж.Э., Нью М., Перро Л., Пурнелл Дж., Ребар Р. , Сингер Ф., Тренс Д.Л., Виник А., Уилсон Д.П., Нота Н.М., Хейер М., Гурен Л.Дж. (2000). «Оценка и лечение взрослых с гендерной дисфорией/гендерной неконгруэнтностью» . Эндотекст [Интернет] . ПМИД 31343858 .
- ^ Jump up to: а б с Ивамото С.Дж., Дефрейн Дж., Ротман М.С., Ван Шуйленберг Дж., Ван де Брюэн Л., Мотманс Дж., Т'Шоен Дж. (2019). «Соображения о здоровье трансгендерных женщин и оставшихся неизвестных: обзор повествования» . Ther Adv Endocrinol Metab . 10 : 2042018819871166. дои : 10.1177/2042018819871166 . ПМЦ 6719479 . ПМИД 31516689 .
- ^ Якобсен Б.М., Хорвиц КБ (2012). «Прогестероновые рецепторы, их изоформы и транскрипция, регулируемая прогестероном» . Мол. Клетка. Эндокринол . 357 (1–2): 18–29. дои : 10.1016/j.mce.2011.09.016 . ПМЦ 3272316 . ПМИД 21952082 .
- ^ Скарпин К.М., Грэм Дж.Д., Моут П.А., Кларк К.Л. (2009). «Действие прогестерона в тканях человека: регуляция экспрессией изоформы рецептора прогестерона (PR), расположение ядра и экспрессия корегулятора» . Сигнал нукле-рецепта . 7 : e009. дои : 10.1621/nrs.07009 . ПМК 2807635 . ПМИД 20087430 .
- ^ Томас П., Панг Ю (2012). «Мембранные рецепторы прогестерона: данные о нейропротекторных, нейростероидных сигнальных и нейроэндокринных функциях в нейрональных клетках» . Нейроэндокринология . 96 (2): 162–71. дои : 10.1159/000339822 . ПМК 3489003 . ПМИД 22687885 .
- ^ Петерсен С.Л., Интлекофер К.А., Моура-Конлон П.Дж., Брюэр Д.Н., Дель Пино Санс Дж., Лопес Х.А. (2013). «Новые рецепторы прогестерона: нервная локализация и возможные функции» . Границы в неврологии . 7 : 164. дои : 10.3389/fnins.2013.00164 . ПМЦ 3776953 . ПМИД 24065878 .
- ^ Гомпель А, Плю-Бюро G (август 2018 г.). «Прогестерон, прогестины и грудь в лечении менопаузы». Климактерический . 21 (4): 326–332. дои : 10.1080/13697137.2018.1476483 . ПМИД 29852797 . S2CID 46922084 .
- ^ Шиндлер А.Е., Кампаньоли С., Дракманн Р., Хубер Дж., Паскуалини Дж.Р., Швеппе К.В., Тийссен Дж.Х. (декабрь 2003 г.). «Классификация и фармакология прогестинов». Матуритас . 46 Приложение 1: S7–S16. дои : 10.1016/зрелость.2003.09.014 . ПМИД 14670641 .
- ^ Куль Х (2011). «Фармакология прогестагенов» (PDF) . J Репродукция эндокринола . 8 (1): 157–177.
- ^ Куль Х (2005). «Фармакология эстрогенов и прогестагенов: влияние различных путей введения» (PDF) . Климактерический . 8 Приложение 1: 3–63. дои : 10.1080/13697130500148875 . ПМИД 16112947 .
- ^ Лауритцен С. (сентябрь 1990 г.). «Клиническое применение эстрогенов и прогестагенов». Зрелость . 12 (3): 199–214. дои : 10.1016/0378-5122(90)90004-П . ПМИД 2215269 .
- ^ Куль Х. (сентябрь 1990 г.). «Фармакокинетика эстрогенов и прогестагенов». Зрелость . 12 (3): 171–97. дои : 10.1016/0378-5122(90)90003-о . ПМИД 2170822 .
- ^ Кнёрр К., Кнёрр-Гертнер Х., Беллер Ф.К., Лауритцен К. (8 марта 2013 г.). Акушерство и гинекология: физиология и патология репродукции . Издательство Спрингер. стр. 583–. ISBN 978-3-642-95583-9 .
- ^ Кнёрр К., Беллер ФК, Лауритцен С (17 апреля 2013 г.). Учебник гинекологии . Издательство Спрингер. стр. 214–. ISBN 978-3-662-00942-0 .
- ^ Горский Ю, Пресль Ю (1981). «Гормональное лечение нарушений менструального цикла». В Дж. Горском, Дж. Пресле (ред.). Функция яичников и ее нарушения: диагностика и терапия . Springer Science & Business Media. стр. 309–332. дои : 10.1007/978-94-009-8195-9_11 . ISBN 978-94-009-8195-9 .
- ^ Ферин Дж. (сентябрь 1972 г.). «Перорально активные гестагенные соединения. Исследования на человеке: воздействие на маточно-вагинальный тракт» . В М. Тауске (ред.). Фармакология эндокринной системы и родственных препаратов: прогестерон, гестагенные препараты и средства против бесплодия . Том. II. Пергамон Пресс. стр. 245–273. ISBN 978-0080168128 . OCLC 278011135 .
- ^ Фреймут А. Лейденбергер, Томас Стровицкий, Олаф Ортманн (29 августа 2009 г.). Клиническая эндокринология для гинекологов . Издательство Спрингер. стр. 225, 227. ISBN. 978-3-540-89760-6 .
- ^ Нойманн Ф., Дюстерберг Б. (1998). «Разработки в области гестагенов». Репродуктивная медицина . 14 (4): 257–264. дои : 10.1007/s004440050042 . ISSN 1434-6931 .
- ^ Хаммерштейн Дж (1990). «Антиандрогены: клинические аспекты». Волосы и их болезни . стр. 827–886. дои : 10.1007/978-3-642-74612-3_35 .
- ^ Виллибальд Пширембель (1968). Практическая гинекология: для студентов и врачей . Вальтер де Грюйтер. п. 599. ИСБН 978-3-11-150424-7 .
- ^ Шор Дж (1968). «Терапевтическое применение прогестагенов у людей» [Терапевтическое использование прогестагенов у людей]. Гестагены [ прогестагены ]. Издательство Спрингер. стр. 1026–1124. дои : 10.1007/978-3-642-99941-3_7 . ISBN 978-3-642-99941-3 .
Чтобы трансформировать эндометрий, им требовалось 200-400 мг этистерона за цикл, и они постулировали эффект, который был примерно в шесть раз слабее, чем от применяемого прогестерона.
- ^ Jump up to: а б Эндрикат Дж., Герлингер С., Ричард С., Розенбаум П., Дюстерберг Б. (декабрь 2011 г.). «Дозы прогестинов для ингибирования овуляции: систематический обзор доступной литературы и препаратов, продаваемых во всем мире». Контрацепция . 84 (6): 549–57. doi : 10.1016/j.contraception.2011.04.009 . ПМИД 22078182 .
Таблица 1. Публикации о дозах прогестинов для ингибирования овуляции: Прогестин: Прогестерон. Ссылка: Пинкус (1956). Метод: Мочевой Пдиол. Суточная доза (мг): 300.000. Общее количество циклов у всех испытуемых: 61. Общее количество овуляций у всех испытуемых: 30. % овуляций у всех испытуемых: 49.
- ^ Милан Растислав Хенцль, Джон А. Эдвардс (10 ноября 1999 г.). «Фармакология прогестинов: производные 17α-гидроксипрогестерона и прогестины первого и второго поколения». В Режин Ситрук-Уэр, Дэниел Р. Мишелл (ред.). Прогестины и антипрогестины в клинической практике . Тейлор и Фрэнсис. стр. 101–132. ISBN 978-0-8247-8291-7 .
- ^ Копера Х (1991). «Гормоны половых желез». Гормональная терапия для женщин . стр. 59–124. дои : 10.1007/978-3-642-95670-6_6 . ISBN 978-3-642-95670-6 . ISSN 0172-777X .
- ^ Рабочая группа МАИР по оценке канцерогенных рисков для человека, Всемирная организация здравоохранения, Международное агентство по исследованию рака (2007). «Приложение 2: Состав пероральных и инъекционных эстроген-прогестагенных контрацептивов». Комбинированные эстроген-прогестагенные контрацептивы и комбинированная эстроген-прогестагенная менопаузальная терапия . Всемирная организация здравоохранения. стр. 431–464. ISBN 978-92-832-1291-1 .
- ^ Лобо Р.А., Станчик ФЗ (1994). «Новые знания в физиологии гормональных контрацептивов». Американский журнал акушерства и гинекологии . 170 (5): 1499–1507. дои : 10.1016/S0002-9378(12)91807-4 . ISSN 0002-9378 .
- ^ Хенцль М.Р. (1986). «Контрацептивные гормоны и их клиническое применение». В Сэмюэле С.К. Йене, Роберте Б. Джаффе (ред.). Репродуктивная эндокринология: физиология, патофизиология и клиническое ведение . Сондерс. стр. 643–682. ISBN 978-0-7216-9630-0 .
- ^ Остергаард Э. (февраль 1965 г.). «Пероральные гестагенные и антиовуляторные свойства мегестрола ацетата и его терапевтическое применение при гинекологических заболеваниях». J Obstet Gynaecol Br Emp . 72 (1): 45–48. дои : 10.1111/j.1471-0528.1965.tb01372.x . ПМИД 12332461 .
Антиовуляторные свойства мегестрола ацетата 5 мг. плюс местранол 0,1 мг. были продемонстрированы у тридцати пяти женщин при прямом осмотре яичников. При монотерапии мегестрола ацетатом 5 мг. или Местранол 0,1 мг. не предотвращал овуляцию во всех случаях.
- ^ Шактер Л., Розенцвейг М., Канетта Р., Келли С., Никез С., Смальдоне Л. (март 1989 г.). «Мегестрола ацетат: клинический опыт». Лечение рака. Преподобный . 16 (1): 49–63. дои : 10.1016/0305-7372(89)90004-2 . ПМИД 2471590 .
В дозе 0,25 мг/день МА не оказывает очевидного влияния на гистологию эндометрия и неэффективен в качестве контрацептива (53). Однако в дозах 0,35 и 0,5 мг/сут препарат является эффективным контрацептивом (10). В дозе 0,5 мг/день МА не ингибирует овуляцию, но снижает подвижность сперматозоидов в посткоитальных тестах (68).
- ^ Весси М., Мирс Э., Андолшек Л., Огринц-Овен М. (1972). «Рандомизированное двойное слепое исследование четырех пероральных контрацептивов, содержащих только прогестаген». Ланцет . 299 (7757): 915–922. дои : 10.1016/S0140-6736(72)91492-4 . ISSN 0140-6736 .
- ^ Офрер МБ, Бенсон Х (июнь 1976 г.). «Прогестерон: обзор и последние достижения». J Pharm Sci . 65 (6): 783–800. дои : 10.1002/jps.2600650602 . ПМИД 945344 .
Ранние исследования его использования в качестве перорального контрацептива показали, что в дозе 300 мг/день (с 5 по 25 день менструального цикла) прогестерон эффективно предотвращает овуляцию в течение четырех циклов (263). Также было исследовано связанное с этим влияние более высоких доз прогестерона на экскрецию гонадотропинов. Ротшильд (264) обнаружил, что постоянное или периодическое внутривенное введение прогестерона (100-400 мг/день) в течение 10 дней снижает общее количество гонадотропина, выводимого с мочой. Однако Полсен и др. (265) обнаружили, что пероральный прогестерон в дозе 1000 мг/день в течение 87 дней не оказывал существенного влияния на экскрецию гонадотропина с мочой. Эффективность прогестерона в качестве перорального контрацептива никогда полностью не проверялась, поскольку были доступны синтетические прогестероновые средства, эффективные при пероральном приеме.
- ^ Пинкус Дж. (декабрь 1958 г.). «Гормональный контроль овуляции и раннего развития». Последипломный мед . 24 (6): 654–60. дои : 10.1080/00325481.1958.11692305 . ПМИД 13614060 .
Таблица 1: Влияние перорального прогестерона на три показателя овуляции: Лекарство: Прогестерон. Количество: 69. Средняя длина цикла: 25,5 ± 0,59. Процент положительных результатов на овуляцию по следующим критериям: Базальная температура: 27. Биопсия эндометрия: 18. Вагинальный мазок: 6. [...] мы остановились на 300 мг. в день [пероральный прогерстерон] в качестве значительно эффективной дозы [ингибирования овуляции], и ее вводили с пятого по двадцать четвертый день менструального цикла. [...] Мы наблюдали за каждым из 33 добровольцев во время контрольного цикла без лечения и в течение одного-трех последовательных циклов приема лекарств сразу после контрольного цикла. В качестве показателей наступления овуляции принимали суточные базальные температуры и влагалищные мазки, а на девятнадцатый-двадцать второй день цикла - биопсию эндометрия. [...] Хотя мы, таким образом, продемонстрировали ингибирующую овуляцию активность прогестерона у женщин с нормальной овуляцией, пероральные препараты прогестерона имели два недостатка: (l) большая суточная доза (300 мг), которая, по-видимому, должна была бы быть еще больше, если бы добивался 100-процентного сдерживания1 [...]
- ^ Пинкус Дж. (1956). «Некоторые эффекты прогестерона и родственных соединений на репродукцию и раннее развитие млекопитающих». Acta Endocrinol Suppl (Копенга) . 23 (Приложение 28): 18–36. дои : 10.1530/acta.0.023S018 . ПМИД 13394044 .
- ^ Стоун А, Купперман HS (1955). «Влияние прогестерона на овуляцию: предварительный отчет» . Пятая Международная конференция по планированию семьи: тема, перенаселение и планирование семьи: отчет о работе, 24-29 октября 1955 г., Токио, Япония . Международная федерация планирования семьи. п. 185.
- ^ С. Байер, Б. Дюстерберг, М. Ф. Эль Этреби, В. Элгер, Ф. Нейман, Ю. Нишино (1983). «Токсикология средств, регулирующих гормональную фертильность». В Джузеппе Бенаджано, Эгоне Дичфалузи (ред.). Эндокринные механизмы регуляции фертильности . Рэйвен Пресс. стр. 261–346. ISBN 978-0-89004-464-3 .
- ^ Кнёрр К., Беллер ФК, Лауритцен С (17 апреля 2013 г.). Учебник гинекологии . Издательство Спрингер. стр. 214–. ISBN 978-3-662-00942-0 .
- ^ Кнёрр К., Кнёрр-Гертнер Х., Беллер Ф.К., Лауритцен К. (8 марта 2013 г.). Акушерство и гинекология: физиология и патология репродукции . Издательство Спрингер. стр. 583–. ISBN 978-3-642-95583-9 .
- ^ Лабхарт А. (6 декабря 2012 г.). Клиническая эндокринология: теория и практика . Springer Science & Business Media. стр. 554–. ISBN 978-3-642-96158-8 .
- ^ Горский Ю, Пресль Ю (1981). «Гормональное лечение нарушений менструального цикла» . В Горский Дж., Пресл К. (ред.). Функция яичников и ее нарушения: диагностика и терапия . Springer Science & Business Media. стр. 309–332. дои : 10.1007/978-94-009-8195-9_11 . ISBN 978-94-009-8195-9 .
- ^ Уфер Дж (1969). Принципы и практика гормональной терапии в гинекологии и акушерстве . де Грюйтер. п. 49. ИСБН 9783110006148 .
17α-Гидроксипрогестерона капроат представляет собой депо-прогестаген, полностью не имеющий побочных действий. Доза, необходимая для индукции секреторных изменений в примированном эндометрии, составляет около 250 мг. за менструальный цикл.
- ^ Пширембель В. (1968). Практическая гинекология: для студентов и врачей . Вальтер де Грюйтер. стр. 598, 601. ISBN. 978-3-11-150424-7 .
- ^ Ферин Дж. (сентябрь 1972 г.). «Эффекты, продолжительность действия и метаболизм у человека» . В Тауске М (ред.). Фармакология эндокринной системы и родственных препаратов: прогестерон, гестагенные препараты и средства против бесплодия . Том. II. Пергамон Пресс. стр. 13–24. ISBN 978-0080168128 . OCLC 278011135 .
- ^ Хенцль М.Р., Эдвардс Дж.А. (10 ноября 1999 г.). «Фармакология прогестинов: производные 17α-гидроксипрогестерона и прогестины первого и второго поколения». В Sitruk-Ware R, Mishell DR (ред.). Прогестины и антипрогестины в клинической практике . Тейлор и Фрэнсис. стр. 101–132. ISBN 978-0-8247-8291-7 .
- ^ Браттон Дж (1976). Фармакология половых гормонов . Академическая пресса. п. 114. ИСБН 978-0-12-137250-7 .
- ^ Санг Г.В. (апрель 1994 г.). «Фармакодинамические эффекты комбинированных инъекционных контрацептивов, принимаемых один раз в месяц». Контрацепция . 49 (4): 361–385. дои : 10.1016/0010-7824(94)90033-7 . ПМИД 8013220 .
- ^ Топпозада МК (апрель 1994 г.). «Существующие комбинированные инъекционные контрацептивы разового приема в месяц». Контрацепция . 49 (4): 293–301. дои : 10.1016/0010-7824(94)90029-9 . ПМИД 8013216 .
- ^ Гебельсманн Ю (1986). «Фармакокинетика противозачаточных стероидов у человека» . В Грегуаре А.Т., Блай Р.П. (ред.). Противозачаточные стероиды: фармакология и безопасность . Springer Science & Business Media. стр. 67–111. дои : 10.1007/978-1-4613-2241-2_4 . ISBN 978-1-4613-2241-2 .
- ^ Беккер Х., Дюстерберг Б., Клостерхалфен Х. (1980). «[Биодоступность ципротерона ацетата после перорального и внутримышечного применения у мужчин (перевод автора)]» [Биодоступность ципротерона ацетата после перорального и внутримышечного применения у мужчин]. Международная урология . 35 (6): 381–385. дои : 10.1159/000280353 . ПМИД 6452729 .
- ^ Мольц Л., Хаазе Ф., Шварц У., Хаммерштейн Дж. (май 1983 г.). «[Лечение вирилизированных женщин внутримышечным введением ципротерона ацетата]» [Эффективность внутримышечного применения ципротерона ацетата при гиперандрогении]. Geburtshilfe und Frauenheilkunde . 43 (5): 281–287. дои : 10.1055/s-2008-1036893 . ПМИД 6223851 .
- ^ Райт Джей Си, Берджесс диджей (29 января 2012 г.). Инъекции длительного действия и имплантаты . Springer Science & Business Media. стр. 114–. ISBN 978-1-4614-0554-2 .
- ^ Чу Ю. Х., Ли Ц, Чжао З. Ф. (апрель 1986 г.). «Фармакокинетика мегестрола ацетата у женщин, получающих внутримышечные инъекции инъекционного контрацептива длительного действия эстрадиол-мегестрол» . Китайский журнал клинической фармакологии .
Результаты показали, что после инъекции концентрация МА в плазме быстро увеличивалась. Среднее время пикового уровня МА в плазме приходилось на 3-й день, наблюдалась линейная зависимость между log концентрации МА в плазме и временем (днями) после введения у всех субъектов, период полувыведения t1/2β = 14,35 ± 9,1 дня.
- ^ Руннебаум БК, Рабе Т, Кизель Л (6 декабря 2012 г.). Женская контрацепция: последние новости и тенденции . Springer Science & Business Media. стр. 429–. ISBN 978-3-642-73790-9 .
- ^ Артини П.Г., Дженаццани А.Р., Петралья Ф (11 декабря 2001 г.). Достижения гинекологической эндокринологии . ЦРК Пресс. стр. 105–. ISBN 978-1-84214-071-0 .
- ^ Кинг Т.Л., Брукер М.К., Крибс Дж.М., Фэйи Дж.О. (21 октября 2013 г.). Акушерство Варни . Издательство Джонс и Бартлетт. стр. 495–. ISBN 978-1-284-02542-2 .
- ^ де Линьер Б., Зильберштейн С. (апрель 2000 г.). «Фармакодинамика эстрогенов и прогестагенов» . Цефалгия: Международный журнал головной боли . 20 (3): 200–7. дои : 10.1046/j.1468-2982.2000.00042.x . ПМИД 10997774 . S2CID 40392817 .
- ^ Чассар Д., Шац Б. (2005). «[Антигонадротропная активность ацетата хлормадинона у женщин репродуктивного возраста]». Гинекология, акушерство и фертильность (на французском языке). 33 (1–2): 29–34. дои : 10.1016/j.gyobfe.2004.12.002 . ПМИД 15752663 .
- ^ Jump up to: а б Брэди Б.М., Андерсон Р.А., Киннибург Д., Бэрд Д.Т. (апрель 2003 г.). «Демонстрация подавления гонадотропина, опосредованного рецептором прогестерона, у мужчин» . Клиническая эндокринология . 58 (4): 506–12. дои : 10.1046/j.1365-2265.2003.01751.x . ПМИД 12641635 . S2CID 12567639 .
- ^ Нойманн Ф (1978). «Физиологическое действие прогестерона и фармакологические эффекты прогестагенов - краткий обзор». Последипломный медицинский журнал . 54 (Приложение 2): 11–24. ПМИД 368741 .
- ^ Вейн А.Дж., Кавусси Л.Р., Новик А.К., Партин А.В., Петерс К.А. (25 августа 2011 г.). Урология Кэмпбелла-Уолша: Expert Consult Premium Edition: расширенные онлайн-функции и печать, набор из 4 томов . Elsevier Науки о здоровье. стр. 2938–. ISBN 978-1-4160-6911-9 .
- ^ Кьелд Дж.М., Пуа К.М., Кауфман Б., Лойзу С., Влотидес Дж., Гви Х.М., Кан Ф., Суд Р., Джоплин Г.Ф. (1979). «Влияние приема норгестрела и этинилэстрадиола на уровень половых гормонов и гонадотропинов в сыворотке крови у мужчин». Клиническая эндокринология . 11 (5): 497–504. doi : 10.1111/j.1365–2265.1979.tb03102.x . ПМИД 519881 . S2CID 5836155 .
- ^ Уротекст (1 января 2001 г.). Уротекст-Луц: Урология . Уротекст. стр. 71–. ISBN 978-1-903737-03-3 .
- ^ Якоби Г.Х., Альтвейн Дж.Е., Курт К.Х., Бастинг Р., Хоэнфеллнер Р. (1980). «Лечение распространенного рака предстательной железы парентеральным ацетатом ципротерона: рандомизированное исследование III фазы». Бр Дж. Урол . 52 (3): 208–15. дои : 10.1111/j.1464-410x.1980.tb02961.x . ПМИД 7000222 .
- ^ Jump up to: а б с Й. Горский, Й. Пресль (6 декабря 2012 г.). Функция яичников и ее нарушения: диагностика и терапия . Springer Science & Business Media. стр. 329–. ISBN 978-94-009-8195-9 .
- ^ Буллок LP, Бардин CW (март 1977 г.). «Андрогенное, синандрогенное и антиандрогенное действие прогестинов». Анналы Нью-Йоркской академии наук . 286 (1 Биохимический А): 321–330. Бибкод : 1977NYASA.286..321B . дои : 10.1111/j.1749-6632.1977.tb29427.x . ПМИД 281183 . S2CID 33611807 .
- ^ Jump up to: а б с Дарни П.Д. (январь 1995 г.). «Андрогенность прогестинов». Американский медицинский журнал . 98 (1А): 104С–110С. дои : 10.1016/S0002-9343(99)80067-9 . ПМИД 7825629 .
- ^ Кампаньоли К., Клавель-Шапелон Ф., Каакс Р., Перис К., Беррино Ф. (июль 2005 г.). «Прогестины и прогестерон в заместительной гормональной терапии и риск рака молочной железы» . Журнал биохимии стероидов и молекулярной биологии . 96 (2): 95–108. дои : 10.1016/j.jsbmb.2005.02.014 . ЧВК 1974841 . ПМИД 15908197 .
- ^ Кеннет Хугдаль, Рене Вестерхаузен (2010). Две половины мозга: обработка информации в полушариях головного мозга . МТИ Пресс. стр. 272–. ISBN 978-0-262-01413-7 .
- ^ Jump up to: а б Шиндлер А.Е., Кампаньоли С., Дракманн Р., Хубер Дж., Паскуалини Дж.Р., Швеппе К.В., Тийссен Дж.Х. (декабрь 2003 г.). «Классификация и фармакология прогестинов». Матуритас . 46 (Приложение 1): С7–С16. дои : 10.1016/зрелость.2003.09.014 . ПМИД 14670641 .
- ^ Jump up to: а б с Дэвид А. Уильямс, Уильям О. Фой, Томас Л. Лемке (январь 2002 г.). Принципы медицинской химии Фоя . Липпинкотт Уильямс и Уилкинс. стр. 700–. ISBN 978-0-683-30737-5 .
- ^ Jump up to: а б с Рикардо Аззиз (8 ноября 2007 г.). Расстройства избытка андрогенов у женщин . Springer Science & Business Media. стр. 124–. ISBN 978-1-59745-179-6 .
- ^ Jump up to: а б Пи Джей Бентли (1980). Эндокринная фармакология: физиологические основы и терапевтическое применение . Архив Кубка. стр. 4–. ISBN 978-0-521-22673-8 .
- ^ Сенгупта (1 января 2007 г.). Гинекология для аспирантов и практикующих врачей . Эльзевир Индия. стр. 137–. ISBN 978-81-312-0436-8 .
- ^ Ферин Дж. (январь 1962 г.). «Искусственная индукция гипоэстрогенной аменореи с помощью метилэстренолона или линестренола». Акта Эндокринологика . 39 (1): 47–67. дои : 10.1530/acta.0.0390047 . ПМИД 13892354 .
- ^ Сондерс Ф.Дж., Дрилл, Вирджиния (май 1956 г.). «Миотрофические и андрогенные эффекты 17-этил-19-нортестостерона и родственных соединений». Эндокринология . 58 (5): 567–572. дои : 10.1210/эндо-58-5-567 . ПМИД 13317831 .
- ^ Jump up to: а б с Армен Х. Ташджян, Эрин Дж. Армстронг (21 июля 2011 г.). Принципы фармакологии: патофизиологические основы лекарственной терапии . Липпинкотт Уильямс и Уилкинс. стр. 523–. ISBN 978-1-4511-1805-6 .
- ^ де Гойер М.Э., Декерс Г.Х., Шунен В.Г., Верхёль Х.А., Клоостербур Х.Дж. (январь 2003 г.). «Профилирование рецепторов и эндокринные взаимодействия тиболона». Стероиды . 68 (1): 21–30. дои : 10.1016/S0039-128X(02)00112-5 . ПМИД 12475720 . S2CID 40426061 .
[Норэтистерон] обладает сходным, а [норэтинодрел] более слабым андрогенным действием по сравнению с тиболоном.
- ^ Рейно Дж.П., Оджасу Т. (1986). «Разработка и использование антагонистов половых стероидов». Дж. Стероидная биохимия . 25 (5Б): 811–33. дои : 10.1016/0022-4731(86)90313-4 . ПМИД 3543501 .
Аналогичным андрогенным потенциалом обладает норэтистерон и его пролекарства (норэтистерона ацетат, этинодиола диацетат, линестренол, норэтинодрел, квингестанол).
- ^ Jump up to: а б Чаудхури (1 января 2007 г.). Практика контроля рождаемости: комплексное руководство (7-е изд.). Эльзевир Индия. стр. 122–. ISBN 978-81-312-1150-2 .
- ^ Куль Х (1996). «Сравнительная фармакология новых прогестагенов». Наркотики . 51 (2): 188–215. дои : 10.2165/00003495-199651020-00002 . ПМИД 8808163 . S2CID 1019532 .
- ^ Офферманнс С., Розенталь В. (14 августа 2008 г.). Энциклопедия молекулярной фармакологии . Springer Science & Business Media. стр. 391–. ISBN 978-3-540-38916-3 .
- ^ Лара Маркс (2001). Сексуальная химия: история противозачаточных таблеток . Издательство Йельского университета. стр. 73–75, 77–78. ISBN 978-0-300-08943-1 .
- ^ Корн Г.В. (март 1961 г.). «Применение норэтинодрела (эновида) в клинической практике» . Журнал Канадской медицинской ассоциации . 84 (11): 584–587. ЧВК 1939348 . ПМИД 13753182 .
Псевдогермафродитизм не должен быть проблемой у этих пациентов, поскольку оказывается, что норэтинодрел не обладает андрогенными свойствами, но считается, что Уилкинс обнаружил один такой случай у пациента, который проходил терапию норэтинодрелом.
- ^ де Гойер М.Э., Декерс Г.Х., Шунен В.Г., Верхёль Х.А., Клоостербур Х.Дж. (январь 2003 г.). «Профилирование рецепторов и эндокринные взаимодействия тиболона». Стероиды . 68 (1): 21–30. дои : 10.1016/s0039-128x(02)00112-5 . ПМИД 12475720 . S2CID 40426061 .
- ^ де Руджери П., Матчер Р., Лупо С., Спаццоли Г. (1965). «Биологические свойства 17α-винил-5(10)-эстрен-17β-ол-3-она (норвинодрел) как прогестагенного и клаудогенного соединения». Стероиды . 5 (1): 73–91. дои : 10.1016/0039-128X(65)90133-9 . ISSN 0039-128X .
- ^ Дж. А. Симпсон, ESC Weiner (1997). Серия дополнений к Оксфордскому словарю английского языка . Кларендон Пресс. стр. 36–. ISBN 978-0-19-860027-5 .
- ^ ДЖАКЕР (8 марта 2013 г.). Достижения в области исследований лекарственных средств / Прогресс в исследованиях лекарственных средств / Progrès des recherches pharmaceutiques . Биркгаузер. стр. 166–. ISBN 978-3-0348-7053-5 .
- ^ Jump up to: а б Годовые отчеты по медицинской химии . Академическая пресса. 8 сентября 1989 г., стр. 199–. ISBN 978-0-08-058368-6 .
- ^ Jump up to: а б с Раудрант Д., Рабе Т. (2003). «Прогестагены с антиандрогенными свойствами». Наркотики . 63 (5): 463–492. дои : 10.2165/00003495-200363050-00003 . ПМИД 12600226 . S2CID 28436828 .
- ^ Шнайдер HP (ноябрь 2003 г.). «Андрогены и антиандрогены». Анналы Нью-Йоркской академии наук . 997 (1): 292–306. Бибкод : 2003NYASA.997..292S . дои : 10.1196/анналы.1290.033 . ПМИД 14644837 . S2CID 8400556 .
- ^ Ботелла Дж., Пэрис Дж., Лалу Б. (август 1987 г.). «Клеточный механизм антиандрогенного действия номегестрола ацетата, нового 19-нор прогестагена, на простату крыс». Акта Эндокринологика . 115 (4): 544–550. дои : 10.1530/acta.0.1150544 . ПМИД 3630545 .
- ^ Хаммерштейн Дж (1990). «Пролекарства: преимущество или недостаток?». Являюсь. Дж. Обстет. Гинекол . 163 (6, часть 2): 2198–203. дои : 10.1016/0002-9378(90)90561-К . ПМИД 2256526 .
- ^ Jump up to: а б Полсен К.А., Лич Р.Б., Ланман Дж., Голдстон Н., Мэддок В.О., Хеллер К.Г. (1962). «Природная эстрогенность норэтиндрона и норэтинодрела: сравнение с другими синтетическими прогестинами и прогестероном». Дж. Клин. Эндокринол. Метаб . 22 (10): 1033–9. doi : 10.1210/jcem-22-10-1033 . ПМИД 13942007 .
- ^ Jump up to: а б Нойманн Ф, Дюстерберг Б, Лоран Х (1988). «Разработка прогестагенов». Женская контрацепция . стр. 129–140. дои : 10.1007/978-3-642-73790-9_11 . ISBN 978-3-642-73792-3 .
- ^ Jump up to: а б Харви П.В. (28 марта 1996 г.). Надпочечники в токсикологии: орган-мишень и модулятор токсичности . ЦРК Пресс. стр. 284–. ISBN 978-0-7484-0330-1 .
- ^ Кускьери А., Ханна Г. (20 января 2015 г.). Основная хирургическая практика: Высшая хирургическая подготовка по общей хирургии, издание пятое . ЦРК Пресс. стр. 899–. ISBN 978-1-4441-3763-7 .
- ^ Джон А. Томас (12 марта 1997 г.). Эндокринная токсикология, второе издание . ЦРК Пресс. стр. 152–. ISBN 978-1-4398-1048-4 .
- ^ Ник Панай, Паула Бриггс, Габ Ковач (20 августа 2015 г.). Управление менопаузой . Издательство Кембриджского университета. стр. 126–. ISBN 978-1-107-45182-7 .
- ^ Мейс П.Дж. (май 2005 г.). «17-гидроксипрогестерон для профилактики преждевременных родов». Акушерство и гинекология . 105 (5, ч. 1): 1128–1135. дои : 10.1097/01.AOG.0000160432.95395.8f . ПМИД 15863556 .
- ^ Куль Х (2005). «Фармакология эстрогенов и прогестагенов: влияние различных путей введения» (PDF) . Климактерический . 8 Приложение 1: 3–63. дои : 10.1080/13697130500148875 . ПМИД 16112947 . S2CID 24616324 .
- ^ Лу-дю Туа Р., Хэпгуд Дж. П., Африканец Д. (май 2020 г.). «Прямое сравнение транскрипционной активности прогестинов, используемых в контрацепции и менопаузальной гормональной терапии, через минералокортикоидный рецептор» . Биохим. Биофиз. Рез. Коммун . 526 (2): 466–471. дои : 10.1016/j.bbrc.2020.03.100 . ПМЦ 7287572 . ПМИД 32234237 .
- ^ Олкерс В. (2002). «Антиминералокортикоидная активность нового перорального контрацептива, содержащего дроспиренон, уникальный прогестаген, напоминающий природный прогестерон». Eur J Contracept Reprod Health Care . 7 (Приложение 3): 19–26, обсуждение 42–3. ПМИД 12659403 .
- ^ Фойдар Дж. М., Фаустман Т. (2007). «Достижения в заместительной гормональной терапии: польза дроспиренона, прогестагена, полученного из 17-альфа-спиролактона, в весе». Гинекол. Эндокринол . 23 (12): 692–9. дои : 10.1080/09513590701582323 . ПМИД 18075844 . S2CID 12572825 .
- ^ Генаццани А.Р., Маннелла П., Симончини Т. (2007). «Дроспиренон и его антиальдостероновые свойства». Климактерический . 10 (Приложение 1): 11–8. дои : 10.1080/13697130601114891 . ПМИД 17364593 . S2CID 24872884 .
- ^ Паласиос С., Фойдар Ж.М., Генаццани А.Р. (2006). «Достижения в заместительной гормональной терапии дроспиреноном, уникальным прогестагеном, обладающим антагонизмом к рецепторам альдостерона» . Матуритас . 55 (4): 297–307. дои : 10.1016/j.maturitas.2006.07.009 . hdl : 2268/9932 . ПМИД 16949774 .
- ^ Член парламента Блэнтона, Се Ю, Данготт Л.Дж., Коэн Дж.Б. (февраль 1999 г.). «Стероид промегестон является неконкурентным антагонистом никотинового ацетилхолинового рецептора Торпедо, который взаимодействует с границей раздела липид-белок». Мол. Фармакол . 55 (2): 269–78. дои : 10.1124/моль.55.2.269 . ПМИД 9927618 . S2CID 491327 .
- ^ Jump up to: а б Нойбауэр Х., Ма Кью, Чжоу Дж., Юй К., Руан Х., Сигер Х., Фем Т., Муек А.О. (октябрь 2013 г.). «Возможная роль PGRMC1 в развитии рака молочной железы». Климактерический . 16 (5): 509–13. дои : 10.3109/13697137.2013.800038 . ПМИД 23758160 . S2CID 29808177 .
- ^ Руан Х, Нойбауэр Х, Ян Й, Шнек Х, Шульц С, Фем Т, Кэхилл М.А., Сигер Х, Муек А.О. (октябрь 2012 г.). «Прогестагены и мембрано-инициируемые эффекты на пролиферацию клеток рака молочной железы человека». Климактерический . 15 (5): 467–72. дои : 10.3109/13697137.2011.648232 . ПМИД 22335423 . S2CID 11302554 .
- ^ Траберт Б., Шерман М.Э., Каннан Н., Станчик Ф.З. (сентябрь 2019 г.). «Прогестерон и рак молочной железы» . Эндокр. Преподобный . 41 (2): 320–344. дои : 10.1210/endrev/bnz001 . ПМЦ 7156851 . ПМИД 31512725 .
- ^ Jump up to: а б с Фотерби К. (август 1996 г.). «Биодоступность пероральных половых стероидов, используемых в оральной контрацепции и заместительной гормональной терапии». Контрацепция . 54 (2): 59–69. дои : 10.1016/0010-7824(96)00136-9 . ПМИД 8842581 .
- ^ Харгроув Дж.Т., Мэксон В.С., Венц AC (октябрь 1989 г.). «Абсорбция перорального прогестерона зависит от носителя и размера частиц». Являюсь. Дж. Обстет. Гинекол . 161 (4): 948–51. дои : 10.1016/0002-9378(89)90759-X . ПМИД 2801843 .
- ^ Левин Х., Уотсон Н. (март 2000 г.). «Сравнение фармакокинетики кринона 8%, вводимого вагинально, и прометрия, принимаемого перорально у женщин в постменопаузе (3)» . Плодородный. Стерильный . 73 (3): 516–21. дои : 10.1016/S0015-0282(99)00553-1 . ПМИД 10689005 .
- ^ Офрер МБ, Бенсон Х (июнь 1976 г.). «Прогестерон: обзор и последние достижения». J Pharm Sci . 65 (6): 783–800. дои : 10.1002/jps.2600650602 . ПМИД 945344 .
- ^ Jump up to: а б Бенно Клеменс Руннебаум, Томас Рабе, Людвиг Кизель (6 декабря 2012 г.). Женская контрацепция: последние новости и тенденции . Springer Science & Business Media. стр. 429–. ISBN 978-3-642-73790-9 .
- ^ Jump up to: а б Кнёрр К., Кнёрр-Гертнер Х., Беллер Ф.К., Лауритцен К. (17 апреля 2013 г.). Учебник гинекологии . Издательство Спрингер. стр. 214–. ISBN 978-3-662-00942-0 .
- ^ Jump up to: а б Кнёрр К., Кнёрр-Гертнер Х., Беллер Ф.К., Лауритцен К. (8 марта 2013 г.). Акушерство и гинекология: физиология и патология репродукции . Издательство Спрингер. стр. 583–. ISBN 978-3-642-95583-9 .
- ^ Jump up to: а б А. Лабхарт (6 декабря 2012 г.). Клиническая эндокринология: теория и практика . Springer Science & Business Media. стр. 554–. ISBN 978-3-642-96158-8 .
- ^ Jump up to: а б Горский Ю, Пресль Ю (1981). «Гормональное лечение нарушений менструального цикла» . В Горский Дж., Пресл Дж. (ред.). Функция яичников и ее нарушения . Springer Science & Business Media. стр. 309–332. дои : 10.1007/978-94-009-8195-9_11 . ISBN 978-94-009-8195-9 .
- ^ Станчик ФЗ (2014). «Лечение женщин в постменопаузе местными кремами и гелями прогестерона: эффективно ли они?». Климактерический . 17 (Приложение 2): 8–11. дои : 10.3109/13697137.2014.944496 . ПМИД 25196424 . S2CID 20019151 .
- ^ Станчик Ф.З., Полсон Р.Дж., Рой С. (2005). «Чрескожное введение прогестерона: уровень в крови и защита эндометрия». Менопауза . 12 (2): 232–7. дои : 10.1097/00042192-200512020-00019 . ПМИД 15772572 . S2CID 10982395 .
- ^ Шиндлер А.Е., Кампаньоли С., Друкманн Р., Хубер Дж., Паскуалини Дж.Р., Швеппе К.В., Тийссен Дж.Х. (2008). «Классификация и фармакология прогестинов» (PDF ) Матуритас . 61 (1–2): 171–80. дои : 10.1016/зрелость.2008.11.013 . ПМИД 19434889 . [ постоянная мертвая ссылка ]
- ^ Эдгрен Р.А., Станчик ФЗ (декабрь 1999 г.). «Номенклатура гонановых прогестинов». Контрацепция . 60 (6): 313. дои : 10.1016/s0010-7824(99)00101-8 . ПМИД 10715364 .
- ^ Инхоффен Х.Х., Логеманн В., Хольвег В., Серини А. (4 мая 1938 г.). «Исследования в серии половых гормонов» . О Dtsch Chem Ges . 71 (5): 1024–32. дои : 10.1002/cber.19380710520 . Архивировано из оригинала 17 декабря 2012 года.
- ^ Jump up to: а б с Мейзел, Альберт К. (1965). Гормональный квест . Нью-Йорк: Рэндом Хаус. OCLC 543168 .
- ^ Jump up to: а б с Петров В. (1970). «Контрацептивные прогестагены». Хим. преп . 70 (6): 713–26. дои : 10.1021/cr60268a004 . ПМИД 4098492 .
- ^ Jump up to: а б с Снидер, Уолтер (2005). «Аналоги гормонов». Открытие лекарств: история . Хобокен, Нью-Джерси: John Wiley & Sons. стр. 188–225. ISBN 978-0-471-89980-8 .
- ^ Jump up to: а б с Джерасси С. (2006). «Химическое рождение таблетки». Am J Obstet Gynecol . 194 (1): 290–8. дои : 10.1016/j.ajog.2005.06.010 . ПМИД 16389046 .
- ^ Джерасси К., Мирамонтес Л., Розенкранц Г., Сондхаймер Ф. (1954). «Стероиды. ЛИВ. Синтез 19-Нор-17α-этинилтестостерона и 19-Нор-17α-метилтестостерона» (PDF) . J Am Chem Soc . 76 (16): 4089–91. дои : 10.1021/ja01645a009 .
- ^ Колтон Ф.Б. (1992). «Стероиды и «таблетки»: ранние исследования стероидов в Сирле». Стероиды . 57 (12): 624–30. дои : 10.1016/0039-128X(92)90015-2 . ПМИД 1481226 . S2CID 28718601 .
- ^ Крейнин, доктор медицинских наук, Дженсен Дж.Т. (сентябрь 2020 г.). «Поколения оральных контрацептивов – пора прекратить использовать маркетинговый миф для определения номенклатуры» . Контрацепция . 102 (3): 143–144. doi : 10.1016/j.contraception.2020.05.017 . ПМИД 32504633 . S2CID 219529452 .
- ^ Jump up to: а б с Нишлаг Э (2010). «Клинические испытания мужской гормональной контрацепции» (PDF) . Контрацепция . 82 (5): 457–70. doi : 10.1016/j.contraception.2010.03.020 . ПМИД 20933120 .
- ^ К. Кутифарис, Л. Мастроянни (15 августа 1997 г.). Новые горизонты репродуктивной медицины . ЦРК Пресс. стр. 101–. ISBN 978-1-85070-793-6 .
- ^ Шио Кумар Сингх (4 сентября 2015 г.). Эндокринология млекопитающих и репродуктивная биология мужчин . ЦРК Пресс. стр. 270–. ISBN 978-1-4987-2736-5 .
- ^ Фрик Дж (1973). «Контроль сперматогенеза у мужчин путем комбинированного введения прогестина и андрогена». Контрацепция . 8 (3): 191–206. дои : 10.1016/0010-7824(73)90030-9 . ISSN 0010-7824 .
- ^ Нишлаг Э., Кумар Н., Ситрук-Вэр Р. (2013). «7α-метил-19-нортестостерон (MENTR): вклад совета народонаселения в исследования мужской контрацепции и лечения гипогонадизма». Контрацепция . 87 (3): 288–95. doi : 10.1016/j.contraception.2012.08.036 . ПМИД 23063338 .
- ^ Аттарди Б.Дж., Хильд С.А., Рил-младший (2006). «Ундеканоат диметандролона: новый мощный перорально активный андроген с прогестагенной активностью» . Эндокринология . 147 (6): 3016–26. дои : 10.1210/en.2005-1524 . ПМИД 16497801 .
- ^ Фог М (1983). «Оценка стероидов как противозачаточных средств у мужчин». Acta Endocrinol Suppl (Копенга) . 260 (3_Supplb): 3–48. дои : 10.1530/acta.0.104S009 . ПМИД 6415998 .
На момент начала наших исследований на мужчинах было протестировано 11 различных гестагенов. Все пероральные препараты применялись в дозах, в 5–12 раз превышающих дозы женских пероральных контрацептивов. Единственным исключением был левоноргестрел, который применялся в очень низкой дозе, а именно 100 мкг в день (Fotherby et al., 1972). Однако никакого влияния на количество сперматозоидов и проникновение сперматозоидов in vitro получено не было.
Дальнейшее чтение
[ редактировать ]- Куль Х. (сентябрь 1990 г.). «Фармакокинетика эстрогенов и прогестагенов». Зрелость . 12 (3): 171–97. дои : 10.1016/0378-5122(90)90003-о . ПМИД 2170822 .
- Лауритцен С. (сентябрь 1990 г.). «Клиническое применение эстрогенов и прогестагенов». Зрелость . 12 (3): 199–214. дои : 10.1016/0378-5122(90)90004-П . ПМИД 2215269 .
- Станчик ФЗ (сентябрь 2002 г.). «Фармакокинетика и эффективность прогестинов, используемых для заместительной гормональной терапии и контрацепции». Преподобный Эндокр Метаб Расстройство . 3 (3): 211–24. дои : 10.1023/А:1020072325818 . ПМИД 12215716 . S2CID 27018468 .
- Раудрант Д., Рабе Т. (2003). «Прогестагены с антиандрогенными свойствами». Наркотики . 63 (5): 463–92. дои : 10.2165/00003495-200363050-00003 . ПМИД 12600226 . S2CID 28436828 .
- Станчик ФЗ (ноябрь 2003 г.). «Не все прогестины одинаковы». Стероиды . 68 (10–13): 879–90. doi : 10.1016/j.steroids.2003.08.003 . ПМИД 14667980 . S2CID 44601264 .
- Нишлаг Э., Зитцманн М., Камишке А. (ноябрь 2003 г.). «Использование прогестинов в мужской контрацепции». Стероиды . 68 (10–13): 965–72. дои : 10.1016/S0039-128X(03)00135-1 . ПМИД 14667989 . S2CID 22458746 .
- Виграц I, Куль Х (август 2004 г.). «Прогестагенная терапия: различия в клинических эффектах?». Тенденции Эндокринол. Метаб . 15 (6): 277–85. дои : 10.1016/j.tem.2004.06.006 . ПМИД 15358281 . S2CID 35891204 .
- Куль Х (2005). «Фармакология эстрогенов и прогестагенов: влияние различных путей введения» (PDF) . Климактерический . 8 (Приложение 1): 3–63. дои : 10.1080/13697130500148875 . ПМИД 16112947 . S2CID 24616324 .
- Ситрук-Вэр Р (октябрь 2005 г.). «Фармакология различных прогестагенов: особый случай дроспиренона». Климактерический . 8 (Приложение 3): 4–12. дои : 10.1080/13697130500330382 . ПМИД 16203650 . S2CID 24205704 .
- Виграц I, Куль Х (сентябрь 2006 г.). «Метаболические и клинические эффекты прогестагенов». Eur J Contracept Reprod Health Care . 11 (3): 153–61. дои : 10.1080/13625180600772741 . ПМИД 17056444 . S2CID 27088428 .
- Станчик ФЗ (2007). «Взаимосвязь структура-функция, фармакокинетика и эффективность прогестагенов, вводимых перорально и парентерально». Лечение женщин в постменопаузе . стр. 779–798. дои : 10.1016/B978-012369443-0/50067-3 . ISBN 978-0-12-369443-0 .
- Ситрук-Уэр Р., Нат А. (ноябрь 2010 г.). «Использование новых прогестинов для контрацепции». Контрацепция . 82 (5): 410–7. doi : 10.1016/j.contraception.2010.04.004 . ПМИД 20933114 .
- Куль Х (2011). «Фармакология прогестагенов» (PDF) . Журнал репродуктивной медицины и эндокринологии – Журнал репродуктивной медицины и эндокринологии . 8 (Специальный выпуск 1): 157–176.
- Лори Т.А., Хельмерхорст Ф.М., Майтра Н.К., Кулиер Р., Блуменкамп К., Гюльмезоглу А.М. (май 2011 г.). «Типы прогестагенов в комбинированной пероральной контрацепции: эффективность и побочные эффекты». Cochrane Database Syst Rev (5): CD004861. дои : 10.1002/14651858.CD004861.pub2 . ПМИД 21563141 .
- Эндрикат Дж., Герлингер С., Ричард С., Розенбаум П., Дюстерберг Б. (декабрь 2011 г.). «Дозы прогестинов для ингибирования овуляции: систематический обзор доступной литературы и препаратов, продаваемых во всем мире». Контрацепция . 84 (6): 549–57. doi : 10.1016/j.contraception.2011.04.009 . ПМИД 22078182 .
- Мур Н.Л., Хики Т.Е., Батлер Л.М., Тилли В.Д. (июнь 2012 г.). «Множественные сигнальные пути ядерных рецепторов опосредуют действие синтетических прогестинов в клетках-мишенях». Мол. Клетка. Эндокринол . 357 (1–2): 60–70. дои : 10.1016/j.mce.2011.09.019 . ПМИД 21945474 . S2CID 20006148 .
- Станчик Ф.З., Хэпгуд Дж.П., Винер С., Мишелл Д.Р. (апрель 2013 г.). «Прогестагены, используемые в гормональной терапии в постменопаузе: различия в их фармакологических свойствах, внутриклеточном действии и клинических эффектах» . Эндокр. Преподобный . 34 (2): 171–208. дои : 10.1210/er.2012-1008 . ПМК 3610676 . ПМИД 23238854 .
- Граймс Д.А., Лопес Л.М., О'Брайен П.А., Раймонд Э.Г. (ноябрь 2013 г.). «Прогестиновые таблетки для контрацепции». Cochrane Database Syst Rev (11): CD007541. дои : 10.1002/14651858.CD007541.pub3 . ПМИД 24226383 .
- Хэпгуд Дж. П., Африкандер Д., Лоу Р., Рэй Р. М., Ровер Дж. М. (июль 2014 г.). «Потенциал прогестагенов, используемых в гормональной терапии: к пониманию дифференциальных действий». J. Стероидная биохимия. Мол. Биол . 142 : 39–47. дои : 10.1016/j.jsbmb.2013.08.001 . ПМИД 23954501 . S2CID 12142015 .
- Ситрук-Уэр Р., Эль-Этр М (август 2013 г.). «Прогестерон и родственные прогестины: новые потенциальные преимущества для здоровья». Климактерический . 16 (Приложение 1): 69–78. дои : 10.3109/13697137.2013.802556 . ПМИД 23647429 . S2CID 25447915 .
- Биньковская М., Воронь Ю. (июнь 2015 г.). «Прогестагены в менопаузальной гормональной терапии» . Прз Менопаузальный . 14 (2): 134–43. дои : 10.5114/pm.2015.52154 . ПМЦ 4498031 . ПМИД 26327902 .