Меленгестрол
 | |
| Клинические данные | |
|---|---|
| код АТС |
|
| Идентификаторы | |
| Номер CAS | |
| ПабХим CID | |
| ХимическийПаук | |
| НЕКОТОРЫЙ | |
| Панель управления CompTox ( EPA ) | |
| Информационная карта ECHA | 100.024.613 |
| Химические и физические данные | |
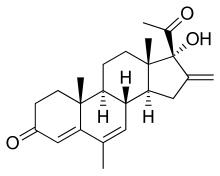
| Формула | С 23 Н 30 О 3 |
| Молярная масса | 354.490 g·mol −1 |
| 3D model ( JSmol ) | |
| | |
Меленгестрол ( МНН , БАН ) — стероидный прогестин группы 17α-гидроксипрогестерона и противоопухолевый препарат , который никогда не поступал на рынок. [ 1 ] Ацилированное у производное меленгестрола ацетат используется в качестве стимулятора роста животных. [ 1 ]
Хотя меленгестрол иногда используется как синоним ацетата меленгестрола , обычно имеется в виду ацетат меленгестрола, а не меленгестрол.
Синтез
[ редактировать ]6-Метил-16-дегидропрегненолона ацетат ( 5 ) является ключевым промежуточным продуктом для получения как меленгестерола ацетата, так и медрогестона . Петров и его сотрудники разработали несколько интересных схем, отправной диосгенин точкой которых является . Эти схемы выполняют необходимые модификации в кольцах A и B, сохраняя при этом боковую цепь сапогенина. По сути, этот подход использует эту боковую цепь в качестве защитной группы для будущей функции 16-дегидро-20-кетона. По одному из этих путей диосгенин сначала превращается в 3-толуолсульфонат ( 1 ). Сольволиз этого производного гомоаллильного спирта дает 3,5-циклостероид ( 2 ) через циклопропилкарбинильный ион ( карбениевый ион ) (не показан). (Эта общая реакция, вероятно, впервые была обнаружена в стероидах и носила название « перегруппировка i -стероидов».) Окисление продукта с помощью PCC дает кетон. Реакция этого вещества с йодидом метилмагния дает два изомерных карбинола с преобладанием α-изомера ( 3 ). Сольволиз в присутствии нуклеофила, такого как уксусная кислота, обращает циклопропилкарбинильное превращение с образованием гомоаллилового ацетата. Удаление боковой цепи сапогенина приводит к получению желаемого продукта ( 5 ). [ 2 ]

Было обнаружено, что замена в 16-м положении приводит к дальнейшему усилению прогестагенной активности. Реакция с диазометаном по сопряженной двойной связи в положении 16 дает сначала пиразол ( 6 ). Этот гетероцикл дает 16-метиленон при пиролизе ( 7 ) . Селективное эпоксидирование сопряженной двойной связи до 16,17α-эпоксида по сравнению с 5,6 достигается окислением основной перекисью водорода ( 8 ). Открытие этого тетразамещенного оксиранового кольца в кислоте происходит с потерей протона из β-положения (16 метил) ( 9 ) с образованием желаемой 16-метилен-17α-гидрокси-20-кетоновой функциональности в кольце D ( 10 ). Продукт омыляют, а затем подвергают окислению Оппенауэра , которое затем дегидрируют до 4,6-диена с помощью хлоранила ( 11 ). Ацетилирование в вынуждающих условиях завершает синтез ацетата меленгестерола.
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б Макдональд Ф (1997). Словарь фармакологических средств . ЦРК Пресс. п. 1269. ИСБН 978-0-412-46630-4 . Проверено 30 мая 2012 г.
- ^ Берн Д., Эллис Б., Петроу В., Стюарт-Уэбб И.А., Уильямсон Д.М. (1957). «809. Модифицированные стероидные гормоны. Часть IV. Производные 6-метилпрегнана». Журнал Химического общества (обновленный) : 4092–4098. дои : 10.1039/JR9570004092 .
- ^ Кирк Д.Н., Петроу В., Уильямсон Д.М. (1961). «550. Модифицированные стероидные гормоны. Часть XXII. 6?,16?-Диметилпрогестерон и 17?-ацетокси-6?-метил-16-метиленпрогестерон». Журнал Химического общества (возобновленный) : 2821–2824. дои : 10.1039/JR9610002821 .