Норэтинодрел
 | |
 | |
| Клинические данные | |
|---|---|
| Торговые названия | Эновид (с местранолом ), др. |
| Другие имена | Норэтинодрел; Норетинодрел Норетинодрел; Нью-Йорк; СК-4642; НСК-15432; 5(10)-норэтистерон; 17α-этинил-19-нор-5(10)-тестостерон; 17α-Этинил-δ 5(10) -19-нортестостерон; 17α-этинилэстр-5(10)-ен-17β-ол-3-он; 19-Нор-17α-прегн-5(10)-ен-20-ин-17β-ол-3-он |
| Маршруты администрация | Через рот |
| Класс препарата | прогестаген ; Прогестин ; Эстроген |
| код АТС | |
| Фармакокинетические данные | |
| Связывание с белками | Норэтинодрел: к альбумину , а не к SHBG , или CBG. [ 1 ] |
| Метаболизм | Печень , кишечник ( гидроксилирование , изомеризация , конъюгация ) [ 1 ] [ 3 ] |
| Метаболиты | • 3α-гидроксиноретинодрел [ 2 ] • 3β-гидроксиноретинодрел [ 2 ] • Норэтистерон [ 2 ] [ 1 ] [ 3 ] • Этинилэстрадиол [ 3 ] [ 4 ] • Конъюгаты [ 3 ] |
| Период полувыведения | Очень короткий (< 30 минут) [ 5 ] |
| Экскреция | Грудное молоко : 1% [ 6 ] |
| Идентификаторы | |
| Номер CAS | |
| ПабХим CID | |
| Лекарственный Банк | |
| ХимическийПаук | |
| НЕКОТОРЫЙ | |
| КЕГГ | |
| КЭБ | |
| ХЭМБЛ | |
| Панель управления CompTox ( EPA ) | |
| Информационная карта ECHA | 100.000.620 |
| Химические и физические данные | |
| Формула | С 20 Н 26 О 2 |
| Молярная масса | 298.426 g·mol −1 |
| 3D model ( JSmol ) | |
| (проверять) | |
Норэтинодрел , или норэтинодрел под торговой маркой Enovid , продаваемый , среди прочего, , представляет собой препарат прогестина , который ранее использовался в противозачаточных таблетках и для лечения гинекологических заболеваний , но в настоящее время больше не продается. [ 3 ] [ 6 ] [ 7 ] [ 8 ] Он был доступен как отдельно, так и в сочетании с эстрогеном . [ 7 ] [ 8 ] [ 9 ] Лекарство принимают внутрь . [ 7 ]
Норэтинодрел представляет собой прогестин или синтетический прогестаген и, следовательно, является агонистом рецептора прогестерона , биологической мишени прогестагенов, таких как прогестерон . [ 3 ] Это относительно слабый прогестаген. [ 10 ] Препарат обладает слабой эстрогенной активностью, отсутствием или очень слабой андрогенной активностью и отсутствием другой важной гормональной активности. [ 3 ] [ 8 ] [ 11 ] [ 12 ] Это пролекарство различных активных метаболитов в организме, таких как норэтистерон и другие. [ 3 ] [ 13 ]
Норэтинодрел был представлен для медицинского применения в 1957 году. [ 8 ] В это время он был специально одобрен в сочетании с местранолом для лечения гинекологических и менструальных нарушений . [ 8 ] Впоследствии, в 1960 году, этот состав был одобрен для использования в качестве противозачаточных таблеток. [ 8 ] [ 14 ] Это была первая противозачаточная таблетка, вскоре после этого последовали противозачаточные таблетки, содержащие норэтистерон и другие прогестины. [ 8 ] [ 14 ] [ 15 ] Из-за того, что норэтинодрел является относительно слабым прогестагеном, он больше не используется в медицине. [ 10 ] Как таковой он больше не продается. [ 6 ] [ 16 ]
Медицинское использование
[ редактировать ]Норэтинодрел ранее использовался в сочетании с эстрогеном местранолом при лечении гинекологических и менструальных нарушений , а также в качестве комбинированной противозачаточной таблетки . [ 8 ] [ 14 ] Он также использовался при лечении эндометриоза в высоких дозах от 40 до 100 мг/день. [ 17 ] Препарат снят с производства, больше не продается и не используется в медицинских целях. [ 10 ] [ 16 ] [ 18 ]
Противопоказания
[ редактировать ]побочных эффектов не наблюдалось . У грудных детей, матерей которых лечили норэтинодрелом, [ 6 ] По этой причине Американская академия педиатрии считает, что норэтинодрел обычно совместим с грудным вскармливанием. [ 6 ]
Побочные эффекты
[ редактировать ]Сообщается о случае признаков маскулинизации у младенца женского пола, мать которого лечилась норэтинодрелом по поводу угрозы выкидыша во время беременности . [ 6 ] [ 19 ] [ 20 ]
Передозировка
[ редактировать ]Взаимодействия
[ редактировать ]Фармакология
[ редактировать ]Фармакодинамика
[ редактировать ]
Норэтинодрел обладает слабой прогестагенной активностью, слабой эстрогенной активностью и отсутствием или очень слабой андрогенной активностью. [ 3 ] Он считается пролекарством , и по этой причине метаболиты норэтинодрела играют важную роль в его биологической активности . [ 3 ] Таким образом, фармакодинамику норэтинодрела невозможно понять без учета его метаболизма . [ 3 ]
Норэтинодрел тесно связан с норэтистероном и тиболоном, которые являются дельта-диабетическими препаратами. 4 -изомер и 7α- метилпроизводное норэтинодрела соответственно. [ 2 ] [ 21 ] Он метаболизируется аналогично тиболону, тогда как метаболизм норэтистерона отличается. [ 2 ] И норэтинодрел, и тиболон трансформируются в 3α- и 3β-гидроксилированные метаболиты и δ-гидроксилированные метаболиты. 4 -изомерный метаболит (в случае норетинодрела это норэтистерон), тогда как норэтистерон не 3α- или 3β-гидроксилирован (и, конечно, не образует δ 4 -изомерный метаболит). [ 2 ] [ 21 ] Основными метаболитами норэтинодрела являются 3α-гидроксиноретинодрел и в меньшей степени 3β-гидроксиноретинодрел, образующиеся соответственно и 3β гидроксистероиддегидрогеназами ( AKR1C1–4 - 3α- ), тогда как δ 4 -изомер норэтистерона представляет собой второстепенный метаболит, образующийся в небольших количествах. [ 2 ]
Тиболон считается пролекарством как его 3α- и 3β-гидроксилированного, так и δ-гидроксилированного. 4 -изомеризованные метаболиты. [ 2 ] Норэтинодрел также считается пролекарством, поскольку он быстро метаболизируется и выводится из кровообращения и демонстрирует очень слабое относительное сродство к рецептору прогестерона (PR), хотя, по-видимому, он образует норэтистерон лишь в незначительных количествах. [ 2 ] [ 5 ] [ 13 ]
Прогестагенная активность
[ редактировать ]Норэтинодрел является относительно слабым прогестагеном , обладающим лишь одной десятой прогестагенной активности норэтистерона. [ 10 ] Доза норэтинодрела, подавляющая овуляцию , составляет 4,0 мг/день по сравнению с 0,4 мг/день в случае норэтистерона. [ 1 ] И наоборот, доза норэтинодрела для трансформации эндометрия составляет 150 мг за цикл по сравнению с 120 мг за цикл норэтистерона. [ 1 ] Что касается PR, норэтинодрел обладает лишь примерно от 6 до 19% сродства норэтистерона к PR A , тогда как сродство двух препаратов к PR B одинаковое (норэтинодрел обладает 94% сродства норэтистерона к PR B). Б ). [ 21 ] Тиболон и δ 4 -изомерный метаболит тиболона имеет такое же сродство к PR, как норэтинодрел и норэтистерон соответственно, тогда как 3α- и 3β-гидроксилированные метаболиты тиболона практически лишены сродства к PR. [ 21 ] Поскольку структурно родственный андроген / анаболический стероид трестолон (7α-метил-19-нортестостерон) известен как мощный прогестаген, [ 22 ] предполагая, что замена 7α-метила не влияет на прогестагенную активность, 3α- и 3β-гидроксиноретинодрель, вероятно, лишены сродства к PR, подобно 3α- и 3β-гидроксилированным метаболитам тиболона. [ 21 ]
Андрогенная активность
[ редактировать ]Сообщается, что норэтинодрел не обладает андрогенной активностью или обладает очень слабой андрогенной активностью. [ 8 ] [ 11 ] [ 12 ] В этом отличие от норэтистерона, который проявляет умеренную, но значительную андрогенность. [ 8 ] [ 3 ] По сравнению с норэтистероном норэтинодрел имеет на 45–81 % более низкое сродство к андрогенным рецепторам (АР). [ 21 ] Соответственно, никаких андрогенных эффектов (таких как гирсутизм , увеличение клитора или изменение голоса при применении норэтинодрела в больших дозах (например, 60 мг/день) в течение длительных периодов времени (9–12 месяцев) не наблюдалось ). лечение женщин с эндометриозом . [ 23 ] Кроме того, не было обнаружено, что норэтинодрел вызывает вирилизацию плодов женского пола , в отличие от многих других прогестинов, производных тестостерона, включая этистерон , норэтистерон и норэтистерон ацетат . [ 24 ] по крайней мере один случай псевдогермафродитизма (вирилизация гениталий), который мог быть следствием норэтинодрела. Однако наблюдался [ 20 ] д 4 -изомерный метаболит тиболона демонстрирует резко и непропорционально повышенное сродство к АР по сравнению с норэтистероном и норэтинодрелом (в 5,7–18,5 раз выше, чем у норэтистерона), что указывает на то, что 7α-метильная группа тиболона заметно увеличивает его андрогенную активность и ответственна за это. из-за большего андрогенного эффекта тиболона по сравнению с норэтинодрелом. [ 21 ]
Эстрогенная активность
[ редактировать ]Норэтинодрел, в отличие от большинства прогестинов, но, как и диацетат этинодиола , обладает некоторой эстрогенной активностью. [ 11 ] Считается, что по сравнению с другими прогестинами 19-нортестостерона норэтинодрел обладает гораздо более сильной эстрогенной активностью. [ 5 ] Сообщалось, что в тесте Аллена-Дойзи на эстрогенность на животных норэтинодрел обладает в 100 раз большей эстрогенной активностью, чем норэтистерон. [ 3 ] В то время как норэтистерон практически не имеет сродства к рецепторам эстрогена (ЭР), норэтинодрел демонстрирует некоторое, хотя и очень слабое сродство как к ERα , так и к ERβ (с точки зрения относительной аффинности связывания , 0,7% и 0,22% от аффинности эстрадиола соответственно). [ 21 ] [ 25 ] Эстрогенная активность 3α- и 3β-гидроксиноретинодрела никогда не оценивалась. [ 2 ] Однако, хотя тиболон проявляет такое же сродство к ЭР, как и норэтинодрел, 3α- и 3β-гидроксилированные метаболиты тиболона обладают в несколько раз повышенным сродством к ЭР. [ 2 ] [ 21 ] Таким образом, 3α- и 3β-гидроксилированные метаболиты норэтинодрела также могут проявлять повышенную эстрогенную активность, и это может объяснить известные эстрогенные эффекты норэтинодрела. [ 2 ] [ 21 ]
д 4 -изомер тиболона, как и норэтистерон, практически лишен сродства к ЭР. [ 21 ] Ни тиболон, ни его метаболиты не ароматизируются, тогда как трестолон легко ароматизируется аналогично тестостерону и 19-нортестостерону, и по этим причинам маловероятно, что норэтинодрел или его метаболиты, кроме норэтистерона, также ароматизируются. [ 26 ] Таким образом, ароматизация, вероятно, не играет роли в эстрогенной активности тиболона или норэтинодрела. [ 26 ] Однако по этому поводу существуют разногласия, и другие исследователи предположили, что тиболон и норэтинодрел могут в небольших количествах ароматизироваться до сильнодействующих эстрогенов ( этинилэстрадиола и его 7α-метилового производного соответственно). [ 27 ] [ 28 ]
Фармакокинетика
[ редактировать ]Норэтинодрел быстро всасывается при пероральном приеме и быстро метаболизируется , исчезая из кровообращения в течение 30 минут. [ 29 ] [ 5 ] Что касается связывания с белками плазмы , норэтинодрел связывается с альбумином и сам не проявляет сродства к глобулину, связывающему половые гормоны , или глобулину, связывающему кортикостероиды . [ 1 ] Однако связывание с белками плазмы его метаболитов , таких как норэтистерон , может различаться. [ 3 ]
Основными метаболитами норэтинодрела в кровообращении являются 3α-гидроксиноретинодрел (образованный 3α-HSD ) и в меньшей степени 3β-гидроксинорэтинодрел (образующийся 3β-HSD ), а также более второстепенные метаболиты норэтинодрела в кровотоке. норэтинодрел представляют собой норэтистерон (образованный δ 5-4 -изомераза ) и, возможно, этинилэстрадиол (образующийся ароматазой или, возможно, другими цитохрома Р450 ферментами , скорее всего, монооксигеназами ). [ 3 ] [ 2 ] [ 4 ] [ 29 ] Из-за очень короткого периода полувыведения и низкого сродства к рецепторам стероидных гормонов в анализах связывания рецепторов норэтинодрел считается пролекарством , которое после перорального приема быстро трансформируется в свои активные метаболиты в кишечнике и печени . [ 1 ] [ 3 ] [ 5 ] [ 13 ] Некоторые исследователи заявили, что это именно пролекарство норэтистерона. [ 1 ] [ 3 ] [ 13 ] Однако, по мнению других исследователей, из-за отсутствия исследований недостаточно данных, чтобы однозначно показать, что это так в настоящее время. [ 13 ]
Около 1% пероральной дозы норетинодрела обнаруживается в грудном молоке . [ 6 ]
Фармакокинетика норэтинодрела была рассмотрена. [ 30 ]
Химия
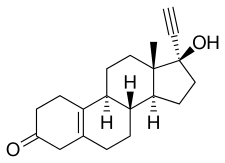
[ редактировать ]Норэтинодрел, также известный как 17α-этинил-δ. 5(10) -19-нортестостерон или 17α-этинилэстр-5(10)-ен-17β-ол-3-он представляет синтетический эстран стероид и производное тестостерона собой . [ 18 ] [ 31 ] В частности, это производное тестостерона, которое было этинилировано в положении C17α, деметилировано в положении C19 и дегидрировано (т.е. имеет двойную связь ) между положениями C5 и C10). [ 18 ] [ 31 ] Таким образом, норэтинодрел также является комбинированным производным нандролона (19-нортестостерона) и этистерона (17α-этинилтестостерона). [ 18 ] [ 31 ] Кроме того, это изомер норэтистерона (17α-этинил-19-нортестостерон), в котором двойная связь С4 заменена двойной связью между положениями С5 и С10. [ 18 ] [ 31 ] По этой причине норэтинодрел также известен как 5(10)-норэтистерон. [ 18 ] [ 31 ] Немногие другие 19-нортестостероновые прогестины имеют двойную связь C5(10) норэтинодрела, но примеры пар, которые действительно включают тиболон производное C7α , метильное норэтинодрела (т.е. 7α-метилнорэтинодрела), и норгестерон C17α , виниловый аналог норэтинодрела . . [ 18 ] [ 31 ]
Синтез
[ редактировать ]химического синтеза норэтинодрела. Опубликованы результаты [ 31 ] [ 30 ]
История
[ редактировать ]Норэтинодрел был впервые синтезирован Фрэнком Б. Колтоном из GD Searle & Company в 1952 году, и этому предшествовал синтез норэтистерона Луисом Э. Мирамонтесом и Карлом Джерасси из Syntex в 1951 году. [ 8 ] В 1957 году норэтинодрел и норэтистерон в сочетании с местранолом были одобрены в США для лечения нарушений менструального цикла . [ 15 ] В 1960 году норэтинодрел в сочетании с местранолом (как Эновид ) был представлен в Соединенных Штатах в качестве первого орального контрацептива, а комбинация норэтистерона и местранола последовала в 1963 году в качестве второго введенного на рынок перорального контрацептива. [ 15 ] В 1988 году прием Эновида, как и других пероральных контрацептивов, содержащих высокие дозы эстрогена, был прекращен. [ 32 ] [ 33 ]
Норэтинодрел был впервые изучен при лечении эндометриоза в 1961 году и стал первым прогестином, исследованным для лечения этого заболевания. [ 17 ]
Общество и культура
[ редактировать ]Общие имена
[ редактировать ]Норэтинодрел — это указанное в подсказке МНН препарата, , а норэтинодрел — это USAN , и BAN . [ 6 ] [ 16 ] [ 18 ] [ 31 ] Он также известен под кодовым названием разработки SC-4642 . [ 6 ] [ 16 ] [ 18 ] [ 31 ]
Названия брендов
[ редактировать ]Норэтинодрел продается отдельно под торговыми марками Энидрел, Оргаметрил и Превисон и в сочетании с местранолом под торговыми марками Коновид, Коновид Е, Энавид, Энавид Е, Эновид, Эновид Е. Норолен и Сингестол. [ 9 ]
Доступность
[ редактировать ]Норэтинодрел больше не доступен ни в одной форме в США. [ 34 ] и, судя по всему, он до сих пор не продается ни в одной другой стране. [ 16 ] [ 18 ]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Перейти обратно: а б с д и ж г час Куль Х. (сентябрь 1990 г.). «Фармакокинетика эстрогенов и прогестагенов». Зрелость . 12 (3): 171–97. дои : 10.1016/0378-5122(90)90003-О . ПМИД 2170822 .
- ^ Перейти обратно: а б с д и ж г час я дж к л м Джин Ю, Дуань Л., Чен М., Пеннинг Т.М., Клоостербоер Х.Дж. (2012). «Метаболизм синтетического прогестагена норэтинодрел человеческими кетостероидредуктазами суперсемейства альдокеторедуктаз» . J. Стероидная биохимия. Мол. Биол . 129 (3–5): 139–44. дои : 10.1016/j.jsbmb.2011.12.002 . ПМК 3303946 . ПМИД 22210085 .
- ^ Перейти обратно: а б с д и ж г час я дж к л м н тот п д Куль Х (2005). «Фармакология эстрогенов и прогестагенов: влияние различных путей введения» (PDF) . Климактерический . 8 (Приложение 1): 3–63. дои : 10.1080/13697130500148875 . ПМИД 16112947 . S2CID 24616324 .
- ^ Перейти обратно: а б Куль Х (2011). «Фармакология прогестагенов» (PDF) . J Репродукция эндокринола . 8 (1): 157–177.
- ^ Перейти обратно: а б с д и Хаммерштейн Дж. (декабрь 1990 г.). «Пролекарства: преимущество или недостаток?». Американский журнал акушерства и гинекологии . 163 (6, ч. 2): 2198–2203. дои : 10.1016/0002-9378(90)90561-К . ПМИД 2256526 .
- ^ Перейти обратно: а б с д и ж г час я Свитман С.С., изд. (2009). «Половые гормоны и их модуляторы» . Мартиндейл: Полный справочник лекарств (36-е изд.). Лондон: Фармацевтическая пресса. стр. 2120–2121. ISBN 978-0-85369-840-1 .
- ^ Перейти обратно: а б с Джакер Э., изд. (21 декабря 2013 г.). Прогресс в исследованиях лекарств / Достижения в исследованиях лекарств / Progrès des recherches pharmaceutiques . Биркхойзер. стр. 85–88. ISBN 978-3-0348-7065-8 .
- ^ Перейти обратно: а б с д и ж г час я дж к Маркс Л (2010). Сексуальная химия: история противозачаточных таблеток . Издательство Йельского университета. стр. 74–75. ISBN 978-0-300-16791-7 .
- ^ Перейти обратно: а б Рабочая группа МАИР по оценке канцерогенного риска химических веществ для человека (1974). Монографии МАИР по оценке канцерогенного риска химических веществ для человека: половые гормоны (PDF) . Всемирная организация здравоохранения. п. 88 191. ISBN 9789283212065 .
- ^ Перейти обратно: а б с д Уильямс Д.А., Фой В.О., Лемке Т.Л. (январь 2002 г.). Принципы медицинской химии Фоя . Липпинкотт Уильямс и Уилкинс. стр. 700–. ISBN 978-0-683-30737-5 .
- ^ Перейти обратно: а б с Руннебаум БК, Рабе Т, Кизель Л (6 декабря 2012 г.). Женская контрацепция: последние новости и тенденции . Springer Science & Business Media. стр. 36–. ISBN 978-3-642-73790-9 .
- ^ Перейти обратно: а б Слоан Э (2002). Биология женщин . Cengage Обучение. стр. 426–. ISBN 978-0-7668-1142-3 .
- ^ Перейти обратно: а б с д и Станчик ФЗ (сентябрь 2002 г.). «Фармакокинетика и эффективность прогестинов, используемых для заместительной гормональной терапии и контрацепции». Обзоры по эндокринным и метаболическим расстройствам . 3 (3): 211–224. дои : 10.1023/А:1020072325818 . ПМИД 12215716 . S2CID 27018468 .
нет Хотя убедительных доказательств трансформации норэтинодрела в норэтиндрон in vivo , данные тестов на связывание рецепторов и биоанализов позволяют предположить, что норэтинодрел также является пролекарством.
- ^ Перейти обратно: а б с Холлингер М.А. (19 октября 2007 г.). Введение в фармакологию, третье издание . ЦРК Пресс. стр. 160–. ISBN 978-1-4200-4742-4 .
- ^ Перейти обратно: а б с Равина Э (11 января 2011 г.). Эволюция открытия лекарств: от традиционных лекарств к современным лекарствам . Джон Уайли и сыновья. стр. 190–. ISBN 978-3-527-32669-3 .
- ^ Перейти обратно: а б с д и [1] [ мертвая ссылка ]
- ^ Перейти обратно: а б Томас Э.Дж., Рок Джей (6 декабря 2012 г.). Современные подходы к эндометриозу . Springer Science & Business Media. стр. 223–. ISBN 978-94-011-3864-2 .
- ^ Перейти обратно: а б с д и ж г час я дж Index Nominum 2000: Международный каталог лекарств . Тейлор и Фрэнсис. Январь 2000 г. стр. 1-1. 1–. ISBN 978-3-88763-075-1 .
- ^ УИЛКИНС Л. (март 1960 г.). «Маскулинизация плода женского пола из-за использования перорально вводимых прогестинов». Проблемы врожденных дефектов . Том. 172. стр. 1028–32. дои : 10.1007/978-94-011-6621-8_31 . ISBN 978-94-011-6623-2 . ПМИД 13844748 .
{{cite book}}:|journal=игнорируется ( помогите ) - ^ Перейти обратно: а б Корн Г.В. (1961). «Применение норэтинодрела (эновида) в клинической практике» . Может ли Med Assoc J. 84 (11): 584–7. ЧВК 1939348 . ПМИД 13753182 .
Псевдогермафродитизм не должен быть проблемой у этих пациентов, поскольку оказывается, что норэтинодрел не обладает андрогенными свойствами, но считается, что Уилкинс обнаружил один такой случай у пациента, который проходил терапию норэтинодрелом.
- ^ Перейти обратно: а б с д и ж г час я дж к де Гойер М.Э., Декерс Г.Х., Шунен В.Г., Верхёль Х.А., Клоостербур Х.Дж. (2003). «Профилирование рецепторов и эндокринные взаимодействия тиболона». Стероиды . 68 (1): 21–30. дои : 10.1016/s0039-128x(02)00112-5 . ПМИД 12475720 . S2CID 40426061 .
- ^ Бери Р., Кумар Н., Сэвидж Т., Беналькасар Л., Сундарам К. (ноябрь 1998 г.). «Эстрогенная и прогестагенная активность 7альфа-метил-19-нортестостерона, синтетического андрогена». Журнал биохимии стероидов и молекулярной биологии . 67 (3): 275–283. дои : 10.1016/S0960-0760(98)00114-9 . ПМИД 9879986 . S2CID 21302338 .
- ^ Кистнер Р.В. (1964). «Стероидные соединения с гестагенной активностью». Последипломный мед . 35 (3): 225–32. дои : 10.1080/00325481.1964.11695038 . ПМИД 14129897 .
Это различие важно клинически, поскольку не сообщалось об андрогенных эффектах (гирсутизм, увеличение клитора, изменение голоса) даже при применении высоких доз норэтинодрела (60 мг в день) в течение 9–12 месяцев у пациенток с эндометриозом.
- ^ Симпсон Дж.Л., Кауфман Р.Х. (1998). «Влияние эстрогенов, прогестагенов и диэтилстильбестрола на плод». Во Фрейзере И.С. (ред.). Эстрогены и прогестагены в клинической практике (3-е изд.). Лондон: Черчилль Ливингстон. стр. 533–53. ISBN 978-0-443-04706-0 .
- ^ Койпер Г.Г., Карлссон Б., Грандьен К., Энмарк Е., Хэггблад Дж., Нильссон С., Густафссон Дж.А. (1997). «Сравнение специфичности связывания лигандов и распределения транскриптов в тканях альфа- и бета-рецепторов эстрогена» . Эндокринология . 138 (3): 863–70. дои : 10.1210/endo.138.3.4979 . ПМИД 9048584 .
- ^ Перейти обратно: а б де Гойер М.Е., Опперс-Тиемиссен Х.М., Лейсен Д., Верхёль Х.А., Клоостербур Х.Дж. (март 2003 г.). «Тиболон не преобразуется человеческой ароматазой в 7альфа-метил-17альфа-этинилэстрадиол (7альфа-MEE): анализы с помощью чувствительных биоанализов на эстрогены и андрогены и с помощью LC-MSMS». Стероиды . 68 (3): 235–243. дои : 10.1016/S0039-128X(02)00184-8 . ПМИД 12628686 . S2CID 29486350 .
- ^ Куль Х., Виграц I (август 2007 г.). «Могут ли производные 19-нортестостерона ароматизироваться в печени взрослых людей? Есть ли клинические последствия?». Климактерический . 10 (4): 344–353. дои : 10.1080/13697130701380434 . ПМИД 17653961 . S2CID 20759583 .
- ^ Клоостербур HJ (апрель 2008 г.). «Тиболон не ароматизируется у женщин в постменопаузе». Климактерический . 11 (2): 175, ответ автора 175-175, ответ автора 176. doi : 10.1080/13697130701752087 . ПМИД 18365860 . S2CID 37940652 .
- ^ Перейти обратно: а б Зейффарт Г. (6 декабря 2012 г.). Дозировка лекарств при почечной недостаточности . Springer Science & Business Media. стр. 423–. ISBN 978-94-011-3804-8 .
- ^ Перейти обратно: а б Гестагены . Издательство Спрингер. 27 ноября 2013 г., стр. 15, 285. ISBN. 978-3-642-99941-3 .
- ^ Перейти обратно: а б с д и ж г час я Элкс Дж. (14 ноября 2014 г.). Словарь лекарств: Химические данные: Химические данные, структуры и библиография . Спрингер. стр. 886–. ISBN 978-1-4757-2085-3 .
- ^ Служба новостей Рейтер (15 апреля 1988 г.). «Сирл и еще двое должны прекратить принимать таблетки с высоким содержанием эстрогена» . Пост-отправка Сент-Луиса . стр. 7D . Проверено 29 августа 2009 г.
- ^ «Таблетки с высоким содержанием эстрогена исчезнут с рынка» . Сан-Хосе Меркьюри Ньюс . 15 апреля 1988 г. Проверено 29 августа 2009 г.
- ^ «Drugs@FDA: Лекарственные препараты, одобренные FDA» . Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США . Проверено 27 ноября 2016 г.