Биоконъюгация
Эта статья может быть слишком технической для понимания большинства читателей . ( Октябрь 2022 г. ) |
Биоконъюгация — это химическая стратегия формирования стабильной ковалентной связи между двумя молекулами, по крайней мере одна из которых является биомолекулой .
Обзор
[ редактировать ]Функция
[ редактировать ]Недавние достижения в понимании биомолекул позволили их применение во многих областях, таких как медицина, диагностика, биокатализ и материалы. Синтетически модифицированные биомолекулы могут иметь разнообразные функциональные возможности, такие как отслеживание клеточных событий, выявление функции ферментов , определение белков биораспределения , визуализация специфических биомаркеров и доставка лекарств в клетки-мишени. [ 1 ] [ 2 ] [ 3 ] [ 4 ] Биоконъюгация является важнейшей стратегией, которая связывает эти модифицированные биомолекулы с различными субстратами . Помимо применения в биомедицинских исследованиях, биоконъюгация в последнее время также приобрела важное значение в нанотехнологиях, таких как биоконъюгированные квантовые точки .
Типы сопряженных молекул
[ редактировать ]Наиболее распространенные типы биоконъюгации включают связывание небольшой молекулы (например, биотина или флуоресцентного красителя) с белком. Конъюгаты антитело-лекарственное средство , такие как Брентуксимаб ведотин и Гемтузумаб озогамицин, являются примерами, попадающими в эту категорию. [ 5 ]
Белковые конъюгации, такие как связывание антитела с ферментом или связывание белковых комплексов, также облегчаются посредством биоконъюгации. [ 6 ] [ 7 ]
Другими менее распространенными молекулами, используемыми в биоконъюгации, являются олигосахариды , нуклеиновые кислоты , синтетические полимеры, такие как полиэтиленгликоль , [ 8 ] и углеродные нанотрубки . [ 9 ]
Общие реакции биоконъюгации
[ редактировать ]Синтез биоконъюгатов включает в себя множество задач: от простого и неспецифического использования флуоресцентного красителя- маркера до сложной разработки конъюгатов антитело-лекарственное средство . [ 1 ] [ 3 ] Для химической модификации белков были разработаны различные реакции биоконъюгации. Распространенными типами реакций биоконъюгации белков являются связывание лизина , цистеина и тирозина аминокислотных остатков , а также модификация триптофана остатков , а также N- и С-конца . [ 1 ] [ 3 ] [ 4 ]
Однако этим реакциям часто не хватает хемоселективности и эффективности, поскольку они зависят от присутствия нативных аминокислот, которые присутствуют в больших количествах, препятствующих селективности. Существует растущая потребность в химических стратегиях, которые могут эффективно прикреплять синтетические молекулы к белкам. Одна из стратегий состоит в том, чтобы сначала установить уникальную функциональную группу на белок, а затем использовать биоортогональную реакцию для соединения биомолекулы с этой уникальной функциональной группой. [ 1 ] Биоортогональные реакции, направленные на ненативные функциональные группы, широко используются в химии биоконъюгации. Некоторыми важными реакциями являются модификация кетонов и альдегидов , лигирование Штаудингера с органическими азидами , катализируемое медью циклоприсоединение азидов по Хейсгену и стимулируемое напряжением циклоприсоединение азидов по Хьюсгену. [ 10 ] [ 11 ] [ 12 ] [ 13 ]
О натуральных аминокислотах
[ редактировать ]Реакции лизинов
[ редактировать ]Нуклеофильный остаток лизина обычно является местом-мишенью при биоконъюгации белков, обычно через N аминореактивные - гидроксисукцинимидиловые (NHS) эфиры . [ 3 ] Чтобы получить оптимальное количество депротонированных остатков лизина, pH должен водного раствора быть ниже pKa группы лизина аммониевой , которое составляет около 10,5, поэтому типичный pH реакции составляет около 8 и 9. Общий реагент для связывания реакция представляет собой NHS-эфир (показан в первой реакции ниже на рисунке 1 лизина ), который реагирует с нуклеофильным лизином посредством механизма ацилирования . Другими подобными реагентами являются изоцианаты и изотиоцианаты , которые действуют по аналогичному механизму (показано на второй и третьей реакциях на рисунке 1 ниже). [ 1 ] Бензоилфториды (показаны в последней реакции ниже на рисунке 1 ), которые позволяют модифицировать белки лизином в мягких условиях (низкая температура, физиологический pH ), были недавно предложены в качестве альтернативы классически используемым реагентам, специфичным для лизина. [ 14 ]
Реакции цистеинов
[ редактировать ]Поскольку свободный цистеин редко встречается на поверхности белка, он является отличным выбором для хемоселективной модификации. [ 15 ] В основных условиях остатки цистеина будут депротонированы с образованием тиолатного нуклеофила, который будет реагировать с мягкими электрофилами , такими как малеимиды и йодацетамиды (показаны в первых двух реакциях на рисунке 2 ниже). В результате связь углерод-сера образуется . Другая модификация остатков цистеина включает образование дисульфидной связи (показано на третьей реакции на рисунке 2 ). Восстановленные экзогенными остатки цистеина реагируют с дисульфидами , образуя новую дисульфидную связь в белке. Для ускорения реакции часто используют избыток дисульфидов, таких как 2-тиопиридон и 3-карбокси-4-нитротиофенол. [ 1 ] [ 3 ] Показано, что электронодефицитные алкины избирательно реагируют с цистеиновыми остатками белков в присутствии других нуклеофильных аминокислотных остатков. В зависимости от алкинового замещения эти реакции могут давать либо расщепляемые (при использовании производных алкинона), [ 16 ] или гидролитически стабильные биоконъюгаты (при 3-арилпропиолонитрилов использовании ; последняя реакция ниже на Фигуре 2 ). [ 17 ]
Реакции тирозина
[ редактировать ]Остатки тирозина относительно нереакционноспособны; поэтому они не были популярными мишенями для биоконъюгации. Недавние разработки показали, что тирозин можно модифицировать посредством реакций электрофильного ароматического замещения (EAS), и он селективен по отношению к ароматическому углероду, соседнему с фенольной гидроксильной группой. [ 1 ] Это становится особенно полезным в случае, когда остатки цистеина не могут быть нацелены. В частности, диазоний эффективно соединяется с остатками тирозина ( соль диазония показана в качестве реагента в первой реакции на рисунке 3 ниже), а электроноакцепторный заместитель в 4-положении соли диазония может эффективно повысить эффективность реакции. циклическое производное диазодикарбоксиамида, такое как 4-фенил-1,2,4-триазол-3,5-дион (ПТАД), Сообщалось, что селективно биоконъюгирует по остаткам тирозина (вторая реакция на рисунке 3 ниже). [ 18 ] Трехкомпонентная реакция типа Манниха с альдегидами и анилинами (последняя реакция на рисунке 3 ) также была описана как относительно селективная по тирозину в мягких оптимизированных условиях реакции. [ 19 ]
Реакции N- и C-концев
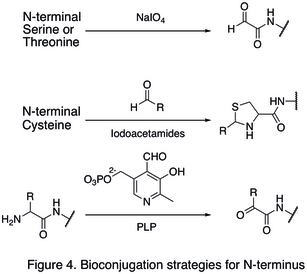
[ редактировать ]Поскольку природные аминокислотные остатки обычно присутствуют в больших количествах, часто бывает трудно модифицировать один единственный сайт. Были разработаны стратегии, нацеленные на концы белка, поскольку они значительно повышают селективность сайта модификации белка. Одна из модификаций N-конца включает функционализацию концевой аминокислоты. Окисление рисунке N-концевых остатков серина и треонина способно генерировать N-концевой альдегид, который может подвергаться дальнейшим биоортогональным реакциям (показано в первой реакции на 4 ). Другой тип модификации включает конденсацию N-концевого цистеина с альдегидом, в результате чего образуется тиазолидин , стабильный при высоком pH (вторая реакция на рисунке 4 ). При использовании пиридоксальфосфата (PLP) несколько N-концевых аминокислот могут подвергаться трансаминированию с образованием N-концевого альдегида , такого как глицин и аспарагиновая кислота (третья реакция на рисунке 4 ).
Примером модификации С-конца является нативное химическое лигирование (NCL), которое представляет собой соединение между С-концевым тиоэфиром и N-концевым цистеином ( рис. 5 ).
Биоортогональные реакции: об уникальных функциональных группах
[ редактировать ]Модификация кетонов и альдегидов
[ редактировать ]Кетон или альдегид могут быть присоединены к белку посредством окисления N-концевых остатков серина или трансаминирования с помощью PLP. Кроме того, их можно вводить путем включения неприродных аминокислот с помощью метода Тиррелла или метода Шульца . [ 10 ] Затем они избирательно конденсируются с алкоксиамином и гидразином , образуя производные оксима и гидразона (показаны в первой и второй реакциях соответственно на рисунке 6 ). Эта реакция высокохемоселективна с точки зрения биоконъюгации белков, но скорость реакции низкая. Механистические исследования показывают, что стадией, определяющей скорость, является дегидратация тетраэдрического промежуточного продукта слабый кислый раствор. , поэтому для ускорения стадии дегидратации часто используется [ 2 ]
Введение нуклеофильного катализатора позволяет значительно повысить скорость реакции (показано на рисунке 7 ). Например, при использовании анилина в качестве нуклеофильного катализатора менее заселенный протонированный карбонил становится сильно заселенным протонированным основанием Шиффа . [ 20 ] Другими словами, он генерирует высокую концентрацию реактивных электрофилов. Затем может легко произойти лигирование оксима, и сообщалось, что скорость увеличивается до 400 раз в мягкой кислой среде. [ 20 ] Ключевым моментом этого катализатора является то, что он может генерировать реакционноспособный электрофил, не конкурируя с желаемым продуктом.
Недавние разработки, в которых используются проксимальные функциональные группы, позволили осуществлять конденсацию гидразона. [ 21 ] работать на расстоянии 20 М −1 с −1 при нейтральном pH, при этом обнаружены конденсации оксимов, протекающие при 500-10000 М. −1 с −1 при нейтральном pH без добавления катализаторов. [ 22 ] [ 23 ]
Лигирование Штаудингера с кислотами
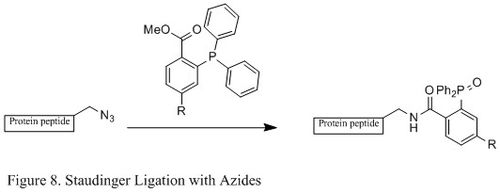
[ редактировать ]азидов Лигирование Штаудингера и фосфина широко использовалось в области химической биологии. Поскольку он способен образовывать стабильную амидную связь в живых клетках и животных, его применяют для модификации клеточных мембран , in vivo визуализации и других исследований биоконъюгации. [ 24 ] [ 25 ] [ 26 ] [ 27 ]
В отличие от классической реакции Штаудингера, лигирование Штаудингера представляет собой реакцию второго порядка , в которой лимитирующей стадией является образование фосфазида (специфический механизм реакции показан на рисунке 9 ). Трифенилфосфин промежуточному четырехчленного кольца сначала реагирует с азидом с образованием азаилида через переходное состояние , а затем внутримолекулярная реакция приводит к иминофосфорану , который затем дает амидную связь при гидролизе. [ 28 ]
Хейсгеновская циклизация азидов
[ редактировать ]Катализируемая медью циклизация азидов по Хейсгену
[ редактировать ]Азиды стали популярной мишенью для хемоселективной модификации белков, поскольку они имеют небольшой размер и благоприятный термодинамический реакционный потенциал . Одной из таких азидных реакций является реакция [3+2] циклоприсоединения с алкином , но реакция требует высокой температуры и часто дает смеси региоизомеров .
Усовершенствованная реакция, разработанная химиком Карлом Барри Шарплессом , включает медный (I) катализатор, который связывает азид с терминальным алкином, что дает только 1,4-замещенные 1,2,3-триазолы с высокими выходами (показано ниже на рисунке 11 ). Механистическое исследование предполагает ступенчатую реакцию. [ 13 ] Cu (I) сначала соединяется с ацетиленами , а затем реагирует с азидом с образованием шестичленного промежуточного соединения. Процесс очень устойчив и протекает при pH в диапазоне от 4 до 12, а сульфат меди (II) часто используется в качестве катализатора в присутствии восстановителя . [ 13 ]
Штамм способствовал циклизации азидов по Хьюсгену.
[ редактировать ]Несмотря на то, что лигирование Штаудингера является подходящей биоконъюгацией в живых клетках без значительной токсичности, чувствительность фосфина к окислению воздухом и его плохая растворимость в воде значительно снижают его эффективность. Катализируемое медью (I) сочетание азида и алкина имеет разумную скорость реакции и эффективность в физиологических условиях, но медь обладает значительной токсичностью и иногда нарушает функции белков в живых клетках. В 2004 году лаборатория химика Кэролайн Р. Бертоцци разработала безметалловое [3+2] циклоприсоединение с использованием напряженных циклооктина и азида . Циклооктин, который является наименьшим стабильным циклоалкином, может соединяться с азидом посредством [3+2] циклоприсоединения, приводя к двум региоизомерным триазолам ( рис. 12 ). [ 11 ] Реакция легко протекает при комнатной температуре и поэтому может быть использована для эффективной модификации живых клеток без негативных последствий. Сообщалось также, что установка фторсодержащих заместителей на циклический алкин может значительно ускорить скорость реакции. [ 2 ] [ 29 ]
Реакции биоконъюгации, опосредованные переходными металлами
[ редактировать ]Биоконъюгация на основе переходных металлов была сложной задачей из-за характера биологических условий – водного раствора, комнатной температуры, умеренного pH и низких концентраций субстрата – которые обычно затрудняют металлоорганические реакции . Однако в последнее время, помимо катализируемой медью реакции циклоприсоединения [3 + 2] азида алкина, все более разнообразные химические превращения, опосредованные переходными металлами, применяются для реакций биоконъюгации, вводя метатезис олефинов , алкилирование, арилирование C–H, C–C, C–S и C–N Реакции кросс-сочетания . [ 30 ] [ 31 ]
Алкилирование
[ редактировать ]О натуральных аминокислотах
[ редактировать ]Использование резус-фактора, полученного in situ II Показано , что -карбеноиды при активации винилзамещенных диазосоединений Rh 2 (OAc) 4 , триптофанами и цистеинами селективно алкилируются в водных средах.
Однако этот метод ограничен поверхностными триптофанами и цистеинами, возможно, из-за стерических ограничений. [ 34 ]
- Ir-катализируемое Lys и N-концевое (восстановительное) алкилирование [ 35 ]
Имины, образующиеся в результате конденсации альдегидов с лизинами или N-концом, могут быть эффективно восстановлены водоустойчивым комплексом [Cp*Ir(bipy)(H 2 O)]SO 4 в присутствии формиат-ионов (служащих гидридом источник). Реакция легко протекает в физиологически соответствующих условиях и приводит к высокой конверсии различных ароматических альдегидов.
- Pd-катализируемое Tyr O-алкилирование [ 36 ]
Используя предварительно полученный электрофильный реагент π-аллилпалладия (II), полученный из предшественников аллилацетата или карбамата, можно добиться селективного аллильного алкилирования тирозинов в водном растворе при комнатной температуре и в присутствии цистеинов.
- Au-катализируемое Cys-алкилирование [ 37 ]
Было показано, что цистеинсодержащие пептиды подвергаются 1,2-присоединению к алленам в присутствии солей золота (I) и/или серебра (I) с образованием гидроксилзамещенных винилтиоэфиров. Реакция с пептидами протекает с высокими выходами и селективна в отношении цистеинов по сравнению с другими нуклеофильными остатками.
Однако реактивность по отношению к белкам значительно снижается, возможно, из-за координации золота с основной цепью белка.
Арилирование
[ редактировать ]О натуральных аминокислотах
[ редактировать ]- Trp-арилирование
Сообщалось о нескольких методах арилирования триптофана C–H, при которых различные электрофилы, такие как арилгалогениды, [ 38 ] [ 39 ] и арилбороновые кислоты [ 40 ] (пример показан ниже) использовались для переноса арильных групп.
Однако текущие условия реакции арилирования триптофана C–H остаются относительно суровыми, требуя органических растворителей, низкого pH и/или высоких температур.
- Цис-арилирование
Свободные тиолы считались неблагоприятными для реакций, опосредованных Pd, из-за разложения Pd-катализатора. [ 41 ] Однако Пд II Было показано, что комплексы окислительного присоединения (ОАК), поддерживаемые диалкилбиарилфосфиновыми лигандами, эффективно способствуют S-арилированию цистеина.
Первый пример – использование Pd II ОАК с РуФосом : [ 42 ] ПД II Комплекс, полученный в результате окислительного присоединения арилгалогенидов или трифторметансульфонатов и использования RuPhos в качестве лиганда, может хемоселективно модифицировать цистеины в различных буферах с 5% органическим сорастворителем при нейтральном pH. Показано, что этот метод модифицирует пептиды и белки, обеспечивает макроциклизацию пептидов (с использованием реагента бис-палладия и пептидов с двумя незащищенными цистеинами). [ 43 ] и синтез конъюгатов антитело-лекарственное средство (ADC) . Замена лиганда на sSPhos поддерживает Pd II Комплекс должен быть достаточно растворим в воде для достижения S-арилирования цистеина в водных условиях без сорастворителей. [ 44 ]
Существуют и другие применения этого метода, где Pd II комплексы были созданы как Pd II -пептидные ОАК путем введения 4-галогенфенилаланина в пептиды во время SPPS для достижения лигирования пептид-пептид или пептид-белок. [ 45 ]
В качестве альтернативы прямому окислительному присоединению к пептиду ОАЦ Pd также могут быть перенесены в белок посредством реакции амин-селективного ацилирования через эфир NHS. Последний был применен для избирательного мечения поверхностных остатков лизина белка (образующих Pd II -белковые ОАЦ) и олигонуклеотиды (образующие Pd II -олигонуклеотиды OAC), которые затем можно было бы связать с цистеинсодержащими пептидами или белками. [ 46 ]
Другой пример белок-белкового кросс-сочетания достигается за счет преобразования остатков цистеина в электрофильный S-арил-Pd-X ОАЦ с использованием стратегии внутримолекулярного окислительного присоединения. [ 47 ]
- Лиз-арилирование [ 48 ]
Подобно цистеину, N-арилирование лизина может быть достигнуто с помощью Pd OAC с различными диалкилбиарилфосфиновыми лигандами . Показано, что из-за более слабой нуклеофильности и более медленной скорости восстановительного элиминирования по сравнению с цистеином выбор поддерживающих лигандов имеет решающее значение. Объемистые лиганды BrettPhos и t -BuBrettPhos в сочетании со слабоосновным феноксидом натрия использовались в качестве стратегии функционализации лизинов на пептидных субстратах. Реакция протекает в мягких условиях и избирательна по отношению к большинству других нуклеофильных аминокислотных остатков.
О неприродных аминокислотах
[ редактировать ]Pd-опосредованные Соногаширы , Хека и реакции кросс-сочетания Сузуки-Мияуры широко применялись для модификации пептидов и белков, при этом были разработаны разнообразные Pd-реагенты для применения в водных растворах. [ 49 ] Эти реакции требуют белкового или пептидного субстрата, несущего неприродные функциональные группы, такие как алкин, [ 50 ] [ 51 ] [ 52 ] арилгалогениды, [ 53 ] [ 54 ] [ 55 ] [ 56 ] и арилбороновые кислоты, [ 57 ] чего можно достичь за счет расширения генетического кода или посттрансляционных модификаций.
Примеры прикладных методов биоконъюгации
[ редактировать ]Факторы роста
[ редактировать ]Сообщалось о биоконъюгации TGF-β с наночастицами оксида железа и его активации посредством магнитной гипертермии in vitro. [ 58 ] Это было сделано с использованием 1-(3-диметиламинопропил)этилкарбодиимида в сочетании с N-гидроксисукцинимидом для образования первичных амидных связей со свободными первичными аминами на факторе роста. Углеродные нанотрубки успешно использовались в сочетании с биоконъюгацией для связывания TGF-β с последующей активацией ближним инфракрасным светом. [ 59 ] Обычно эти реакции включают использование сшивающего агента, но некоторые из них добавляют молекулярное пространство между интересующим соединением и основным материалом и, в свою очередь, вызывают более высокую степень неспецифического связывания и нежелательную реакционную способность. [ 60 ]
См. также
[ редактировать ]- Иммунофлуоресценция
- Биомолекулярная инженерия
- Биотинилирование
- SpyTag/SpyCatcher
- Циклизация белков in situ
- Ненатуральные аминокислоты
- химии биоконъюгатов Журнал
Ссылки
[ редактировать ]- ^ Jump up to: а б с д и ж г Стефанопулос Н., Фрэнсис М.Б. (ноябрь 2011 г.). «Выбор эффективной стратегии биоконъюгации белков». Химическая биология природы . 7 (12): 876–884. дои : 10.1038/nchembio.720 . ПМИД 22086289 .
- ^ Jump up to: а б с Тилли С.Д., Джоши Н.С., Фрэнсис М.Б. (2008). «Белки: химия и химическая реакционная способность». Энциклопедия химической биологии Wiley . стр. 1–16. дои : 10.1002/9780470048672.wecb493 . ISBN 978-0470048672 .
- ^ Jump up to: а б с д и Фрэнсис МБ, Каррико И.С. (декабрь 2010 г.). «Новые рубежи биоконъюгации белков». Современное мнение в области химической биологии . 14 (6): 771–773. дои : 10.1016/j.cbpa.2010.11.006 . ПМИД 21112236 .
- ^ Jump up to: а б Калия Дж., Рейнс RT (январь 2010 г.). «Достижения в области биоконъюгации» . Современная органическая химия . 14 (2): 138–147. дои : 10.2174/138527210790069839 . ПМК 2901115 . ПМИД 20622973 .
- ^ Гербер Х.П., Сентер П.Д., Гревал И.С. (2009). «Конъюгаты антител с лекарственными средствами, воздействующие на сосуды опухоли: текущие и будущие разработки» . МАБ . 1 (3): 247–253. дои : 10.4161/mabs.1.3.8515 . ПМЦ 2726597 . ПМИД 20069754 . Архивировано из оригинала 2 февраля 2014 года.
- ^ Коньев О., Вагнер А (август 2015 г.). «Разработки и последние достижения в области реакций селективного образования эндогенных аминокислотных связей для биоконъюгации» . Обзоры химического общества . 44 (15): 5495–5551. дои : 10.1039/C5CS00048C . ПМИД 26000775 .
- ^ Хатчинс Г.Х., Кисталлер С., Пок П., Льюис А.Х., О Дж., Садиги Р. и др. (февраль 2024 г.). «Ковалентная бициклизация белковых комплексов приводит к образованию прочных четвертичных структур» . Хим . 10 (2): 615–627. Бибкод : 2024Chem...10..615H . дои : 10.1016/j.chempr.2023.10.003 . ПМЦ 10857811 . ПМИД 38344167 .
- ^ Тордарсон П., Ле Друмаге Б., Велония К. (ноябрь 2006 г.). «Четко определенные белково-полимерные конъюгаты - синтез и потенциальное применение» . Прикладная микробиология и биотехнология . 73 (2): 243–254. дои : 10.1007/s00253-006-0574-4 . ПМИД 17061132 . S2CID 23657616 .
- ^ Ян В., Тордарсон П. (2007). «Углеродные нанотрубки для биологического и биомедицинского применения». Нанотехнологии . 18 (41): 412001. Бибкод : 2007Nanot..18O2001Y . дои : 10.1088/0957-4484/18/41/412001 . S2CID 137867074 .
- ^ Jump up to: а б Каррико И.С., Карлсон Б.Л., Бертоцци Ч.Р. (июнь 2007 г.). «Введение генетически закодированных альдегидов в белки». Химическая биология природы . 3 (6): 321–322. дои : 10.1038/nchembio878 . ПМИД 17450134 .
- ^ Jump up to: а б Агард, Нью-Джерси, Прешер Дж. А., Бертоцци Ч. Р. (ноябрь 2004 г.). «Стимулируемое штаммом [3 + 2] азид-алкиновое циклоприсоединение для ковалентной модификации биомолекул в живых системах». Журнал Американского химического общества . 126 (46): 15046–15047. дои : 10.1021/ja044996f . ПМИД 15547999 .
- ^ Колб ХК, Финн МГ, Шарплесс КБ (июнь 2001 г.). «Клик-химия: разнообразные химические функции из нескольких хороших реакций». Ангеванде Хеми . 40 (11): 2004–2021. doi : 10.1002/1521-3773(20010601)40:11<2004::AID-ANIE2004>3.0.CO;2-5 . ПМИД 11433435 .
- ^ Jump up to: а б с Ростовцев В.В., Грин Л.Г., Фокин В.В., Шарплесс КБ (июль 2002 г.). «Ступенчатый процесс циклоприсоединения Хейсгена: катализируемое медью (I) региоселективное «связывание» азидов и концевых алкинов». Ангеванде Хеми . 41 (14): 2596–2599. doi : 10.1002/1521-3773(20020715)41:14<2596::AID-ANIE2596>3.0.CO;2-4 . ПМИД 12203546 .
- ^ Довгань И., Урсуеги С., Эрб С., Мишель С., Колодыч С., Чианферани С. и др. (май 2017 г.). «Ацилфториды: быстрая, эффективная и универсальная конъюгация белков на основе лизина с помощью стратегии Plug-and-Play». Биоконъюгатная химия . 28 (5): 1452–1457. doi : 10.1021/acs.bioconjchem.7b00141 . ПМИД 28443656 .
- ^ Фодже М.Н., Аль-Карадаги С. (май 2002 г.). «Возникновение, конформационные особенности и склонность аминокислот к пи-спирали» . Белковая инженерия . 15 (5): 353–358. дои : 10.1093/протеин/15.5.353 . ПМИД 12034854 .
- ^ Шиу ХИ, Чан ТК, Хо СМ, Лю Ю, Вонг МК, Че СМ (2009). «Электронодефицитные алкины как расщепляемые реагенты для модификации цистеинсодержащих пептидов в водной среде». Химия: Европейский журнал . 15 (15): 3839–3850. дои : 10.1002/chem.200800669 . ПМИД 19229937 .
- ^ Коньев О., Лериш Г., Нотисен М., Реми Дж.С., Струб Дж.М., Шеффер-Рейсс С. и др. (февраль 2014 г.). «Селективное необратимое химическое мечение цистеина 3-арилпропиолонитрилами». Биоконъюгатная химия . 25 (2): 202–206. дои : 10.1021/bc400469d . ПМИД 24410136 .
- ^ Бан Х, Нагано М, Гаврилюк Дж, Хакамата В, Инокума Т, Барбас КФ (апрель 2013 г.). «Легкие и стабильные связи через тирозин: стратегии биоконъюгации с реакцией тирозинового щелчка» . Биоконъюгатная химия . 24 (4): 520–532. дои : 10.1021/bc300665t . ПМЦ 3658467 . ПМИД 23534985 .
- ^ Джоши Н.С., Уитакер Л.Р., Фрэнсис М.Б. (декабрь 2004 г.). «Трехкомпонентная реакция типа Манниха для селективной биоконъюгации тирозина». Журнал Американского химического общества . 126 (49): 15942–15943. дои : 10.1021/ja0439017 . ПМИД 15584710 .
- ^ Jump up to: а б Дирксен А., Хакенг Т.М., Доусон П.Е. (ноябрь 2006 г.). «Нуклеофильный катализ лигирования оксима» . Ангеванде Хеми . 45 (45): 7581–7584. дои : 10.1002/anie.200602877 . ПМИД 17051631 .
- ^ Kool ET, Park DH, Crisalli P (ноябрь 2013 г.). «Быстрые гидразонные реагенты: электронные и кислотно-основные эффекты сильно влияют на скорость при биологическом pH» . Журнал Американского химического общества . 135 (47): 17663–17666. дои : 10.1021/ja407407h . ПМЦ 3874453 . ПМИД 24224646 .
- ^ Шмидт П., Чжоу Л., Тишинов К., Циммерманн К., Джиллингем Д. (октябрь 2014 г.). «Диальдегиды приводят к исключительно быстрой биоконъюгации при нейтральном pH благодаря циклическому промежуточному соединению». Ангеванде Хеми . 53 (41): 10928–10931. дои : 10.1002/anie.201406132 . ПМИД 25164607 .
- ^ Шмидт П., Стресс С., Джиллингем Д. (июнь 2015 г.). «Боровые кислоты способствуют быстрой конденсации оксима при нейтральном pH» . Химическая наука . 6 (6): 3329–3333. дои : 10.1039/C5SC00921A . ПМК 5656983 . ПМИД 29142692 .
- ^ Лемье Г.А., Де Граффенрид К.Л., Бертоцци Ч.Р. (апрель 2003 г.). «Флуорогенный краситель, активируемый лигированием Штаудингера». Журнал Американского химического общества . 125 (16): 4708–4709. дои : 10.1021/ja029013y . ПМИД 12696879 .
- ^ Лафлин С.Т., Баскин Дж.М., Амахер С.Л., Бертоцци Ч.Р. (май 2008 г.). «Визуализация мембраносвязанных гликанов in vivo у развивающихся рыбок данио» . Наука . 320 (5876): 664–667. Бибкод : 2008Sci...320..664L . дои : 10.1126/science.1155106 . ПМК 2701225 . ПМИД 18451302 .
- ^ Саксон Э., Бертоцци ЧР (март 2000 г.). «Инженерия клеточной поверхности с помощью модифицированной реакции Штаудингера». Наука . 287 (5460): 2007–2010. Бибкод : 2000Sci...287.2007S . дои : 10.1126/science.287.5460.2007 . ПМИД 10720325 . S2CID 19720277 .
- ^ Прешер Дж. А., Дубе Д. Х., Бертоцци Ч. Р. (август 2004 г.). «Химическое ремоделирование клеточных поверхностей у живых животных». Природа . 430 (7002): 873–877. Бибкод : 2004Natur.430..873P . дои : 10.1038/nature02791 . ПМИД 15318217 . S2CID 4371934 .
- ^ Лин Ф.Л., Хойт Х.М., ван Халбек Х., Бергман Р.Г., Бертоцци Ч.Р. (март 2005 г.). «Механистическое исследование перевязки Штаудингера». Журнал Американского химического общества . 127 (8): 2686–2695. дои : 10.1021/ja044461m . ПМИД 15725026 .
- ^ Чанг П.В., Прешер Дж.А., Слеттен Э.М., Баскин Дж.М., Миллер И.А., Агард, Нью-Джерси и др. (февраль 2010 г.). «Химия щелчков без меди у живых животных» . Труды Национальной академии наук Соединенных Штатов Америки . 107 (5): 1821–1826. Бибкод : 2010PNAS..107.1821C . дои : 10.1073/pnas.0911116107 . ПМЦ 2836626 . ПМИД 20080615 .
- ^ Родригес Х., Мартинес-Кальво М. (август 2020 г.). «Модификация биомолекул, опосредованная переходными металлами». Химия: Европейский журнал . 26 (44): 9792–9813. дои : 10.1002/chem.202001287 . ПМИД 32602145 . S2CID 220272489 .
- ^ Виноградова Е.В. (01.11.2017). «Металлоорганическая химическая биология: металлоорганический подход к биоконъюгации». Чистая и прикладная химия . 89 (11): 1619–1640. doi : 10.1515/pac-2017-0207 (неактивен 26 июня 2024 г.). ISSN 1365-3075 . S2CID 103469980 .
{{cite journal}}: CS1 maint: DOI неактивен по состоянию на июнь 2024 г. ( ссылка ) - ^ Антос Дж. М., Фрэнсис М.Б. (август 2004 г.). «Селективная модификация триптофана карбеноидами родия в водном растворе». Журнал Американского химического общества . 126 (33): 10256–10257. дои : 10.1021/ja047272c . ПМИД 15315433 .
- ^ Кунду Р., Болл З.Т. (май 2013 г.). «Родий-катализируемая модификация цистеина диазореагентами». Химические коммуникации . 49 (39): 4166–4168. дои : 10.1039/c2cc37323h . ПМИД 23175246 .
- ^ Заутхофф Дж. (1 января 1996 г.). "Intermetallics J. Chem Am . . 118 Soc . 1996 , " , 934 . Журнал Американского химического общества . 118 (43): 10678. дои : 10.1021/ja965445v . ISSN 0002-7863 .
- ^ Макфарланд Дж. М., Фрэнсис М.Б. (октябрь 2005 г.). «Восстановительное алкилирование белков с использованием трансферного гидрирования, катализируемого иридием». Журнал Американского химического общества . 127 (39): 13490–13491. дои : 10.1021/ja054686c . ПМИД 16190700 .
- ^ Тилли С.Д., Фрэнсис М.Б. (февраль 2006 г.). «Тирозин-селективное алкилирование белков с использованием комплексов пи-аллилпалладия». Журнал Американского химического общества . 128 (4): 1080–1081. дои : 10.1021/ja057106k . ПМИД 16433516 .
- ^ Чан А.О., Цай Дж.Л., Ло В.К., Ли Г.Л., Вонг М.К., Че С.М. (февраль 2013 г.). «Селективная цистеиновая модификация пептидов, опосредованная золотом, с использованием алленов». Химические коммуникации . 49 (14): 1428–1430. дои : 10.1039/c2cc38214h . ПМИД 23322001 .
- ^ Руис-Родригес Х., Альберисио Ф., Лавилла Р. (январь 2010 г.). «Постсинтетическая модификация пептидов: хемоселективное С-арилирование остатков триптофана». Химия: Европейский журнал . 16 (4): 1124–1127. дои : 10.1002/chem.200902676 . ПМИД 20013969 .
- ^ Шишко А, Рен Х, Капланерис Н, Аккерманн Л (февраль 2017 г.). «Биоортогональная диверсификация пептидов посредством селективной активации CH, катализируемой рутением (II)». Ангеванде Хеми . 56 (6): 1576–1580. дои : 10.1002/anie.201609631 . ПМИД 28074503 .
- ^ Уильямс Т.Дж., Рей Эй.Дж., Уитвуд АС, Фэйрлэмб И.Дж. (март 2014 г.). «Мягкая и селективная Pd-опосредованная методология синтеза высокофлуоресцентных 2-арилированных триптофана и триптофансодержащих пептидов: каталитическая роль наночастиц Pd(0)?» . Химические коммуникации . 50 (23): 3052–3054. дои : 10.1039/C3CC48481E . ПМИД 24516861 .
- ^ Бонг Д.Т., Гадири М.Р. (август 2001 г.). «Хемоселективное связывание пептидов, катализируемое Pd (0), в воде». Органические письма . 3 (16): 2509–2511. дои : 10.1021/ol016169e . ПМИД 11483047 .
- ^ Виноградова Е.В., Чжан С., Спокойный А.М., Пентелюта Б.Л., Бухвальд С.Л. (октябрь 2015 г.). «Металлоорганические палладиевые реагенты для биоконъюгации цистеина» . Природа . 526 (7575): 687–691. Бибкод : 2015Природа.526..687В . дои : 10.1038/nature15739 . ПМЦ 4809359 . ПМИД 26511579 .
- ^ Рохас А.Дж., Чжан С., Виноградова Е.В., Бухвальд Н.Х., Рейли Дж., Пентелюте Б.Л. и др. (июнь 2017 г.). «Дивергентная макроциклизация незащищенного пептида путем палладий-опосредованного арилирования цистеина» . Химическая наука . 8 (6): 4257–4263. дои : 10.1039/C6SC05454D . ПМЦ 5635729 . ПМИД 29081961 .
- ^ Рохас А.Дж., Пентелюте Б.Л., Бухвальд С.Л. (август 2017 г.). «Водорастворимые палладиевые реагенты для S-арилирования цистеина в водных условиях» . Органические письма . 19 (16): 4263–4266. doi : 10.1021/acs.orglett.7b01911 . ПМЦ 5818991 . ПМИД 28777001 .
- ^ Рохас А.Дж., Вулф Дж.М., Данджи Х.Х., Буслов И., Труекс Н.Л., Лю Р.Ю. и др. (октябрь 2022 г.). «Комплексы окислительного присоединения палладий-пептид для биоконъюгации» . Химическая наука . 13 (40): 11891–11895. дои : 10.1039/D2SC04074C . ПМЦ 9580489 . ПМИД 36320916 .
- ^ Джбара М., Родригес Дж., Данджи Х.Х., Лоас А., Бухвальд С.Л., Пентелюте Б.Л. (май 2021 г.). «Биоконъюгация олигонуклеотидов с бифункциональными палладиевыми реагентами» . Ангеванде Хеми . 60 (21): 12109–12115. дои : 10.1002/anie.202103180 . ПМК 8143041 . ПМИД 33730425 .
- ^ Дханджи Х.Х., Саеби А., Буслов И., Лофтис А.Р., Бухвальд С.Л., Пентелюта Б.Л. (май 2020 г.). «Кросс-сочетание белок-белок посредством комплексов окислительного присоединения палладий-белок из остатков цистеина» . Журнал Американского химического общества . 142 (20): 9124–9129. дои : 10.1021/jacs.0c03143 . ПМЦ 7586714 . ПМИД 32364380 .
- ^ Ли Х.Г., Лотретт Дж., Пентелют Б.Л., Бухвальд С.Л. (март 2017 г.). «Палладий-опосредованное арилирование лизина в незащищенных пептидах» . Ангеванде Хеми . 56 (12): 3177–3181. дои : 10.1002/anie.201611202 . ПМК 5741856 . ПМИД 28206688 .
- ^ Ли Дж, Чен П.Р. (август 2012 г.). «Перемещение Pd-опосредованного белкового перекрестного соединения в живые системы». ХимБиоХим . 13 (12): 1728–1731. дои : 10.1002/cbic.201200353 . ПМИД 22764130 . S2CID 19601358 .
- ^ Ли Дж., Линь С., Ван Дж., Цзя С., Ян М., Хао З. и др. (май 2013 г.). «Безлигандная палладий-опосредованная сайт-специфическая маркировка белков внутри грамотрицательных бактериальных патогенов». Журнал Американского химического общества . 135 (19): 7330–7338. дои : 10.1021/ja402424j . ПМИД 23641876 .
- ^ Ли Н, Лим Р.К., Эдвардраджа С., Лин Кью (октябрь 2011 г.). «Кросс-сочетание Соногаширы без меди для функционализации белков, кодируемых алкинами, в водной среде и в бактериальных клетках» . Журнал Американского химического общества . 133 (39): 15316–15319. дои : 10.1021/ja2066913 . ПМК 3184007 . ПМИД 21899368 .
- ^ Ли Н, Рамиль К.П., Лим Р.К., Лин Кью (февраль 2015 г.). «Генетически закодированный алкин направляет палладий-опосредованную маркировку белка на поверхность живых клеток млекопитающих» . АКС Химическая биология . 10 (2): 379–384. дои : 10.1021/cb500649q . ПМК 4340352 . ПМИД 25347611 .
- ^ Чалкер Дж. М., Вуд К.С., Дэвис Б.Г. (ноябрь 2009 г.). «Удобный катализатор водного и белкового кросс-сочетания Сузуки-Мияуры». Журнал Американского химического общества . 131 (45): 16346–16347. дои : 10.1021/ja907150m . ПМИД 19852502 .
- ^ Компакт-диск Спайсера, Дэвис Б.Г. (февраль 2011 г.). «Сайт-селективная модификация белка Сузуки-Мияуры, опосредованная палладием, генетически кодируемых арилгалогенидов». Химические коммуникации . 47 (6): 1698–1700. дои : 10.1039/C0CC04970K . ПМИД 21206952 .
- ^ Спайсер CD, Тример Т., Дэвис Б.Г. (январь 2012 г.). «Метка клеточной поверхности, опосредованная палладием». Журнал Американского химического общества . 134 (2): 800–803. дои : 10.1021/ja209352s . ПМИД 22175226 .
- ^ Дюма А., Спайсер С.Д., Гао З., Такехана Т., Лин Ю.А., Ясукочи Т. и др. (апрель 2013 г.). «Самолигандированное соединение Сузуки-Мияуры для сайт-селективного ПЭГилирования белка». Ангеванде Хеми . 52 (14): 3916–3921. дои : 10.1002/anie.201208626 . ПМИД 23440916 .
- ^ Брустад Э., Буши М.Л., Ли Дж.В., Грофф Д., Лю В., Шульц П.Г. (13 октября 2008 г.). «Генетически кодируемая боронатсодержащая аминокислота» . Ангеванде Хеми . 47 (43): 8220–8223. дои : 10.1002/anie.200803240 . ПМЦ 2873848 . ПМИД 18816552 .
- ^ Ази О, Гринберг З.Ф., Батич К.Д., Добсон Дж.П. (июнь 2019 г.). «Карбодиимидное конъюгирование латентного трансформирующего фактора роста β1 с суперпарамагнитными наночастицами оксида железа для удаленной активации» . Международный журнал молекулярных наук . 20 (13): 3190. doi : 10.3390/ijms20133190 . ПМК 6651417 . ПМИД 31261853 .
- ^ Линь Л., Лю Л., Чжао Б., Се Р., Линь В., Ли Х. и др. (май 2015 г.). «Оптическая активация передачи сигналов TGF-β с помощью углеродных нанотрубок ближним инфракрасным светом». Природные нанотехнологии . 10 (5): 465–471. Бибкод : 2015НатНа..10..465Л . дои : 10.1038/nnano.2015.28 . ПМИД 25775150 .
- ^ Лалли Э., Сарти Г., Бой С. (2018). «Влияние спейсера на неспецифическое связывание в мембранной аффинной хроматографии». МРС Коммуникации . 8 (1): 65–70. дои : 10.1557/mrc.2018.4 . S2CID 103064199 .