1-тетралон

| |

| |
| Имена | |
|---|---|
| Предпочтительное название ИЮПАК
3,4-Дигидро-2Н - нафталин-1-он | |
| Другие имена
α-тетралон; 1-тетралон
| |
| Идентификаторы | |
3D model ( JSmol )
|
|
| ХЭМБЛ | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.007.692 |
| Номер ЕС |
|
ПабХим CID
|
|
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA )
|
|
| Характеристики | |
| С 10 Н 10 О | |
| Молярная масса | 146.189 g·mol −1 |
| Появление | бесцветная жидкость |
| Плотность | 1,099 г·см −3 (25 °С ) [ 1 ] |
| Температура плавления | 2–7 °С [ 1 ] |
| Точка кипения | 255–257 °С [ 2 ] 113–116 °С (8 гПа) [ 1 ] |
| нерастворимый [ 3 ] | |
| Растворимость | растворим в органических растворителях |
| Давление пара | 2,7 Па (20 °С) [ 3 ] |
Показатель преломления ( n D )
|
1.5672 |
| Опасности | |
| СГС Маркировка : [ 4 ] | |

| |
| Предупреждение | |
| H302 | |
| П264 , П270 , П301+П317 , П330 , П501 | |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
1-Тетралон представляет собой бициклический ароматический углеводород и кетон. По своей структуре его также можно рассматривать как бензоконденсированный циклогексанон. Это бесцветное масло со слабым запахом. [ 5 ] Он используется в качестве исходного материала для сельскохозяйственных и фармацевтических агентов . Углеродный скелет 1-тетралона встречается в натуральных продуктах, таких как Аристелегон А (4,7-диметил-6-метокси-1-тетралон) из семейства Aristolochiaceae , используемый в традиционной китайской медицине . [ 6 ]
Подготовка
[ редактировать ]Путем окисления 1,2,3,4-тетрагидронафталина
[ редактировать ]Как уже описал в 1933 году Генрих Хок , 1,2,3,4-тетрагидронафталин имеет тенденцию к самоокислению и постепенно образует 1-гидропероксид с кислородом воздуха. [ 7 ] Ионы тяжелых металлов катализируют окисление на воздухе 1,2,3,4-тетрагидронафталина с Cr. 3+ [ 8 ] или Cu 2+ в жидкой фазе через гидропероксид приводит к смеси промежуточного продукта 1-тетралола и конечного продукта 1-тетралона. [ 9 ]

Точки кипения основного компонента 1-тетралона (255–257 °С) и второстепенного компонента 1-тетралола (255 °С) [ 2 ] практически идентичны, поэтому последний удаляется химической реакцией. [ 10 ]
По реакциям Фриделя-Крафтса
[ редактировать ]Исходное соединение 4-фенилбутановая кислота получается из 3-бензоилпропановой кислоты посредством каталитического гидрирования с использованием палладиевого контактного катализатора. [ 5 ] 3-бензоилпропановая кислота [ 11 ] сам по себе может быть получен реакцией Хаворта (вариант реакции Фриделя-Крафтса ) из бензола и янтарного ангидрида.
Внутримолекулярная циклизация 4-фенилбутановой кислоты в 1-тетралон катализируется полифосфорной кислотой. [ 5 ] и метансульфоновая кислота. [ 12 ]

Это было описано как обучающий эксперимент на уроках химии. [ 13 ] 4-Фенилбутановую кислоту также можно количественно превратить в 1-тетралон путем нагревания в присутствии сильного катализатора на основе кислоты Льюиса, такого как бис(трифторметансульфонил)амид висмута(III). [ 14 ] [Bi(NTf 2 ) 3 ], который относительно легко доступен. [ 15 ]
Использование хлорангидрида и хлорида олова(IV) (SnCl 4 ) позволяет значительно сократить время реакции, чем ацилирование Фриделя-Крафтса 4-фенилбутановой кислотой. [ 10 ]

Хлорангидриды 4-фенилбутановой кислоты с электронодонорными группами можно циклизовать до 1-тетралонов в мягких условиях реакции с выходом более 90% с использованием с сильными водородными связями растворителя гексафторизопропанола (HFIP). [ 16 ]
Катализируемое AlCl 3 ацилирование бензола γ-бутиролактоном дает 1-тетралон. [ 10 ]

Реакции
[ редактировать ]1-Тетралон можно восстановить восстановлением по Берчу в литием жидком аммиаке до 1,2,3,4-тетрагидронафталина. [ 17 ] Кетогруппа также может быть восстановлена до вторичного спирта с образованием 1-тетралола при использовании модифицированного процесса с добавлением водного раствора хлорида аммония после испарения аммиака. [ 18 ]

Под действием кальция в жидком аммиаке 1-тетралон восстанавливается до 1-тетралола при -33 °C с выходом 81%. [ 19 ]
Метиленовая группа в α-положении к кетогруппе особенно реакционноспособна и может быть преобразована формальдегидом (в форме тримерного триоксана ) в 2-метилен-1-тетралон в присутствии трифторуксусной кислоты соли N -метиланилина с доходность до 91%.

2-метиленкетон стабилен при температуре ниже -5 °C, но полностью полимеризуется при комнатной температуре в течение 12 часов. [ 20 ]
В реакции Пфитцингера 1-тетралона с изатином образуется соединение, называемое тетрофаном (3,4-дигидро-1,2-бензакридин-5-карбоновая кислота).

Реакционная способность α-метиленовой группы также используется в реакции 1-тетралона с метанолом при 270–290 °C, в результате которой путем дегидрирования и образования ароматической нафталиновой кольцевой системы образуется 2-метил-1-нафтол с выходом 66%. . [ 21 ]

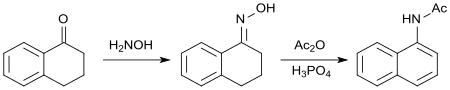
Оксим 1-тетралона реагирует с уксусным ангидридом , приводя к ароматизации циклоалканонового кольца. Полученный N-(1-нафтил)ацетамид. [ 22 ] имеет биологические свойства, подобные свойствам 2-(1-нафтил)уксусной кислоты в качестве синтетического ауксина .
Третичный спирт, образующийся в реакции Гриньяра 1-тетралона с фенилмагнийбромидом, реагирует с уксусным ангидридом при отщеплении воды до 1-фенил-3,4-дигидронафталина, который дегидратируется элементарной серой с общим выходом около 45% к 1. -фенилнафталин . [ 23 ]

Катализируемое рутением (II) арилирование 1-тетралона с использованием неопентилгликолевого эфира фенилбороновой кислоты дает 8-фенил-1-тетралон с выходом до 86%. [ 24 ]

С 5-аминотетразолом и ароматическим альдегидом 1-тетралон реагирует в многокомпонентной реакции под микроволновым облучением с образованием четырехчленной гетероциклической кольцевой системы. [ 25 ]

Приложения
[ редактировать ]Безусловно, наиболее важным применением 1-тетралона является синтез 1-нафтола путем ароматизации , например, при контакте с платиновыми катализаторами при температуре от 200 до 450 °C. [ 26 ]
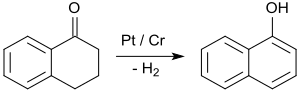
1-Нафтол является исходным материалом для инсектицидов карбарила и бета-блокаторов пропранолола .
Безопасность
[ редактировать ]Токсикологические исследования проводились на кроликах, ЛД50 составила 2192 мг·кг. −1 наблюдается масса тела. [ 1 ]
Ссылки
[ редактировать ]- ^ Перейти обратно: а б с д Sigma-Aldrich Co. , α-Тетралон . Проверено 25 ноября 2017 г.
- ^ Перейти обратно: а б Уильям М. Хейнс (2016), Справочник CRC по химии и физике, 97-е издание , Бока-Ратон, Флорида, США: CRC Press, стр. 3–504, ISBN 978-1-4987-5429-3
- ^ Перейти обратно: а б «Альфа-Тетралон 529-34-0 | TCI Deutschland GmbH» . www.tcichemicals.com (на немецком языке) . Проверено 17 декабря 2017 г.
- ^ «1-Тетралон» . pubchem.ncbi.nlm.nih.gov .
- ^ Перейти обратно: а б с HR Снайдер, FX Вербер (1940). «α-Тетралон». Орг. Синтез . 20:94 . дои : 10.15227/orgsyn.020.0094 .
- ^ П.-К. Куо; Ю.-К. Ли; Т.-С. Ву (2012), «Химические компоненты и фармакология видов Aristolochia», EJTCM , vol. 2, нет. 4, стр. 249–266, doi : 10.1016/S2225-4110(16)30111-0 , PMC 3942903 , PMID 24716140
- ^ Х.Хок; W. Susemihl (1933), «Автоокисление углеводородов: о пероксиде тетрагидронафталина, полученном автоокислением (I. Comm.)», Ber. Немецкий. Chem. (на немецком языке), том. 66, № 1, стр. 61–68, номер документа : 10.1002/cber.19330660113.
- ^ С. Бхаттачарджи; Ю.-Р. Ли; В.-С. Ан (2017), «Окисление тетралина до 1-тетралона над CrAPO-5», Korean J. Chem. англ. (на немецком языке), том. 34, нет. 3, стр. 701–705, doi : 10.1007/s11814-016-0310-4 , S2CID 100124813
- ^ US 4473711 , RW Coon, «Жидкофазный процесс окисления тетралина», опубликован 25 сентября 1984 г., передан Union Carbide Corp.
- ^ Перейти обратно: а б с CE Олсон, А. Р. Бадер (1955). «α-Тетралон». Орг. Синтез . 35 : 95. дои : 10.15227/orgsyn.035.0095 .
- ^ LF Somerville, CFH Аллен (1933). «β-Бензоилпропионовая кислота». Орг. Синтез . 13:12 . дои : 10.15227/orgsyn.013.0012 .
- ^ В. Премасагар; В.А. Паланисвами; EJ Eisenbraun (1981), «Метансульфоновая кислота катализирует циклизацию 3-арилпропановой и 4-арилбутановой кислот до 1-инданонов и 1-тетралонов», J. Org. хим. , том. 46, нет. 14, стр. 2974–2976, doi : 10.1021/jo00325a028.
- ^ М. С. Холден; Р. Д. Крауч; К.А. Баркер (2005), «Образование α-тетралона путем внутримолекулярного ацилирования Фриделя-Крафтса», J. Chem. Образование. , том. 82, нет. 6, стр. 934–935, Бибкод : 2005JChEd..82..934H , doi : 10.1021/ed082p934.
- ^ С. Антониотти; Э. Дунач (2008), «Простое получение трифлатов и трифлимидатов металлов путем окислительного растворения металлических порошков», Chem. Коммун. , том. 8, нет. 8, стр. 993–995, doi : 10.1039/B717689A , PMID 18283360
- ^ Д.-М. Кюи; М. Кавамура; С. Шимада; Т. Хаяши; М. Танака (2003), «Синтез 1-тетралонов внутримолекулярной реакцией Фриделя-Крафтса 4-арилмасляных кислот с использованием катализаторов на основе кислот Льюиса», Tetrahedron Lett. , том. 44, нет. 21, стр. 4007–4010, номер документа : 10.1016/S0040-4039(03)00855-4.
- ^ Х. Мотивала; Р.Х. Священник; Дж. Обе (2015), «Внутримолекулярная реакция ацилирования Фриделя-Крафтса, стимулируемая 1,1,1,3,3,3-гексафтор-2-пропанолом», Org. Летт. (на немецком языке), том. 17, нет. 21, с. , 5484–5487 doi : 10.1021/acs.orglett.5b02851 , PMID 26496158
- ^ Зал СС; С.Д. Липский; Ф. Дж. Макинрой; AP Bartels (1971), "Литий-аммиачное восстановление ароматических кетонов до ароматических углеводородов", J. Org. хим. , том. 38, нет. 18, стр. 2588–2591, номер документа : 10.1021/jo00817a004.
- ^ З. Марцинов; PW Rabideau (1988), "Восстановление метал-аммиака α-тетралона. Конкуренция между восстановлением кольца, восстановлением карбонила и образованием димера", J. Org. хим. , том. 53, нет. 9, стр. 2117–2119, doi : 10.1021/jo00244a054.
- ^ Дж. Р. Хву; Ю.С. Вейн; Ю.-Ж. Леу (1996), «Металлический кальций в жидком аммиаке для селективного восстановления органических соединений», J. Org. хим. (на немецком языке), том. 61, нет. 4, стр. 1493–1499, doi : 10.1021/jo951219c.
- ^ «Метиленкетоны и альдегиды путем простого прямого переноса метилена: 2-метилен-1-оксо-1,2,3,4-тетрагидронафталин». Органические синтезы . дои : 10.15227/orgsyn.060.0088 .
- ^ И. Юранов; Л. Киви-Минскер; А. Ренкен (2002), «Одностадийный парофазный синтез 2-метил-1-нафтола из 1-тетралона» , Appl. Катал. А (на немецком языке), том. 226, нет. 1–2, стр. 193–198, doi : 10.1016/S0926-860X(01)00902-4.
- ^ М. С. Ньюман; WM Hung (1973), «Улучшенная ароматизация α-тетралоноксимов до N-(1-нафтил)ацетамидов», J. Org. хим. (на немецком языке), том. 38, нет. 23, стр. 4073–4074, doi : 10.1021/jo00987a029.
- ^ «1-Фенилнафталин». Органические синтезы . дои : 10.15227/orgsyn.024.0084 .
- ^ «Катализируемое рутением арилирование орто-СН-связи в ароматическом соединении с арилборонатом: 8-фенил-1-тетралон». Органические синтезы . дои : 10.15227/orgsyn.087.0209 .
- ^ Г.П. Кантин; М. Красавин (2016), «Взаимодействие α-тетралона, 1 H -тетразол-5-амина и ароматических альдегидов при микроволновом облучении – удобный метод синтеза 5,6,7,12-тетрагидробензо[h]тетразоло». [5,1-b]хиназолины», Chem. Гетероцикл. Компд. (на немецком языке), том. 52, нет. 11, стр. 918–922, номер документа : 10.1007/s10593-017-1985-0 , S2CID 99144245.
- ^ DE 2421745 , К. Кудо, Т. Омае, А. Уно, «Способ производства α-нафтола каталитическим дегидрированием α-тетралона», опубликовано 20 ноября 1975 г., передано Sumitomo Chemical Co., Ltd.