Базовый иссеченный ремонт

Базовая эксцизионная репарация ( BER ) — это клеточный механизм, изучаемый в области биохимии и генетики , который восстанавливает поврежденную ДНК на протяжении всего клеточного цикла. Он отвечает в первую очередь за удаление из генома небольших, не искажающих основание спирали повреждений. Соответствующий путь эксцизионной репарации нуклеотидов восстанавливает объемные повреждения, искажающие спираль. BER важен для удаления поврежденных оснований, которые в противном случае могли бы вызвать мутации из-за неправильного спаривания или привести к разрывам ДНК во время репликации. BER инициируется ДНК-гликозилазами , которые распознают и удаляют определенные поврежденные или неподходящие основания, образуя AP-сайты . Затем они расщепляются эндонуклеазой AP . Полученный одноцепочечный разрыв затем может быть обработан либо с помощью BER с коротким патчем (где заменяется один нуклеотид), либо с помощью BER с длинным патчем (когда синтезируются 2–10 новых нуклеотидов). [ 1 ]
Поражения, обработанные BER
[ редактировать ]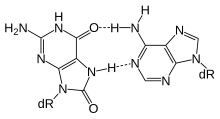
Отдельные основания ДНК могут быть химически повреждены различными механизмами, наиболее распространенными из которых являются дезаминирование, окисление и алкилирование. Эти модификации могут повлиять на способность основания образовывать водородные связи, что приведет к неправильному спариванию оснований и, как следствие, к мутациям в ДНК. Например, включение аденина напротив 8-оксогуанина (справа) во время репликации ДНК приводит к мутации пары оснований G:C в T:A. Другие примеры базовых повреждений, устраненных с помощью BER, включают:
- Окисленные основания : 8-оксогуанин , 2,6-диамино-4-гидрокси-5-формамидопиримидин (FapyG, FapyA).
- Алкилированные основания : 3-метиладенин , 7-метилгуанозин.
- Дезаминированные основания : гипоксантин, образующийся при дезаминировании аденина . Ксантин образуется в результате дезаминирования гуанина. ( Продукты тимидина после дезаминирования 5-метилцитозина труднее распознать, но они могут быть восстановлены гликозилазами, специфичными для несовпадений)
- Урацил неправильно включен в ДНК или образуется в результате дезаминирования цитозина . [ 2 ]
Помимо повреждений основания, последующие этапы BER также используются для восстановления одноцепочечных разрывов.
Выбор между длительным и коротким ремонтом
[ редактировать ]Выбор между коротким и длительным ремонтом в настоящее время находится на стадии изучения. Считается, что на это решение влияют различные факторы, включая тип поражения, стадию клеточного цикла и то, является ли клетка окончательно дифференцированной или активно делящейся. [ 3 ] Некоторые повреждения, такие как окисленные или восстановленные AP-сайты, устойчивы к активности поли-β-лиазы и, следовательно, должны обрабатываться с помощью BER с длинными заплатками.
Предпочтения путей также могут различаться у разных организмов. В то время как человеческие клетки используют BER как с короткими, так и с длинными участками, дрожжи Saccharomyces cerevisiae долгое время считались лишенными пути с короткими участками, поскольку они не имеют гомологов нескольких белков с короткими участками млекопитающих, включая pol β, ДНК-лигазу III, XRCC1. и киназный домен PNKP . Недавнее открытие того, что поли-А-полимераза Trf4 обладает активностью 5'-dRP-лиазы, поставило под сомнение эту точку зрения. [ 4 ]
Белки, участвующие в репарации иссеченного основания
[ редактировать ]ДНК-гликозилазы
[ редактировать ]
ДНК-гликозилазы ответственны за первоначальное распознавание поражения. Они выворачивают поврежденное основание из двойной спирали, как показано на рисунке, и расщепляют N-гликозидную связь поврежденного основания, оставляя AP-сайт . Существует две категории гликозилаз: монофункциональные и бифункциональные. Монофункциональные гликозилазы обладают только гликозилазной активностью, тогда как бифункциональные гликозилазы обладают также AP-лиазной активностью. Следовательно, бифункциональные гликозилазы могут превращать повреждение основания в одноцепочечный разрыв без необходимости использования эндонуклеазы AP . β-Устранение AP-сайта гликозилазой-лиазой приводит к образованию 3'-α,β-ненасыщенного альдегида, соседнего с 5'-фосфатом, который отличается от продукта расщепления AP-эндонуклеазой. [ 5 ] Некоторые гликозилазо-лиазы могут дополнительно осуществлять δ-элиминирование, которое превращает 3'-альдегид в 3'-фосфат. В ходе эволюции появилось множество гликозилаз, способных распознавать различные поврежденные основания. Примеры ДНК-гликозилаз включают Ogg1 , который распознает 8-оксогуанин, MPG , который распознает 3-метиладенин, и UNG , который удаляет урацил из ДНК.
AP-эндонуклеазы
[ редактировать ]Эндонуклеазы AP расщепляют сайт AP с образованием 3'-гидроксила, соседнего с 5'-дезоксирибозофосфатом (dRP). AP-эндонуклеазы делятся на два семейства на основании их гомологии с предковыми бактериальными AP-эндонуклеазами, эндонуклеазой IV и экзонуклеазой III . [ 6 ] Многие эукариоты имеют представителей обоих семейств, включая дрожжи Saccharomyces cerevisiae , у которых Apn1 является гомологом EndoIV, а Apn2 связан с ExoIII. У человека две AP-эндонуклеазы: APE1 и APE2 . идентифицированы [ 7 ] Это член семейства ExoIII.
Ферменты конечной обработки
[ редактировать ]Чтобы произошло лигирование, разрыв цепи ДНК должен иметь гидроксил на 3'-конце и фосфат на 5'-конце . У людей полинуклеотидкиназа-фосфатаза ( PNKP ) способствует образованию этих концов во время BER. Этот белок имеет киназный домен, который фосфорилирует 5'-гидроксильные концы, и фосфатазный домен, который удаляет фосфаты с 3'-концов. В совокупности эти действия подготавливают одноцепочечные разрывы с поврежденными концами к лигированию. Эндонуклеазы AP также участвуют в процессинге 3'-конца. Помимо открытия AP-сайтов, они обладают 3'-фосфодиэстеразной активностью и могут удалять различные 3'-повреждения, включая фосфаты, фосфогликолаты и альдегиды. 3'-процессинг должен произойти до того, как сможет начаться синтез ДНК, поскольку ДНК-полимеразы требуют, чтобы от них отходил 3'-гидроксил.
ДНК-полимеразы
[ редактировать ]Pol β является основной полимеразой человека, которая катализирует BER с короткими участками, при этом pol λ способна компенсировать ее отсутствие. [ 8 ] Эти полимеразы являются членами семейства Pol X и обычно вставляют только один нуклеотид. В дополнение к полимеразной активности эти ферменты имеют лиазный домен, который удаляет 5'-dRP, оставшийся в результате расщепления эндонуклеазой AP. Считается, что во время BER с длинными участками синтез ДНК опосредуется pol δ и pol ε вместе с фактором процессивности PCNA , теми же полимеразами, которые осуществляют репликацию ДНК . Эти полимеразы осуществляют вытесняющий синтез, то есть нижний 5'-конец ДНК «смещается», образуя лоскут (см. диаграмму выше). Pol β также может осуществлять синтез замещения длинных участков и, следовательно, может участвовать в любом пути BER. [ 9 ] Синтез длинных участков обычно вводит от 2 до 10 новых нуклеотидов.
Лоскутная эндонуклеаза
[ редактировать ]FEN1 удаляет 5'-закрытие, генерируемое во время длинного патча BER. Эта эндонуклеаза отдает предпочтение длинному 5'-лоску, примыкающему к 3'-лоску из 1 нуклеотида. [ 10 ] Дрожжевой гомолог FEN1 — RAD27 . В дополнение к своей роли в BER с длинными участками, FEN1 расщепляет лоскуты со сходной структурой во время процессинга фрагмента Оказаки , что является важным этапом в замедленной репликации цепи ДНК .
ДНК-лигаза
[ редактировать ]ДНК-лигаза III вместе со своим кофактором XRCC1 катализирует стадию запечатывания разрывов при BER с короткими участками у людей. [ 11 ] [ 12 ] ДНК-лигаза I лигирует разрыв длинного участка BER. [ 13 ]
Связи с раком
[ редактировать ]Дефекты в различных путях восстановления ДНК приводят к предрасположенности к раку, и BER, по-видимому, следует этой закономерности. Было показано, что делеционные мутации в генах BER приводят к более высокой частоте мутаций у различных организмов, а это означает, что потеря BER может способствовать развитию рака. Действительно, соматические мутации Pol β были обнаружены в 30% случаев рака человека, и некоторые из этих мутаций приводят к трансформации при экспрессии в клетках мыши. [ 14 ] мутации ДНК-гликозилазы MYH Известно также, что повышают предрасположенность к раку толстой кишки . [ 15 ]
Эпигенетические нарушения при раке
[ редактировать ]Эпигенетические изменения (эпимутации) в генах эксцизионной репарации оснований только недавно начали оцениваться при некоторых видах рака, по сравнению с многочисленными предыдущими исследованиями эпимутаций в генах, участвующих в других путях репарации ДНК (таких как MLH1 при репарации ошибочного спаривания и MGMT при прямом обращении). ). [ нужна ссылка ] Некоторые примеры эпимутаций в базовых генах эксцизионной репарации, возникающих при раке, приведены ниже.
МБД4
[ редактировать ]
MBD4 (белок 4 метил-CpG-связывающего домена) представляет собой гликозилазу, используемую на начальном этапе эксцизионной репарации оснований. Белок MBD4 преимущественно связывается с полностью метилированными сайтами CpG и с измененными основаниями ДНК в этих сайтах. Эти измененные основания возникают в результате частого гидролиза цитозина до урацила (см. изображение) и гидролиза 5-метилцитозина до тимина, в результате чего образуются пары оснований G:U и G:T. [ 16 ] Если неправильные урацилы или тимины в этих парах оснований не удалить перед репликацией ДНК, они вызовут переходные мутации . MBD4 специфически катализирует удаление T и U в паре с гуанином (G) в сайтах CpG. [ 17 ] Это важная функция репарации, поскольку около 1/3 всех внутригенных мутаций одной пары оснований при раке человека происходит в динуклеотидах CpG и является результатом переходов G:C в A:T. [ 17 ] [ 18 ] Эти переходы составляют наиболее частые мутации при раке человека. Например, почти 50% соматических мутаций гена-супрессора опухоли р53 при колоректальном раке представляют собой переходы G:C в A:T внутри сайтов CpG. [ 17 ] Таким образом, снижение экспрессии MBD4 может вызвать увеличение канцерогенных мутаций.
Экспрессия MBD4 снижается практически во всех колоректальных из -за метилирования промоторной новообразованиях области MBD4. [ 19 ] Также MBD4 дефицитен из-за мутации примерно в 4% случаев колоректального рака. [ 20 ]
Большинство гистологически нормальных полей, окружающих неопластические разрастания (аденомы и рак толстой кишки) в толстой кишке, также демонстрируют пониженную экспрессию мРНК MBD4 ( дефект поля ) по сравнению с гистологически нормальной тканью у людей, у которых никогда не было новообразования толстой кишки. [ 19 ] Это открытие предполагает, что эпигенетическое подавление MBD4 является ранним этапом колоректального канцерогенеза .
MBD4 Glu346Lys В китайской популяции, которая была оценена, полиморфизм был связан со снижением риска рака шейки матки примерно на 50%, что позволяет предположить, что изменения в MBD4 могут иметь важное значение при раке. [ 21 ]
НИЛ1
[ редактировать ]NEIL1 распознает (нацеливается) и удаляет определенные окислительно- поврежденные основания, а затем разрезает абазисный сайт посредством β,δ-элиминирования, оставляя 3'- и 5'-фосфатные концы. NEIL1 распознает окисленные пиримидины , формамидопиримидины, остатки тимина , окисленные по метильной группе, и оба стереоизомера тимингликоля . [ 22 ] Лучшими субстратами для человеческого NEIL1, по-видимому, являются гидантоиновые очаги, гуанидиногидантоин и спироиминодигидантоин, которые являются продуктами дальнейшего окисления 8-oxoG . NEIL1 также способен удалять повреждения из одноцепочечной ДНК, а также из пузырьковых и раздвоенных структур ДНК. Дефицит NEIL1 вызывает усиление мутагенеза в месте пары 8-оксо-Gua:C, при этом большинство мутаций представляют собой трансверсии G:C в T:A. [ 23 ]
Исследование 2004 года показало, что в 46% случаев первичного рака желудка наблюдалось снижение экспрессии мРНК NEIL1 , хотя механизм снижения не был известен. [ 24 ] Это исследование также показало, что 4% случаев рака желудка имели мутации в NEIL1. Авторы предположили, что низкая активность NEIL1, возникающая из-за снижения экспрессии и/или мутации NEIL1, часто участвует в канцерогенезе желудка.
Скрининг 145 генов репарации ДНК на предмет аберрантного метилирования промотора был проведен на тканях плоскоклеточного рака головы и шеи (HNSCC) от 20 пациентов и на образцах слизистой головы и шеи от 5 неонкологических пациентов. [ 25 ] Этот скрининг показал, что NEIL1 со значительно повышенным гиперметилированием имел наиболее существенно отличающуюся частоту метилирования. Более того, гиперметилирование соответствовало снижению экспрессии мРНК NEIL1. Дальнейшая работа со 135 опухолями и 38 нормальными тканями также показала, что 71% образцов тканей HNSCC имели повышенное метилирование промотора NEIL1. [ 25 ]
(НМРЛ) оценивали 8 генов репарации ДНК Когда в опухолях немелкоклеточного рака легких , 42% из них были гиперметилированы в области промотора NEIL1. [ 26 ] Это была наиболее частая аномалия репарации ДНК, обнаруженная среди 8 протестированных генов репарации ДНК. NEIL1 также был одним из шести генов репарации ДНК, которые были гиперметилированы в своих промоторных областях при колоректальном раке . [ 27 ]
Связи с познанием
[ редактировать ]
Активное ДНК метилирование и деметилирование необходимо для познания процесса , формирования и поддержания памяти . [ 29 ] У крыс контекстуальное обусловливание страха может вызвать пожизненную память об этом событии с помощью одного испытания, а изменения метилирования, по-видимому, коррелируют с запуском особенно долгоживущих воспоминаний. [ 29 ] При контекстуальном обуславливании страха мозга крысы, через 24 часа ДНК, выделенная из области гиппокампа имела 2097 дифференциально метилированные гены, часть из которых деметилирована. [ 29 ] По отзывам Байрактара и Кройца, [ 28 ] Деметилирование ДНК зависит от эксцизионной репарации оснований (см. Рисунок).
Физические упражнения хорошо зарекомендовали себя на обучении и памяти (см. «Нейробиологические эффекты физических упражнений »). BDNF является особенно важным регулятором обучения и памяти. [ 30 ] Согласно обзору Фернандеса и др., [ 31 ] У крыс физические упражнения усиливают экспрессию в гиппокампе гена Bdnf , который играет важную роль в формировании памяти. Повышенная экспрессия Bdnf промотора CpG - происходит за счет деметилирования его островка в экзоне IV. [ 31 ] а деметилирование зависит от базовой эксцизионной репарации (см. рисунок). [ 28 ]
Снижение BER с возрастом
[ редактировать ]Активность ДНК-гликозилазы , удаляющей метилированные основания в лейкоцитах человека, снижается с возрастом. [ 32 ] Снижение удаления метилированных оснований из ДНК предполагает возрастное снижение уровня 3-метиладенин-ДНК-гликозилазы , фермента BER, ответственного за удаление алкилированных оснований. [ 32 ]
Молодые крысы (от 4 до 5 месяцев), но не старые крысы (от 24 до 28 месяцев), обладают способностью индуцировать бета-полимеразу ДНК и эндонуклеазу AP в ответ на окислительное повреждение. [ 33 ]
См. также
[ редактировать ]- Исправление несоответствия ДНК
- восстановление ДНК
- Гомологичная рекомбинация
- негомологичное соединение концов
- Эксцизионная репарация нуклеотидов
- Анализ реактивации клетки-хозяина
Ссылки
[ редактировать ]- ^ Лю Ю, Прасад Р., Берд В.А., Кедар П.С., Хоу Э.В., Шок Д.Д., Уилсон С.Х. (2007). «Координация этапов эксцизионной репарации однонуклеотидных оснований, опосредованной апуриновой/апиримидиновой эндонуклеазой 1 и ДНК-полимеразой β» . Журнал биологической химии . 282 (18): 13532–13541. дои : 10.1074/jbc.M611295200 . ПМК 2366199 . ПМИД 17355977 .
- ^ Джаянта Чаудхури и Фредерик В. Альт (2004). «Рекомбинация с переключением классов: взаимодействие транскрипции, дезаминирования ДНК и репарации ДНК». Обзоры природы Иммунология . 4 (7): 541–552. дои : 10.1038/nri1395 . ПМИД 15229473 . S2CID 34376550 .
- ^ Фортини П., Доглиотти Э. (апрель 2007 г.). «Повреждение основания и восстановление одноцепочечного разрыва: механизмы и функциональное значение подпутей восстановления коротких и длинных участков». Восстановление ДНК . 6 (4): 398–409. дои : 10.1016/j.dnarep.2006.10.008 . ПМИД 17129767 .
- ^ Геллон Л., Карсон Д.Р., Карсон Дж.П., Демпл Б. (февраль 2008 г.). «Внутренняя 5'-дезоксирибозо-5-фосфат-лиазная активность в белке Trf4 Saccharomyces cerevisiae с возможной ролью в восстановлении ДНК с вырезанием оснований» . Восстановление ДНК . 7 (2): 187–98. дои : 10.1016/j.dnarep.2007.09.009 . ПМК 2258243 . ПМИД 17983848 .
- ^ Фромм Дж.К., Банерджи А., Вердин Г.Л. (февраль 2004 г.). «Распознавание и катализ ДНК-гликозилазы». Курс. Мнение. Структура. Биол . 14 (1): 43–9. дои : 10.1016/j.sbi.2004.01.003 . ПМИД 15102448 .
- ^ Аравинд Л., Уокер Д.Р., Кунин Е.В. (1999). «Консервативные домены в белках репарации ДНК и эволюция систем репарации» . Исследования нуклеиновых кислот . 27 (5): 1223–1242. дои : 10.1093/нар/27.5.1223 . ПМК 148307 . ПМИД 9973609 .
- ^ Демпл Б., Герман Т., Чен Д.С. (1991). «Клонирование и экспрессия APE, кДНК, кодирующей основную апуриновую эндонуклеазу человека: определение семейства ферментов репарации ДНК» . ПНАС США . 88 (24): 11450–11454. Бибкод : 1991PNAS...8811450D . дои : 10.1073/pnas.88.24.11450 . ПМЦ 53153 . ПМИД 1722334 .
- ^ Брейтуэйт Э.К., Прасад Р., Шок Д.Д., Хоу Э.В., Бирд В.А., Уилсон С.Х. (май 2005 г.). «ДНК-полимераза лямбда опосредует активность эксцизионной репарации резервного основания в экстрактах эмбриональных фибробластов мыши» . Ж. Биол. Хим . 280 (18): 18469–75. дои : 10.1074/jbc.M411864200 . ПМИД 15749700 .
- ^ Берд В.А., Прасад Р., Уилсон С.Х. (2006). «Деятельность и механизм ДНК-полимеразы». Восстановление ДНК, Часть А. Методы энзимологии. Том. 408. стр. 91–107. дои : 10.1016/S0076-6879(06)08007-4 . ISBN 9780121828134 . ПМИД 16793365 .
- ^ Као Х.И., Хенриксен Л.А., Лю Ю., Бамбара Р.А. (апрель 2002 г.). «Специфичность расщепления эндонуклеазы лоскута 1 Saccharomyces cerevisiae предполагает структуру двойного лоскута в качестве клеточного субстрата» . Ж. Биол. Хим . 277 (17): 14379–89. дои : 10.1074/jbc.M110662200 . ПМИД 11825897 .
- ^ Каппелли, Энрико (1997). «Участие продуктов гена XRCC1 и ДНК-лигазы III в эксцизионной репарации оснований ДНК» . Журнал биологической химии . 272 (38): 23970–23975. дои : 10.1074/jbc.272.38.23970 . ПМИД 9295348 .
- ^ Калдекотт, Кейт (1995). «Характеристика комплекса XRCC1-ДНК-лигаза III in vitro и его отсутствие в мутантных клетках хомяка» . Исследования нуклеиновых кислот . 23 (23): 4836–4843. дои : 10.1093/нар/23.23.4836 . ПМК 307472 . ПМИД 8532526 . Проверено 10 марта 2019 г.
- ^ Паскуччи, Барбара (1999). «Эксцизионное восстановление длинного патч-основания с использованием очищенных человеческих белков ДНК-ЛИГАЗЫ I КАК МЕДИАТОРА РАЗМЕРА ЗАПЛАТКИ ДЛЯ ДНК-ПОЛИМЕРАЗ δ И ε» . Журнал биологической химии . 274 (47): 33696–33702. дои : 10.1074/jbc.274.47.33696 . ПМИД 10559260 .
- ^ Старчевич Д., Далал С., Суизи Дж.Б. (август 2004 г.). «Есть ли связь между ДНК-полимеразой бета и раком?» . Клеточный цикл . 3 (8): 998–1001. дои : 10.4161/cc.3.8.1062 . ПМИД 15280658 .
- ^ Фаррингтон, С.М.; Тенеса, А; Барнетсон, Р.; Уилтшир, А; Прендергаст, Дж; Портеус, М; Кэмпбелл, Х; Данлоп, МГ (2005). «Восприимчивость зародышевой линии к колоректальному раку из-за дефектов гена репарации основания» . Американский журнал генетики человека . 77 (1): 112–9. дои : 10.1086/431213 . ПМК 1226182 . ПМИД 15931596 .
- ^ Беллакоса А, Дроат АС (август 2015 г.). «Роль базовой эксцизионной репарации в поддержании генетической и эпигенетической целостности сайтов CpG» . Восстановление ДНК . 32 : 33–42. дои : 10.1016/j.dnarep.2015.04.011 . ПМК 4903958 . ПМИД 26021671 .
- ^ Перейти обратно: а б с Сьолунд А.Б., Сенежани А.Г., Суизи Дж.Б. (2013). «MBD4 и TDG: многогранные ДНК-гликозилазы с постоянно расширяющейся биологической ролью» . Мутационные исследования . 743–744: 12–25. Бибкод : 2013MRFMM.743...12S . дои : 10.1016/j.mrfmmm.2012.11.001 . ПМЦ 3661743 . ПМИД 23195996 .
- ^ Купер Д.Н., Юсуфьян Х. (февраль 1988 г.). «Динуклеотид CpG и генетические заболевания человека». Генетика человека . 78 (2): 151–5. дои : 10.1007/bf00278187 . ПМИД 3338800 . S2CID 41948691 .
- ^ Перейти обратно: а б Ховард Дж. Х., Фролов А., Ценг К.В., Стюарт А., Мидзак А., Маймундар А., Годвин А., Хеслин М., Беллакоса А., Арнолетти Дж. П. (январь 2009 г.). «Эпигенетическое подавление гена репарации ДНК MED1/MBD4 при колоректальном раке и раке яичников» . Биология и терапия рака . 8 (1): 94–100. дои : 10.4161/cbt.8.1.7469 . ПМЦ 2683899 . ПМИД 19127118 .
- ^ Трикарико Р., Кортеллино С., Риччио А., Джагмохан-Чангур С., Ван дер Клифт Х., Вейнен Дж., Тёрнер Д., Вентура А., Ровелла В., Перчезепе А., Луччи-Кордиско Е., Радиче П., Бертарио Л., Педрони М., Понц де Леон М., Манкузо П., Девараджан К., Кай К.К., Кляйн-Сзанто А.Дж., Нери Г., Мёллер П., Виль А., Дженуарди М., Фодде Р., Беллакоса А. (октябрь 2015 г.). «Участие инактивации MBD4 в онкогенезе с дефицитом репарации ошибочного спаривания» . Онкотаргет . 6 (40): 42892–904. дои : 10.18632/oncotarget.5740 . ПМЦ 4767479 . ПМИД 26503472 .
- ^ Сюн XD, Луо XP, Лю X, Цзин X, Цзэн LQ, Лэй М, Хун XS, Чэнь Ю (2012). «Полиморфизм MBD4 Glu346Lys связан с риском развития рака шейки матки у населения Китая». Межд. Дж. Гинекол. Рак . 22 (9): 1552–6. дои : 10.1097/IGC.0b013e31826e22e4 . ПМИД 23027038 . S2CID 788490 .
- ^ Немец А.А., Уоллес С.С., Суизи Дж.Б. (октябрь 2010 г.). «Варианты базовых белков эксцизионной репарации: факторы нестабильности генома» . Семинары по биологии рака . 20 (5): 320–8. дои : 10.1016/j.semcancer.2010.10.010 . ПМЦ 3254599 . ПМИД 20955798 .
- ^ Сузуки Т., Харашима Х., Камия Х (2010). «Влияние белков эксцизионной репарации оснований на мутагенез с помощью 8-оксо-7,8-дигидрогуанина (8-гидроксигуанина) в сочетании с цитозином и аденином». Восстановление ДНК (Амст.) . 9 (5): 542–50. дои : 10.1016/j.dnarep.2010.02.004 . hdl : 2115/43021 . ПМИД 20197241 . S2CID 207147128 .
- ^ Шинмура К., Тао Х., Гото М., Игараси Х., Танигучи Т., Маэкава М., Такезаки Т., Сугимура Х. (2004). «Инактивирующие мутации человеческого гена эксцизионной репарации NEIL1 при раке желудка» . Канцерогенез . 25 (12): 2311–7. дои : 10.1093/carcin/bgh267 . ПМИД 15319300 .
- ^ Перейти обратно: а б Чайсаингмонгкол Дж., Попанда О., Варта Р., Дюкхофф Г., Херпель Е., Гейзельхарт Л., Клаус Р., Ласичка Ф., Кампос Б., Оукс CC, Бермехо Дж.Л., Херольд-Менде С., Пласс С., Шмезер П. (2012). «Эпигенетический скрининг генов репарации ДНК человека выявляет аберрантное метилирование промотора NEIL1 при плоскоклеточном раке головы и шеи» . Онкоген . 31 (49): 5108–16. дои : 10.1038/onc.2011.660 . ПМИД 22286769 .
- ^ До Х., Вонг Н.К., Муроне С., Джон Т., Соломон Б., Митчелл П.Л., Добрович А. (2014). «Критическая переоценка метилирования промотора гена репарации ДНК при немелкоклеточной карциноме легкого» . Научные отчеты . 4 : 4186. Бибкод : 2014NatSR...4E4186D . дои : 10.1038/srep04186 . ПМЦ 3935198 . ПМИД 24569633 .
- ^ Фаркас С.А., Выметалкова В, Водичкова Л, Водицка П, Нильссон ТК (апрель 2014 г.). «Изменения метилирования ДНК в генах, часто мутирующих при спорадическом колоректальном раке, а также в генах репарации ДНК и сигнального пути Wnt/β-катенина». Эпигеномика . 6 (2): 179–91. дои : 10.2217/эпи.14.7 . ПМИД 24811787 .
- ^ Перейти обратно: а б с Байрактар Г., Кройц М.Р. (2018). «Роль деметилирования ДНК, зависящего от активности, в мозге взрослого человека и при неврологических расстройствах» . Фронт Мол Нейроски . 11 : 169. дои : 10.3389/fnmol.2018.00169 . ПМЦ 5975432 . ПМИД 29875631 .
- ^ Перейти обратно: а б с Дюк К.Г., Кеннеди А.Дж., Гэвин К.Ф., Дэй Дж.Дж., Суэтт Дж.Д. (июль 2017 г.). «Эпигеномная реорганизация в гиппокампе, зависящая от опыта» . Учиться. Мем . 24 (7): 278–288. дои : 10.1101/lm.045112.117 . ПМК 5473107 . ПМИД 28620075 .
- ^ Карпова Н.Н. (январь 2014 г.). «Роль эпигенетики BDNF в пластичности нейронов, зависящей от активности» . Нейрофармакология . 76 Ч. С: 709–18. doi : 10.1016/j.neuropharm.2013.04.002 . ПМИД 23587647 .
- ^ Перейти обратно: а б Фернандес Х., Арида Р.М., Гомес-Пинилья Ф. (сентябрь 2017 г.). «Физические упражнения как эпигенетический модулятор пластичности и познания мозга» . Neurosci Biobehav Rev. 80 : 443–456. doi : 10.1016/j.neubiorev.2017.06.012 . ПМК 5705447 . ПМИД 28666827 .
- ^ Перейти обратно: а б Атамна Х, Чунг И, Эймс Б.Н. (2000). «Метод обнаружения абазовых сайтов в живых клетках: возрастные изменения в эксцизионной репарации оснований» . Учеб. Натл. акад. наук. США . 97 (2): 686–91. Бибкод : 2000PNAS...97..686A . дои : 10.1073/pnas.97.2.686 . ПМК 15391 . ПМИД 10639140 .
- ^ Кабелоф, округ Колумбия, Раффул Дж.Дж., Ге Ю., Ван Реммен Х., Матерли Л.Х., Хейдари А.Р. (2006). «Возрастная потеря реакции восстановления ДНК после воздействия окислительного стресса» . Дж. Геронтол. Биол. наук. Мед. Наука . 61 (5): 427–34. дои : 10.1093/герона/61.5.427 . ПМИД 16720738 .
Внешние ссылки
[ редактировать ]- База + удаление + ремонт в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)