ДНК-гликозилаза
ДНК-гликозилазы представляют собой семейство ферментов, участвующих в репарации вырезаемых оснований , классифицированных под номером EC EC 3.2.2. Эксцизионная репарация оснований — это механизм, с помощью которого поврежденные основания в ДНК удаляются и заменяются. ДНК-гликозилазы катализируют первый этап этого процесса. Они удаляют поврежденное азотистое основание, оставляя сахарофосфатный остов нетронутым, создавая апуриновый/апиримидиновый сайт, обычно называемый АР-сайтом . Это достигается путем выворачивания поврежденного основания из двойной спирали с последующим разрывом N- гликозидной связи . [ 1 ]
Гликозилазы были впервые обнаружены у бактерий, а с тех пор их обнаруживают во всех царствах жизни. Помимо своей роли в репарации вырезаемых оснований, ферменты ДНК-гликозилазы участвуют в подавлении молчания генов у A. thaliana , N. tabacum и других растений путем активного деметилирования. Остатки 5-метилцитозина вырезаются и заменяются неметилированными цитозинами, открывая доступ к структуре хроматина ферментам и белкам, необходимым для транскрипции и последующей трансляции. [ 2 ] [ 3 ]
Монофункциональные и бифункциональные гликозилазы
[ редактировать ]Существует два основных класса гликозилаз: монофункциональные и бифункциональные. Монофункциональные гликозилазы обладают только гликозилазной активностью, тогда как бифункциональные гликозилазы также обладают AP-лиазной активностью, которая позволяет им разрезать фосфодиэфирную связь ДНК, создавая одноцепочечный разрыв без необходимости использования AP-эндонуклеазы . β-Устранение AP-сайта гликозилазой-лиазой приводит к образованию 3'-α,β-ненасыщенного альдегида, соседнего с 5'-фосфатом, который отличается от продукта расщепления AP-эндонуклеазой. [ 4 ] Некоторые гликозилазо-лиазы могут дополнительно осуществлять δ-элиминирование, которое превращает 3'-альдегид в 3'-фосфат.
Биохимический механизм
[ редактировать ]Первая кристаллическая структура ДНК-гликозилазы была получена для E. coli Nth. [ 5 ] Эта структура показала, что фермент выталкивает поврежденное основание из двойной спирали в карман активного центра, чтобы удалить его. С тех пор было обнаружено, что другие гликозилазы следуют той же общей парадигме, включая человеческий UNG, изображенный ниже. Чтобы расщепить N-гликозидную связь, монофункциональные гликозилазы используют активированную молекулу воды для атаки углерода 1 субстрата. Вместо этого бифункциональные гликозилазы используют аминный остаток в качестве нуклеофила для атаки того же углерода, проходя через промежуточное соединение основания Шиффа .
Виды гликозилаз
[ редактировать ]Кристаллические структуры многих гликозилаз решены. На основании структурного сходства гликозилазы сгруппированы в четыре суперсемейства. Семейства UDG и AAG содержат небольшие компактные гликозилазы, тогда как семейства MutM/Fpg и HhH-GPD содержат более крупные ферменты с множеством доменов. [ 4 ]
В ходе эволюции появилось множество гликозилаз, способных распознавать различные поврежденные основания. В таблице ниже суммированы свойства известных гликозилаз в обычно изучаемых модельных организмах.
| кишечная палочка | Б. цереус | Дрожжи ( S. cerevisiae ) | Человек | Тип | Субстраты |
|---|---|---|---|---|---|
| АлкА | АлкЭ | Маг1 | MPG (N-метилпурин ДНК-гликозилаза) | монофункциональный | 3-меА (3-алкиладенин), гипоксантин |
| РЕДАКТИРОВАТЬ | Ung1 | ДА | монофункциональный | урацил | |
| Фпг | Огг1 | hhOGG1 | бифункциональный | 8-oxoG (8-оксогуанин), FapyG | |
| N-й | Нтг 1 | ч NTH1 | бифункциональный | Tg, hoU, hoC, мочевина, FapyG(2,6-диамино-4-гидрокси-5-формамидопиримидин) | |
| нтг2 | |||||
| В | Нет | hNEIL1 | бифункциональный | Tg, hoU, hoC, мочевина, FapyG, FapyA (4,6-диамино-5-формамидопиримидин) | |
| hNEIL2 | Сайт AP, да | ||||
| hNEIL3 | неизвестный | ||||
| MuTY | Нет | hMYH | монофункциональный | А:8-оксоG | |
| Нет | Нет | hSMUG1 | монофункциональный | U, hoU(5-гидроксиурацил), hmU(5-гидроксиметилурацил), fu(5-формилурацил) | |
| Нет | Нет | ТДГ | монофункциональный | Ошибка T:G | |
| Нет | Нет | МБД4 | монофункциональный | Ошибка T:G | |
| АлкС | АлкС | Нет | Нет | монофункциональный | Алкилпурин |
| АлкД | АлкД | Нет | Нет | монофункциональный | Алкилпурин |
ДНК-гликозилазы можно сгруппировать в следующие категории в зависимости от их субстрата (субстратов):
Урацил-ДНК-гликозилазы
[ редактировать ]
В молекулярной биологии белков семейство урацил-ДНК-гликозилаза (UDG) представляет собой фермент , который обращает мутации в ДНК. Наиболее распространенной мутацией дезаминирование цитозина является в урацил . UDG восстанавливает эти мутации. UDG имеет решающее значение в восстановлении ДНК , без него эти мутации могут привести к раку . [ 8 ]
В этой записи представлены различные урацил-ДНК-гликозилазы и родственные ДНК-гликозилазы ( EC ), такие как урацил-ДНК-гликозилаза, [ 9 ] термофильная урацил-ДНК-гликозилаза, [ 10 ] G:T/U-специфическая ДНК-гликозилаза (Mug), [ 11 ] и одноцепочечную селективную монофункциональную урацил-ДНК-гликозилазу (SMUG1). [ 12 ]
Урацил-ДНК-гликозилазы удаляют урацил из ДНК, что может возникнуть либо в результате спонтанного дезаминирования цитозина, либо в результате неправильного включения dU напротив dA во время репликации ДНК . Прототипическим членом этого семейства является E. coli UDG, которая была одной из первых открытых гликозилаз. В клетках млекопитающих были идентифицированы четыре различных активности урацил-ДНК-гликозилазы, включая UNG , SMUG1 , TDG и MBD4 . Они различаются по субстратной специфичности и субклеточной локализации. SMUG1 предпочитает в качестве субстрата одноцепочечную ДНК, но также удаляет U из двухцепочечной ДНК. Помимо немодифицированного урацила, SMUG1 может удалять 5-гидроксиурацил, 5-гидроксиметилурацил и 5-формилурацил, несущие окисленную группу в кольце С5. [ 13 ] TDG и MBD4 строго специфичны для двухцепочечной ДНК. TDG может удалять тимингликоль, когда он присутствует напротив гуанина, а также производные U с модификациями у углерода 5. Имеющиеся данные свидетельствуют о том, что в клетках человека TDG и SMUG1 являются основными ферментами, ответственными за восстановление неправильных пар U:G, вызванных спонтанное дезаминирование цитозина, тогда как урацил, возникающий в ДНК в результате неправильного включения dU, в основном занимается УНГ. Считается, что MBD4 корректирует несоответствия T:G, возникающие в результате дезаминирования 5-метилцитозина в тимин в сайтах CpG. [ 14 ] Мутантные мыши MBD4 развиваются нормально и не демонстрируют повышенной восприимчивости к раку или снижения выживаемости. Но они приобретают больше мутаций CT в последовательностях CpG в эпителиальных клетках тонкой кишки. [ 15 ]
Структура человеческого UNG в комплексе с ДНК показала, что, как и другие гликозилазы, она выводит целевой нуклеотид из двойной спирали в карман активного сайта. [ 16 ] UDG претерпевает конформационные изменения из «открытого» несвязанного состояния в «закрытое» состояние, связанное с ДНК. [ 17 ]
| РЕДАКТИРОВАТЬ | |||
|---|---|---|---|
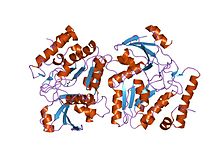 Урацил-ДНК-гликозилаза вируса Эпштейна-Барр в комплексе с уги из pbs-2 | |||
| Идентификаторы | |||
| Символ | РЕДАКТИРОВАТЬ | ||
| Пфам | PF03167 | ||
| ИнтерПро | ИПР005122 | ||
| PROSITE | PDOC00121 | ||
| ОБЛАСТЬ ПРИМЕНЕНИЯ 2 | 1удж / СКОПе / СУПФАМ | ||
| CDD | cd09593 | ||
| |||
История
[ редактировать ]Линдаль был первым, кто наблюдал репарацию урацила в ДНК. UDG был очищен из Escherichia coli , и он гидролизовал N- гликозидную связь, соединяющую основание с дезоксирибозным сахаром основной цепи ДНК. [ 8 ]
Функция
[ редактировать ]Функция UDG заключается в удалении мутаций в ДНК, точнее в удалении урацила.
Структура
[ редактировать ]Эти белки имеют трехслойную структуру альфа/бета/альфа . Полипептидная топология UDG аналогична классическому альфа/бета-белку. Структура состоит в основном из центрального четырехцепочечного, полностью параллельного бета-листа, окруженного с обеих сторон в общей сложности восемью альфа-спиралями, и называется параллельным бета-листом с двойной обмоткой. [ 9 ]
Механизм
[ редактировать ]репарации ДНК Урацил-ДНК-гликозилазы представляют собой ферменты , которые вырезают урацила остатки из ДНК путем расщепления N-гликозидной связи, инициируя путь репарации с вырезанием оснований . Урацил в ДНК может возникать либо в результате дезаминирования цитозина с образованием мутагенных неправильных пар U:G, либо в результате включения dUMP ДНК- полимеразой с образованием пар U:A . [ 18 ] Эти аберрантные остатки урацила генотоксичны. [ 19 ]
Локализация
[ редактировать ]В эукариотических клетках активность UNG обнаруживается как в ядре , так и в митохондриях . Белок UNG1 человека транспортируется как в митохондрии , так и в ядро . [ 20 ]
Сохранение
[ редактировать ]Последовательность . урацил-ДНК-гликозилазы чрезвычайно хорошо консервативна [ 21 ] у бактерий и эукариот, а также у вирусов герпеса . Более отдаленно родственные урацил-ДНК-гликозилазы также обнаружены в поксвирусах . [ 22 ] N-концевые 77 аминокислот UNG1, по-видимому, необходимы для митохондриальной локализации, но присутствие митохондриального транзитного пептида напрямую не продемонстрировано. Наиболее консервативная N-концевая область содержит аспарагиновой кислоты остаток , который был предположен на основании рентгеновских структур. [ 23 ] действовать как общая основа в каталитическом механизме .
Семья
[ редактировать ]Существует два семейства UDG: Семейство 1 и Семейство 2. Семейство 1 активно. против урацила в оцДНК и дцДНК. Семейство 2 удаляет урацил от несовпадений с гуанином . [ 8 ]
Гликозилазы окисленных оснований
[ редактировать ]
Различные гликозилазы эволюционировали, чтобы распознавать окисленные основания, которые обычно образуются активными формами кислорода, образующимися в ходе клеточного метаболизма. Наиболее распространенными повреждениями, образующимися на остатках гуанина, являются 2,6-диамино-4-гидрокси-5-формамидопиримидин (FapyG) и 8-оксогуанин . Из-за неправильного спаривания с аденином во время репликации 8-oxoG обладает высокой мутагенностью, что приводит к трансверсиям G в T. Восстановление этого повреждения инициируется бифункциональной ДНК-гликозилазой OGG1 , которая распознает 8-oxoG в паре с C. hOGG1 представляет собой бифункциональную гликозилазу, принадлежащую к семейству спираль-шпилька-спираль (HhH). MYH распознает неправильное спаривание аденина с 8-oxoG, но удаляет A, оставляя 8-oxoG нетронутым. У мышей, нокаутных по OGG1, не наблюдается повышенная заболеваемость опухолями, но с возрастом они накапливают 8-oxoG в печени. [ 24 ] Похожий фенотип наблюдается при инактивации MYH, но одновременная инактивация как MYH, так и OGG1 вызывает накопление 8-oxoG во многих тканях, включая легкие и тонкий кишечник. [ 25 ] У людей мутации в MYH связаны с повышенным риском развития полипов толстой кишки и рака толстой кишки . Помимо OGG1 и MYH, клетки человека содержат еще три ДНК-гликозилазы: NEIL1 , NEIL2 и NEIL3 . Они гомологичны бактериальным Nei, и их присутствие, вероятно, объясняет легкие фенотипы мышей с нокаутом OGG1 и MYH.
Гликозилазы алкилированных оснований
[ редактировать ]В эту группу входят E. coli AlkA и родственные белки высших эукариот. Эти гликозилазы монофункциональны и распознают метилированные основания, такие как 3-метиладенин.
АлкА
[ редактировать ]AlkA относится к 3-метиладенин-ДНК-гликозилазе II . [ 26 ]
Патология
[ редактировать ]- ДНК-гликозилазы, участвующие в эксцизионной репарации оснований (BER), могут быть связаны с риском развития рака у BRCA1 и BRCA2 . носителей мутаций [ 27 ]
Эпигенетические нарушения при раке
[ редактировать ]Эпигенетические изменения (эпимутации) в генах ДНК-гликозилазы только недавно начали оцениваться при некоторых видах рака, по сравнению с многочисленными предыдущими исследованиями эпимутаций в генах, действующих в других путях репарации ДНК (таких как MLH1 при репарации ошибочного спаривания и MGMT при прямом обращении). . [ нужна ссылка ] Ниже приведены два примера эпимутаций в генах ДНК-гликозилазы, возникающих при раке.
МБД4
[ редактировать ]
MBD4 (белок 4 метил-CpG-связывающего домена) представляет собой гликозилазу, используемую на начальном этапе эксцизионной репарации оснований. Белок MBD4 преимущественно связывается с полностью метилированными сайтами CpG . [ 28 ] Эти измененные основания возникают в результате частого гидролиза цитозина до урацила (см. изображение) и гидролиза 5-метилцитозина до тимина, в результате чего образуются пары оснований G:U и G:T. [ 29 ] Если неправильные урацилы или тимины в этих парах оснований не удалить перед репликацией ДНК, они вызовут переходные мутации . MBD4 специфически катализирует удаление T и U в паре с гуанином (G) в сайтах CpG. [ 30 ] Это важная функция репарации, поскольку около 1/3 всех внутригенных мутаций одной пары оснований при раке человека происходит в динуклеотидах CpG и является результатом переходов G:C в A:T. [ 30 ] [ 31 ] Эти переходы составляют наиболее частые мутации при раке человека. Например, почти 50% соматических мутаций гена-супрессора опухоли р53 при колоректальном раке представляют собой переходы G:C в A:T внутри сайтов CpG. [ 30 ] Таким образом, снижение экспрессии MBD4 может вызвать увеличение канцерогенных мутаций.
Экспрессия MBD4 снижается практически во всех колоректальных из -за метилирования промоторной новообразованиях области MBD4. [ 32 ] Кроме того, MBD4 дефицитен из-за мутации примерно в 4% случаев колоректального рака. [ 33 ]
Большинство гистологически нормальных полей, окружающих неопластические разрастания (аденомы и рак толстой кишки) в толстой кишке, также демонстрируют пониженную экспрессию мРНК MBD4 ( дефект поля ) по сравнению с гистологически нормальной тканью у людей, у которых никогда не было новообразования толстой кишки. [ 32 ] Это открытие предполагает, что эпигенетическое подавление MBD4 является ранним этапом колоректального канцерогенеза .
MBD4 Glu346Lys В китайской популяции, которая была оценена, полиморфизм был связан со снижением риска рака шейки матки примерно на 50%, что позволяет предположить, что изменения в MBD4 важны при этом раке. [ 34 ]
НИЛ1
[ редактировать ]Nei-подобная (NEIL) 1 представляет собой ДНК-гликозилазу семейства Nei (которая также содержит NEIL2 и NEIL3). [ 35 ] NEIL1 является компонентом комплекса репликации ДНК, необходимого для наблюдения за окисленными основаниями перед репликацией, и, по-видимому, действует как «ловец коров», замедляя репликацию до тех пор, пока NEIL1 не сможет действовать как гликозилаза и удалять окислительно поврежденное основание. [ 35 ]
Белок NEIL1 распознает (нацеливается) и удаляет определенные окислительно- поврежденные основания, а затем разрезает абазисный участок посредством β,δ-элиминирования, оставляя 3'- и 5'-фосфатные концы. NEIL1 распознает окисленные пиримидины , формамидопиримидины, остатки тимина , окисленные по метильной группе, и оба стереоизомера тимингликоля . [ 36 ] Лучшими субстратами для человеческого NEIL1, по-видимому, являются гидантоиновые очаги, гуанидиногидантоин и спироиминодигидантоин, которые являются продуктами дальнейшего окисления 8-oxoG . NEIL1 также способен удалять повреждения из одноцепочечной ДНК, а также из пузырьковых и раздвоенных структур ДНК. Дефицит NEIL1 вызывает усиление мутагенеза в месте пары 8-оксо-Gua:C, при этом большинство мутаций представляют собой трансверсии G:C в T:A. [ 37 ]
Исследование 2004 года показало, что в 46% случаев первичного рака желудка наблюдалось снижение экспрессии мРНК NEIL1 , хотя механизм снижения не был известен. [ 38 ] Это исследование также показало, что 4% случаев рака желудка имели мутации в гене NEIL1. Авторы предположили, что низкая активность NEIL1, возникающая из-за снижения экспрессии и/или мутации гена NEIL1, часто участвует в канцерогенезе желудка.
Скрининг 145 генов репарации ДНК на аберрантное метилирование промотора был проведен на тканях плоскоклеточной карциномы головы и шеи (HNSCC) от 20 пациентов и на образцах слизистой головы и шеи от 5 неонкологических пациентов. [ 39 ] Этот скрининг показал, что ген NEIL1 существенно увеличил гиперметилирование, а из 145 оцененных генов репарации ДНК NEIL1 имел наиболее существенно отличающуюся частоту метилирования. Более того, гиперметилирование соответствовало снижению экспрессии мРНК NEIL1. Дальнейшая работа со 135 опухолями и 38 нормальными тканями также показала, что 71% образцов тканей HNSCC имели повышенное метилирование промотора NEIL1. [ 39 ]
(НМРЛ) оценивали 8 генов репарации ДНК Когда в опухолях немелкоклеточного рака легких , 42% из них были гиперметилированы в области промотора NEIL1. [ 40 ] Это была наиболее частая аномалия репарации ДНК, обнаруженная среди 8 протестированных генов репарации ДНК. NEIL1 также был одним из шести генов репарации ДНК, которые были гиперметилированы в своих промоторных областях при колоректальном раке . [ 41 ]
Ссылки
[ редактировать ]- ^ Линдал, Т. (1986). «ДНК-гликозилазы в репарации ДНК». Механизмы повреждения и репарации ДНК . Том. 38. С. 335–340. дои : 10.1007/978-1-4615-9462-8_36 . ISBN 978-1-4615-9464-2 . ПМИД 3527146 .
{{cite book}}:|journal=игнорируется ( помогите ) - ^ Агис, Ф.; Капур, А; Чжу, Дж. К. (2006). «Роль ДНК-гликозилазы/лиазы ROS1 Arabidopsis в активном деметилировании ДНК» . Учеб. Натл. акад. наук. США . 103 (31): 11796–11801. Бибкод : 2006PNAS..10311796A . дои : 10.1073/pnas.0603563103 . ПМЦ 1544249 . ПМИД 16864782 .
- ^ Чой, CS.; Сано, Х. (2007). «Идентификация генов табака, кодирующих белки, обладающие активностью удаления 5-метилцитозинов из интактной ДНК табака» . Биотехнология растений . 24 (3): 339–344. doi : 10.5511/plantbiotechnology.24.339 .
- ^ Jump up to: а б Фромм Дж.К., Банерджи А., Вердин Г.Л. (февраль 2004 г.). «Распознавание и катализ ДНК-гликозилазы». Современное мнение в области структурной биологии . 14 (1): 43–9. дои : 10.1016/j.sbi.2004.01.003 . ПМИД 15102448 .
- ^ Куо К.Ф., Макри Д.Е., Фишер К.Л., О'Хэндли С.Ф., Каннингем Р.П., Тайнер Дж.А. (октябрь 1992 г.). «Атомная структура фермента эндонуклеазы III репарации ДНК [4Fe-4S]». Наука . 258 (5081): 434–40. Бибкод : 1992Sci...258..434K . дои : 10.1126/science.1411536 . ПМИД 1411536 .
- ^ Иде Х., Котера М. (апрель 2004 г.). «ДНК-гликозилазы человека, участвующие в восстановлении окислительно поврежденной ДНК» . Биол. Фарм. Бык . 27 (4): 480–5. дои : 10.1248/bpb.27.480 . ПМИД 15056851 .
- ^ Алсет И., Осман Ф., Корвальд Х. и др. (2005). «Биохимическая характеристика и взаимодействие путей репарации ДНК при Mag1-опосредованной эксцизионной репарации оснований у Schizosaccharomyces pombe» . Нуклеиновые кислоты Рез . 33 (3): 1123–31. дои : 10.1093/nar/gki259 . ПМК 549418 . ПМИД 15722486 .
- ^ Jump up to: а б с Перл Л.Х. (2000). «Структура и функции суперсемейства урацил-ДНК-гликозилаз». Мутат Рес . 460 (3–4): 165–81. дои : 10.1016/S0921-8777(00)00025-2 . ПМИД 10946227 .
- ^ Jump up to: а б Мол С.Д., Арваи А.С., Слупфауг Г., Кавли Б., Алсет И., Крокан Х.Е., Тайнер Дж.А. (март 1995 г.). «Кристаллическая структура и мутационный анализ урацил-ДНК-гликозилазы человека: структурные основы специфичности и катализа» . Клетка . 80 (6): 869–78. дои : 10.1016/0092-8674(95)90290-2 . ПМИД 7697717 . S2CID 14851787 .
- ^ Сандигурский М., Франклин В.А. (май 1999 г.). «Термостабильная урацил-ДНК-гликозилаза из Thermotoga maritima, член нового класса ферментов репарации ДНК» . Курс. Биол . 9 (10): 531–4. дои : 10.1016/S0960-9822(99)80237-1 . ПМИД 10339434 . S2CID 32822653 .
- ^ Барретт Т.Э., Савва Р., Панайоту Дж., Барлоу Т., Браун Т., Джирични Дж., Перл Л.Х. (январь 1998 г.). «Кристаллическая структура ДНК-гликозилазы, специфичной для несоответствия G:T/U: распознавание несоответствия посредством взаимодействий комплементарных цепей» . Клетка . 92 (1): 117–29. дои : 10.1016/S0092-8674(00)80904-6 . ПМИД 9489705 . S2CID 9136303 .
- ^ Бакли Б., Эренфельд Э. (октябрь 1987 г.). «Кэп-связывающий белковый комплекс в неинфицированных и инфицированных полиовирусом клетках HeLa» . Ж. Биол. Хим . 262 (28): 13599–606. дои : 10.1016/S0021-9258(19)76470-9 . ПМИД 2820976 .
- ^ Мацубара М, Танака Т, Терато Х, Омае Э, Изуми С, Катаянаги К, Иде Х (2004). «Мутационный анализ распознавания повреждений и каталитического механизма ДНК-гликозилазы SMUG1 человека» . Нуклеиновые кислоты Рез . 32 (17): 5291–5302. дои : 10.1093/nar/gkh859 . ПМК 521670 . ПМИД 15466595 .
- ^ У, Пейин; Цю, Чен; Сохаил, Анджум; Чжан, Син; Бхагват, Ашок С.; Ченг, Сяодун (14 февраля 2003 г.). «Репарация ошибочного спаривания в метилированной ДНК. Структура и активность домена тимингликозилазы, специфичного для ошибочного спаривания, метил-CpG-связывающего белка MBD4» . Журнал биологической химии . 278 (7): 5285–5291. дои : 10.1074/jbc.M210884200 . ISSN 0021-9258 . ПМЦ 2764232 . ПМИД 12456671 .
- ^ Вонг Э; Ян К; Курагучи М; Верлинг Ю; Авдиевич Е; Фан К; Фаззари М; Джин Б; Браун МС; и др. (1995). «Инактивация Mbd4 увеличивает мутации перехода C → T и способствует образованию опухолей желудочно-кишечного тракта» . ПНАС . 99 (23): 14937–14942. дои : 10.1073/pnas.232579299 . ПМК 137523 . ПМИД 12417741 .
- ^ Мол С.Д., Арваи А.С., Слупфауг Г., Кавли Б., Алсет И., Крокан Х.Е., Тайнер Дж.А. (1995). «Кристаллическая структура и мутационный анализ урацил-ДНК-гликозилазы человека» . Клетка . 80 (6): 869–878. дои : 10.1016/0092-8674(95)90290-2 . ПМИД 7697717 . S2CID 14851787 .
- ^ Слупфауг Г., Мол CD, Кавли Б., Арваи А.С., Крокан Х.Э., Тайнер Дж.А. (1996). Механизм переворота нуклеотидов, основанный на структуре урацил-ДНК-гликозилазы человека, связанной с ДНК. 384: 87-92.
- ^ Кавли Б., Оттерлей М., Слупфауг Г., Крокан Х.Э. (апрель 2007 г.). «Урацил в ДНК — общий мутаген, но нормальный промежуточный продукт приобретенного иммунитета». Восстановление ДНК (Амст.) . 6 (4): 505–16. дои : 10.1016/j.dnarep.2006.10.014 . ПМИД 17116429 .
- ^ Хаген Л; Пенья-Диас Дж; Кавли Б; Оттерлей М; Слупфауг Г; Крокан Х.Э. (август 2006 г.). «Геномный урацил и болезни человека». Эксп. Сотовый Res . 312 (14): 2666–72. doi : 10.1016/j.yexcr.2006.06.015 . ПМИД 16860315 .
- ^ Слупфауг Г., Маркуссен Ф.Х., Олсен Л.К., Осланд Р., Орсетер Н., Бакке О., Крокан Х.Э., Хелланд Д.Э. (июнь 1993 г.). «Ядерные и митохондриальные формы урацил-ДНК-гликозилазы человека кодируются одним и тем же геном» . Нуклеиновые кислоты Рез . 21 (11): 2579–84. дои : 10.1093/нар/21.11.2579 . ПМК 309584 . ПМИД 8332455 .
- ^ Олсен Л.К., Осланд Р., Виттвер К.У., Крокан Х.Э., Хелланд Д.Э. (октябрь 1989 г.). «Молекулярное клонирование урацил-ДНК-гликозилазы человека, высококонсервативного фермента репарации ДНК» . ЭМБО Дж . 8 (10): 3121–5. дои : 10.1002/j.1460-2075.1989.tb08464.x . ПМК 401392 . ПМИД 2555154 .
- ^ Аптон С., Стюарт Д.Т., Макфадден Дж. (май 1993 г.). «Идентификация гена поксвируса, кодирующего урацил-ДНК-гликозилазу» . Учеб. Натл. акад. наук. США . 90 (10): 4518–22. Бибкод : 1993PNAS...90.4518U . дои : 10.1073/pnas.90.10.4518 . ПМЦ 46543 . ПМИД 8389453 .
- ^ Савва Р., Маколи-Хехт К., Браун Т., Перл Л. (февраль 1995 г.). «Структурные основы специфической репарации оснований с помощью урацил-ДНК-гликозилазы». Природа . 373 (6514): 487–93. Бибкод : 1995Natur.373..487S . дои : 10.1038/373487a0 . ПМИД 7845459 . S2CID 4315434 .
- ^ Клунгланд А; Розуэлл I; Холленбах С; Ларсен Э; Дейли Дж; Эпе А; Сиберг Э; Линдал Т; Барнс Д.Э.; и др. (1999). «Накопление премутагенных повреждений ДНК у мышей, дефектных в удалении повреждений окислительных оснований» . ПНАС . 96 (23): 13300–13305. Бибкод : 1999PNAS...9613300K . дои : 10.1073/pnas.96.23.13300 . ПМК 23942 . ПМИД 10557315 .
- ^ Руссо, Мария Тереза; Де Лука, Габриэле; Деган, Паоло; Парланти, Элеонора; Доглиотти, Евгения; Барнс, Дебора Э.; Линдаль, Томас; Ян, Ханьцзин; Миллер, Джеффри Х.; Бигнами, Маргарита; и др. (2004). «Накопление 8-гидроксигуанина, пораженного окислительным основанием, в ДНК предрасположенных к опухолям мышей, дефектных как по ДНК-гликозилазам Myh, так и по Ogg1». Рак Рез . 64 (13): 4411–4414. дои : 10.1158/0008-5472.can-04-0355 . ПМИД 15231648 .
- ^ Мо Э., Холл Д.Р., Лейрос И., Монсен В.Т., Тимминс Дж., МакСвини С. (2012). «Исследование структуры и функции необычной 3-метиладенин-ДНК-гликозилазы II (AlkA) из Deinococcus radiodurans». Акта Кристаллогр Д. 68 (6): 703–12. дои : 10.1107/S090744491200947X . ПМИД 22683793 .
- ^ Осорио, А; Милн, РЛ; Кухенбекер, К; Вацлова, Т; Питер, Г; Алонсо, Р; Петерлонго, П; Уайт, я; де ла Хойя, М; Дюран, М; Десять, О; Рамон и Кахаль, Т; Константинопулу, я; Мартинес-Бузас, центральный; Эндрю Рэббит, R; Суси, П; Макгаффог, Л; Барроудейл, Д; Ли, А; Све-Брка; Арвер, Б; Рантала, Дж; Ломан, Н; Эренкрона, Х; Олопаде, ОИ; Битти, MS; Домчек, С.М.; Натансон, К; Реббек, TR ; и др. (2014). «ДНК-гликозилазы, участвующие в восстановлении эксцизионных оснований, могут быть связаны с риском рака у носителей мутаций BRCA1 и BRCA2» . ПЛОС Генетика . 10 (4): e1004256. дои : 10.1371/journal.pgen.1004256 . ПМЦ 3974638 . ПМИД 24698998 .
- ^ Валавалкар, Нинад (2014). «Структура раствора и внутримолекулярный обмен белка 4 метилцитозинсвязывающего домена (MBD4) на ДНК предполагает механизм сканирования несоответствий mCpG/TpG» . Исследования нуклеиновых кислот . 42 (17): 11218–11232. дои : 10.1093/nar/gku782 . ПМЦ 4176167 . ПМИД 25183517 .
- ^ Беллакоса А, Дроат АС (август 2015 г.). «Роль базовой эксцизионной репарации в поддержании генетической и эпигенетической целостности сайтов CpG» . Восстановление ДНК . 32 : 33–42. дои : 10.1016/j.dnarep.2015.04.011 . ПМК 4903958 . ПМИД 26021671 .
- ^ Jump up to: а б с Сьолунд А.Б., Сенежани А.Г., Суизи Дж.Б. (2013). «MBD4 и TDG: многогранные ДНК-гликозилазы с постоянно расширяющейся биологической ролью» . Мутационные исследования . 743–744: 12–25. дои : 10.1016/j.mrfmmm.2012.11.001 . ПМЦ 3661743 . ПМИД 23195996 .
- ^ Купер Д.Н., Юсуфьян Х. (февраль 1988 г.). «Динуклеотид CpG и генетические заболевания человека». Генетика человека . 78 (2): 151–5. дои : 10.1007/bf00278187 . ПМИД 3338800 . S2CID 41948691 .
- ^ Jump up to: а б Ховард Дж. Х., Фролов А., Ценг К.В., Стюарт А., Мидзак А., Маймундар А., Годвин А., Хеслин М., Беллакоса А., Арнолетти Дж. П. (январь 2009 г.). «Эпигенетическое подавление гена репарации ДНК MED1/MBD4 при колоректальном раке и раке яичников» . Биология и терапия рака . 8 (1): 94–100. дои : 10.4161/cbt.8.1.7469 . ПМЦ 2683899 . ПМИД 19127118 .
- ^ Трикарико Р., Кортеллино С., Риччио А., Джагмохан-Чангур С., Ван дер Клифт Х., Вейнен Дж., Тёрнер Д., Вентура А., Ровелла В., Перчезепе А., Луччи-Кордиско Е., Радиче П., Бертарио Л., Педрони М., Понц де Леон М., Манкузо П., Девараджан К., Кай К.К., Кляйн-Сзанто А.Дж., Нери Г., Мёллер П., Виль А., Дженуарди М., Фодде Р., Беллакоса А. (октябрь 2015 г.). «Участие инактивации MBD4 в онкогенезе с дефицитом репарации ошибочного спаривания» (PDF) . Онкотаргет . 6 (40): 42892–904. дои : 10.18632/oncotarget.5740 . ПМЦ 4767479 . ПМИД 26503472 .
- ^ Сюн XD, Луо XP, Лю X, Цзин X, Цзэн LQ, Лэй М, Хун XS, Чэнь Ю (2012). «Полиморфизм MBD4 Glu346Lys связан с риском развития рака шейки матки у населения Китая». Межд. Дж. Гинекол. Рак . 22 (9): 1552–6. дои : 10.1097/IGC.0b013e31826e22e4 . ПМИД 23027038 . S2CID 788490 .
- ^ Jump up to: а б Хегде М.Л., Хегде П.М., Белло Л.Дж., Мандал С.М., Хазра Т.К., Ли Г.М., Болдох И., Томкинсон А.Е., Митра С. (2013). «Пререпликативная репарация окисленных оснований в геноме человека опосредована ДНК-гликозилазой NEIL1 вместе с белками репликации» . Учеб. Натл. акад. наук. США . 110 (33): E3090–9. Бибкод : 2013PNAS..110E3090H . дои : 10.1073/pnas.1304231110 . ПМЦ 3746843 . ПМИД 23898192 .
- ^ Немец А.А., Уоллес С.С., Суизи Дж.Б. (октябрь 2010 г.). «Варианты базовых белков эксцизионной репарации: факторы нестабильности генома» . Семинары по биологии рака . 20 (5): 320–8. дои : 10.1016/j.semcancer.2010.10.010 . ПМЦ 3254599 . ПМИД 20955798 .
- ^ Сузуки Т., Харашима Х., Камия Х (2010). «Влияние белков эксцизионной репарации оснований на мутагенез с помощью 8-оксо-7,8-дигидрогуанина (8-гидроксигуанина) в сочетании с цитозином и аденином». Восстановление ДНК (Амст.) . 9 (5): 542–50. дои : 10.1016/j.dnarep.2010.02.004 . hdl : 2115/43021 . ПМИД 20197241 . S2CID 207147128 .
- ^ Шинмура К., Тао Х., Гото М., Игараси Х., Танигучи Т., Маэкава М., Такезаки Т., Сугимура Х. (2004). «Инактивирующие мутации человеческого гена эксцизионной репарации NEIL1 при раке желудка» . Канцерогенез . 25 (12): 2311–7. дои : 10.1093/carcin/bgh267 . ПМИД 15319300 .
- ^ Jump up to: а б Чайсаингмонгкол Дж., Попанда О., Варта Р., Дюкхофф Г., Херпель Е., Гейзельхарт Л., Клаус Р., Ласичка Ф., Кампос Б., Оукс CC, Бермехо Дж.Л., Херольд-Менде С., Пласс С., Шмезер П. (2012). «Эпигенетический скрининг генов репарации ДНК человека выявляет аберрантное метилирование промотора NEIL1 при плоскоклеточном раке головы и шеи» . Онкоген . 31 (49): 5108–16. дои : 10.1038/onc.2011.660 . ПМИД 22286769 .
- ^ До Х., Вонг Н.К., Муроне С., Джон Т., Соломон Б., Митчелл П.Л., Добрович А. (2014). «Критическая переоценка метилирования промотора гена репарации ДНК при немелкоклеточной карциноме легкого» . Научные отчеты . 4 : 4186. Бибкод : 2014NatSR...4E4186D . дои : 10.1038/srep04186 . ПМЦ 3935198 . ПМИД 24569633 .
- ^ Фаркас С.А., Выметалкова В, Водикова Л, Водицка П, Нильссон ТК (апрель 2014 г.). «Изменения метилирования ДНК в генах, часто мутирующих при спорадическом колоректальном раке, а также в генах репарации ДНК и сигнального пути Wnt/β-катенина». Эпигеномика . 6 (2): 179–91. дои : 10.2217/эпи.14.7 . ПМИД 24811787 .
Внешние ссылки
[ редактировать ] СМИ, связанные с ДНК-гликозилазой, на Викискладе?
СМИ, связанные с ДНК-гликозилазой, на Викискладе? - ДНК + гликозилазы Национальной медицинской библиотеки США по медицинским предметным рубрикам (MeSH)