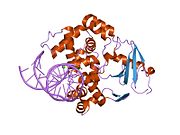
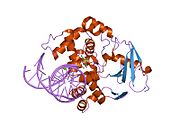
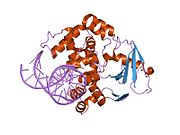
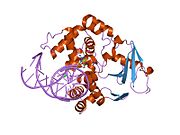
Оксугуанин -гликозилаза
| OGG1 | |||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | OGG1 , HMMH, HMUTM, OGH1, 8-оксогуанин-гликозилаза | ||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | Омим : 601982 ; MGI : 1097693 ; Гомологен : 1909 ; GeneCards : OGG1 ; OMA : OGG1 - ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Викидид | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| 8-оксогуаниновая ДНК-гликозилаза, N-концевой домен | |||
|---|---|---|---|
 Структура каталитически неактивной Q315A человека 8-оксогуаниновой гликозилазы, комплексной до 8-оксогуанинной ДНК | |||
| Идентификаторы | |||
| Символ | Ogg_n | ||
| Pfam | PF07934 | ||
| PFAM клан | CL0407 | ||
| InterPro | IPR012904 | ||
| Краткое содержание | 1EBM / SCOPE / SUPFAM | ||
| |||
8-оксогуанин-гликозилаза , также известная как OGG1 , представляет собой фермент ДНК-гликозилазы , который у людей кодируется OGG1 геном . Он участвует в ремонте базового удаления . Это обнаруживается у бактериальных , архиальных и эукариотических видов .
Функция
[ редактировать ]OGG1 является основным ферментом, ответственным за удаление 8-оксогуанина (8-оксог), побочного продукта мутагенного основания, который возникает в результате воздействия активных форм кислорода (АФК). OGG1 представляет собой бифункциональную гликозилазу, так как она способна как расщеплять гликозидную связь мутагенного поражения и вызвать разрыв цепи в основе ДНК. Альтернативный сплайсинг С-концевой области этого гена классифицирует варианты сплайсинга на две основные группы, тип 1 и тип 2, в зависимости от последнего экзона последовательности. Альтернативные варианты сплайсинга типа 1 заканчиваются экзоном 7 и конец типа 2 с экзоном 8. Один набор сплайсированных форм обозначен 1А, 1b, 2a до 2E. [ 5 ] Все варианты имеют N-концевую область общей. Было описано много альтернативных вариантов сплайсинга для этого гена, но полноразмерная природа для каждого варианта не была определена. У эукариот N-конце этого гена содержит сигнал митохондриального нацеливания, необходимый для локализации митохондрий. [ 6 ] Тем не менее, OGG1-1A также имеет сигнал ядерного местоположения на его C-концевом конце, который подавляет митохондриальное нацеливание и вызывает локализацию OGG1-1A в ядро. [ 5 ] Основной формой OGG1, которая локализуется в митохондриях, является OGG1-2A. [ 5 ] Консервативный оксогуаниновый N-концевой домен способствует остаткам в 8- карман . Этот домен организован в одну копию TBP -подобного сгиба . [ 7 ]
Несмотря на предполагаемую важность этого фермента, мыши, лишенные OGG1, были получены и обнаружили, что имеют нормальную продолжительность жизни, [ 8 ] и мыши, нокаутированные на OGG1, имеют более высокую вероятность развития рака, тогда как нарушение гена MTH1 одновременно подавляет развитие рака легких у мышей OGG1-/-. [ 9 ] Было показано, что мыши, лишенные OGG1, подвержены повышению массы тела и ожирению, а также индуцированной индуцированной инсулином с высоким содержанием жира . [ 10 ] Есть некоторые противоречия относительно того, действительно ли делеция OGG1 приводит к увеличению уровней 8-оксо-2'-дезоксигуанозин (8-оксо-DG): высокоэффективная жидкая хроматография с анализом электрохимического обнаружения (ВЭЖХ-ECD) предполагает, что делом может привести к До 6 раз более высокий уровень 8-оксо-DG в ядерной ДНК и 20-кратный более высокий уровень в митохондриальной ДНК, тогда как анализ гликозилазы ДНК-фарпира указывает на изменение уровня 8-оксо-DG. [ Цитация необходима ]
Повышение окислительного стресса временно инактивирует OGG1, который рекрутирует факторы транскрипции, такие как NFKB , и, таким образом, активирует экспрессию воспалительных генов. [ 11 ]
Дефицит OGG1 и увеличение 8-оксо-DG у мышей
[ редактировать ]
Мыши без функционального гена OGG1 имеют примерно 5-кратный повышенный уровень 8-оксо-DG в их печени по сравнению с мышами с OGG1 дикого типа . [ 9 ] Мыши, дефектные в OGG1, также имеют повышенный риск развития рака. [ 9 ] Kunisada et al. [ 13 ] Облученные мыши без функционального гена OGG1 (мышей OGG1, нокаутированных OGG1) и мышей дикого типа три раза в неделю в течение 40 недель при свете UVB при относительно низкой дозе (недостаточно, чтобы вызвать покраснение кожи). Оба типа мышей имели высокий уровень 8-оксо-DG в своих эпидермальных клетках через три часа после облучения. Через 24 часа более половины начального количества 8-оксо-DG отсутствовали в эпидермальных клетках мышей дикого типа, но 8-оксо-DG оставался повышенным в эпидермальных клетках OGG1 нокаутных мышей . Облученные мыши, нокаутированные на OGG1, развивались более чем в два раза больше частоты опухолей кожи по сравнению с облученными мышами дикого типа, а скорость злокачественности в опухолях была выше у мышей, нокаутированных по OGG1 (73%), чем у мыши дикого типа (50%).
Как рассмотрено Valavanidis et al., [ 14 ] Повышенные уровни 8-оксо-DG в ткани могут служить биомаркером окислительного стресса. Они также отметили, что повышение уровня 8-оксо-DG часто обнаруживается во время канцерогенеза.
In the figure showing examples of mouse colonic epithelium, the colonic epithelium from a mouse on a normal diet was found to have a low level of 8-oxo-dG in its colonic crypts (panel A). However, a mouse likely undergoing colonic tumorigenesis (due to deoxycholate added to its diet[12]) was found to have a high level of 8-oxo-dG in its colonic epithelium (panel B). Deoxycholate increases intracellular production of reactive oxygen resulting in increased oxidative stress,[15]>[16] and this can lead to tumorigenesis and carcinogenesis.
Epigenetic control
[edit]In a breast cancer study, the methylation level of the OGG1 promoter was found to be negatively correlated with expression level of OGG1 messenger RNA.[17] This means that hypermethylation was associated with low expression of OGG1 and hypomethylation was correlated with over-expression of OGG1. Thus, OGG1 expression is under epigenetic control. Breast cancers with methylation levels of the OGG1 promoter that were more than two standard deviations either above or below the normal were each associated with reduced patient survival.[17]
In cancers
[edit]OGG1 is the primary enzyme responsible for the excision of 8-oxo-dG. Even when OGG1 expression is normal, the presence of 8-oxo-dG is mutagenic, since OGG1 is not 100% effective. Yasui et al.[18] examined the fate of 8-oxo-dG when this oxidized derivative of deoxyguanosine was inserted into a specific gene in 800 cells in culture. After replication of the cells, 8-oxo-dG was restored to G in 86% of the clones, probably reflecting accurate OGG1 base excision repair or translesion synthesis without mutation. G:C to T:A transversions occurred in 5.9% of the clones, single base deletions in 2.1% and G:C to C:G transversions in 1.2%. Together, these mutations were the most common, totalling 9.2% of the 14% of mutations generated at the site of the 8-oxo-dG insertion. Among the other mutations in the 800 clones analyzed, there were also 3 larger deletions, of sizes 6, 33 and 135 base pairs. Thus 8-oxo-dG can directly cause mutations, some of which may contribute to carcinogenesis.
If OGG1 expression is reduced in cells, increased mutagenesis, and therefore increased carcinogenesis, would be expected. The table below lists some cancers associated with reduced expression of OGG1.
| Cancer | Expression | Form of OGG1 | 8-oxo-dG | Evaluation method | Ref. |
|---|---|---|---|---|---|
| Head and neck cancer | Under-expression | OGG1-2a | - | messenger RNA | [19] |
| Adenocarcinoma of gastric cardia | Under-expression | cytoplasmic | increased | immunohistochemistry | [20] |
| Astrocytoma | Under-expression | total cell OGG1 | - | messenger RNA | [21] |
| Esophageal cancer | 48% Under-expression | nuclear | increased | immunohistochemistry | [22] |
| - | 40% Under-expression | cytoplasm | increased | immunohistochemistry | [22] |
OGG1 or OGG activity in blood, and cancer
[edit]OGG1 methylation levels in blood cells were measured in a prospective study of 582 US military veterans, median age 72, and followed for 13 years. High OGG1 methylation at a particular promoter region was associated with increased risk for any cancer, and in particular for risk of prostate cancer.[23]
Enzymatic activity excising 8-oxoguanine from DNA (OGG activity) was reduced in peripheral blood mononuclear cells (PBMCs), and in paired lung tissue, from patients with non–small cell lung cancer.[24] OGG activity was also reduced in PBMCs of patients with head and neck squamous cell carcinoma (HNSCC).[25]
An important effect on cancer is expected to derive from the drastic enhancement of gene expression for certain immunity genes, which OGG1 regulates.[26]
Interactions
[edit]Oxoguanine glycosylase has been shown to interact with XRCC1[27] and PKC alpha.[28]
Pathology
[edit]See also
[edit]References
[edit]- ^ Jump up to: a b c GRCh38: Ensembl release 89: ENSG00000114026 – Ensembl, May 2017
- ^ Jump up to: a b c GRCm38: Ensembl release 89: ENSMUSG00000030271 – Ensembl, May 2017
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ Jump up to: a b c Nishioka K, Ohtsubo T, Oda H, Fujiwara T, Kang D, Sugimachi K, Nakabeppu Y (May 1999). "Expression and differential intracellular localization of two major forms of human 8-oxoguanine DNA glycosylase encoded by alternatively spliced OGG1 mRNAs". Molecular Biology of the Cell. 10 (5): 1637–1652. doi:10.1091/mbc.10.5.1637. PMC 30487. PMID 10233168.
- ^ EntrezGene 4968 "OGG1 8-oxoguanine DNA glycosylase"
- ^ Bjørås M, Seeberg E, Luna L, Pearl LH, Barrett TE (March 2002). "Reciprocal 'flipping' underlies substrate recognition and catalytic activation by the human 8-oxo-guanine DNA glycosylase". Journal of Molecular Biology. 317 (2): 171–177. doi:10.1006/jmbi.2002.5400. PMID 11902834.
- ^ Klungland A, Rosewell I, Hollenbach S, Larsen E, Daly G, Epe B, Seeberg E, Lindahl T, Barnes DE (November 1999). "Accumulation of premutagenic DNA lesions in mice defective in removal of oxidative base damage". Proceedings of the National Academy of Sciences of the United States of America. 96 (23): 13300–13305. Bibcode:1999PNAS...9613300K. doi:10.1073/pnas.96.23.13300. PMC 23942. PMID 10557315.
- ^ Jump up to: a b c Sakumi K, Tominaga Y, Furuichi M, Xu P, Tsuzuki T, Sekiguchi M, Nakabeppu Y (March 2003). "Ogg1 knockout-associated lung tumorigenesis and its suppression by Mth1 gene disruption". Cancer Research. 63 (5): 902–905. PMID 12615700.
- ^ Sampath H, Vartanian V, Rollins MR, Sakumi K, Nakabeppu Y, Lloyd RS (December 2012). "8-Oxoguanine DNA glycosylase (OGG1) deficiency increases susceptibility to obesity and metabolic dysfunction". PLOS ONE. 7 (12): e51697. Bibcode:2012PLoSO...751697S. doi:10.1371/journal.pone.0051697. PMC 3524114. PMID 23284747.
- ^ Pan L, Zhu B, Hao W, Zeng X, Vlahopoulos SA, Hazra TK, Hegde ML, Radak Z, Bacsi A, Brasier AR, Ba X, Boldogh I (2 December 2016). "Oxidized Guanine Base Lesions Function in 8-Oxoguanine DNA Glycosylase-1-mediated Epigenetic Regulation of Nuclear Factor κB-driven Gene Expression". The Journal of Biological Chemistry. 291 (49): 25553–25566. doi:10.1074/jbc.M116.751453. PMC 5207254. PMID 27756845.
- ^ Jump up to: a b Prasad AR, Prasad S, Nguyen H, Facista A, Lewis C, Zaitlin B, Bernstein H, Bernstein C (July 2014). "Novel diet-related mouse model of colon cancer parallels human colon cancer". World Journal of Gastrointestinal Oncology. 6 (7): 225–243. doi:10.4251/wjgo.v6.i7.225. PMC 4092339. PMID 25024814.
- ^ Kunisada M, Sakumi K, Tominaga Y, Budiyanto A, Ueda M, Ichihashi M, Nakabeppu Y, Nishigori C (July 2005). "8-Oxoguanine formation induced by chronic UVB exposure makes Ogg1 knockout mice susceptible to skin carcinogenesis". Cancer Research. 65 (14): 6006–6010. doi:10.1158/0008-5472.CAN-05-0724. PMID 16024598.
- ^ Valavanidis A, Vlachogianni T, Fiotakis K, Loridas S (August 2013). "Pulmonary oxidative stress, inflammation and cancer: respirable particulate matter, fibrous dusts and ozone as major causes of lung carcinogenesis through reactive oxygen species mechanisms". International Journal of Environmental Research and Public Health. 10 (9): 3886–3907. doi:10.3390/ijerph10093886. PMC 3799517. PMID 23985773.
- ^ Tsuei J, Chau T, Mills D, Wan YJ (November 2014). "Bile acid dysregulation, gut dysbiosis, and gastrointestinal cancer". Experimental Biology and Medicine. 239 (11): 1489–1504. doi:10.1177/1535370214538743. PMC 4357421. PMID 24951470.
- ^ Ajouz H, Mukherji D, Shamseddine A (май 2014). «Вторичные желчные кислоты: недооцененная причина рака толстой кишки» . Мировой журнал хирургической онкологии . 12 : 164. DOI : 10.1186/1477-7819-12-164 . PMC 4041630 . PMID 24884764 .
- ^ Jump up to: а беременный Fleischer T, Edvardsen H, Solvang HK, Daviaud C, Naume B, Børresen-Dale AL, Kristensen VN, Tost J (июнь 2014 г.). «Интегрированный анализ профилей метилирования ДНК с высоким разрешением, экспрессии генов, генотипов зародышевой линии и клинических конечных точек у пациентов с раком молочной железы» . Международный журнал рака . 134 (11): 2615–2625. doi : 10.1002/ijc.28606 . PMID 24395279 . S2CID 32537522 .
- ^ Yasui M, Kanemaru Y, Kamoshita N, Suzuki T, Arakawa T, Honma M (март 2014 г.). «Отслеживание судьбы сайта-специфически введенных аддуктов ДНК в человеческом геноме» . Репарация ДНК . 15 : 11–20. doi : 10.1016/j.dnarep.2014.01.003 . PMID 24559511 .
- ^ Махджабин I, Каяни М.А. (2016). «Потеря экспрессии генов супрессоров митохондриальных опухолей связана с неблагоприятным клиническим исходом при плоскоклеточной карциноме головы и шеи: данные ретроспективного исследования» . Plos один . 11 (1): E0146948. Bibcode : 2016ploso..1146948m . doi : 10.1371/journal.pone.0146948 . PMC 4718451 . PMID 26785117 .
- ^ Kohno Y, Yamamoto H, Hirahashi M, Kumagae Y, Nakamura M, Oki E, Oda Y (июнь 2016 г.). «Снижение экспрессии Mutyh, MTH1 и OGG1 и мутация TP53 при аденокарциноме желудочной кардии диффузного типа». Человеческая патология . 52 : 145–152. doi : 10.1016/j.humpath.2016.01.006 . PMID 26980051 .
- ^ Jiang Z, Hu J, Li X, Jiang Y, Zhou W, Lu D (декабрь 2006 г.). «Анализ экспрессии 27 генов репарации ДНК в астроцитоме с помощью массива низкой плотности Taqman». Нейробиологические буквы . 409 (2): 112–117. doi : 10.1016/j.neulet.2006.09.038 . PMID 17034947 . S2CID 54278905 .
- ^ Jump up to: а беременный Кубо Н., Морита М., Накашима Ю., Китао Х., Эгашира А., Саеки Х, Оки Е., Какеджи Ю., Ода Й, Маехара Й (апрель 2014). «Окислительное повреждение ДНК при раке пищевода человека: клинический анализ 8-гидроксидеоксигуанозина и его восстановления». Болезни пищевода . 27 (3): 285–293. doi : 10.1111/dote.12107 . HDL : 2324/1441070 . PMID 23902537 .
- ^ Гао Т., Джойс Б.Т., Лю Л., Чжэн Ю., Дай Q, Чжан З., Чжан В., Крубсол М.Дж., Тао М.Х., Шварц Дж., Бакарелли А., Хоу Л (2016). «Метилирование ДНК генов окислительного стресса и риск рака в исследовании нормативного старения» . Американский журнал исследований рака . 6 (2): 553–561. PMC 4859680 . PMID 27186424 .
- ^ Паз-Элизур Т., Крупский М., Блюменштейн С., Элинджер Д., Шехтман Е., Ливнех З. (сентябрь 2003 г.). «Активность репарации ДНК для окислительного повреждения и риска рака легких» . Журнал Национального института рака . 95 (17): 1312–1319. Citeseerx 10.1.1.335.8063 . doi : 10.1093/jnci/djg033 . PMID 12953085 .
- ^ Паз-Элизур Т., Бен-Йосеф Р., Элинджер Д., Векслер А., Крупский М., Берреби А., Шани А., Шехтман Е., Фридман Л., Ливнех З. (декабрь 2006 г.). «Снижение восстановления окислительного повреждения ДНК 8-оксогуанина и риска рака головы и шеи». РАНКА . 66 (24): 11683–11689. doi : 10.1158/0008-5472.can-06-2294 . PMID 17178863 . S2CID 23247597 .
- ^ Vlahopoulos S, Pan L, Varisli L, Dancik GM, Karantanos T, Boldogh I (декабрь 2023). «OGG1 как эпигенетический читатель влияет на NFκB: что это значит для рака» . Рак (Базель) . 16 (1): 148. doi : 10.3390/accers16010148 . PMC 10778025 . PMID 38201575 .
- ^ Marsin S, Vidal AE, Sossou M, Ménissier-De Murcia J, Le Page F, Boiteux S, De Murcia G, Radicella JP (ноябрь 2003 г.). «Роль XRCC1 в координации и стимуляции восстановления окислительного повреждения ДНК, инициированной ДНК -гликозилазой HOGG1» . Журнал биологической химии . 278 (45): 44068–44074. doi : 10.1074/jbc.m306160200 . PMID 12933815 .
- ^ Dantzer F, Luna L, Bjørås M, Seeberg E (июнь 2002 г.). «Человек OGG1 подвергается сериновому фосфорилированию и ассоциируется с ядерным матриксом и митотическим хроматином in vivo» . Исследование нуклеиновых кислот . 30 (11): 2349–2357. doi : 10.1093/nar/30.11.2349 . PMC 117190 . PMID 12034821 .
- ^ Осорио А., Милн Р.Л., Кученбакер К., Ваклова Т., Пита Г., Алонсо Р. и др. (Апрель 2014). «Гликозилазы ДНК, участвующие в восстановлении базового удаления, могут быть связаны с риском рака у носителей мутации BRCA1 и BRCA2» . PLOS Genetics . 10 (4): E1004256. doi : 10.1371/journal.pgen.1004256 . PMC 3974638 . PMID 24698998 .
Дальнейшее чтение
[ редактировать ]- Boiteux S, Radicella JP (май 2000). «Человеческий ген OGG1: структура, функции и его значение в процессе канцерогенеза». Архивы биохимии и биофизики . 377 (1): 1–8. doi : 10.1006/abbi.2000.1773 . PMID 10775435 .
- Park J, Chen L, Tockman MS, Elahi A, Lazarus P (февраль 2004 г.). «8-оксогуаниновая ДНК N-гликозилаза-фермент 8-оксогуанина N-гликозилаза (HOGG1) и его связь с риском рака легких». Фармакогенетика . 14 (2): 103–109. doi : 10.1097/00008571-200402000-00004 . PMID 15077011 .
- Хунг Р.Дж., Холл Дж., Бреннан П., Боффетта П (ноябрь 2005 г.). «Генетические полиморфизмы в базовом пути восстановления удаления и риска рака: огромный обзор» . Американский журнал эпидемиологии . 162 (10): 925–942. doi : 10.1093/aje/kwi318 . PMID 16221808 .
- Мирбахай Л., Кершоу Р.М., Грин Р.М., Хейден Р.Е., Мелдрум Р.А., Ходжес Нью -Джерси (февраль 2010 г.). «Использование молекулярного маяка для отслеживания активности базового иссечения белка OGG1 в живых клетках». Репарация ДНК . 9 (2): 144–152. doi : 10.1016/j.dnarep.2009.11.009 . PMID 20042377 .
- Wang R, Hao W, Pan L, Boldogh I, Ba X (октябрь 2018). «Роли основания репарации эксцизионного фермента OGG1 в экспрессии генов» . Клеточные и молекулярные науки о жизни . 75 (20): 3741–3750. doi : 10.1007/s00018-018-2887-8 . PMC 6154017 . PMID 30043138 .
- Vlahopoulos S, Adamaki M, Khoury N, Zoumpourlis V, Boldogh I (2018). «Роль фермента репарации ДНК OGG1 в врожденном иммунитете и его значении для рака легких» . Фармакология и терапия . 194 : 59–72. doi : 10.1016/j.pharmthera.2018.09.004 . PMC 6504182 . PMID 30240635 .
Внешние ссылки
[ редактировать ]- Оксугуанин+гликозилаза+1,+Человек в Национальной библиотеке Медицинской библиотеки США ) (сетка