Глюкоцереброзидаза
| ПОЛУЧАТЬ | ||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | GBA , GBA1, GCB, GLUC, глюкозилцерамидаза бета, глюкоцереброзидаза | |||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | ОМИМ : 606463 ; МГИ : 95665 ; Гомологен : 68040 ; GeneCards : ГБ ; ОМА : GBA – ортологи | |||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | ||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
β-Глюкоцереброзидаза (также называемая кислой β-глюкозидазой , D -глюкозил-N-ацилсфингозинглюкогидролазой или GCase ) представляет собой фермент с глюкозилцерамидазной активностью ( EC 3.2.1.45 ), который расщепляет путем гидролиза β -гликозидную связь химического глюкоцереброзида , промежуточный продукт метаболизма гликолипидов , которого много в клеточных мембранах (особенно в клетках кожи). [5] Он локализуется в лизосоме , где остается связанным с лизосомальной мембраной. [6] β-глюкоцереброзидаза имеет длину 497 аминокислот и молекулярную массу 59 700 Да . [ нужна ссылка ]
Структура
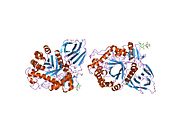
[ редактировать ]β-глюкоцереброзидаза является членом семейства гликозидгидролаз 30 и состоит из трех отдельных доменов (I-III). [7]
- Трехмерное изображение глюкоцереброзидазы с помощью PyMol с выделенными тремя доменами.
- Трехмерное изображение глюкоцереброзидазы с помощью PyMol с выделенными каталитическими остатками.
Домен I (остатки 1–27 и 383–414) образует трехцепочечный антипараллельный β-лист. Этот домен содержит два дисульфидных мостика, необходимые для правильного сворачивания, а также гликозилированный остаток (Asn19), необходимый для каталитической активности in vivo. Домен II (остатки 30–75 и 431–497) состоит из двух β-листов, напоминающих складку иммуноглобулина . Домен III (остатки 76–381 и 416–430) гомологичен стволу TIM и является высококонсервативным доменом среди гликозидгидролаз . [8] Домен III содержит активный сайт, который связывает субстрат глюкоцереброзид в непосредственной близости от каталитических остатков E340 и E235. Домены I и III тесно связаны, а домены II и III соединены неупорядоченным линкером. [7]
Механизм
[ редактировать ]Кристаллические структуры что β-глюкоцереброзидаза связывает глюкозный фрагмент и прилегающую О-гликозидную связь глюкоцереброзида показывают , . Две алифатические цепи глюкоцереброзида могут оставаться связанными с лизосомальным бислоем или взаимодействовать с активирующим белком сапозином С. [7]
Как и в случае с другими гликозидгидролазами, механизм гидролиза глюкоцереброзида β-глюкоцереброзидазой включает кислотно-основной катализ с участием двух остатков глутаминовой кислоты (E340 и E235) и предшествует двухэтапному механизму. На первом этапе E340 осуществляет нуклеофильную атаку по углероду O-гликозидной связи, вытесняя сфингозиновый фрагмент, который одновременно протонируется E235 по мере его высвобождения из активного центра. На втором этапе глюкоза гидролизуется из остатка E340 для регенерации активного фермента. [7] [9]
Характеристики
[ редактировать ]β-глюкоцереброзидаза максимально активна при рН 5,5, рН лизосомального компартмента. [10] Внутри лизосомы он остается связанным с мембраной, где связывается и расщепляет свой субстрат глюкоцереброзид (GluCer). Для максимальной каталитической активности требуется активирующий белок сапозин С, а также отрицательно заряженные липиды. [11] [12] Роль сапозина С неизвестна; однако показано, что он связывает как лизосомальную мембрану, так и липидные фрагменты GluCer и, следовательно, может рекрутировать GluCer в активный центр фермента. [13] [14]
β-глюкоцереброзидаза специфически и необратимо ингибируется аналогом глюкозы эпоксидом кондуритола B. Эпоксид кондуритола B связывается с активным центром GCase, где фермент расщепляет свое эпоксидное кольцо, образуя постоянную ковалентную связь между ферментом и ингибитором. [15]
Первоначально считалось, что GCase является одним из немногих лизосомальных ферментов, который не следует по маннозо-6-фосфатному пути доставки в лизосому . [16] Исследование I-клеточной болезни фибробластов (в которых фосфотрансфераза , которая помещает маннозо-6-фосфат в белки, чтобы направить их в лизосому, является дефектной) показало нацеливание GCase на лизосому независимо от пути M6P. [17] Было показано, что лизосомальный транспортер и интегральный мембранный белок LIMP-2 (лизосомальный интегральный мембранный белок 2) связывают GCase и облегчают транспорт в лизосому, демонстрируя механизм M6P-независимого лизосомального транспорта. Этот вывод был поставлен под сомнение, когда кристаллическая структура GCase в комплексе с LIMP-2 показала наличие маннозо-6-фосфатного фрагмента в LIMP-2, что позволяет предположить, что комплекс также может следовать традиционному маннозо-6-фосфатному пути . [18]
Клиническое значение
[ редактировать ]Мутации глюкоцереброзидазы в гене вызывают болезнь Гоше — лизосомальную болезнь накопления, характеризующуюся накоплением глюкоцереброзидов в макрофагах, которые инфильтрируют многие жизненно важные органы. [19] [20]
Мутации в гене глюкоцереброзидазы также связаны с болезнью Паркинсона . [21] [22]
Родственный псевдоген находится примерно на 12 т.п.н. ниже этого гена на хромосоме 1 . Альтернативный сплайсинг приводит к образованию нескольких вариантов транскрипта, кодирующих один и тот же белок. [23]
Наркотики
[ редактировать ]Альглюцераза (цередаза) представляла собой версию глюкоцереброзидазы, которую получали из плацентарной ткани человека и затем модифицировали с помощью ферментов. [24] Он был одобрен FDA в 1991 году. [25] но был снят с рынка [26] [27] из-за одобрения аналогичных препаратов, изготовленных с использованием технологии рекомбинантной ДНК, а не из ткани. Лекарства, полученные рекомбинантным путем, не представляют риска передачи заболеваний из тканей, используемых при сборе урожая, и их производство дешевле. [24]
Рекомбинантные глюкоцереброзидазы, используемые в качестве лекарств, включают: [28]
- Имиглюцераза (Церезим) [24]
- Велаглюцераза (Vpriv) [24]
- Талиглюцераза альфа (Elelyso) [29]
См. также
[ редактировать ]- Близкородственные ферменты
Ссылки
[ редактировать ]- ^ Jump up to: а б с ENSG00000177628 GRCh38: выпуск Ensembl 89: ENSG00000262446, ENSG00000177628 – Ensembl , май 2017 г.
- ^ Jump up to: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000028048 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ Вильхабер Г., Пфайффер С., Брэйд Л., Линднер Б., Гольдманн Т., Фоллмер Э., Хинтце У., Виттерн К.П., Вепф Р. (ноябрь 2001 г.). «Локализация церамидов и глюкозилцерамидов в эпидермисе человека методом электронной микроскопии иммунозолота» . Журнал исследовательской дерматологии . 117 (5): 1126–36. дои : 10.1046/j.0022-202x.2001.01527.x . ПМИД 11710923 .
- ^ Рейнбутт С., Аэртс Х.М., Гёз Х.Дж., Тагер Дж.М., Строус Г.Дж. (март 1991 г.). «Маннозо-6-фосфат-независимая мембранная ассоциация катепсина D, глюкоцереброзидазы и белка, активирующего сфинголипид, в клетках HepG2» . Журнал биологической химии . 266 (8): 4862–8. дои : 10.1016/S0021-9258(19)67728-8 . hdl : 1887/50559 . ПМИД 1848227 .
- ^ Jump up to: а б с д Либерман Р.Л. (2011). «Экскурсия по структурной биологии болезни Гоше: кислая-β-глюкозидаза и сапозин С» . Ферментные исследования . 2011 : 973231. doi : 10.4061/2011/973231 . ПМЦ 3226326 . ПМИД 22145077 .
- ^ Ригден DJ, Енджеяс М.Ю., де Мелло Л.В. (июнь 2003 г.). «Идентификация и анализ каталитических бочковых доменов TIM в семи других семействах гликозидгидролаз» . Письма ФЭБС . 544 (1–3): 103–11. дои : 10.1016/S0014-5793(03)00481-2 . ПМИД 12782298 .
- ^ Vocadlo DJ, Дэвис Дж.Дж., Лэйн Р., Уизерс С.Г. (август 2001 г.). «Катализ лизоцимом куриного яичного белка протекает через ковалентное промежуточное соединение» (PDF) . Природа . 412 (6849): 835–8. Бибкод : 2001Natur.412..835V . дои : 10.1038/35090602 . ПМИД 11518970 . S2CID 205020153 .
- ^ Синклер Дж., Пфайфер Т.А., Грильятти Т.А., Чой Ф.Ю. (апрель 2006 г.). «Секреция глюкоцереброзидазы человека из стабильных трансформированных клеток насекомых с использованием нативных сигнальных последовательностей». Биохимия и клеточная биология . 84 (2): 148–56. дои : 10.1139/o05-165 . ПМИД 16609695 .
- ^ Аэртс Дж.М., Са Миранда М.К., Брауэр-Келдер Э.М., Ван Вили С., Баррангер Дж.А., Тагер Дж.М. (октябрь 1990 г.). «Состояния, влияющие на активность глюкоцереброзидазы, очищенной из селезенки контрольной группы и пациентов с болезнью Гоше 1 типа». Biochimica et Biophysical Acta (BBA) - Структура белка и молекулярная энзимология . 1041 (1): 55–63. дои : 10.1016/0167-4838(90)90122-В . ПМИД 2223847 .
- ^ Вейлер С., Кисимото Ю., О'Брайен Дж.С., Барранджер Дж.А., Томич Дж.М. (апрель 1995 г.). «Идентификация сайтов связывания и активации белка-активатора сфинголипидов сапозина С с глюкоцереброзидазой» . Белковая наука . 4 (4): 756–64. дои : 10.1002/pro.5560040415 . ПМК 2143096 . ПМИД 7613473 .
- ^ Алаттиа-младший, Шоу Дж.Э., Ип СМ, Приве Г.Г. (октябрь 2006 г.). «Прямая визуализация ремоделирования сапозином липидных бислоев». Журнал молекулярной биологии . 362 (5): 943–53. дои : 10.1016/j.jmb.2006.08.009 . ПМИД 16949605 .
- ^ Тамарго Р.Дж., Велаяти А, Голдин Е, Сидрански Э (июль 2012 г.). «Роль сапозина С при болезни Гоше» . Молекулярная генетика и обмен веществ . 106 (3): 257–63. дои : 10.1016/j.ymgme.2012.04.024 . ПМЦ 3534739 . ПМИД 22652185 .
- ^ Огава С., Уэцуки С., Тэдзука Ю., Морикава Т., Такахаши А., Сато К. (июнь 1999 г.). «Синтез и оценка ингибирующей глюкоцереброзидазу активности ангидродезоксиинозитолов из (+)-эпи- и (-)-вибо-кверцитов». Письма по биоорганической и медицинской химии . 9 (11): 1493–8. дои : 10.1016/S0960-894X(99)00223-1 . ПМИД 10386923 .
- ^ Речек Д., Швейк М., Шредер Дж., Хьюз Х., Бланц Дж., Джин Икс, Брондик В., Ван Паттен С., Эдмундс Т., Сафтиг П. (ноябрь 2007 г.). «LIMP-2 представляет собой рецептор для лизосомальной маннозо-6-фосфат-независимой доставки бета-глюкоцереброзидазы» . Клетка . 131 (4): 770–83. дои : 10.1016/j.cell.2007.10.018 . ПМИД 18022370 . S2CID 6771697 .
- ^ Гликман Дж. Н., Корнфельд С. (октябрь 1993 г.). «Маннозо-6-фосфат-независимое нацеливание на лизосомальные ферменты в лимфобластах B-клеточной болезни» . Журнал клеточной биологии . 123 (1): 99–108. дои : 10.1083/jcb.123.1.99 . ПМК 2119824 . ПМИД 8408210 .
- ^ Чжао И., Рен Дж., Падилья-Парра С., Фрай Э.Э., Стюарт Д.И. (июль 2014 г.). «Сортировка β-глюкоцереброзидазы в лизосомах с помощью LIMP-2 осуществляется рецептором маннозо-6-фосфата» . Природные коммуникации . 5 : 4321. Бибкод : 2014NatCo...5.4321Z . дои : 10.1038/ncomms5321 . ПМК 4104448 . ПМИД 25027712 .
- ^ Муччи Дж. М., Розенфельд П. (2015). «Патогенез костных изменений при болезни Гоше: роль иммунной системы» . Журнал иммунологических исследований . 2015 : 192761. дои : 10.1155/2015/192761 . ПМЦ 4433682 . ПМИД 26064996 .
- ^ Стирнеманн Дж, Бельматог Н, Каму Ф, Серратрис С, Фруассар Р, Кайо С, Левад Т, Астудильо Л, Серратрис Дж, Брасье А, Роуз С, Биллетт де Вильмер Т, Бергер М.Г. (февраль 2017 г.). «Обзор патофизиологии, клинической картины и лечения болезни Гоше» . Международный журнал молекулярных наук . 18 (2): 441. doi : 10.3390/ijms18020441 . ПМК 5343975 . ПМИД 28218669 .
- ^ Калия Л.В., Ланг А.Е. (август 2015 г.). «Болезнь Паркинсона». Ланцет . 386 (9996): 896–912. дои : 10.1016/S0140-6736(14)61393-3 . ПМИД 25904081 . S2CID 5502904 .
- ^ Доктор философии LS (18 сентября 2023 г.). «Исследователи получают премию за прорыв за открытия в области генетики Паркинсона | Новости Паркинсона сегодня» . parkinsonsnewstoday.com . Проверено 20 сентября 2023 г.
- ^ «Ген Энтреза: GBA глюкозидаза, бета; кислота (включает глюкозилцерамидазу)» .
- ^ Jump up to: а б с д Диган П.Б., Кокс Т.М. (2012). «Имиглюцераза в лечении болезни Гоше: история и перспективы» . Дизайн, разработка и терапия лекарств . 6 : 81–106. дои : 10.2147/DDDT.S14395 . ПМК 3340106 . ПМИД 22563238 .
- ^ «Вопросы регулирования» (PDF) . Информация ВОЗ о лекарствах . 5 (3): 123–4. 1991. Архивировано из оригинала (PDF) 8 ноября 2005 года.
- ^ «Ферментозаместительная терапия лизосомальных нарушений накопления» . Номер бюллетеня клинической политики: 0442. Aetna. 8 августа 2014 г.
- ^ «Список лекарств, отпускаемых по рецепту и без рецепта FDA» (PDF) . Дополнения/удаления в списке рецептурных лекарственных средств. Управление по контролю за продуктами и лекарствами США. Март 2012.
- ^ Грабовский Г.А. (2012). «Болезнь Гоше и другие нарушения памяти» . Гематология. Американское общество гематологии. Образовательная программа . 2012 : 13–8. doi : 10.1182/asheducation.v2012.1.13.3797921 . ПМИД 23233555 .
- ^ Юхананов А (1 мая 2012 г.). «FDA США одобрило препарат Pfizer/Protalix для Гоше» . Чикаго Трибьюн . Рейтер . Проверено 2 мая 2012 г. [ постоянная мертвая ссылка ]
Дальнейшее чтение
[ редактировать ]- Горовиц М., Зимран А. (1994). «Мутации, вызывающие болезнь Гоше» . Человеческая мутация . 3 (1): 1–11. дои : 10.1002/humu.1380030102 . ПМИД 8118460 . S2CID 30605941 .
- Тайеби Н., Стоун Д.Л., Сидрански Э. (октябрь 1999 г.). «Болезнь Гоше 2 типа: расширяющийся фенотип» . Молекулярная генетика и обмен веществ (представленная рукопись). 68 (2): 209–19. дои : 10.1006/mgme.1999.2918 . ПМИД 10527671 .
- Стоун Д.Л., Тайеби Н., Орвиски Э., Стабблфилд Б., Мэдике В., Сидрански Э. (2000). «Мутации гена глюкоцереброзидазы у пациентов с болезнью Гоше 2 типа» . Мутация человека (представленная рукопись). 15 (2): 181–8. doi : 10.1002/(SICI)1098-1004(200002)15:2<181::AID-HUMU7>3.0.CO;2-S . ПМИД 10649495 . S2CID 31438997 .
- Кайо С., Поэнару Л. (2002). «[Болезни Гоше и Фабри: биохимические и генетические аспекты]». Журнал Биологического общества . 196 (2): 135–40. дои : 10.1051/jbio/2002196020135 . ПМИД 12360742 . S2CID 81257040 .
- Фабрега С., Дюран П., Морнон Дж. П., Лен П. (2002). «[Активный центр глюкоцереброзидазы человека: структурные предсказания и экспериментальные подтверждения]». Журнал общества биологии . 196 (2): 151–60. дои : 10.1051/jbio/2002196020151 . ПМИД 12360744 . S2CID 81542873 .
- Альфонсо П., Азнарес С., Жиральт М., Покови М., Хиральдо П. (2007). «Анализ мутаций и взаимоотношения генотипа/фенотипа у пациентов с болезнью Гоше в Испании» . Журнал генетики человека . 52 (5): 391–6. дои : 10.1007/s10038-007-0135-4 . ПМИД 17427031 .
Внешние ссылки
[ редактировать ]- Запись GeneReviews/NCBI/UW/NIH о болезни Гоше
- Глюкоцереброзидаза в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)
- Протеопедия Кислота-бета-глюкозидаза