β-глюкуронидаза
| β-глюкуронидаза | |||
|---|---|---|---|
 | |||
| Идентификаторы | |||
| Номер ЕС. | 3.2.1.31 | ||
| Номер CAS. | 9001-45-0 | ||
| Базы данных | |||
| ИнтЭнк | вид IntEnz | ||
| БРЕНДА | БРЕНДА запись | ||
| Экспаси | Просмотр NiceZyme | ||
| КЕГГ | КЕГГ запись | ||
| МетаЦик | метаболический путь | ||
| ПРЯМОЙ | профиль | ||
| PDB Структуры | RCSB PDB PDBe PDBsum | ||
| Генная онтология | АмиГО / QuickGO | ||
| |||
| β-глюкуронидаза | |||
|---|---|---|---|
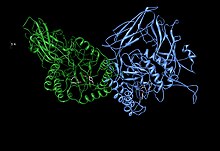 Асимметричная единица β-глюкуронидазы, показывающая остатки активного центра Glu451, Tyr504 и Glu540, а также потенциально поддерживающий остаток Asn450. [1] | |||
| Идентификаторы | |||
| Символ | ГУСБ | ||
| ген NCBI | 2990 | ||
| HGNC | 4696 | ||
| МОЙ БОГ | 611499 | ||
| RefSeq | НМ_000181 | ||
| ЮниПрот | P08236 | ||
| Другие данные | |||
| Номер ЕС | 3.2.1.31 | ||
| Локус | Хр. 7 кв11.21 | ||
| |||
β-глюкуронидазы являются членами гликозидаз семейства ферментов , которые катализируют расщепление сложных углеводов . [2] Человеческая β-глюкуронидаза представляет собой тип глюкуронидазы (член семейства гликозидаз 2), который катализирует гидролиз остатков β- D - глюкуроновой кислоты с невосстанавливающего конца мукополисахаридов (также называемых гликозаминогликанами ), таких как гепарансульфат . [2] [3] [4] Человеческая β-глюкуронидаза расположена в лизосоме . [5] В кишечнике β-глюкуронидаза щеточной каймы преобразует конъюгированный билирубин в неконъюгированную форму для реабсорбции. β-глюкуронидаза также присутствует в грудном молоке, что способствует развитию желтухи новорожденных . Белок кодируется геном GUSB у человека. [6] [7] и геном uidA у бактерий. [8]
Структура
[ редактировать ]Человеческая β-глюкуронидаза синтезируется в виде мономера массой 80 кДа (653 аминокислоты) до того, как протеолиз удаляет 18 аминокислот с С- конца с образованием мономера массой 78 кДа. [9] [10] массой 332 кДа β-глюкуронидаза существует в виде гомотетрамера . [11] β-глюкуронидаза содержит несколько примечательных структурных образований, в том числе тип β-цилиндра, известный как цилиндр желеобразного рулона и цилиндр TIM . [1]
Механизм катализа
[ редактировать ]Человеческая β-глюкуронидаза гомологична ферменту coli Escherichia β-галактозидазе . [12] [13] Эти гомологичные отношения, а также знание того, что гликозидазы часто осуществляют гидролиз, катализируемый двумя кислотными остатками , позволили разработать механистическую гипотезу. Эта гипотеза предполагает, что два остатка глутаминовой кислоты Glu540 и Glu451 являются нуклеофильными и кислотными остатками соответственно и что тирозиновый остаток Tyr504 также участвует в катализе. В подтверждение этой гипотезы экспериментальные мутации в любом из этих трех остатков приводят к значительному снижению ферментативной активности. Повышенная активность мутантного фермента E451A (где Glu451 заменен остатком аланина ) после добавления азида согласуется с Glu451 в качестве кислотно-основного остатка. [14] Используя анализ меченых пептидов β-глюкуронидазы после гидролиза субстрата, который вступает в очень стабильную промежуточную стадию, исследователи определили, что Glu540 является нуклеофильным остатком. [15]
Хотя конкретный тип нуклеофильного замещения, используемый β-глюкуронидазой, неясен, данные о механизмах их гомологов в семействе гликозидаз позволяют предположить, что эти реакции качественно являются реакциями S N 2 . Реакции протекают через переходное состояние с характеристиками иона оксокарбения . Первоначально эти механизмы, из-за этой характеристики переходного состояния оксокарбения, были предложены как реакции S N 1 , протекающие через дискретный промежуточный ион оксокарбения . Однако более поздние данные свидетельствуют о том, что эти состояния ионов оксокарбения имеют время жизни 10 фемтосекунд - 0,1 наносекунды (аналогично периоду колебаний связи ). Эти времена жизни слишком коротки, чтобы их можно было отнести к промежуточному продукту реакции. Из этих данных следует, что эти реакции, хотя и имеют вид S N 1 из-за характеристик ионов оксокарбения в их переходных состояниях, качественно должны быть S N 2 . реакциями [2]
Специфическая активность Tyr504 в каталитическом механизме неясна. [14] Путем сравнения со структурными данными гомологичного фермента ксиланазы было высказано предположение, что Tyr504 β-глюкуронидазы может стабилизировать уходящий нуклеофил (Glu540) или модулировать его активность. [16]
В дополнение к этим остаткам было высказано предположение, что консервативный остаток аспарагина (Asn450) стабилизирует субстрат за счет действия водородной связи в 2-гидроксильной группе сахарного субстрата. [11] [17]
- Повторяющаяся единица гепарансульфатного субстрата β-глюкуронидазы
- Изображение поверхности кармана активного центра β-глюкуронидазы с показанными каталитическими остатками. [1]
- Изображен механизм гидролиза β-глюкуронидазой сахарного субстрата с высокоэнергетическими переходными состояниями, демонстрирующим характер иона оксокарбения. [15]
- Потенциальная стабилизация нуклеофильного остатка Glu540 с помощью Tyr504 в β-глюкуронидазе [16]
Синдром Слая
[ редактировать ]Дефицит β-глюкуронидазы приводит к аутосомно-рецессивному наследственному метаболическому заболеванию, известному как синдром Слая или мукополисахаридоз VII. Дефицит этого фермента приводит к накоплению у пациента негидролизованных мукополисахаридов. Это заболевание может быть чрезвычайно изнурительным для пациента или привести к водянке плода еще до рождения. Кроме того, у выживших больных наблюдаются умственная отсталость, низкий рост, грубые черты лица, аномалии позвоночника, увеличение печени и селезенки. [5] Это заболевание было смоделировано на линиях мышей, а также на семействе собак. [19] [20] Совсем недавно исследователи обнаружили семейство кошек, у которого наблюдается дефицит активности β-глюкуронидазы. Источником этого снижения активности была идентифицирована мутация E351K (Glu351 мутирует до остатка лизина). Glu351 консервативен у млекопитающих, что указывает на важную функцию этого остатка. структуры человека Исследование рентгеновской кристаллической позволяет предположить, что этот остаток (Glu352 в человеческом ферменте), который скрыт глубоко внутри TIM бочкообразного домена , может быть важен для стабилизации третичной структуры фермента. [18] Судя по кристаллической структуре, Arg216, член домена желейного рулона белка, образует солевой мостик с Glu352; следовательно, Glu352, вероятно, участвует в стабилизации взаимодействия между двумя различными трехмерными доменами фермента. [1]
Использование в качестве репортерного гена
[ редактировать ]В молекулярной биологии β-глюкуронидаза используется в качестве репортерного гена для мониторинга экспрессии генов в клетках млекопитающих и растений. Мониторинг активности β-глюкуронидазы с помощью анализа GUS позволяет определить пространственную и временную экспрессию рассматриваемого гена. [21]
- Изображения молекулярной графики были созданы с использованием пакета Chimera из Ресурса биокомпьютеров, визуализации и информатики Калифорнийского университета в Сан-Франциско. [22]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б с д и ж ПДБ : 1BHG ; Джайн С., Дрендел В.Б., Чен З.В., Мэтьюз Ф.С., Слай В.С., Грабб Дж.Х. (апрель 1996 г.). «Структура β-глюкуронидазы человека обнаруживает потенциальные лизосомальные нацеливания и мотивы активного центра». Структурная биология природы . 3 (4): 375–81. дои : 10.1038/nsb0496-375 . ПМИД 8599764 . S2CID 28862883 .
- ^ Jump up to: а б с Синнотт М., изд. (1998). Комплексный биологический катализ . Том. 1. Манчестер, Великобритания: Академик Пресс. стр. 119–138 . ISBN 978-0-12-646864-9 .
- ^ Маккартер JD, Withers SG (декабрь 1994 г.). «Механизмы ферментативного гидролиза гликозидов». Современное мнение в области структурной биологии . 4 (6): 885–92. дои : 10.1016/0959-440X(94)90271-2 . ПМИД 7712292 .
- ^ Синнотт М.Л. (1990). «Каталитические механизмы ферментативного переноса гликозила». Хим. преп . 90 (7): 1171–1202. дои : 10.1021/cr00105a006 .
- ^ Jump up to: а б Найхан В.Л., Баршоп Б., Озанд П. (2005). Атлас метаболических заболеваний (2-е изд.). Лондон, Великобритания: Ходдер Арнольд. стр. 100-1 501–503, 546–550. ISBN 978-0-340-80970-9 .
- ^ Осима А., Кайл Дж.В., Миллер Р.Д., Хоффманн Дж.В., Пауэлл П.П., Грабб Дж.Х., Слай В.С., Тропак М., Гиз К.С., Гравий Р.А. (февраль 1987 г.). «Клонирование, секвенирование и экспрессия кДНК β-глюкуронидазы человека» . Труды Национальной академии наук Соединенных Штатов Америки . 84 (3): 685–9. Бибкод : 1987PNAS...84..685O . дои : 10.1073/pnas.84.3.685 . ПМК 304280 . ПМИД 3468507 .
- ^ «Ген Энтрез: глюкуронидаза GUSB, бета» .
- ^ Мартинс М.Т., Ривера И.Г., Кларк Д.Л., Стюарт М.Х., Вулф Р.Л., Олсон Б.Х. (июль 1993 г.). «Распределение последовательностей гена uidA в изолятах Escherichia coli в водных источниках и сравнение с экспрессией активности бета-глюкуронидазы в среде 4-метилумбеллиферил-β-D-глюкуронида» . Прикладная и экологическая микробиология . 59 (7): 2271–6. Бибкод : 1993ApEnM..59.2271M . дои : 10.1128/АЕМ.59.7.2271-2276.1993 . ПМК 182268 . ПМИД 8357258 .
- ^ Ислам М.Р., Грабб Дж.Х., Слай В.С. (октябрь 1993 г.). «С-концевой процессинг бета-глюкуронидазы человека. Пропептид необходим для полного проявления каталитической активности, внутриклеточного удержания и правильного фосфорилирования» . Журнал биологической химии . 268 (30): 22627–33. дои : 10.1016/S0021-9258(18)41574-8 . ПМИД 8226771 .
- ^ Шипли Дж. М., Грабб Дж. Х., Слай В. С. (июнь 1993 г.). «Роль гликозилирования и фосфорилирования в экспрессии активной β-глюкуронидазы человека» . Журнал биологической химии . 268 (16): 12193–8. дои : 10.1016/S0021-9258(19)50325-8 . ПМИД 8505339 .
- ^ Jump up to: а б с Ким Х.В., Мино К., Исикава К. (декабрь 2008 г.). «Кристаллизация и предварительный рентгеноструктурный анализ эндоглюканазы Pyrococcus horikoshii» . Акта Кристаллографика. Раздел F. Структурная биология и кристаллизационные связи . 64 (Часть 12): 1169–71. дои : 10.1107/S1744309108036919 . ПМЦ 2593689 . ПМИД 19052378 .
- ^ Хенриссат Б, Байрох А (август 1993 г.). «Новые семейства в классификации гликозилгидролаз на основе сходства аминокислотных последовательностей» . Биохимический журнал . 293 (Часть 3) (3): 781–8. дои : 10.1042/bj2930781 . ПМЦ 1134435 . ПМИД 8352747 .
- ^ Хенриссат Б (декабрь 1991 г.). «Классификация гликозилгидролаз, основанная на сходстве аминокислотных последовательностей» . Биохимический журнал . 280 (Часть 2) (2): 309–16. дои : 10.1042/bj2800309 . ПМЦ 1130547 . ПМИД 1747104 .
- ^ Jump up to: а б Ислам М.Р., Томацу С., Шах Г.Н., Грабб Дж.Х., Джайн С., Слай В.С. (август 1999 г.). «Остатки активного центра β-глюкуронидазы человека. Доказательства наличия Glu (540) в качестве нуклеофила и Glu (451) в качестве кислотно-основного остатка» . Журнал биологической химии . 274 (33): 23451–5. дои : 10.1074/jbc.274.33.23451 . ПМИД 10438523 .
- ^ Jump up to: а б Вонг А.В., Хе С., Грабб Дж.Х., Слай В.С., Уизерс С.Г. (декабрь 1998 г.). «Идентификация Glu-540 как каталитического нуклеофила бета-глюкуронидазы человека с помощью масс-спектрометрии электрораспылением» . Журнал биологической химии . 273 (51): 34057–62. дои : 10.1074/jbc.273.51.34057 . ПМИД 9852062 .
- ^ Jump up to: а б «EzCatDB: T00066» . EzCatDB: База данных каталитических механизмов . Архивировано из оригинала 17 июня 2009 г. Проверено 12 декабря 2008 г.
- ^ Jump up to: а б Хенриссат Б., Каллебо И., Фабрега С., Лен П., Морнон Дж. П., Дэвис Дж. (июль 1995 г.). «Консервативный каталитический механизм и предсказание общей складки для нескольких семейств гликозилгидролаз» . Труды Национальной академии наук Соединенных Штатов Америки . 92 (15): 7090–4. Бибкод : 1995PNAS...92.7090H . дои : 10.1073/pnas.92.15.7090 . ПМК 41477 . ПМИД 7624375 .
- ^ Jump up to: а б Файф Дж.К., Куржалс Р.Л., Лассалин М.Э., Хентхорн П.С., Алур П.Р., Ван П., Вулф Дж.Х., Гигер У., Хаскинс М.Е., Паттерсон Д.Ф., Сан Х., Джейн С., Юки Н. (июнь 1999 г.). «Молекулярная основа дефицита бета-глюкуронидазы кошек: животная модель мукополисахаридоза VII». Геномика . 58 (2): 121–8. дои : 10.1006/geno.1999.5825 . ПМИД 10366443 .
- ^ Биркенмайер Э.Х., Дэвиссон М.Т. , Бимер В.Г., Ганшоу Р.Е., Фоглер К.А., Гвинн Б., Лайфорд К.А., Малтаис Л.М., Вавжиняк К.Дж. (апрель 1989 г.). «Мышиный мукополисахаридоз VII типа. Характеристика мыши с дефицитом бета-глюкуронидазы» . Журнал клинических исследований . 83 (4): 1258–66. дои : 10.1172/JCI114010 . ПМК 303816 . ПМИД 2495302 .
- ^ Хаскинс М.Э., Десник Р.Дж., ДиФерранте Н., Ежик П.Ф., Паттерсон Д.Ф. (октябрь 1984 г.). «Дефицит бета-глюкуронидазы у собаки: модель мукополисахаридоза человека VII» . Педиатрические исследования . 18 (10): 980–4. дои : 10.1203/00006450-198410000-00014 . ПМИД 6436780 .
- ^ Марат С.В., МакИвен Дж.Э. (февраль 1995 г.). «Векторы с репортерным геном gus для идентификации и количественного определения промоторных областей в Saccharomyces cerevisiae ». Джин . 154 (1): 105–7. дои : 10.1016/0378-1119(94)00845-J . ПМИД 7867935 .
- ^ Петтерсен Э.Ф., Годдард Т.Д., Хуанг CC, Коуч Г.С., Гринблатт Д.М., Мэн Э.К., Феррин Т.Е. (октябрь 2004 г.). «UCSF Chimera — система визуализации для поисковых исследований и анализа» (PDF) . Журнал вычислительной химии . 25 (13): 1605–12. дои : 10.1002/jcc.20084 . ПМИД 15264254 . S2CID 8747218 .
Дальнейшее чтение
[ редактировать ]- Джордж Дж (июнь 2008 г.). «Повышенный уровень бета-глюкуронидазы в сыворотке отражает хрупкость лизосом печени после токсического повреждения печени у крыс». Биохимия и клеточная биология . 86 (3): 235–43. дои : 10.1139/O08-038 . ПМИД 18523484 .
- Bell CE, Sly WS, Brot FE (январь 1977 г.). «Мукополисахаридоз с дефицитом бета-глюкуронидазы человека: идентификация перекрестно-реактивного антигена в культивируемых фибробластах пациентов с дефицитом бета-глюкуронидазы с помощью иммуноферментного анализа» . Журнал клинических исследований . 59 (1): 97–105. дои : 10.1172/JCI108627 . ПМЦ 333336 . ПМИД 401508 .
- Танака Дж., Гаса С., Сакурада К., Миядзаки Т., Касаи М., Макита А. (январь 1992 г.). «Характеристика субъединиц и сахарной части плацентарной и лейкемической бета-глюкуронидазы человека». Биологическая химия Хоппе-Сейлера . 373 (1): 57–62. дои : 10.1515/bchm3.1992.373.1.57 . ПМИД 1311180 .
- Вулф Дж.Х., Сэндс М.С., Баркер Дж.Э., Гвинн Б., Роу Л.Б., Фоглер К.А., Биркенмайер Э.Х. (1993). «Обращение патологии при мукополисахаридозе VII типа у мышей путем переноса генов соматических клеток». Природа . 360 (6406): 749–53. дои : 10.1038/360749a0 . ПМИД 1465145 . S2CID 4337590 .
- Томацу С., Фукуда С., Сукегава К., Икедо Ю., Ямада С., Ямада Ю., Сасаки Т., Окамото Х., Кувахара Т., Ямагути С. (январь 1991 г.). «Мукополисахаридоз VII типа: характеристика мутаций и молекулярной гетерогенности» . Американский журнал генетики человека . 48 (1): 89–96. ПМЦ 1682743 . ПМИД 1702266 .
- Шипли Дж.М., Миллер Р.Д., Ву Б.М., Грабб Дж.Х., Кристенсен С.Г., Кайл Дж.В., Слай В.С. (август 1991 г.). «Анализ 5'-фланкирующей области гена бета-глюкуронидазы человека». Геномика . 10 (4): 1009–18. дои : 10.1016/0888-7543(91)90192-H . ПМИД 1916806 .
- Оно М., Танигучи Н., Макита А., Фудзита М., Секия С., Намики М. (апрель 1988 г.). «Фосфорилирование бета-глюкуронидаз нормальной печени и гепатомы человека с помощью цАМФ-зависимой протеинкиназы» . Журнал биологической химии . 263 (12): 5884–9. дои : 10.1016/S0021-9258(18)60648-9 . ПМИД 2833520 .
- Гиз К.С., Корнелюк Р.Г., Уэй Дж., Ламхонва А.М., Куан Ф., Палмер Р., Ганшоу Р.Э., Слай В.С., Гравий Р.А. (1985). «Выделение и экспрессия в Escherichia coli клона кДНК, кодирующего бета-глюкуронидазу человека». Джин . 34 (1): 105–10. дои : 10.1016/0378-1119(85)90300-2 . ПМИД 3924735 .
- Хо YC, Хо LH, Хо KJ (1985). «Бета-глюкуронидаза печени человека: исследование кинетики ферментов». Фермент . 33 (1): 9–17. дои : 10.1159/000469398 . ПМИД 3987656 .
- Шипли Дж. М., Клинкенберг М., Ву Б. М., Бачинский Д. Р., Грабб Дж. Х., Слай В. С. (март 1993 г.). «Мутационный анализ больного мукополисахаридозом VII типа и выявление псевдогенов» . Американский журнал генетики человека . 52 (3): 517–26. ПМЦ 1682147 . ПМИД 7680524 .
- Верворт Р., Лиссенс В., Либерс И. (1994). «Молекулярный анализ пациента с водянкой плода, вызванной дефицитом бета-глюкуронидазы, и доказательства наличия дополнительных псевдогенов» . Человеческая мутация . 2 (6): 443–5. дои : 10.1002/humu.1380020604 . ПМИД 8111412 . S2CID 46432543 .
- Ву Б.М., Хитрый В.С. (1994). «Мутационные исследования у пациентки с водянкой плода формой мукополисахаридоза VII типа» . Человеческая мутация . 2 (6): 446–57. дои : 10.1002/humu.1380020605 . ПМИД 8111413 . S2CID 21484555 .
- Маруяма К., Сугано С. (январь 1994 г.). «Олиго-кэпирование: простой метод замены кэп-структуры эукариотических мРНК олигорибонуклеотидами». Джин . 138 (1–2): 171–4. дои : 10.1016/0378-1119(94)90802-8 . ПМИД 8125298 .
- Мюлье П., Бол Д., Херд Дж. М., Данос О. (июнь 1993 г.). «Коррекция лизосомальных запасов в печени и селезенке мышей MPS VII путем имплантации генетически модифицированных фибробластов кожи». Природная генетика . 4 (2): 154–9. дои : 10.1038/ng0693-154 . ПМИД 8348154 . S2CID 26122567 .
- Шипли Дж. М., Грабб Дж. Х., Слай В. С. (июнь 1993 г.). «Роль гликозилирования и фосфорилирования в экспрессии активной бета-глюкуронидазы человека» . Журнал биологической химии . 268 (16): 12193–8. дои : 10.1016/S0021-9258(19)50325-8 . ПМИД 8505339 .
- Нисимура Ю., Като К., Химено М. (июль 1995 г.). «Биохимическая характеристика микросомальных, Гольджи, лизосомальных и сывороточных бета-глюкуронидаз печени у крыс, получавших дибутилфосфат». Журнал биохимии . 118 (1): 56–66. doi : 10.1093/oxfordjournals.jbchem.a124892 . ПМИД 8537326 .
- Джайн С., Дрендел В.Б., Чен З.В., Мэтьюз Ф.С., Слай В.С., Грабб Дж.Х. (апрель 1996 г.). «Структура бета-глюкуронидазы человека обнаруживает потенциальные лизосомальные нацеливания и мотивы активного центра». Структурная биология природы . 3 (4): 375–81. дои : 10.1038/nsb0496-375 . ПМИД 8599764 . S2CID 28862883 .
- Вервурт Р., Ислам М.Р., Слай В.С., Забот М.Т., Клейер В.Дж., Шабас А., Фенсом А., Янг Э.П., Либерс И., Лиссенс В. (март 1996 г.). «Молекулярный анализ пациентов с дефицитом бета-глюкуронидазы, проявляющимся водянкой плода или ранним мукополисахаридозом VII» . Американский журнал генетики человека . 58 (3): 457–71. ЧВК 1914559 . ПМИД 8644704 .
- Бональдо М.Ф., Леннон Дж., Соарес М.Б. (сентябрь 1996 г.). «Нормализация и вычитание: два подхода к открытию генов» . Геномные исследования . 6 (9): 791–806. дои : 10.1101/гр.6.9.791 . ПМИД 8889548 .
- Дентино А.Р., Радж П.А., Де Нардин Э. (январь 1997 г.). «Незначительные различия между рецепторами нейтрофилов человека и кролика, демонстрируемые секреторной активностью ограниченных формильных пептидов». Архив биохимии и биофизики . 337 (2): 267–74. дои : 10.1006/abbi.1996.9791 . ПМИД 9016822 .
Внешние ссылки
[ редактировать ]- Глюкуронидаза в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)
- Обновленное исследование репортерской глюкуронидазы. Архивировано 21 ноября 2020 г. в Wayback Machine и другими репортерами из Reportergene.
- База данных исследований каталитического механизма и другая информация о бета-глюкуронидазе

![Изображение поверхности кармана активного центра β-глюкуронидазы с показанными каталитическими остатками [1]](http://upload.wikimedia.org/wikipedia/commons/thumb/9/98/Beta_Glucuronidase_Active_Site_Pocket.jpg/225px-Beta_Glucuronidase_Active_Site_Pocket.jpg)
![Изображен механизм гидролиза β-глюкуронидазой сахарного субстрата с высокоэнергетическими переходными состояниями, демонстрирующий характер иона оксокарбения [15]](http://upload.wikimedia.org/wikipedia/commons/thumb/7/76/Mechanism_Of_Beta_Glucuronidase.JPG/225px-Mechanism_Of_Beta_Glucuronidase.JPG)
![Потенциальная стабилизация нуклеофильного остатка Glu540 с помощью Tyr504 в β-глюкуронидазе [16]](http://upload.wikimedia.org/wikipedia/commons/thumb/4/4c/File-Predicted_Tyr_504_activity_in_Beta_Glucuronidase.JPG/225px-File-Predicted_Tyr_504_activity_in_Beta_Glucuronidase.JPG)
![Прогнозируемая активность консервативного остатка Asn450 в стабилизации сахарного субстрата β-глюкуронидазы[11][17]](http://upload.wikimedia.org/wikipedia/commons/thumb/1/1e/Predicted_Asn_450_activity_in_beta_glucuronidase.JPG/175px-Predicted_Asn_450_activity_in_beta_glucuronidase.JPG)
![Потенциальный солевой мостик между Glu352 и Arg216 в бета-глюкуронидазе человека[1][18]](http://upload.wikimedia.org/wikipedia/commons/thumb/8/8e/Possible_Salt_Bridge_Human_Beta_Glucuronidase.jpg/225px-Possible_Salt_Bridge_Human_Beta_Glucuronidase.jpg)
