Солевой мостик (белковый и супрамолекулярный)

В химии представляет солевой мостик собой комбинацию двух нековалентных взаимодействий : водородной связи и ионной связи (рис. 1). Спаривание ионов — одна из наиболее важных нековалентных сил в химии, биологических системах, различных материалах и во многих приложениях, таких как ионно-парная хроматография . Это наиболее часто наблюдаемый вклад в стабильность энтропийно неблагоприятной свернутой конформации белков. Хотя известно, что нековалентные взаимодействия являются относительно слабыми взаимодействиями, небольшие стабилизирующие взаимодействия могут в сумме внести важный вклад в общую стабильность конформера. [1] Солевые мостики встречаются не только в белках, но и в супрамолекулярной химии . Термодинамика каждого из них исследуется с помощью экспериментальных процедур, чтобы оценить вклад свободной энергии солевого мостика в общую свободную энергию состояния.
Солевые мостики в химической связи
[ редактировать ]В воде образование солевых мостиков или ионных пар в основном обусловлено энтропией, обычно сопровождающейся неблагоприятными вкладами ΔH из-за десольватации взаимодействующих ионов при ассоциации. [2] Водородные связи способствуют стабильности ионных пар , например, с протонированными ионами аммония , а с анионами, образующимися при депротонировании, как в случае с карбоксилатом , фосфатом и т. д.; тогда константы ассоциации зависят от pH. Энтропийные движущие силы образования ионных пар (при отсутствии значительного вклада водородных связей) также обнаруживаются в метаноле как растворителе. В неполярных растворителях контактные ионные пары с очень высокими константами ассоциации; образуются [3] [4] в газовой фазе энергии ассоциации, например, галогенидов щелочных металлов достигают 200 кДж/моль. [5] или Уравнение Бьеррума уравнение Фуосса описывают ассоциацию ионных пар в зависимости от зарядов ионов zA и zB и диэлектрической проницаемости среды ε; соответствующий график стабильности ΔG в зависимости от zAzB показывает для более чем 200 пар ионов ожидаемую линейную корреляцию для большого количества ионов. [6] Неорганические, а также органические ионы проявляют умеренную ионную силу. I аналогичная ассоциация солевых мостиков. Значения ΔG составляют от 5 до 6 кДж / моль для комбинации аниона и катиона 1: 1, почти независимо от природы (размера, поляризуемости и т. д.) ионов. . [7] [8] Значения ΔG являются аддитивными и приблизительно линейными функциями зарядов, взаимодействие, например, двухзарядного фосфат-аниона с однозарядным катионом аммония составляет около 2x5 = 10 кДж/моль. Значения ΔG зависят от ионной силы I раствора, как это описывается уравнением Дебая–Хюккеля , при нулевой ионной силе наблюдается ΔG = 8 кДж/моль. Стабильность пар щелочных ионов в зависимости от заряда аниона z можно описать более детальным уравнением. [9]
Солевые мостики обнаружены в белках
[ редактировать ]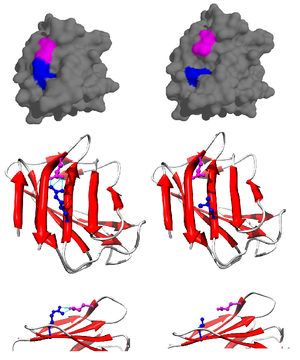
Солевой мостик чаще всего образуется из анионного карбоксилата (RCOO − ) либо аспарагиновой кислоты , либо глутаминовой кислоты и катионного аммония (RNH 3 + ) из лизина или гуанидиния (RNHC(NH 2 ) 2 + ) аргинина (рис. 2). [1] Хотя они являются наиболее распространенными, другие остатки с ионизируемыми боковыми цепями, такие как гистидин , тирозин и серин, также могут участвовать, в зависимости от внешних факторов, нарушающих pKa их . Расстояние между остатками, участвующими в солевом мостике, также считается важным. Требуемое расстояние NO составляет менее 4 Å (400 пм). Аминокислоты, находящиеся на расстоянии больше этого расстояния друг от друга, не могут образовывать солевой мостик. [11] Из-за многочисленных ионизируемых боковых цепей аминокислот, присутствующих в белке, pH, при котором находится белок, имеет решающее значение для его стабильности.
Солевые мостики обнаружены в белково-лигандных комплексах
[ редактировать ]Солевые мостики также могут образовываться между белком и лигандами малых молекул. Было обнаружено, что более 1100 уникальных белково-лигандных комплексов из банка данных белков образуют солевые мостики со своими белками-мишенями, что указывает на то, что солевые мостики часто встречаются при взаимодействии лекарственного средства с белком. [12] Они содержат структуры из разных классов ферментов, включая гидролазу, трансферазы, киназы, редуктазу, оксидоредуктазу, лиазы и рецепторы, связанные с G-белком (GPCR).
Методы количественной оценки стабильности солевых мостиков в белках
[ редактировать ]
Вклад солевого мостика в общую стабильность свернутого состояния белка можно оценить с помощью термодинамических данных, полученных в результате исследований мутагенеза и методов ядерного магнитного резонанса. [13] Используя мутированный белок псевдодикого типа, специально мутированный для предотвращения осаждения при высоком pH, вклад солевого мостика в общую свободную энергию свернутого состояния белка можно определить путем проведения точечной мутации, изменяющей и, следовательно, разрушающей соль. мост. Например, было обнаружено наличие солевого мостика в лизоциме Т4 между аспарагиновой кислотой (Asp) в остатке 70 и гистидином (His) в остатке 31 (рис. 3). Был проведен сайт-направленный мутагенез с аспарагином (Asn) (рис. 4) с получением трех новых мутантов: Asp70Asn His31 (мутант 1), Asp70 His31Asn (мутант 2) и Asp70Asn His31Asn (двойной мутант).

После установления мутантов можно использовать два метода для расчета свободной энергии, связанной с солевым мостиком. Один метод включает наблюдение температуры плавления белка дикого типа по сравнению с температурой плавления трех мутантов. За денатурацией можно следить по изменению кругового дихроизма . Снижение температуры плавления указывает на снижение стабильности. Это количественно определяется с помощью метода, описанного Бектелем и Шеллманом, где разница свободной энергии между ними рассчитывается через Δ T Δ S . [14] С этим расчетом есть некоторые проблемы, и его можно использовать только с очень точными данными. [ нужна ссылка ] В примере с лизоцимом Т4 ранее сообщалось о Δ S псевдодикого типа при pH 5,5, поэтому разница температур средней точки в 11 °C при этом pH умножается на заявленное значение Δ S, равное 360 кал/(моль·К) ( 1,5 кДж/(моль·К)) дает изменение свободной энергии примерно -4 ккал/моль (-17 кДж/моль). Это значение соответствует количеству свободной энергии, вносимой солевым мостиком в стабильность белка.

Второй метод использует спектроскопию ядерного магнитного резонанса для расчета свободной энергии солевого мостика. Титрование проводят, регистрируя при этом химический сдвиг, соответствующий протонам углерода, соседнего с карбоксилатной или аммониевой группой. Средняя точка кривой титрования соответствует p K a или pH, при котором соотношение протонированных: депротонированных молекул составляет 1:1. Продолжая пример с лизоцимом Т4, кривую титрования получают путем наблюдения за сдвигом протона С2 гистидина 31 (рис. 5). На фигуре 5 показано смещение кривой титрования между диким типом и мутантом, в котором Asp70 представляет собой Asn. Образующийся солевой мостик находится между депротонированным Asp70 и протонированным His31. Это взаимодействие вызывает сдвиг, наблюдаемый в p K a His31 . Сообщается, что в развернутом белке дикого типа, где солевой мостик отсутствует, His31 имеет ap K a 6,8 в H 2 O-буферах умеренной ионной силы. На фигуре 5 показано ap K a дикого типа 9,05. Эта разница в п K a поддерживается взаимодействием His31 с Asp70. Чтобы сохранить солевой мостик, His31 попытается сохранить свой протон как можно дольше. Когда солевой мостик разрушается, как у мутанта D70N, p K a возвращается к значению 6,9, что намного ближе к значению His31 в развернутом состоянии.
Разницу в p K a можно определить количественно, чтобы отразить вклад солевого мостика в свободную энергию. Использование свободной энергии Гиббса :Δ G = − RT ln( K eq ), где R — универсальная газовая постоянная, T — температура в кельвинах, а K eq — константа равновесия реакции в равновесии. Депротонирование His31 представляет собой кислотную равновесную реакцию со специальным K eq, известным как константа диссоциации кислоты , K a : His31-H. + ⇌ Хис31 + Н + . Тогда p K a связан с K a следующим образом: p K a = −log( K a ). Расчет разницы свободной энергии мутанта и дикого типа теперь может быть выполнен с использованием уравнения свободной энергии, определения p K a , наблюдаемых значений p K a и соотношения между натуральными логарифмами и логарифмами. В примере с лизоцимом Т4 этот подход дал расчетный вклад около 3 ккал/моль в общую свободную энергию. [13] Аналогичный подход можно применить и к другому участнику солевого мостика, такому как Asp70 в примере с лизоцимом T4, путем мониторинга его сдвига в pKa после мутации His31.
Предостережение при выборе подходящего эксперимента касается расположения солевого мостика внутри белка. Окружение играет большую роль во взаимодействии. [15] При высокой ионной силе солевой мостик может быть полностью замаскирован, поскольку задействовано электростатическое взаимодействие. Солевой мостик His31-Asp70 в лизоциме Т4 был скрыт внутри белка. Энтропия играет более важную роль в поверхностных солевых мостиках, где остатки, которые обычно обладают способностью двигаться, сжимаются из-за электростатического взаимодействия и водородных связей. Было показано, что это уменьшает энтропию настолько, что почти стирает вклад взаимодействия. [16] Поверхностные солевые мостики можно изучать так же, как и похороненные солевые мостики, используя циклы двойных мутантов и ЯМР-титрование. [17] Хотя существуют случаи, когда погребенные соляные мостики, как и все остальное, способствуют стабильности, существуют исключения, и погребенные соляные мостики могут оказывать дестабилизирующее воздействие. [11] Кроме того, поверхностные солевые мостики при определенных условиях могут оказывать стабилизирующее действие. [15] [17] Стабилизирующий или дестабилизирующий эффект должен оцениваться в каждом конкретном случае, и однозначных заявлений сделать мало.
Супрамолекулярная химия
[ редактировать ]

Супрамолекулярная химия — это область, изучающая нековалентные взаимодействия между макромолекулами. Солевые мостики использовались химиками в этой области разнообразными и творческими способами, включая определение анионов, синтез молекулярных капсул и двойных спиральных полимеров.
Анионное комплексообразование
[ редактировать ]Основные достижения супрамолекулярной химии были посвящены распознаванию и обнаружению анионов. [18] [19] [20] [21] [22] [23] Спаривание ионов является наиболее важной движущей силой образования анионных комплексов, но селективность, например, в пределах галогенидного ряда достигается, главным образом, за счет вклада водородных связей.
Молекулярные капсулы
[ редактировать ]Молекулярные капсулы — это химические каркасы, предназначенные для захвата и удержания молекулы-гостя (см. « Молекулярная инкапсуляция »). Шумна и его коллеги разработали новую молекулярную капсулу с хиральным внутренним пространством. [24] Эта капсула состоит из двух половинок, как пластиковое пасхальное яйцо (рис. 6). Взаимодействие солевых мостиков между двумя половинками приводит к их самосборке в растворе (рис. 7). Они стабильны даже при нагревании до 60°C.
Двойные спиральные полимеры
[ редактировать ]Яшима и его коллеги использовали солевые мостики для создания нескольких полимеров, которые принимают конформацию двойной спирали, очень похожую на ДНК . [25] В одном примере они включили платину для создания двухспирального металлополимера. [26] Начиная с мономера и бифенила платины(II) (рис. 8), их металлополимеры самособираются посредством серии реакций обмена лигандов . Две половины мономера скреплены вместе через солевой мостик между депротонированным карбоксилатом и протонированными атомами азота.

Ссылки
[ редактировать ]- ^ Jump up to: а б Догерти, Деннис А. (2006). Современная физико-органическая химия . Саусалито, Калифорния: Университетские научные книги. ISBN 978-1-891389-31-3 .
- ^ Маркус Ю., Хефтер Дж. (ноябрь 2006 г.). «Ионное спаривание». Химические обзоры . 106 (11): 4585–621. дои : 10.1021/cr040087x . ПМИД 17091929 .
- ^ Айзекс Н. (1996). Физическая органическая химия (2-е изд.). Англия: Лонгманс. ISBN 978-0582218635 . [ нужна страница ]
- ^ Ионные взаимодействия в природных и синтетических макромолекулах (А. Чиферри и А. Перико, ред.), 2012 John Wiley & Sons, Inc., стр. 2012. 35 и далее ISBN 978-0-470-52927-0 .
- ^ Чейз МВт (1998). Термохимические таблицы NIST-JANAF . Дж. Физ. хим. Ссылка. Данные. Том. Монография 9 (Четвертое изд.). стр. 1–1951.
- ^ Шнайдер Х.Дж., Яцимирский А.К., ред. (2000). Принципы и методы супрамолекулярной химии . Чичестер: Уайли. ISBN 978-0-471-97253-2 . [ нужна страница ]
- ^ Бидерманн Ф., Шнайдер Х.Дж. (май 2016 г.). «Экспериментальные энергии связи в супрамолекулярных комплексах». Химические обзоры . 116 (9): 5216–300. doi : 10.1021/acs.chemrev.5b00583 . ПМИД 27136957 .
- ^ Шнайдер Х.Дж. (2009). «Механизмы связывания в супрамолекулярных комплексах». Ангеванде Хеми . 48 (22): 3924–77. дои : 10.1002/anie.200802947 . ПМИД 19415701 .
- ^ Даниэле П.Г., Фоти С., Джангуцца А., Пренести Э., Саммартано С. (2008). «Слабые комплексы щелочных и щелочноземельных металлов с низкомолекулярными лигандами в водных растворах». Обзоры координационной химии . 252 (10–11): 1093–1107. дои : 10.1016/j.ccr.2007.08.005 .
- ^ Аль-Хаггар М., Мадей-Пиларчик А., Козловски Л., Буйницкий Дж.М., Яхья С., Абдель-Хади Д., Шамс А., Ахмад Н., Хамед С., Пузяновска-Кузницка М. (ноябрь 2012 г.). «Новая гомозиготная мутация LMNA p.Arg527Leu в двух неродственных египетских семьях вызывает перекрывающуюся нижнечелюстно-акральную дисплазию и синдром прогерии» . Европейский журнал генетики человека . 20 (11): 1134–40. дои : 10.1038/ejhg.2012.77 . ПМЦ 3476705 . ПМИД 22549407 .
- ^ Jump up to: а б Кумар С., Нусинов Р. (июль 2002 г.). «Близкие электростатические взаимодействия в белках». ХимБиоХим . 3 (7): 604–17. doi : 10.1002/1439-7633(20020703)3:7<604::AID-CBIC604>3.0.CO;2-X . ПМИД 12324994 .
- ^ Курчаб, Рафал; Слива, Павел; Ратай, Кшиштоф; Кафель, Рафал; Боярский, Анджей Ю. (26 ноября 2018 г.). «Солевой мостик в лиганд-белковых комплексах – систематические теоретические и статистические исследования» . Журнал химической информации и моделирования . 58 (11): 2224–2238. doi : 10.1021/acs.jcim.8b00266 . ISSN 1549-960X . ПМИД 30351056 .
- ^ Jump up to: а б Андерсон Д.Е., Бектель В.Дж., Далквист Ф.В. (март 1990 г.). «РН-индуцированная денатурация белков: один солевой мостик вносит 3-5 ккал/моль в свободную энергию сворачивания лизоцима Т4». Биохимия . 29 (9): 2403–8. дои : 10.1021/bi00461a025 . ПМИД 2337607 .
- ^ Бектель В.Дж., Шеллман Дж.А. (ноябрь 1987 г.). «Кривые стабильности белка». Биополимеры . 26 (11): 1859–77. дои : 10.1002/bip.360261104 . ПМИД 3689874 .
- ^ Jump up to: а б Горовиц А., Серрано Л., Аврон Б., Байкрофт М., Фершт А.Р. (декабрь 1990 г.). «Сила и взаимодействие вкладов поверхностных солевых мостиков в стабильность белка». Журнал молекулярной биологии . 216 (4): 1031–44. дои : 10.1016/S0022-2836(99)80018-7 . ПМИД 2266554 .
- ^ Сан Д.П., Зауэр У., Николсон Х., Мэтьюз Б.В. (июль 1991 г.). «Вклад сконструированных поверхностных солевых мостиков в стабильность лизоцима Т4, определяемый направленным мутагенезом». Биохимия . 30 (29): 7142–53. дои : 10.1021/bi00243a015 . ПМИД 1854726 .
- ^ Jump up to: а б Строп П., Мэйо С.Л. (февраль 2000 г.). «Вклад поверхностных солевых мостиков в стабильность белка» (PDF) . Биохимия . 39 (6): 1251–5. дои : 10.1021/bi992257j . ПМИД 10684603 .
- ^ Бьянки А., Боуман-Джеймс К., Гарсия-Эспанья Э., ред. (1997). Супрамолекулярная химия анионов . Нью-Йорк: Wiley-VCH. ISBN 9780471186229 .
- ^ Боуман-Джеймс К., Бьянки А., Гарсиа-Эспана Э., ред. (2012). Анионно-координационная химия . Вайнхайм: Wiley-VCH. ISBN 978-3527323708 .
- ^ Сесслер Дж.Л., Гейл П.А., Чо В.С., ред. (2006). Химия анионных рецепторов . Кембридж: Королевское химическое общество. ISBN 978-0854049745 .
- ^ Гейл П.А., Дехаен В., ред. (2010). Распознавание анионов в супрамолекулярной химии . Спрингер Наука. Бибкод : 2010arsc.book.....G . ISBN 978-3642264702 .
- ^ Бушхарт Н., Кальтаджироне С., Ван Россом В., Гейл П.А. (май 2015 г.). «Применения супрамолекулярного распознавания анионов» . Химические обзоры . 115 (15): 8038–155. doi : 10.1021/acs.chemrev.5b00099 . ПМИД 25996028 .
- ^ Эванс, Нью-Хэмпшир, Beer PD (октябрь 2014 г.). «Достижения в анионной супрамолекулярной химии: от признания к химическому применению» (PDF) . Angewandte Chemie, международное издание . 53 (44): 11716–54. дои : 10.1002/anie.201309937 . ПМИД 25204549 .
- ^ Куберски Б., Шумна А. (апрель 2009 г.). «Самособранная хиральная капсула с полярной внутренней частью». Химические коммуникации (15): 1959–61. дои : 10.1039/b820990a . ПМИД 19333456 .
- ^ Лю Дж., Лам Дж.В., Тан Б.З. (ноябрь 2009 г.). «Ацетиленовые полимеры: синтез, структура и функции». Химические обзоры . 109 (11): 5799–867. дои : 10.1021/cr900149d . ПМИД 19678641 .
- ^ Икеда М., Танака Ю., Хасегава Т., Фурушо Ю., Яшима Э. (май 2006 г.). «Построение двухцепочечных металлосупрамолекулярных полимеров с контролируемой спиральностью путем сочетания солевых мостиков и координации металлов». Журнал Американского химического общества . 128 (21): 6806–7. дои : 10.1021/ja0619096 . ПМИД 16719458 .