Лиганд

В координационной лиганд химии [а] представляет собой ион или молекулу с функциональной группой , которая связывается с центральным атомом металла с образованием координационного комплекса . лиганда Соединение с металлом обычно предполагает формальную передачу одной или нескольких электронных пар , часто через основания Льюиса . [1] Характер связи металл-лиганд может варьироваться от ковалентной до ионной . При этом порядок связи металл-лиганд может варьироваться от одного до трех. Лиганды рассматриваются как основания Льюиса, хотя известно, что в редких случаях используются кислотные «лиганды Льюиса». [2] [3]
Металлы и металлоиды связаны с лигандами почти во всех случаях, хотя газообразные «голые» ионы металлов могут генерироваться в высоком вакууме. Лиганды в комплексе определяют реакционную способность центрального атома, включая скорость замещения лигандов, реакционную способность самих лигандов и окислительно-восстановительный потенциал . Выбор лиганда требует критического рассмотрения во многих практических областях, включая бионеорганическую и медицинскую химию , гомогенный катализ и химию окружающей среды .
Лиганды классифицируются по-разному, в том числе: по заряду, размеру (объему), идентичности координирующего атома (атомов) и количеству электронов, отданных металлу ( дентатность или гаптичность ). Размер лиганда определяется углом его конуса .
История
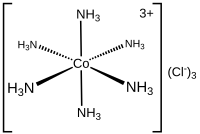
[ редактировать ]Состав координационных комплексов известен с начала 1800-х годов, таких как берлинская лазурь и медный купорос . Ключевой прорыв произошел, когда Альфред Вернер согласовал формулы и изомеры . Он показал, среди прочего, что формулы многих соединений кобальта (III) и хрома (III) можно понять, если металл имеет шесть лигандов в октаэдрической геометрии . Первыми, кто использовал термин «лиганд», были Альфред Вернер и Карл Сомиски применительно к химии кремния. Теория позволяет понять разницу между координированным и ионным хлоридом в хлоридах аммиака кобальта и объяснить многие ранее необъяснимые изомеры. Он разделил первый координационный комплекс, названный гексолом, на оптические изомеры, опровергнув теорию о том, что хиральность обязательно связана с соединениями углерода. [4] [5]
Лиганды сильного и слабого поля.
[ редактировать ]В общем, лиганды рассматриваются как доноры электронов, а металлы как акцепторы электронов, т.е. соответственно основания Льюиса и кислоты Льюиса . Это описание было полуколичественно выражено во многих отношениях, например, в модели ECW . Связь часто описывается с использованием формализмов теории молекулярных орбиталей. [6] [7]
Лиганды и ионы металлов можно упорядочить разными способами; одна система ранжирования фокусируется на «твердости» лиганда (см. также теорию твердой/мягкой кислоты/основания ). Ионы металлов преимущественно связывают определенные лиганды. В общем, ионы «жестких» металлов предпочитают лиганды слабого поля, тогда как ионы «мягких» металлов предпочитают лиганды сильного поля. Согласно теории молекулярных орбиталей, ВЗМО (высшая занятая молекулярная орбиталь) лиганда должна иметь энергию, которая перекрывается с НСМО (самая низкая незанятая молекулярная орбиталь) предпочтительного металла. Ионы металлов, связанные с лигандами сильного поля, подчиняются принципу Ауфбау , тогда как комплексы, связанные с лигандами слабого поля, следуют правилу Хунда .
Связывание металла с лигандами приводит к образованию набора молекулярных орбиталей, где металл можно идентифицировать с новыми ВЗМО и НСМО (орбитали, определяющие свойства и реакционную способность образующегося комплекса) и определенному упорядочению 5 d-орбиталей. (который может быть заполнен или частично заполнен электронами). В октаэдрической среде пять вырожденных d-орбиталей разделяются на наборы по 3 и 2 орбитали (более подробное объяснение см. в теории кристаллического поля ):
- 3 орбитали низкой энергии: d xy , d xz и d yz и
- 2 орбитали высокой энергии: d z 2 и d х 2 − и 2 .
Разница в энергии между этими двумя наборами d-орбиталей называется параметром расщепления Δ o . Величина Δ o определяется напряженностью поля лиганда: лиганды сильного поля по определению увеличивают Δ o больше, чем лиганды слабого поля. Лиганды теперь можно сортировать по величине Δ o (см. таблицу ниже ). Такое упорядочение лигандов почти неизменно для всех ионов металлов и называется спектрохимическим рядом .
Для комплексов с тетраэдрическим окружением d-орбитали снова распадаются на два набора, но на этот раз в обратном порядке:
- 2 орбитали низкой энергии: d z 2 и d х 2 − и 2 и
- 3 орбитали высокой энергии: d xy , d xz и d yz .
Разница в энергии между этими двумя наборами d-орбиталей теперь называется Δt . Величина Δt меньше , чем для Δo , поскольку в тетраэдрическом комплексе на d-орбитали влияют только 4 лиганда, тогда как в октаэдрическом комплексе на d-орбитали влияют 6 лигандов. Когда координационное число не является ни октаэдрическим, ни тетраэдрическим, расщепление становится соответственно более сложным. свойства октаэдрических комплексов и образующаяся в результате Δo . Однако для целей ранжирования лигандов первоочередной интерес представляли
Расположение d-орбиталей на центральном атоме (определяемое «силой» лиганда) оказывает сильное влияние практически на все свойства образующихся комплексов. Например, разница в энергии d-орбиталей оказывает сильное влияние на спектры оптического поглощения металлокомплексов. Оказывается, что валентные электроны, занимающие орбитали со значительным 3d-орбитальным характером, поглощают в области спектра 400–800 нм ( УФ–видимый диапазон). Поглощение света (то, что мы воспринимаем как цвет ) этими электронами (то есть возбуждение электронов с одной орбитали на другую орбиталь под воздействием света) можно соотнести с основным состоянием металлокомплекса, которое отражает связывающие свойства лигандов. Относительное изменение (относительной) энергии d-орбиталей в зависимости от напряженности поля лигандов описывается диаграммами Танабе – Сугано .
В тех случаях, когда лиганд имеет низкую энергию НСМО, такие орбитали также участвуют в связывании. Связь металл-лиганд может быть дополнительно стабилизирована за счет формальной передачи электронной плотности обратно лиганду в процессе, известном как обратная связь . В этом случае заполненная орбиталь на основе центрального атома передает плотность НСМО (координированного) лиганда. Оксид углерода является ярким примером лиганда, который связывает металлы посредством обратного донорства. Дополнительно пи-донором могут служить лиганды с низкоэнергетическими заполненными орбиталями пи-симметрии.

Классификация лигандов как L и X
[ редактировать ]Лиганды классифицируются по количеству электронов, которые они «отдают» металлу. Лиганды L представляют собой основания Льюиса . Лиганды L представлены аминами , фосфинами , CO , N 2 и алкенами . Примеры лигандов L включают диводород и углеводороды, которые взаимодействуют посредством агостических взаимодействий . Лиганды X представляют собой галогениды и псевдогалогениды . Лиганды X обычно происходят из анионных предшественников, таких как хлорид, но включают лиганды, в которых соли аниона на самом деле не существуют, такие как гидрид и алкил. [8] [9]
В частности, в области металлоорганической химии лиганды классифицируются в соответствии с «методом CBC» для классификации ковалентных связей, популяризированным МЛХ Грином и «основанным на представлении о том, что существует три основных типа [лигандов]... представленных символы L, X и Z, которые соответствуют соответственно 2-электронным, 1-электронным и 0-электронным нейтральным лигандам». [10] [11]
Полидентатные и полигаптолигандные мотивы и номенклатура
[ редактировать ]дентатность
[ редактировать ]Многие лиганды способны связывать ионы металлов через несколько сайтов, обычно потому, что лиганды имеют неподеленные пары более чем на одном атоме. Такие лиганды полидентатны. [12] Лиганды, которые связываются более чем одним атомом, часто называют хелатирующими . Лиганд, который связывается через два сайта, классифицируется как бидентатный , а три сайта — как тридентатный . « Угол прикуса » относится к углу между двумя связями бидентатного хелата. Хелатирующие лиганды обычно образуются путем связывания донорных групп посредством органических линкеров. Классическим бидентатным лигандом является этилендиамин , который получается путем связывания двух аммиачных групп этиленовым (-CH 2 CH 2 -) линкером. Классическим примером полидентатного лиганда является гексадентатный хелатирующий агент ЭДТА , который способен связываться через шесть участков, полностью окружая некоторые металлы. Количество раз, когда полидентатный лиганд связывается с металлическим центром, обозначается « κ н ", где n указывает количество мест, с помощью которых лиганд присоединяется к металлу. ЭДТА 4− , когда он шестидентантен, связывается как κ 6 -лиганд, амины и атомы кислорода карбоксилата не смежны. На практике значение n лиганда не указывается явно, а скорее предполагается. Сродство связывания хелатной системы зависит от угла хелатирования или угла прикуса .
Дентичность (обозначенная κ ) — это номенклатура, описывающая количество несмежных атомов лиганда, связанных с металлом. Этот дескриптор часто опускается, поскольку дентальность лиганда часто очевидна. Комплекс трис(этилендиамин)кобальта(III) можно описать как [Co(κ 2 -ru) 3 ] 3+ .
Комплексы полидентатных лигандов называются хелатными комплексами. Они имеют тенденцию быть более стабильными, чем комплексы, полученные из монодентатных лигандов. Эта повышенная стабильность, называемая хелатным эффектом , обычно объясняется эффектами энтропии , которая способствует смещению многих лигандов одним полидентатным лигандом.
С хелатным эффектом связан макроциклический эффект . Макроциклический лиганд — это любой крупный лиганд, который хотя бы частично окружает центральный атом и связывается с ним, оставляя центральный атом в центре большого кольца. Чем жестче и выше его дентатность, тем более инертным будет макроциклический комплекс. Гем является примером, в котором атом железа находится в центре порфиринового макроцикла, связанного с четырьмя атомами азота тетрапиррольного макроцикла. Очень стабильный диметилглиоксиматный комплекс никеля представляет собой синтетический макроцикл, полученный из диметилглиоксима .
Тактильность
[ редактировать ]Гаптичность (обозначенная греческой буквой η ) относится к числу смежных атомов, которые составляют донорный участок и прикрепляются к металлическому центру. Обозначение η применяется, когда координировано несколько атомов. Например, η 2 представляет собой лиганд, который координирует свои действия через два смежных атома. Бутадиен образует оба η 2 и η 4 комплексы в зависимости от числа атомов углерода, связанных с металлом. [13] [14] [15]
Лигандные мотивы
[ редактировать ]Этот раздел нуждается в дополнительных цитатах для проверки . ( январь 2021 г. ) |
Транс-связывающие лиганды
[ редактировать ]Транс-связывающие лиганды представляют собой бидентатные лиганды, которые могут занимать координационные позиции на противоположных сторонах координационного комплекса. [16]
Амбидентатный лиганд
[ редактировать ]В отличие от полидентатных лигандов амбидентатные лиганды могут прикрепляться к центральному атому в любом из двух (или более) мест, но не в обоих. Примером является тиоцианат , SCN. − , который может присоединяться либо к атому серы, либо к атому азота. Такие соединения вызывают изомерию сцепления .
Таким образом, полидентат и амбидентат представляют собой два разных типа полифункциональных лигандов (лиганды с более чем одной функциональной группой ), которые могут связываться с металлическим центром через разные атомы лиганда с образованием различных изомеров. Полидентатные лиганды могут связываться через один атом И другой (или несколько других) одновременно, тогда как амбидентатные лиганды могут связываться через один атом ИЛИ другой. Белки представляют собой сложные примеры полифункциональных лигандов, обычно полидентатных.
Мостиковый лиганд
[ редактировать ]Мостиковый лиганд связывает два или более металлоцентра. Практически все неорганические твердые вещества с простыми формулами представляют собой координационные полимеры , состоящие из центров ионов металлов, связанных мостиковыми лигандами. В эту группу материалов входят все безводные бинарные галогениды и псевдогалогениды металлов. Мостиковые лиганды также сохраняются в растворе. Многоатомные лиганды, такие как карбонат , являются амбидентатными и поэтому часто связываются с двумя или тремя металлами одновременно. Атомы, соединяющие металлы, иногда обозначаются префиксом « μ ». Большинство неорганических твердых веществ являются полимерами благодаря наличию множества мостиковых лигандов. Мостиковые лиганды, способные координировать несколько ионов металлов, привлекают значительный интерес из-за их потенциального использования в качестве строительных блоков для изготовления функциональных мультиметаллических ансамблей. [17]
Двуядерный лиганд
[ редактировать ]Биядерные лиганды связывают два иона металлов. [18] Обычно двуядерные лиганды содержат мостиковые лиганды, такие как феноксид, пиразолат или пиразин, а также другие донорные группы, которые связываются только с одним из двух ионов металлов.
Кратная связь металл-лиганд
[ редактировать ]Некоторые лиганды могут связываться с металлическим центром через один и тот же атом, но с разным числом неподеленных пар . Порядок связи металл-лиганд можно частично определить по углу связи металл-лиганд (M-X-R). Этот валентный угол часто называют линейным или изогнутым, с дальнейшим обсуждением степени, в которой угол изогнут. Например, имидо-лиганд в ионной форме имеет три неподеленные пары. Одна неподеленная пара используется в качестве донора сигма-X, две другие неподеленные пары доступны в качестве доноров pi L-типа. Если обе неподеленные пары используются в пи-связях, то геометрия M-N-R является линейной. Однако если одна или обе эти неподеленные пары не являются связующими, то связь M-N-R искривляется, и степень изгиба говорит о том, насколько сильной может быть пи-связь. η 1 - Оксид азота может координироваться с металлическим центром линейным или изогнутым образом.
Зрительский лиганд
[ редактировать ]Лиганд-спектатор — это сильно координирующийся полидентатный лиганд, который не участвует в химических реакциях, но удаляет активные центры на металле. Лиганды-спектаторы влияют на реакционную способность металлоцентра, с которым они связаны.
Объемные лиганды
[ редактировать ]Объемные лиганды используются для управления стерическими свойствами металлоцентра. Они используются по многим причинам, как практическим, так и академическим. С практической стороны они влияют на селективность металлических катализаторов, например, при гидроформилировании . Представляет академический интерес объемистые лиганды, которые стабилизируют необычные координационные центры, например, реакционноспособные колиганды или низкие координационные числа. Часто объемистые лиганды используются для моделирования стерической защиты, обеспечиваемой белками металлосодержащим активным центрам. Конечно, чрезмерная стерическая масса может препятствовать координации определенных лигандов.

Хиральные лиганды
[ редактировать ]Хиральные лиганды полезны для индукции асимметрии внутри координационной сферы. Часто лиганд используют в виде оптически чистой группы. В некоторых случаях, например, в случае вторичных аминов, асимметрия возникает при координации. Хиральные лиганды используются в гомогенном катализе , например асимметричном гидрировании .
Гемилабильные лиганды
[ редактировать ]Гемилабильные лиганды содержат по крайней мере две электронно различные координационные группы и образуют комплексы, в которых одна из них легко вытесняется из металлического центра, а другая остается прочно связанной, что, как было обнаружено, увеличивает реакционную способность катализаторов по сравнению с использованием более традиционные лиганды.
Невинный лиганд
[ редактировать ]Неиннокентные лиганды связываются с металлами таким образом, что распределение электронной плотности между металлическим центром и лигандом неясно. Описание связывания невинных лигандов часто включает в себя описание нескольких резонансных форм , которые вносят частичный вклад в общее состояние.
Общие лиганды
[ редактировать ]Этот раздел нуждается в дополнительных цитатах для проверки . ( январь 2021 г. ) |
Практически каждая молекула и каждый ион могут служить лигандом (или «координировать») металлов. К монодентатным лигандам относятся практически все анионы и все простые основания Льюиса. Таким образом, галогениды и псевдогалогениды являются важными анионными лигандами, тогда как аммиак , окись углерода и вода являются особенно распространенными лигандами с нейтральным зарядом. Простые органические соединения также очень распространены, будь то анионные ( RO − и РКО −
2 ) или нейтральный ( R 2 O , R 2 S , R 3− x NH x и R 3 P ). Стерические свойства некоторых лигандов оценивают по углам их конусов .
Помимо классических оснований и анионов Льюиса, все ненасыщенные молекулы также являются лигандами, используя свои пи-электроны для образования координатной связи. Кроме того, металлы могут связываться с σ-связями, например, в силанах , углеводородах и диводороде (см. Также: Агостическое взаимодействие ).
В комплексах неиннокентных лигандов лиганд связан с металлами обычными связями, но лиганд также обладает окислительно-восстановительной активностью.
Примеры общих лигандов (по напряженности поля)
[ редактировать ]В следующей таблице лиганды отсортированы по напряженности поля. [ нужна ссылка ] (сначала лиганды слабого поля):
| Лиганд | формула (связывающий атом(ы) выделен жирным шрифтом) | Заряжать | Наиболее распространенная дентальность | Замечание(я) |
|---|---|---|---|---|
| Йодид (йод) | я − | моноанионный | монодентатный | |
| Бромид (бромидо) | Бр − | моноанионный | монодентатный | |
| Сульфид (тио или реже «мостиковый тиолат») | С 2− | дианионный | монодентатный (M = S) или бидентатный мостик (M-S-M') | |
| Тиоцианат ( S -тиоцианат) | S -CN − | моноанионный | монодентатный | амбидентат (см. также изотиоцианат ниже) |
| Хлорид (Хлорид) | кл. − | моноанионный | монодентатный | также нашел перемычку |
| Нитрат (нитрато) | ИЛИ − НЕТ − 2 | моноанионный | монодентатный | |
| Азид (кислота) | Н - Н − 2 | моноанионный | монодентатный | Очень токсично |
| Фторид (фтор) | Ф − | моноанионный | монодентатный | |
| Гидроксид (гидроксидо) | О - Н − | моноанионный | монодентатный | часто встречается в качестве мостикового лиганда |
| Оксалат (оксалат) | [ О -СО-СО- О ] 2− | дианионный | двузубый | |
| Вода (аква) | О -Н 2 | нейтральный | монодентатный | |
| Нитрит (нитрито) | О -Н-О − | моноанионный | монодентатный | амбидентат (см. также нитро) |
| Изотиоцианат (изотиоцианат) | Н =С=С − | моноанионный | монодентатный | амбидентат (см. также тиоцианат выше) |
| Ацетонитрил (ацетонитрил) | СН 3 С Н | нейтральный | монодентатный | |
| Пиридин (py) | С 5 Ч 5 Н | нейтральный | монодентатный | |
| Аммиак (аммиак или реже «аммиак») | NHNH3 | нейтральный | монодентатный | |
| Этилендиамин (en) | Н Ч 2 -СН 2 -СН 2 - Н Ч 2 | нейтральный | двузубый | |
| 2,2'-Бипиридин (бипи) | Н С 5 Ч 4 −С 5 Ч 4 Н | нейтральный | двузубый | легко восстанавливается до своего (радикального) аниона или даже до своего дианиона |
| 1,10-Фенантролин (фен) | С 12 Ч 8 Н 2 | нейтральный | двузубый | |
| Нитрит (нитро) | Н - О − 2 | моноанионный | монодентатный | амбидентатный (см. также нитрито) |
| Трифенилфосфин | п - (С 6 ЧАС 5 ) 3 | нейтральный | монодентатный | |
| Цианид (циано) | C ≡N − N ≡C − | моноанионный | монодентатный | может соединять металлы (оба металла связаны с C или один с C и один с N) |
| Оксид углерода (карбонил) | – КО , другие | нейтральный | монодентатный | может соединять металлы (оба металла связаны с C) |
Записи в таблице отсортированы по напряженности поля, связыванию через указанный атом (т.е. как концевой лиганд). «Сила» лиганда меняется, когда лиганд связывается альтернативным способом связывания (например, когда он образует мостик между металлами) или когда конформация лиганда искажается (например, линейный лиганд, который в результате стерических взаимодействий вынужден связываться в нелинейная мода).
Другие часто встречающиеся лиганды (в алфавитном порядке)
[ редактировать ]В этой таблице другие распространенные лиганды перечислены в алфавитном порядке.
| Лиганд | Формула (связывающий атом(ы) выделен жирным шрифтом) | Заряжать | Наиболее распространенная дентальность | Замечание(я) |
|---|---|---|---|---|
| Ацетилацетонат (acac) | СН 3 -С О -СН 2 -С О -СН 3 | моноанионный | двузубый | Обычно бидентатный, связанный через оба атома кислорода, но иногда связанный только через центральный углерод. см. также аналогичные аналоги кетимина. |
| Алкены | Р 2 С=С Р 2 | нейтральный | соединения с двойной связью C-C | |
| Аминополикарбоновые кислоты (APCA) | ||||
| БАПТА (1,2-бис(о-аминофенокси)этан-N,N,N',N'-тетрауксусная кислота) | ||||
| Бензол | C6HC6H6 | нейтральный | и другие арены | |
| 1,2-бис(дифенилфосфино)этан (dppe) | (C 6 ЧАС 5 ) 2 п - C 2 ЧАС 4 - п (C 6 ЧАС 5 ) 2 | нейтральный | двузубый | |
| 1,1-бис(дифенилфосфино)метан (dppm) | (C 6 ЧАС 5 ) 2 п -CH 2 - п (C 6 ЧАС 5 ) 2 | нейтральный | Может связываться одновременно с двумя атомами металла, образуя димеры. | |
| Корролес | tetradentate | |||
| Краун-эфиры | нейтральный | в первую очередь для катионов щелочных и щелочноземельных металлов | ||
| 2,2,2-криптанд | шестизубый | в первую очередь для катионов щелочных и щелочноземельных металлов | ||
| Криптаты | нейтральный | |||
| Циклопентадиенил (Cp) | С 55Ч − 5 | моноанионный | Хотя он моноанионный, по природе занятых молекулярных орбиталей он способен действовать как тридентатный лиганд. | |
| Диэтилентриамин (диен) | С 4 Ч 13 Н 3 | нейтральный | трехзубый | связано с TACN, но не ограничивается комплексом лица |
| Диметилглиоксимат (dmgH − ) | моноанионный | |||
| 1,4,7,10-тетраазациклододекан-1,4,7,10-тетрауксусная кислота (ДОТА) | ||||
| Диэтилентриаминпентауксусная кислота (ДТПА) ( пентиновая кислота ) | ||||
| Этилендиаминтетрауксусная кислота (ЭДТА) (эдта 4− ) | ( − О О C-CH 2 ) 2 N -C 2 ЧАС 4 - N (CH 2 -C O O − ) 2 | тетраанионный | шестизубый | |
| Этилендиаминотриацетат | − O O C−CH 2 N H−C 2 H 4 − N (CH 2 -C O O − ) 2 | трианионный | пятизубный | |
| Этиленгликольбис(оксиэтиленнитрило)тетраацетат (эгта 4− ) | ( − О О C−CH 2 ) 2 N -C 2 ЧАС 4 - О -C 2 ЧАС 4 - О -C 2 ЧАС 4 - N (CH 2 -C O O − ) 2 | тетраанионный | восьмидесятилетний | |
| Странно-2 | ||||
| Глицинат (глицинато) | Н Н 2 СН 2 С О О − | моноанионный | двузубый | анионы других α-аминокислот сопоставимы (но хиральны) |
| Гем | дианионный | tetradentate | макроциклический лиганд | |
| Иминодиуксусная кислота (ИДА) | трехзубый | Широко используется для изготовления радиофармпрепаратов для сцинтиграфии путем комплексообразования с метастабильным радионуклидом технеций-99m . Например, в холесцинтиграфии используются HIDA, BrIDA, PIPIDA и DISIDA. | ||
| Никотианамин | Повсеместно встречается у высших растений. | |||
| Нитросил | НЕТ + | катионный | (1-й − ) и линейный (3e − ) режим соединения | |
| Нитрилотриуксусная кислота (НТК) | ||||
| Оксо | ТО 2− | дианион | монодентатный | иногда мост |
| пиразин | Н 2 С 4 Ч 4 | нейтральный | дитопический | иногда мост |
| Скорпионатный лиганд | трехзубый | |||
| Сульфит | О — СОЛНЦЕ 2− 2 С - О 2− 3 | моноанионный | монодентатный | амбидентатный |
| 2,2';6',2″-Терпиридин (терпий) | Н С 5 ЧАС 4 -С 5 ЧАС 3 Н -С 5 ЧАС 4 Н | нейтральный | трехзубый | только меридиональное соединение |
| Триазациклононан (такн) | (C 2 H 4 ) 3 ( N R) 3 | нейтральный | трехзубый | макроциклический лиганд см. также N , N ', N ″-триметилированный аналог |
| Трициклогексилфосфин | P (C 6 H 11 ) 3 или P Cy 3 | нейтральный | монодентатный | |
| Триэтилентетрамин (триен) | С 6 Ч 18 Н 4 | нейтральный | tetradentate | |
| Триметилфосфин | П (СН 3 ) 3 | нейтральный | монодентатный | |
| Трис(о-толил)фосфин | Р ( о -толил) 3 | нейтральный | монодентатный | |
| Трис(2-аминоэтил)амин (трен) | ( Н Н 2 СН 2 СН 2 ) 3 Н | нейтральный | tetradentate | |
| Трис(2-дифенилфосфинэтил)амин (np 3 ) | нейтральный | tetradentate | ||
| Тропилий | С 7 ч. + 7 | катионный | ||
| Углекислый газ | – CO 2 другие , | нейтральный | см. комплекс углекислого газа металла | |
| Трифторид фосфора (трифторофосфор) | – П Ф 3 | нейтральный |
Лигандный обмен
[ редактировать ]Лигандный обмен (также называемый заменой лиганда ) — это химическая реакция , в которой лиганд в соединении заменяется другим. Признаны два общих механизма: ассоциативное замещение или диссоциативное замещение .
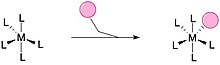
Ассоциативное замещение очень похоже на механизм S N 2 в органической химии. Обычно меньший лиганд может присоединиться к ненасыщенному комплексу с последующей потерей другого лиганда. Обычно скорость замещения имеет первый порядок при входе в лиганд L и ненасыщенный комплекс. [19]

Диссоциативное замещение характерно для октаэдрических комплексов. Этот путь очень похож на механизм S N 1 в органической химии. Идентичность входящего лиганда не влияет на скорость. [19]
База данных связывания лиганд-белок
[ редактировать ]БиоЛиП [20] представляет собой обширную базу данных по взаимодействиям лиганд-белок с трехмерной структурой взаимодействий лиганд-белок, взятой из банка данных белков . MANORAA — веб-сервер для анализа консервативного и дифференциального молекулярного взаимодействия лиганда в комплексе с гомологами белковой структуры из Банка данных белков. Он обеспечивает связь с белками-мишенями, такими как его расположение в биохимических путях, SNP и базовая экспрессия белка/РНК в органе-мишени. [21]
См. также
[ редактировать ]- Мостиковый карбонил
- Теория кристаллического поля
- ДНК-связывающий лиганд
- Неорганическая химия
- Йозифосные лиганды
- Лиганд-зависимый путь
- Теория поля лигандов
- Лигандная изомерия
- Спектрохимическая серия
Пояснительные примечания
[ редактировать ]- ^ Слово «лиганд» происходит от латинского ligare , что означает связывать/связывать. Произносится либо / ˈ l aɪ ɡ n ə d / или / ˈ l ɪ ɡ ə n d / ; оба очень распространены.
Ссылки
[ редактировать ]- ^ Бердж, Дж., и Оверби, Дж. (2020). Химия - Сначала атомы (4-е изд.). Нью-Йорк: МакГроу Хилл. ISBN 978-1260571349
- ^ Коттон, Фрэнк Альберт; Джеффри Уилкинсон; Карлос А. Мурильо (1999). Продвинутая неорганическая химия . Уайли-Интерсайенс. п. 1355. ИСБН 978-0471199571 .
- ^ Мисслер, Гэри Л.; Пол Дж. Фишер; Дональд Артур Тарр (2013). Неорганическая химия . Прентис Холл. п. 696. ИСБН 978-0321811059 .
- ^ Джексон, В. Грегори; Жозефина А. МакКеон; Сильвия Кортес (1 октября 2004 г.). «Неорганические аналоги рацемической и мезомерной винной кислоты Альфреда Вернера: новая веха». Неорганическая химия . 43 (20): 6249–6254. дои : 10.1021/ic040042e . PMID 15446870 .
- ^ Боуман-Джеймс, Кристин (2005). «Возвращение к Альфреду Вернеру: координационная химия анионов». Отчеты о химических исследованиях . 38 (8): 671–678. дои : 10.1021/ar040071t . ПМИД 16104690 .
- ^ Ганс Людвиг Шлефер и Гюнтер Глиманн (1969). Основные принципы теории поля лигандов . Лондон: Wiley Interscience. ISBN 0471761001 .
- ^ Мисслер, Гэри; Фишер, Пол Дж.; Тарр, Дональд А. (2014). Неорганическая химия (5-е изд.). Пирсон. ISBN 978-0321811059 .
- ^ Расмуссен, Сет К. (5 марта 2015 г.). «Правило 18-ти электронов и подсчет электронов в соединениях переходных металлов: теория и применение» . Химтексты . 1 (1): 10. дои : 10.1007/s40828-015-0010-4 . ISSN 2199-3793 .
- ^ К. Эльшенбройх (2006). Металлоорганические соединения . ВЧ. ISBN 978-3-527-29390-2 .
- ^ Грин, MLH (20 сентября 1995 г.). «Новый подход к формальной классификации ковалентных соединений элементов». Журнал металлоорганической химии . 500 (1–2): 127–148. дои : 10.1016/0022-328X(95)00508-N . ISSN 0022-328X .
- ^ «Сюжеты mlxz - Колумбийский университет» , Колумбийский университет, Нью-Йорк.
- ^ Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . п. 906. ИСБН 978-0-08-037941-8 .
- ^ Химия (ИЮПАК), Международный союз теоретической и прикладной химии. «ИЮПАК-η (эта или гапто) (Н01881)» . goldbook.iupac.org . дои : 10.1351/goldbook.h01881 . Проверено 8 ноября 2023 г.
- ^ Химия (ИЮПАК), Международный союз теоретической и прикладной химии. «ИЮПАК – дентальность (D01594)» . goldbook.iupac.org . дои : 10.1351/goldbook.d01594 . Проверено 8 ноября 2023 г.
- ^ Хартвиг, Джон Фредерик (2010). Химия органопереходных металлов: от связывания к катализу . Саусалито (Калифорния): Университетские научные книги. ISBN 978-1-891389-53-5 .
- ^ фон Зелевский, А. «Стереохимия координационных соединений» Джон Вили: Чичестер, 1995. ISBN 047195599X .
- ^ Дикий,Ж.-П.; Коллин, Ж.-П.; Шамброн, Ж.-К.; Гильерес, С.; Кудре, К.; Бальзани, В.; Баригеллетти, Ф.; Де Кола, Л.; Фламиньи, L. Chem. Замри. 1994, 94, 993-1019
- ^ Гаврилова, А.Л.; Боснич, Б., «Принципы проектирования мононуклеирующих и бинуклеирующих лигандов», Chem. Ред. 2004 г., том 104, 349–383. два : 10.1021/cr020604g
- ^ Перейти обратно: а б Уилкинс, Ральф Г. (1991). Кинетика и механизм реакций комплексов переходных металлов (2. Тщательно переработанное изд.). Вайнхайм: ВЧ. ISBN 978-1-56081-125-1 .
- ^ БиоЛиП
- ^ Танрамлюк Д., Нарипиякул Л., Акавипат Р., Гонг С., Чароенсаван В. (2016). «MANORAA (картирование аналогичных ядер на остаток и сродство) для идентификации взаимодействия белка и фрагмента лиганда, путей и SNP» . Исследования нуклеиновых кислот . 44 (П1): W514-21. дои : 10.1093/нар/gkw314 . ПМЦ 4987895 . ПМИД 27131358 .
Внешние ссылки
[ редактировать ]- См. моделирование связывания лиганд-рецептор-лиганд в книге Ву-Куок Л., Интеграл конфигурации (статистическая механика) , 2008. Этот вики-сайт недоступен; см эту статью в Интернет-архиве от 28 апреля 2012 г. .