2-гидрокси-дАТФ-дифосфатаза
| 2-гидрокси-дАТФ-дифосфатаза | |||
|---|---|---|---|
| Идентификаторы | |||
| Номер ЕС. | 3.6.1.56 | ||
| Базы данных | |||
| ИнтЭнк | вид IntEnz | ||
| БРЕНДА | БРЕНДА запись | ||
| Экспаси | Просмотр NiceZyme | ||
| КЕГГ | КЕГГ запись | ||
| МетаЦик | метаболический путь | ||
| ПРЯМОЙ | профиль | ||
| PDB Структуры | RCSB PDB PDBe PDBsum | ||
| |||
2-гидрокси-dATP-дифосфатаза ( EC 3.6.1.56 , также известная как окисленная пуриннуклеозидтрифосфатаза, или (2'-дезокси)рибонуклеозид-5'-трифосфатпирофосфогидролаза, или гидролаза Nudix 1 (NUDT1), или гомолог MutT 1 (MTH1), или 7,8-дигидро-8-оксогуанин трифосфатаза) — фермент , который у человека кодируется NUDT1 геном . [ 1 ] [ 2 ] [ 3 ] Во время репарации ДНК фермент гидролизует окисленные пурины и предотвращает их присоединение к цепи ДНК. Таким образом, он играет важную роль в старении и развитии рака.
Функция
[ редактировать ]Этот фермент катализирует следующую химическую реакцию
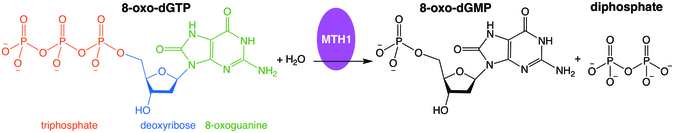
- 2-гидрокси-дАТФ + H 2 O 2-гидрокси-дАМФ + дифосфат
Фермент гидролизует окисленные пуриновые нуклеозидтрифосфаты . Фермент используется для восстановления ДНК, где он гидролизует окисленные пурины и предотвращает их добавление в цепь ДНК. [ 4 ]
Неправильное включение окисленных нуклеозидтрифосфатов в ДНК и/или РНК во время репликации и транскрипции может вызвать мутации, которые могут привести к канцерогенезу или нейродегенерации . Впервые выделен из Escherichia coli из-за его способности предотвращать появление 8-оксогуанина в ДНК. [ 5 ] белок, кодируемый этим геном, представляет собой фермент, который гидролизует окисленные пуриновые нуклеозидтрифосфаты, такие как 8-оксо-dGTP, 8-оксо-dATP, 2-оксо-dATP, 2-гидрокси-dATP и 2-гидрокси rATP, до монофосфатов. , тем самым предотвращая неправильное включение.
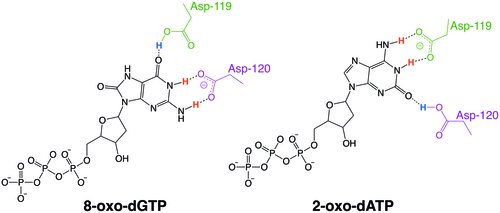
Ферменты MutT в организмах, отличных от человека, часто обладают субстратной специфичностью к определенным типам окисленных нуклеотидов, например, у E. coli , которая специфична к 8-оксогуаниновым нуклеотидам. Однако человеческий MTH1 обладает субстратной специфичностью в отношении гораздо более широкого диапазона нуклеотидов, поврежденных окислением. Механизм широкой специфичности hMTH1 в отношении этих окисленных нуклеотидов обусловлен их распознаванием в субстратсвязывающем кармане фермента вследствие обмена состоянием протонирования между двумя близлежащими остатками аспартата. [ 6 ]
Кодируемый белок локализуется главным образом в цитоплазме , частично в митохондриях , что позволяет предположить, что он участвует в санации пулов нуклеотидов как ядерного, так и митохондриального генома. Также было показано, что у растений MTH1 повышает устойчивость к жарой и паракватом окислительному стрессу, вызванному , что приводит к меньшему количеству мертвых клеток и меньшему накоплению перекиси водорода . [ 7 ]
несколько альтернативно сплайсированных вариантов транскриптов, некоторые из которых кодируют разные изоформы Идентифицировано . Были обнаружены дополнительные варианты, но их полноразмерная природа не установлена. изоформы . Описан однонуклеотидный полиморфизм, приводящий к образованию дополнительной, более длинной [ 3 ]
Исследовать
[ редактировать ]Старение
[ редактировать ]Была изучена модель мыши, которая сверхэкспрессирует hMTH1-Tg (NUDT1). [ 8 ] hMTH1 Мыши hMTH1-Tg экспрессируют высокие уровни гидролазы , которая расщепляет 8-oxodGTP и 8-oxoGTP и, следовательно, исключает 8-оксогуанин из ДНК и РНК . Уровни устойчивого состояния 8-оксогуанина в ДНК нескольких органов, включая мозг, значительно снижаются у мышей со сверхэкспрессией hMTH1-Tg. И наоборот, мыши с нулевым MTH1 демонстрируют значительно более высокий уровень накопления 8-оксо-dGTP, чем у дикого типа. [ 9 ] Сверхэкспрессия hMTH1 предотвращает возрастное накопление ДНК-8-оксогуанина, которое происходит у мышей дикого типа. Более низкие уровни окисленных гуанинов связаны с большей продолжительностью жизни . Животные hMTH1-Tg имеют значительно большую продолжительность жизни, чем их однопометники дикого типа. Эти данные указывают на связь между старением и окислительным повреждением ДНК. [ 8 ] (см. теорию старения, связанную с повреждением ДНК ).
Рак
[ редактировать ]Исследования показали, что этот фермент играет роль как в предотвращении образования раковых клеток, так и в их пролиферации. Это делает его предметом интереса в исследованиях рака , как потенциальным методом предотвращения рака здоровых клеток, так и слабостью воздействия на существующие раковые клетки.
Устранение гена MTH1 у мышей приводит к тому, что у мышей развиваются опухоли более чем в три раза по сравнению с контрольной группой . [ 10 ] Хорошо изученная способность фермента очищать пул нуклеотидов клетки предотвращает развитие мутаций, в том числе раковых. MTH1 В частности, другое исследование показало, что ингибирование в раковых клетках приводит к включению 8-оксо-dGTP и других нуклеотидов, поврежденных окислением, в ДНК клетки, повреждая ее и вызывая гибель клеток. [ 11 ] Однако было также показано, что раковые клетки получают пользу от использования MTH1. Клетки злокачественных опухолей молочной железы демонстрируют экстремальную экспрессию MTH1 по сравнению с другими клетками человека. [ 12 ] Поскольку раковая клетка делится гораздо быстрее, чем нормальная человеческая клетка, она гораздо больше нуждается в таком ферменте, как MTH1, который предотвращает фатальные мутации во время репликации. Это свойство раковых клеток может позволить контролировать эффективность лечения рака путем измерения экспрессии MTH1. В настоящее время ведется разработка подходящих для этой цели зондов. [ 13 ] [ 14 ]
Существуют разногласия относительно функциональности MTH1 в отношении предотвращения повреждения ДНК и рака. Последующие исследования столкнулись с трудностями при воспроизведении ранее сообщавшихся цитотоксических или антипролиферационных эффектов ингибирования MTH1 на раковые клетки, что даже поставило под вопрос, действительно ли MTH1 действительно служит для удаления окислительно поврежденных нуклеотидов из пула нуклеотидов клетки. [ 15 ] [ 16 ] Одно исследование недавно открытых ингибиторов MTH1 предполагает, что эти противораковые свойства, проявляемые более старыми ингибиторами MTH1, могут быть связаны с нецелевым цитотоксическим действием. [ 17 ] После повторного рассмотрения эксперимента первоначальные авторы этого утверждения обнаружили, что, хотя рассматриваемые оригинальные ингибиторы MTH1 приводят к включению поврежденных нуклеотидов в ДНК, они демонстрируют, что другие, которые не вызывают токсичности, не способны вызвать повреждение ДНК. [ 18 ] Исследования по этой теме продолжаются.
Как мишень для наркотиков
[ редактировать ]MTH1 является потенциальной мишенью для лечения рака, однако существуют противоречивые результаты относительно цитотоксичности ингибиторов MTH1 в отношении раковых клеток. [ 19 ]
Каронудиб, ингибитор MTH1, в настоящее время проходит I фазу клинических испытаний на предмет безопасности и переносимости. [ 18 ] [ 20 ] [ 21 ]
Мощный и селективный ингибитор MTH1 AZ13792138, разработанный компанией AstraZeneca, был предоставлен академическим исследователям в качестве химического зонда. [ 22 ] Однако компания AstraZeneca обнаружила, что ни AZ13792138, ни генетический нокдаун MTH1 не проявляют значительной цитотоксичности в отношении раковых клеток. [ 23 ] [ 24 ]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Поннамбалам С., Джексон А.П., ЛеБо М.М., Правчева Д., Раддл Ф.Х., Алиберт С., Пархэм П. (декабрь 1994 г.). «Хромосомное расположение и некоторые структурные особенности генов легкой цепи клатрина человека (CLTA и CLTB)» . Геномика . 24 (3): 440–4. дои : 10.1006/geno.1994.1650 . ПМИД 7713494 .
- ^ Сакуми К., Фуруичи М., Цузуки Т., Какума Т., Кавабата С., Маки Х., Секигути М. (ноябрь 1993 г.). «Клонирование и экспрессия кДНК для человеческого фермента, который гидролизует 8-оксо-dGTP, мутагенный субстрат для синтеза ДНК» . Журнал биологической химии . 268 (31): 23524–30. дои : 10.1016/S0021-9258(19)49494-5 . ПМИД 8226881 .
- ^ Jump up to: а б «Ген Entrez: мотив 1 типа NUDT1 nudix (нуклеозиддифосфат-связанный фрагмент X)» .
- ^ Радлинг, Аксель; Густафссон, Роберт; Альмлёф, Ингрид; Хоман, Эверт; Скоби, Мартин; Варпман Берглунд, Ульрика; Хелледей, Томас; Стенмарк, Пол; Карлссон, Йенс (12 октября 2017 г.). «Открытие и оптимизация ингибиторов ферментов на основе фрагментов путем стыковки коммерческого химического пространства». Журнал медицинской химии . 60 (19): 8160–8169. doi : 10.1021/acs.jmedchem.7b01006 . ISSN 1520-4804 . ПМИД 28929756 .
- ^ Чоу Дж., Касаи Х., Шибутани С., Чунг М.Х., Лаваль Дж., Гроллман А.П., Нишимура С. (июнь 1991 г.). «8-оксогуанин (8-гидроксигуанин) ДНК-гликозилаза и ее субстратная специфичность» . Труды Национальной академии наук Соединенных Штатов Америки . 88 (11): 4690–4. Бибкод : 1991PNAS...88.4690T . дои : 10.1073/pnas.88.11.4690 . ПМК 51731 . ПМИД 2052552 .
- ^ Jump up to: а б Ваз С., Накамура Т., Хирата К., Кога-Огава Ю., Чирифу М., Аримори Т., Тамада Т., Икемидзу С., Накабеппу Ю., Ямагата Ю. (февраль 2017 г.). «Структурные и кинетические исследования человеческой нудикс-гидролазы MTH1 раскрывают механизм ее широкой субстратной специфичности» . Журнал биологической химии . 292 (7): 2785–2794. дои : 10.1074/jbc.m116.749713 . ПМК 5314174 . ПМИД 28035004 .
- ^ Ёсимура К., Огава Т., Цудзимура М., Исикава К., Сигеока С. (сентябрь 2014 г.). «Эктопическая экспрессия человеческой гидролазы Nudix типа MutT, hMTH1, обеспечивает повышенную толерантность к окислительному стрессу у арабидопсиса» . Физиология растений и клеток . 55 (9): 1534–43. дои : 10.1093/pcp/pcu083 . ПМИД 24928220 .
- ^ Jump up to: а б Де Лука Дж., Вентура И., Сангез В., Руссо М.Т., Аджмоне-Кэт М.А., Каччи Э., Мартире А., Пополи П., Фальконе Г., Мишелини Ф., Крещенци М., Деган П., Мингетти Л., Бигнами М., Каламандрей Г. (август 2013 г.) ). «Увеличенная продолжительность жизни с улучшенным исследовательским поведением у мышей со сверхэкспрессией окисленной нуклеозидтрифосфатазы hMTH1» . Старение клеток . 12 (4): 695–705. дои : 10.1111/acel.12094 . ПМИД 23648059 .
- ^ Кадзитани К., Ямагути Х., Дэн Ю., Фуруичи М., Кан Д., Накабеппу Ю. (февраль 2006 г.). «MTH1, окисленная пуриновая нуклеозидтрифосфатаза, подавляет накопление окислительного повреждения нуклеиновых кислот в микроглии гиппокампа во время каинат-индуцированной эксайтотоксичности» . Журнал неврологии . 26 (6): 1688–98. doi : 10.1523/jneurosci.4948-05.2006 . ПМК 6793619 . ПМИД 16467516 .
- ^ Цузуки Т, Эгашира А, Игараси Х, Ивакума Т, Накацуру Ю, Томинага Ю, Кавате Х, Накао К, Накамура К, Иде Ф, Кура С, Накабеппу Ю, Кацуки М, Исикава Т, Секигути М (сентябрь 2001 г.). «Спонтанный онкогенез у мышей с дефектом гена MTH1, кодирующего 8-оксо-дГТФазу» . Труды Национальной академии наук Соединенных Штатов Америки . 98 (20): 11456–61. Бибкод : 2001PNAS...9811456T . дои : 10.1073/pnas.191086798 . ПМК 58751 . ПМИД 11572992 .
- ^ Гад Х., Кулмейстер Т., Джемт А.С., Эштад С., Жак С.А., Стрём CE и др. (апрель 2014 г.). «Ингибирование MTH1 уничтожает рак, предотвращая очистку пула dNTP». Природа . 508 (7495): 215–21. Бибкод : 2014Natur.508..215G . дои : 10.1038/nature13181 . ПМИД 24695224 . S2CID 4468358 .
- ^ Джошкун Э., Яруга П., Джемт А.С., Лосева О., Скэнлан Л.Д., Тона А., Ловенталь М.С., Хелледей Т., Диздароглу М. (сентябрь 2015 г.). «Пристрастие к белку MTH1 приводит к интенсивной экспрессии в тканях рака молочной железы человека, что измерено с помощью тандемной масс-спектрометрии с жидкостной хроматографией, изотопным разбавлением». Восстановление ДНК . 33 : 101–10. дои : 10.1016/j.dnarep.2015.05.008 . ПМИД 26202347 .
- ^ Джи Д., Бехарри А.А., Форд Дж.М., Кул ET (июль 2016 г.). «Химерный АТФ-связанный нуклеотид обеспечивает люминесцентную сигнализацию о наблюдении за повреждением с помощью MTH1, мишени рака» . Журнал Американского химического общества . 138 (29): 9005–8. дои : 10.1021/jacs.6b02895 . ПМК 5500214 . ПМИД 27413803 .
- ^ Самаранайке GJ, Трокколи CI, Huynh MQ, Win A, Ji D, Kool ET, Rai P (июль 2017 г.). «На пути к лучшему пониманию MTH1 как терапевтической мишени при раке, вызванном РАС [аннотация]». Рак Рез . 77 (13): 5473. doi : 10.1158/1538-7445.AM2017-5473 .
- ^ Петрокки А, Лео Э, Рейна Н.Дж., Гамильтон ММ, Ши Х, Паркер К.А., Мси Ф, Барденхаген Дж.П., Леонард П., Кросс Дж.Б., Хуанг С., Цзян Ю., Кардосо М., Дрэтта Г., Марсалек Дж.Р., Тониятти С., Джонс П. , Льюис RT (март 2016 г.). «Идентификация мощных и селективных ингибиторов MTH1». Письма по биоорганической и медицинской химии . 26 (6): 1503–7. дои : 10.1016/j.bmcl.2016.02.026 . ПМИД 26898335 .
- ^ Эллерманн М., Эхайм А., Рам Ф., Виклунд Дж., Гюнтер Дж., Андерссон М. и др. (июль 2017 г.). «Новый класс мощных и клеточно активных ингибиторов лишает MTH1 статуса мишени рака широкого спектра действия» . АКС Химическая биология . 12 (8): 1986–1992. doi : 10.1021/acschembio.7b00370 . ПМИД 28679043 .
- ^ Кеттл Дж., Алван Х., Биста М., Брид Дж., Дэвис Н.Л., Экерсли К., Филлери С., Фут К.М., Гудвин Л., Джонс Д.Р., Кэк Х., Лау А., Ниссинк Дж.В., Рид Дж., Скотт Дж.С., Тейлор Б., Уокер Дж. , Висслер Л., Уайлот М. (март 2016 г.). «Мощные и селективные ингибиторы MTH1 исследуют его роль в выживании раковых клеток» . Журнал медицинской химии . 59 (6): 2346–61. doi : 10.1021/acs.jmedchem.5b01760 . ПМИД 26878898 .
- ^ Jump up to: а б Варпман Берглунд У., Санджив К., Гад Х., Кальдерен С., Кулмейстер Т., Фам Т. и др. (декабрь 2016 г.). «Валидация и разработка ингибиторов MTH1 для лечения рака» . Анналы онкологии . 27 (12): 2275–2283. дои : 10.1093/annonc/mdw429 . ПМИД 27827301 .
- ^ Самаранаяке Г.Дж., Хюинь М., Рай П. (2017). «MTH1 как химиотерапевтическая мишень: слон в комнате» . Раки . 9 (5): 47. doi : 10.3390/cancers9050047 . ПМЦ 5447957 . ПМИД 28481306 .
- ^ Томас А. (21 сентября 2016 г.). «Команда Helleday представляет мощный ингибитор MTH1 «Каронудиб» и экспериментально устраняет неактивные ингибиторы MTH1» . Лаборатория Хелледея . Проверено 19 июля 2017 г.
- ^ «MTH1, фаза I, исследование ингибирования опухолей, первое в своем классе на людях (MASTIF)» . ClinicalTrials.gov . Национальные институты здравоохранения США. 14 февраля 2017 года . Проверено 19 июля 2017 г.
- ^ "AZ13792138" . Открытые инновации . АстраЗенека. 2016 . Проверено 19 июля 2017 г.
- ^ Кеттл Дж.Г., Алван Х., Биста М., Брид Дж., Дэвис Н.Л., Экерсли К. и др. (2016). «Мощные и селективные ингибиторы MTH1 исследуют его роль в выживании раковых клеток» . Журнал медицинской химии . 59 (6): 2346–61. doi : 10.1021/acs.jmedchem.5b01760 . ПМИД 26878898 .
- ^ Папео Дж. (2016). «Гомолог MutT 1 (MTH1): подавление цели» . Журнал медицинской химии . 59 (6): 2343–5. doi : 10.1021/acs.jmedchem.6b00283 . ПМИД 26924380 .
Дальнейшее чтение
[ редактировать ]- Фуруичи М., Ёсида М.К., Ода Х., Тадзири Т., Накабеппу Ю., Цузуки Т., Секигути М. (декабрь 1994 г.). «Геномная структура и расположение хромосом гомологического гена mutT человека MTH1, кодирующего 8-оксо-dGTPазу, для предотвращения трансверсии A:T в C:G». Геномика . 24 (3): 485–90. дои : 10.1006/geno.1994.1657 . ПМИД 7713500 .
- Канг Д., Нисида Дж., Ияма А., Накабеппу Ю., Фуруичи М., Фудзивара Т., Секигути М., Такэсигэ К. (июнь 1995 г.). «Внутриклеточная локализация 8-оксо-дГТФазы в клетках человека с особым упором на роль фермента в митохондриях» . Журнал биологической химии . 270 (24): 14659–65. дои : 10.1074/jbc.270.24.14659 . ПМИД 7782328 .
- Ода Х., Накабеппу Ю., Фуруичи М., Секигути М. (июль 1997 г.). «Регуляция экспрессии гена MTH1 человека, кодирующего 8-оксо-dGTPазу. Альтернативный сплайсинг продуктов транскрипции» . Журнал биологической химии . 272 (28): 17843–50. дои : 10.1074/jbc.272.28.17843 . ПМИД 9211940 .
- Ода Х., Такэтоми А., Маруяма Р., Ито Р., Нисиока К., Якусиджи Х., Судзуки Т., Секигути М., Накабеппу Ю. (ноябрь 1999 г.). «Мультиформы полипептидов MTH1 человека, полученные путем альтернативной инициации трансляции и однонуклеотидного полиморфизма» . Исследования нуклеиновых кислот . 27 (22): 4335–43. дои : 10.1093/нар/27.22.4335 . ПМК 148714 . ПМИД 10536140 .
- Сакаи Ю., Фуруичи М., Такахаси М., Мисима М., Иваи С., Сиракава М., Накабеппу Ю. (март 2002 г.). «Молекулярная основа селективного распознавания 2-гидрокси-dATP и 8-оксо-dGTP человеческим MTH1» . Журнал биологической химии . 277 (10): 8579–87. дои : 10.1074/jbc.M110566200 . ПМИД 11756418 .
- Фудзикава К., Якусидзи Х., Накабеппу Ю., Сузуки Т., Масуда М., Осима Х., Касаи Х. (февраль 2002 г.). «8-Хлор-dGTP, нуклеотид, модифицированный хлорноватистой кислотой, гидролизуется hMTH1, гомологом MutT человека» . Письма ФЭБС . 512 (1–3): 149–51. дои : 10.1016/S0014-5793(02)02240-8 . ПМИД 11852070 .
- Топп Х., Армбруст С., Ленггер С., Шёх Г., Дэвис Дж., Штихлер В., Манц Ф., Фуш К. (июнь 2002 г.). «Почечная экскреция 8-оксо-7,8-дигидро-2 (')-дезоксигуанозина: скорость деградации РНК и скорость метаболизма у человека». Архив биохимии и биофизики . 402 (1): 31–7. дои : 10.1016/S0003-9861(02)00034-6 . ПМИД 12051680 .
- Такахаши М., Марабоф Ф., Сакаи Ю., Якусидзи Х., Мисима М., Сиракава М., Иваи С., Хаякава Х., Секигути М., Накабеппу Ю. (май 2002 г.). «Роль остатков триптофана в распознавании мутагенных окисленных нуклеотидов человеческим антимутаторным белком MTH1». Журнал молекулярной биологии . 319 (1): 129–39. дои : 10.1016/S0022-2836(02) 00163-8 ПМИД 12051941 .
- Лю З., Ван Л.Е., Стром С.С., Шпиц М.Р., Бабайан Р.Дж., ДиДжованни Дж., Вэй К. (март 2003 г.). «Сверхэкспрессия чМТГ в периферических лимфоцитах и риск рака простаты: анализ случай-контроль». Молекулярный канцерогенез . 36 (3): 123–9. дои : 10.1002/mc.10108 . ПМИД 12619034 . S2CID 26364277 .
- Исибаши Т., Хаякава Х., Секигути М. (май 2003 г.). «Новый механизм предотвращения мутаций, вызванных окислением гуаниновых нуклеотидов» . Отчеты ЭМБО . 4 (5): 479–83. дои : 10.1038/sj.embor.embor838 . ПМЦ 1319193 . ПМИД 12717453 .
- Кеннеди Ч., Пасс Х.И., Митчелл Дж.Б. (июнь 2003 г.). «Экспрессия белка гомолога MutT человека (hMTH1) в первичных немелкоклеточных карциномах легких и гистологически нормальной окружающей ткани». Свободно-радикальная биология и медицина . 34 (11): 1447–57. дои : 10.1016/S0891-5849(03)00176-X . ПМИД 12757855 .
- Ёсимура Д., Сакуми К., Оно М., Сакаи Ю., Фуруичи М., Иваи С., Накабеппу Ю. (сентябрь 2003 г.). «Окисленная пуриновая нуклеозидтрифосфатаза, MTH1, подавляет гибель клеток, вызванную окислительным стрессом» . Журнал биологической химии . 278 (39): 37965–73. дои : 10.1074/jbc.M306201200 . ПМИД 12857738 .
- Камия Х., Дуге Л., Якусидзи Х., Почет С., Накабеппу Ю., Харашима Х. (2003). «Распознавание субстрата человеческим белком MTH1» . Исследования нуклеиновых кислот. Добавка . 2 (2): 85–6. дои : 10.1093/насс/2.1.85 . ПМИД 12903117 .
- Бялковский К., Каспржак К.С. (сентябрь 2003 г.). «Ингибирование активности 8-оксо-2'-дезоксигуанозин-5'-трифосфатпирофосфогидролазы (8-оксо-dGTPase) антимутагенного человеческого белка MTH1 нуклеозид-5'-дифосфатами». Свободно-радикальная биология и медицина . 35 (6): 595–602. дои : 10.1016/S0891-5849(03)00362-9 . ПМИД 12957652 .
- Камия Х., Якусидзи Х., Дюге Л., Танимото М., Почет С., Накабеппу Ю., Харашима Х. (февраль 2004 г.). «Исследование механизма распознавания субстрата человеческого белка MTH1 с помощью аналогов нуклеотидов». Журнал молекулярной биологии . 336 (4): 843–50. дои : 10.1016/j.jmb.2003.12.060 . ПМИД 15095864 .
- Лоу, Дерек (7 июля 2017 г.). «MTH1: от горячей темы к девалидации?» . Наука трансляционной медицины . Американская ассоциация содействия развитию науки. Архивировано из оригинала 10 июля 2017 года . Проверено 19 июля 2017 г.
- Уоркман, Пол (10 июля 2017 г.). «Призыв к ученым-биологам: выбирайте и используйте химические зонды очень осторожно» . Институт исследования рака, Лондон . Институт исследования рака . Проверено 19 июля 2017 г.
Внешние ссылки
[ редактировать ]- 2-гидрокси-dATP + дифосфатаза в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)

