AP-сайт
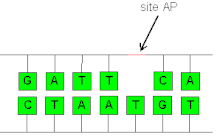
В биохимии и молекулярной генетике ( АР-сайт апуриновый /апиримидиновый сайт ), также известный как абазический сайт , представляет собой участок в ДНК (также в РНК , но гораздо реже), который не имеет ни пуринового , ни пиримидинового основания ни спонтанно, ни пиримидинового основания. из-за повреждения ДНК . Подсчитано, что в физиологических условиях в клетке ежедневно может генерироваться 10 000 апуриновых сайтов и 500 апиримидиновых. [1] [2]
AP-сайты могут образовываться в результате спонтанной депуринации , но также могут выступать в качестве промежуточных продуктов в эксцизионной репарации оснований . [3] В этом процессе ДНК-гликозилаза распознает поврежденное основание и расщепляет N-гликозидную связь, высвобождая основание, оставляя AP-сайт. Существует множество гликозилаз, которые распознают различные типы повреждений, включая окисленные или метилированные основания или урацил в ДНК. Затем сайт AP может быть расщеплен эндонуклеазой AP , оставляя 3'-гидроксильный и дезоксирибозо-5-фосфатный концы (см. Структуру ДНК ). Альтернативно, бифункциональные гликозилазы-лиазы могут расщеплять AP-сайт, оставляя 5'-фосфат рядом с 3'-α,β-ненасыщенным альдегидом. Оба механизма образуют одноцепочечный разрыв, который затем восстанавливается путем иссечения основания с помощью короткой или длинной заплатки. [4]
Если их не восстановить, AP-сайты могут привести к мутации во время полуконсервативной репликации . Они могут вызвать остановку репликационной вилки и обходят их посредством транслезионного синтеза . В E. coli аденин преимущественно вставляется напротив AP-сайтов, что известно как «правило А». Ситуация более сложная у высших эукариот, где предпочтение отдается разным нуклеотидам в зависимости от организма и условий эксперимента. [3]
Формирование
[ редактировать ]AP-сайты образуются, когда дезоксирибоза отщепляется от азотистого основания , разрывая гликозидную связь между ними. Это может произойти спонтанно, в результате химической активности, радиации или вследствие активности ферментов. Гликозидные связи в ДНК могут быть разорваны посредством кислотно -катализируемого гидролиза . Пуриновые основания могут выделяться в слабокислых условиях, тогда как пиримидины для расщепления требуют более сильной кислотности. Пурины могут быть удалены даже при нейтральном pH , если температура достаточно повысится.Образование AP-сайта также может быть вызвано различными химическими веществами, модифицирующими основания. Алкилирование , дезаминирование и окисление отдельных оснований могут привести к ослаблению гликозильной связи, поэтому воздействие агентов, вызывающих эти модификации, может способствовать образованию AP-сайта. [2]
Ионизирующее излучение также может привести к образованию AP-сайта. Облученная среда содержит радикалы, которые могут способствовать образованию AP-сайтов разными способами. Гидроксильные радикалы могут атаковать гликозидные связи, непосредственно создавая AP-сайт, или делать гликозильную связь менее благоприятной, связываясь с основанием или дезоксирибозным кольцом. [2]
Ферменты, а именно ДНК-гликозилазы, также обычно создают AP-сайты как часть пути эксцизионной репарации оснований. По оценкам, в одной клетке млекопитающих в день образуется 5000–10 000 апуриновых сайтов. Апиримидиновые сайты формируются примерно в 20 раз медленнее, по оценкам, около 500 событий образования в день на клетку. При таких высоких показателях для клеток крайне важно иметь надежный аппарат восстановления, чтобы предотвратить мутацию.
Характеристики
[ редактировать ]Химические характеристики
[ редактировать ]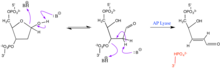
Сайты AP чрезвычайно реактивны. Они колеблются между фуранозным с открытой цепью кольцом и конформацией свободного альдегида и свободного спирта . Воздействие нуклеофила может вызвать реакцию β-элиминирования, при которой 3'- фосфоэфирная связь разрывается, вызывая одноцепочечный разрыв. Эту реакцию может катализировать AP-лиаза . [2] В присутствии избытка реагента может произойти дополнительное отщепление на 5'-стороне. Свободный альдегид может также реагировать с нуклеофильными аминосодержащими альдегидами. Эти реакции могут дополнительно способствовать расщеплению фосфоэфирной связи. Альдегиды, содержащие группы O-HN 2, могут служить для стабилизации абазисного сайта путем реакции с альдегидной группой. Это взаимодействие не разрывает фосфоэфирную связь.
Биологическая активность
[ редактировать ]AP-сайты в живых клетках могут вызывать различные и серьезные последствия, включая гибель клеток. Одноцепочечные разрывы, возникающие в результате β-элиминирования, требуют восстановления ДНК-лигазой, чтобы избежать мутаций. Когда ДНК-полимераза встречает абазический сайт, репликация ДНК обычно блокируется, что само по себе может привести к одноцепочечному или двухцепочечному разрыву спирали ДНК. [4] В E. coli , когда ферменту удается обойти абазический участок, аденин преимущественно включается в новую цепь. [2] [3] Если AP-сайты в ДНК не репарированы, репликация ДНК не может протекать нормально, что может привести к значительным мутациям. [4] Если мутации представляют собой просто однонуклеотидные полиморфизмы , то клетка потенциально может быть незатронутой. Однако при возникновении более серьезных мутаций функция клетки может серьезно нарушиться, рост и деление могут быть нарушены, или клетка может просто погибнуть.
Ремонт
[ редактировать ]AP-сайты являются важной особенностью пути эксцизионной репарации основания. ДНК-гликозилазы сначала создают абазические сайты, распознавая и удаляя модифицированные основания. Существует множество вариантов гликозилазы, способных противостоять множеству способов повреждения основания. Наиболее распространенными обстоятельствами являются алкилирование оснований, окисление и присутствие урацила в цепи ДНК. [4] После успешного создания AP-сайта эндонуклеаза AP катализирует разрыв одной фосфоэфирной связи, создавая разрыв в основной цепи спирали. [4] Разрыв может происходить либо на 3', либо на 5' участке, в зависимости от варианта фермента. Завершите обработку ферментов, затем подготовьте место для Ника. лигирование, которое осуществляется ДНК-полимеразой. [4] Основание, вставляемое в зазубрину, определяется соответствующим основанием на противоположной пряди. Затем разрыв запечатывается ДНК-лигазой.
Активность эндонуклеазы AP в восстановлении участков AP в лобной/теменной коре, мозжечке , стволе головного мозга , среднем мозге и гипоталамусе снижается с возрастом у крыс, находящихся на диете ad libitum . [5] у крыс с ограниченным потреблением калорий активность эндонуклеазы AP в этих областях мозга остается выше с возрастом. Для сравнения, [5] Эти данные позволяют предположить, что повышенное восстановление AP-сайта у животных с ограниченным потреблением калорий может замедлить процесс старения.
Ссылки
[ редактировать ]- ^ Тропп, Бертон (2012). Молекулярная биология . Садбери, Массачусетс: Jones & Bartlett Learning. п. 455. ИСБН 978-1-4496-0091-4 .
- ^ Jump up to: а б с д и Борле, Мириам (1987). «Формирование, обнаружение и восстановление точек доступа». Мутационные исследования . 181 (1): 45–56. дои : 10.1016/0027-5107(87)90286-7 . ПМИД 2444877 .
- ^ Jump up to: а б с Абазовые участки ДНК: репарация и биологические последствия у Saccharomyces cerevisiae. Восстановление ДНК (Амст). 2004 январь 5;3(1):1-12.
- ^ Jump up to: а б с д и ж Линдал, Томас (1993). «Нестабильность и распад первичной структуры ДНК». Природа . 362 (6422): 709–715. Бибкод : 1993Natur.362..709L . дои : 10.1038/362709a0 . ПМИД 8469282 . S2CID 4283694 .
- ^ Jump up to: а б Кисби Дж.Э., Кохама С.Г., Оливас А., Черчвелл М., Дорж Д., Спенглер Е., де Кабо Р., Ингрэм Д.К., Имхоф Б., Бао Г., Коу Ю.В. Влияние ограничения калорий на восстановление основания (BER) в мозге стареющих крыс. Эксп Геронтол. Март 2010 г.;45(3):208-16. doi: 10.1016/j.exger.2009.12.003. Epub 2009, 11 декабря. PMID 20005284; PMCID: PMC2826610