Урацил-ДНК-гликозилаза
| ДА | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | UNG , DGU, HIGM4, HIGM5, UDG, UNG1, UNG15, UNG2, урацил-ДНК-гликозилаза | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | ОМИМ : 191525 ; МГИ : 109352 ; Гомологен : 6585 ; GeneCards : UNG ; ОМА : УНГ – ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Урацил-ДНК-гликозилаза (также известная как УНГ или УДГ ) представляет собой фермент. Его наиболее важной функцией является предотвращение мутагенеза путем устранения урацила из молекул ДНК путем расщепления N-гликозидной связи и инициирования пути репарации с вырезанием оснований (BER).
Функция
[ редактировать ]Ген человека кодирует одну из нескольких урацил-ДНК-гликозилаз. Альтернативное использование промотора и сплайсинг этого гена приводит к образованию двух разных изоформ: митохондриальной UNG1 и ядерной UNG2. [ 5 ] Одной из важных функций урацил-ДНК-гликозилаз является предотвращение мутагенеза путем удаления урацила из молекул ДНК путем расщепления N-гликозидной связи и инициации пути репарации с вырезанием оснований (BER). Основания урацила возникают в результате цитозина дезаминирования или неправильного включения остатков dUMP . После возникновения мутации мутагенная угроза урацила распространяется на все последующие этапы репликации ДНК . [ 6 ] После расстегивания несовпадающие гуанина и урацила пары разделяются, и ДНК-полимераза вставляет комплементарные основания с образованием пары гуанин-цитозин (GC) в одной дочерней цепи и пары аденин -урацил (AU) в другой. [ 7 ] Половина всей ДНК потомства, полученной из мутированной матрицы, наследует сдвиг от GC к AU в сайте мутации. [ 7 ] UDG удаляет урацил как из пар AU, так и из GU, чтобы предотвратить распространение несоответствия оснований на последующие процессы транскрипции и трансляции . [ 7 ] Обладая высокой эффективностью и специфичностью, эта гликозилаза ежедневно восстанавливает 100–500 оснований, поврежденных в клетке человека. [ 8 ] Клетки человека экспрессируют пять-шесть типов ДНК-гликозилаз , все из которых имеют общий механизм выворота и вырезания оснований как средства восстановления ДНК. [ 9 ]
Структура
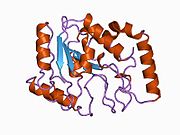
[ редактировать ]UDG состоит из четырехцепочечного параллельного β-листа, окруженного восемью α-спиралями . [ 10 ] Активный центр состоит из пяти высококонсервативных мотивов , которые вместе катализируют расщепление гликозидных связей : [ 11 ] [ 12 ]
- Петля, активирующая воду: 63-QDPYH-67 [ 12 ]
- Про -богатая петля: 165-PPPPS-169 [ 10 ]
- Урацил-связывающий мотив: 199-GVLLLN-204. [ 10 ] [ 11 ]
- Гли - Сер петля: 246-GS-247 [ 10 ]
- петля с малой канавкой Вставочная : 268-HPSPLS-273 [ 10 ] [ 11 ]
Механизм
[ редактировать ]Расщепление гликозидных связей происходит по механизму «пинч-толкай-тяни» с использованием пяти сохранившиеся мотивы. [ 10 ]
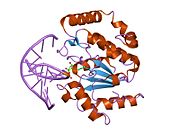
Ущипнуть : UDG сканирует ДНК на наличие урацила, неспецифически связываясь с цепью и создавая излом в магистрали, тем самым позиционируя выбранную базу для обнаружения. Петли Pro-rich и Gly-Ser образуют полярные контакты с 3'- и 5'-фосфатами, фланкирующими исследуемое основание. [ 11 ] Такое сжатие остова ДНК , или «защемление», обеспечивает тесный контакт между UDG и интересующим основанием. [ 10 ]
Толкать : Чтобы полностью оценить идентичность нуклеотида, интеркаляционная петля проникает в малую бороздку ДНК или вталкивается в нее и вызывает конформационные изменения, позволяющие вывернуть нуклеотид из спирали. [ 13 ] Сжатие остова благоприятствует вывороту теперь уже внеспирального нуклеотида, который расположен для распознавания урацил-связывающим мотивом. [ 10 ] Сочетание интеркаляции и выворота помогает компенсировать нарушение благоприятных взаимодействий при укладке оснований внутри спирали ДНК. Leu 272 заполняет пустоту, оставленную перевернутым нуклеотидом, создавая дисперсионные взаимодействия с соседними основаниями и восстанавливая стабильность стэкинга. [ 11 ]
Тянуть : Теперь доступный для активного сайта нуклеотид взаимодействует с мотивом связывания урацила. Форма активного центра дополняет вывернутую структуру урацила, обеспечивая высокую субстратную специфичность. Пурины слишком велики, чтобы поместиться в активном центре, а неблагоприятные взаимодействия с другими пиримидинами препятствуют связыванию альтернативных субстратов. [ 9 ] Боковая цепь Tyr 147 стерически взаимодействует с тимина C5 метильной группой , в то время как специфическая водородная связь урацила O2 между карбонилом и Gln 144 дискриминирует цитозиновый субстрат, в котором отсутствует необходимый карбонил. [ 9 ] После распознавания урацила расщепление гликозидной связи происходит по механизму, описанному ниже.



Положение остатков, которые активируют водный нуклеофил урацила, и протонируют уходящую группу широко обсуждается, хотя наиболее часто используемый механизм использует петлю, активирующую воду, подробно описанную в структуре фермента. [ 12 ] [ 14 ] Независимо от положения, идентичность остатков аспарагиновой кислоты и гистидина одинакова во всех каталитических исследованиях. [ 10 ] [ 11 ] [ 12 ] [ 14 ] [ 15 ]
Лабораторное использование
[ редактировать ]Урацил- N -гликозилаза (UNG) используется для устранения продуктов полимеразной цепной реакции (ПЦР) с переносом в ПЦР. Этот метод модифицирует продукты ПЦР таким образом, что в новой реакции любые остаточные продукты предыдущих амплификаций ПЦР будут расщепляться и предотвращать амплификацию, но истинные матрицы ДНК не будут затронуты. [ 16 ] ПЦР синтезирует большое количество продуктов амплификации в каждом раунде, но загрязнение последующих раундов ПЦР следовыми количествами этих продуктов, называемое переносным загрязнением, дает ложноположительные результаты. Перенос загрязнения от некоторых предыдущих ПЦР может стать серьезной проблемой как из-за обилия продуктов ПЦР, так и из-за идеальной структуры загрязняющего материала для повторной амплификации. Однако переносимое загрязнение можно контролировать с помощью следующих двух этапов: (i) включения dUTP во все продукты ПЦР (путем замены dUTP на dTTP или путем включения урацила во время синтеза праймеров; и (ii) обработки всех последующих полностью предварительно собранных стартовых реакций). с урацил-ДНК-гликозилазой (UDG) с последующей термической инактивацией UDG отщепляет урациловое основание от фосфодиэфирного остова урацил-содержащей ДНК, но не влияет на природную (т. е. тиминсодержащую) ДНК, блокируя образующиеся апиримидиновые сайты. репликация ДНК-полимеразами и очень лабильны к кислотно-основному гидролизу. Поскольку UDG не реагирует с dTTP, а также инактивируется тепловой денатурацией перед фактической ПЦР, переносное загрязнение ПЦР можно эффективно контролировать, если загрязняющие вещества содержат. урацилы вместо тимина. [ 6 ]
Урацил -N -гликозилаза также использовалась в исследовании для обнаружения доказательств продолжающейся низкой метаболической активности и восстановления ДНК у древних бактерий. [ 17 ] Долгосрочное выживание бактерий может происходить либо за счет образования эндоспор (при котором бактерия впадает в полный покой, без какой-либо метаболической активности и, следовательно, без восстановления ДНК), либо за счет снижения метаболической активности до очень низкого уровня. Скорость, достаточная для непрерывного восстановления ДНК и предотвращения истощения других нестабильных молекул (таких как АТФ ), при которой микроб способен восстанавливать повреждения своей ДНК, но при этом продолжает медленно потреблять питательные вещества. [ 17 ] Последовательности ДНК бактерий вечной мерзлоты амплифицировали с помощью ПЦР. В одной серии анализов последовательности ДНК амплифицировались как есть (чтобы обнаружить всю живую бактериальную ДНК в образцах), в то время как в другой серии специально искали ДНК, которая подвергалась постоянной репарации; для этого ДНК обрабатывали УНГ для удаления урацилов. Это предотвращало амплификацию невосстановленной ДНК двумя способами: во-первых, абазиновые сайты, образующиеся в результате удаления урацилов, не позволяли ДНК-полимеразе, используемой в ПЦР, проходить мимо места повреждения, в то время как эти абазитовые сайты также напрямую ослабляли ДНК и повышали вероятность повреждения. фрагментироваться при нагревании. [ 17 ] Таким образом, исследователи смогли продемонстрировать доказательства продолжающейся репарации ДНК у с высоким содержанием GC грамположительных бактерий возрастом до 600 000 лет. [ 17 ]
Урацил-N-гликозилаза также использовалась в методе клонирования фрагментов ДНК, амплифицированных с помощью ПЦР. В этом методе праймеры, используемые в ПЦР, синтезируются с остатками урацила вместо тимина. Когда эти праймеры включаются в ПЦР-амплифицированные фрагменты, последовательность праймера становится восприимчивой к расщеплению урацил-N-гликозилазой и образует 3'-выступающие концы, которые можно отжигать с соответствующим образом приготовленной векторной ДНК. Полученные химерные молекулы можно с высокой эффективностью трансформировать в компетентные клетки без необходимости лигирования in vitro. [ 18 ]
Взаимодействия
[ редактировать ]Было показано, что урацил-ДНК-гликозилаза взаимодействует с RPA2 . [ 19 ]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Перейти обратно: а б с GRCh38: Ensembl, выпуск 89: ENSG00000076248 – Ensembl , май 2017 г.
- ^ Перейти обратно: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000029591 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ген Энтрез: УНГ урацил-ДНК-гликозилаза» . Ncbi.nlm.nih.gov . Проверено 29 декабря 2017 г.
- ^ Перейти обратно: а б Лонго М.С., Бернингер М.С., Хартли Дж.Л. (сентябрь 1990 г.). «Использование урацил-ДНК-гликозилазы для контроля переноса загрязнения в полимеразных цепных реакциях». Джин . 93 (1): 125–8. дои : 10.1016/0378-1119(90)90145-H . ПМИД 2227421 .
- ^ Перейти обратно: а б с Перл Л.Х. (август 2000 г.). «Структура и функции суперсемейства урацил-ДНК-гликозилаз». Мутационные исследования . 460 (3–4): 165–81. дои : 10.1016/S0921-8777(00)00025-2 . ПМИД 10946227 .
- ^ Слупфауг Г., Мол С.Д., Кавли Б., Арваи А.С., Крокан Х.Е., Тайнер Дж.А. (ноябрь 1996 г.). «Механизм переворота нуклеотидов в структуре человеческой урацил-ДНК-гликозилазы, связанной с ДНК». Природа . 384 (6604): 87–92. Бибкод : 1996Natur.384...87S . дои : 10.1038/384087a0 . ПМИД 8900285 . S2CID 4310250 .
- ^ Перейти обратно: а б с Линдал Т. (апрель 2000 г.). «Подавление спонтанного мутагенеза в клетках человека путем вырезания-восстановления оснований ДНК». Мутационные исследования . 462 (2–3): 129–35. дои : 10.1016/S1383-5742(00)00024-7 . ПМИД 10767624 .
- ^ Перейти обратно: а б с д и ж г час я Парих С.С., Патнэм К.Д., Тайнер Дж.А. (август 2000 г.). «Уроки, извлеченные из структурных результатов урацил-ДНК-гликозилазы». Мутационные исследования . 460 (3–4): 183–99. дои : 10.1016/S0921-8777(00)00026-4 . ПМИД 10946228 .
- ^ Перейти обратно: а б с д и ж Жарков Д.О., Мечетин Г.В., Невинский Г.А. (март 2010 г.). «Урацил-ДНК-гликозилаза: структурные, термодинамические и кинетические аспекты поиска и распознавания поражений» . Мутационные исследования . 685 (1–2): 11–20. дои : 10.1016/j.mrfmmm.2009.10.017 . ПМК 3000906 . ПМИД 19909758 .
- ^ Перейти обратно: а б с д Ачарья Н., Кумар П., Варшни У. (июль 2003 г.). «Комплексы белка-ингибитора урацил-ДНК-гликозилазы Ugi с урацил-ДНК-гликозилазами Mycobacterium smegmatis и Mycobacterium Tuberculosis». Микробиология . 149 (Часть 7): 1647–58. дои : 10.1099/mic.0.26228-0 . ПМИД 12855717 .
{{cite journal}}: CS1 maint: неотмеченный бесплатный DOI ( ссылка ) - ^ Мол С.Д., Арваи А.С., Слупфауг Г., Кавли Б., Алсет И., Крокан Х.Е., Тайнер Дж.А. (март 1995 г.). «Кристаллическая структура и мутационный анализ урацил-ДНК-гликозилазы человека: структурные основы специфичности и катализа» . Клетка . 80 (6): 869–78. дои : 10.1016/0092-8674(95)90290-2 . ПМИД 7697717 . S2CID 14851787 .
- ^ Перейти обратно: а б Шорманн Н, Григорян А, Самал А, Кришнан Р, ДеЛукас Л, Чаттопадхай Д (2007). «Кристаллическая структура урацил-ДНК-гликозилазы вируса коровьей оспы обнаруживает димерную сборку» . BMC Структурная биология . 7:45 . дои : 10.1186/1472-6807-7-45 . ЧВК 1936997 . ПМИД 17605817 .
- ^ Савва Р., Маколи-Хехт К., Браун Т., Перл Л. (февраль 1995 г.). «Структурные основы специфической репарации оснований с помощью урацил-ДНК-гликозилазы». Природа . 373 (6514): 487–93. Бибкод : 1995Natur.373..487S . дои : 10.1038/373487a0 . ПМИД 7845459 . S2CID 4315434 .
- ^ «Центры поддержки — Thermo Fisher Scientific» . Abcommunity.thermofisher.com . Проверено 29 декабря 2017 г.
- ^ Перейти обратно: а б с д Джонсон СС; Хебсгаард МБ; Кристенсен Т.Р.; Масстепанов М; Нильсен Р; Мунк К; Марка Т; Гилберт М.Т.; Зубер МТ; Банс М; Рённ Р; Гиличинский Д; Фрёзе Д; Виллерслев Э. (сентябрь 2007 г.). «Древние бактерии демонстрируют доказательства восстановления ДНК» . ПНАС . 104 (36): 14401–5. Бибкод : 2007PNAS..10414401J . дои : 10.1073/pnas.0706787104 . ЧВК 1958816 . ПМИД 17728401 .
- ^ .Аналитическая биохимия 1992;206(1):91-7.
- ^ Нагельхус Т.А., Хауг Т., Сингх К.К., Кешав К.Ф., Скорпен Ф., Оттерлей М., Бхарати С., Линдмо Т., Беничу С., Бенарус Р., Крокан Х.Э. (март 1997 г.). «Последовательность в N-концевой области урацил-ДНК-гликозилазы человека, гомологичная XPA, взаимодействует с С-концевой частью субъединицы 34-кДа репликационного белка А» . Журнал биологической химии . 272 (10): 6561–6. дои : 10.1074/jbc.272.10.6561 . ПМИД 9045683 .