Экстракорпоральное оплодотворение
| Экстракорпоральное оплодотворение | |
|---|---|
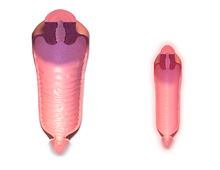
 На этом изображении показана интрацитоплазматическая инъекция спермы — наиболее часто используемый метод ЭКО. | |
| Специальность | Репродуктивная эндокринология и бесплодие |
| МКБ-10-ПКС | 8E0ZXY1 |
Экстракорпоральное оплодотворение ( ЭКО ) — это процесс оплодотворения , при котором яйцеклетка объединяется со спермой in vitro («в стекле»). женщины Этот процесс включает в себя мониторинг и стимуляцию овуляторного процесса , удаление яйцеклетки или яйцеклетки (яйцеклетки или яйцеклеток) из их яичников и предоставление возможности сперме мужчины оплодотворить их в культуральной среде в лаборатории. как оплодотворенная яйцеклетка ( зигота ) подвергается культивированию эмбриона в течение 2–6 дней, ее переносят катетером После того , в матку с целью установления успешной беременности .
ЭКО — это тип вспомогательной репродуктивной технологии, используемый для бесплодия лечения , суррогатного материнства и, в сочетании с предимплантационным генетическим тестированием , для предотвращения передачи генетических заболеваний. Оплодотворенная яйцеклетка донора может имплантироваться в матку суррогатной матери, и полученный в результате ребенок генетически не связан с суррогатной матерью. Некоторые страны запретили или иным образом регулируют доступность лечения ЭКО, что привело к развитию плодородного туризма . Ограничения на доступность ЭКО включают стоимость и возраст, необходимые для того, чтобы человек мог выносить здоровую беременность до срока.
В июле 1978 года Луиза Браун стала первым ребенком, успешно родившимся после того, как ее мать прошла процедуру ЭКО. [1] Браун родилась в результате ЭКО в естественном цикле, без стимуляции. Процедура проходила в больнице доктора Кершоу (ныне хоспис доктора Кершоу) в Ройтоне , Олдем, Англия. Роберт Эдвардс был удостоен Нобелевской премии по физиологии и медицине в 2010 году. Физиолог разработал метод лечения вместе с Патриком Стептоу и эмбриологом Джин Перди, но последние двое не имели права на рассмотрение, поскольку они умерли, а Нобелевская премия не присуждается посмертно. . [2] [3]
Благодаря донорству яйцеклеток и ЭКО многие женщины, которые уже достигли репродуктивного возраста, имеют бесплодных партнеров, имеют идиопатические проблемы с женской фертильностью или достигли менопаузы , которые все еще могут забеременеть. После процедуры ЭКО некоторые пары беременеют без каких-либо методов лечения бесплодия. [4] По оценкам, в 2023 году во всем мире с помощью ЭКО и других вспомогательных репродуктивных технологий родилось двенадцать миллионов детей. [5] Исследование 2019 года, в котором изучаются 10 вспомогательных средств ЭКО (скрининговая гистероскопия, ДГЭА, тестостерон, гормон роста, аспирин, гепарин, антиоксиданты, семенная плазма и ПРП), предполагает, что до тех пор, пока не будет получено больше доказательств, подтверждающих безопасность и эффективность этих вспомогательных средств, их следует использовать избегал. [6]
Терминология
Латинский термин in vitro , означающий «в стекле», используется потому, что ранние биологические эксперименты, включающие культивирование тканей вне живого организма, проводились в стеклянных контейнерах, таких как мензурки, пробирки или чашки Петри. Современный научный термин «in vitro» относится к любой биологической процедуре, выполняемой вне организма, в котором она обычно происходила бы, в отличие от процедуры in vivo (например, оплодотворения in vivo ), при которой ткань остается внутри живого организма. организм, в котором он обычно встречается.
Разговорный термин для детей, зачатых в результате ЭКО, «дети из пробирки» относится к трубчатым контейнерам из стекла или пластиковой смолы, называемым пробирками , которые обычно используются в химических и биологических лабораториях. Однако ЭКО обычно проводят в чашках Петри , которые одновременно шире и мельче и часто используются для культивирования культур.
ЭКО – это форма вспомогательных репродуктивных технологий .
История
Первое успешное рождение ребенка после лечения ЭКО Луизы Браун произошло в 1978 году. Луиза Браун родилась в результате ЭКО в естественном цикле, при котором не проводилось никакой стимуляции. Процедура проходила в больнице доктора Кершоу (ныне хоспис доктора Кершоу) в Ройтоне , Олдем, Англия. Роберт Дж. Эдвардс , физиолог, разработавший метод лечения, был удостоен Нобелевской премии по физиологии и медицине в 2010 году. Его коллеги, Патрик Стептоу и Джин Перди , не имели права на рассмотрение, поскольку Нобелевская премия не присуждается посмертно. . [2] [3]
Второе успешное рождение «ребенка из пробирки» произошло в Индии 3 октября 1978 года, всего через 67 дней после рождения Луизы Браун. Девочка по имени Дурга была зачата in vitro с использованием метода, разработанного независимо Субхашем Мукхопадхьяем , врачом и исследователем из Хазарибага . Мухопадьяй проводил эксперименты самостоятельно, используя примитивные инструменты и бытовой холодильник. [7] Однако власти штата не позволили ему представить свои работы на научных конференциях. [8] и прошло много лет, прежде чем вклад Мукхопадьяя был признан в работах, посвященных этой теме. [9] [ нужен лучший источник ]
Адриана Илиеску была рекордсменом самой старой женщины, родившей ребенка с помощью ЭКО и донорской яйцеклетки: она родила в 2004 году в возрасте 66 лет, рекорд был установлен в 2006 году. После процедуры ЭКО некоторые пары могут забеременеть без каких-либо лечение бесплодия. [4] По оценкам, в 2018 году во всем мире с помощью ЭКО и других вспомогательных репродуктивных технологий родилось восемь миллионов детей. [10]
Медицинское использование
Показания
ЭКО может быть использовано для преодоления женского бесплодия , когда оно вызвано проблемами с маточными трубами , что затрудняет экстракорпоральное оплодотворение. Он также может помочь при мужском бесплодии , в тех случаях, когда имеется дефект качества спермы ; в таких ситуациях можно использовать интрацитоплазматическую инъекцию сперматозоида (ИКСИ), при которой сперматозоид вводится непосредственно в яйцеклетку. Это используется, когда сперме трудно проникнуть в яйцеклетку. ИКСИ также используется, когда количество сперматозоидов очень низкое. Было обнаружено, что при наличии показаний использование ИКСИ увеличивает вероятность успеха ЭКО.
Согласно рекомендациям Национального института здравоохранения и передового опыта Великобритании (NICE), лечение ЭКО целесообразно в случаях необъяснимого бесплодия у людей, которые не смогли зачать ребенка после 2 лет регулярных незащищенных половых контактов. [11]
У людей с ановуляцией это может быть альтернативой после 7–12 попыток индукции овуляции , поскольку последняя является дорогостоящей и ее легче контролировать. [12]
Показатели успеха
Показатели успеха ЭКО — это процент всех процедур ЭКО, которые привели к благоприятным результатам. В зависимости от типа используемого расчета этот результат может представлять собой количество подтвержденных беременностей, называемое коэффициентом беременности , или количество живорождений, называемое коэффициентом живорождения . Благодаря достижениям в области репродуктивных технологий, уровень живорождения к пятому циклу ЭКО увеличился с 76% в 2005 году до 80% в 2010 году, несмотря на сокращение количества переносимых эмбрионов (что снизило коэффициент многоплодия с 25% до 8 %). [13]
Вероятность успеха зависит от переменных факторов, таких как возраст женщины, причина бесплодия, статус эмбриона, репродуктивный анамнез и факторы образа жизни. Более молодые кандидаты на ЭКО имеют больше шансов забеременеть. Люди старше 41 года с большей вероятностью забеременеют от донорской яйцеклетки. [14] Люди, которые ранее были беременны, во многих случаях более успешны в лечении ЭКО, чем те, кто никогда не был беременен. [14]
Живорождения
Показатель живорождения – это процент всех циклов ЭКО, которые привели к рождению живого ребенка. В этот показатель не включены выкидыши и мертворождения ; Рождения нескольких порядков, например двойни и тройни, считаются за одну беременность.
В сводном отчете за 2021 год, составленном Обществом вспомогательных репродуктивных технологий (SART), в котором сообщается о средних показателях успеха ЭКО в Соединенных Штатах в каждой возрастной группе с использованием недонорских яйцеклеток, собраны следующие данные: [15]
| < 35 | 35–37 | 38–40 | 41–42 | > 42 | |
|---|---|---|---|---|---|
| Коэффициент живорождения (%) | 54 | 40.5 | 26 | 13.3 | 4 |
В 2006 году канадские клиники сообщили о показателе живорождения в 27%. [16] Показатели рождаемости у более молодых пациентов были немного выше: показатель успеха составил 35,3% для пациентов в возрасте 21 года и моложе, согласно оценке самой молодой группы. Показатели успеха для пожилых пациентов также были ниже и уменьшались с возрастом: 37-летние составили 27,4%, а у пациентов старше 48 лет не было живорождений, как оценивала самая старшая группа. [17] Некоторые клиники превысили эти показатели, но невозможно определить, связано ли это с превосходной техникой или отбором пациентов, поскольку можно искусственно увеличить показатели успеха, отказываясь принимать самых трудных пациентов или направляя их на ооцитов циклы донорства (что составляются отдельно). Кроме того, вероятность наступления беременности может быть увеличена за счет размещения нескольких эмбрионов с риском увеличения шанса на многократную беременность.
Because not each IVF cycle that is started will lead to oocyte retrieval or embryo transfer, reports of live birth rates need to specify the denominator, namely IVF cycles started, IVF retrievals, or embryo transfers. The SART summarised 2008–9 success rates for US clinics for fresh embryo cycles that did not involve donor eggs and gave live birth rates by the age of the prospective mother, with a peak at 41.3% per cycle started and 47.3% per embryo transfer for patients under 35 years of age.
IVF attempts in multiple cycles result in increased cumulative live birth rates. Depending on the demographic group, one study reported 45% to 53% for three attempts, and 51% to 71% to 80% for six attempts.[18]
According to the 2021 National Summary Report compiled by the Society for Assisted Reproductive Technology (SART), the mean number of embryos transfers for patients achieving live birth go as follows:[19]
| < 35 | 35–37 | 38–40 | 41–42 | > 42 | |
|---|---|---|---|---|---|
| Mean # of transfers | 1.33 | 1.28 | 1.19 | 1.11 | 1.10 |
Effective from 15 February 2021 the majority of Australian IVF clinics publish their individual success rate online via YourIVFSuccess.com.au. This site also contains a predictor tool.[20]
Pregnancy rate
Pregnancy rate may be defined in various ways. In the United States, SART and the Centers for Disease Control (and appearing in the table in the Success Rates section above) include statistics on positive pregnancy test and clinical pregnancy rate.
The 2019 summary compiled by the SART the following data for non-donor eggs (first embryo transfer) in the United States:[21]
| <35 | 35-37 | 38-40 | 41–42 | >42 | |
|---|---|---|---|---|---|
| Positive pregnancy test rate (%) | 55.1 | 44.8 | 32.9 | 19.1 | 8.5 |
| Clinical pregnancy rate (%) | 47.5 | 38.3 | 27.5 | 15.5 | 6.3 |
In 2006, Canadian clinics reported an average pregnancy rate of 35%.[16] A French study estimated that 66% of patients starting IVF treatment finally succeed in having a child (40% during the IVF treatment at the centre and 26% after IVF discontinuation). Achievement of having a child after IVF discontinuation was mainly due to adoption (46%) or spontaneous pregnancy (42%).[22]
Miscarriage rate
According to a study done by the Mayo Clinic, miscarriage rates for IVF are somewhere between 15 and 25% for those under the age of 35.[23] In naturally conceived pregnancies, the rate of miscarriage is between 10 and 20% for those under the age of 35.[24] Risk of miscarriage, regardless of the method of conception, does increase with age.[23]
Predictors of success
The main potential factors that influence pregnancy (and live birth) rates in IVF have been suggested to be maternal age, duration of infertility or subfertility, bFSH and number of oocytes, all reflecting ovarian function.[25] Optimal age is 23–39 years at time of treatment.[26]

Biomarkers that affect the pregnancy chances of IVF include:
- Antral follicle count, with higher count giving higher success rates.[28]
- Anti-Müllerian hormone levels, with higher levels indicating higher chances of pregnancy,[28] as well as of live birth after IVF, even after adjusting for age.[29]
- Level of DNA fragmentation[30] as measured, e.g. by Comet assay, advanced maternal age and semen quality.
- People with ovary-specific FMR1 genotypes including het-norm/low have significantly decreased pregnancy chances in IVF.[31]
- Progesterone elevation on the day of induction of final maturation is associated with lower pregnancy rates in IVF cycles in women undergoing ovarian stimulation using GnRH analogues and gonadotrophins.[32] At this time, compared to a progesterone level below 0.8 ng/ml, a level between 0.8 and 1.1 ng/ml confers an odds ratio of pregnancy of approximately 0.8, and a level between 1.2 and 3.0 ng/ml confers an odds ratio of pregnancy of between 0.6 and 0.7.[32] On the other hand, progesterone elevation does not seem to confer a decreased chance of pregnancy in frozen–thawed cycles and cycles with egg donation.[32]
- Characteristics of cells from the cumulus oophorus and the membrana granulosa, which are easily aspirated during oocyte retrieval. These cells are closely associated with the oocyte and share the same microenvironment, and the rate of expression of certain genes in such cells are associated with higher or lower pregnancy rate.[33]
- An endometrial thickness (EMT) of less than 7 mm decreases the pregnancy rate by an odds ratio of approximately 0.4 compared to an EMT of over 7 mm. However, such low thickness rarely occurs, and any routine use of this parameter is regarded as not justified.[34]
Other determinants of outcome of IVF include:
- As maternal age increases, the likelihood of conception decreases[35] and the chance of miscarriage increases.[36]
- With increasing paternal age, especially 50 years and older, the rate of blastocyst formation decreases.[37]
- Tobacco smoking reduces the chances of IVF producing a live birth by 34% and increases the risk of an IVF pregnancy miscarrying by 30%.[38]
- A body mass index (BMI) over 27 causes a 33% decrease in likelihood to have a live birth after the first cycle of IVF, compared to those with a BMI between 20 and 27.[38] Also, pregnant people who are obese have higher rates of miscarriage, gestational diabetes, hypertension, thromboembolism and problems during delivery, as well as leading to an increased risk of fetal congenital abnormality.[38] Ideal body mass index is 19–30,[26] and many clinics restrict this BMI range as a criterion for initiation of the IVF process.[39]
- Salpingectomy or laparoscopic tubal occlusion before IVF treatment increases chances for people with hydrosalpinges.[26][40]
- Success with previous pregnancy and/or live birth increases chances[26]
- Low alcohol/caffeine intake increases success rate[26]
- The number of embryos transferred in the treatment cycle[41]
- Embryo quality
- Some studies also suggest that autoimmune disease may also play a role in decreasing IVF success rates by interfering with the proper implantation of the embryo after transfer.[31]
Aspirin is sometimes prescribed to people for the purpose of increasing the chances of conception by IVF, but as of 2016[update] there was no evidence to show that it is safe and effective.[42][43]
A 2013 review and meta analysis of randomised controlled trials of acupuncture as an adjuvant therapy in IVF found no overall benefit, and concluded that an apparent benefit detected in a subset of published trials where the control group (those not using acupuncture) experienced a lower than average rate of pregnancy requires further study, due to the possibility of publication bias and other factors.[44]
A Cochrane review came to the result that endometrial injury performed in the month prior to ovarian induction appeared to increase both the live birth rate and clinical pregnancy rate in IVF compared with no endometrial injury. There was no evidence of a difference between the groups in miscarriage, multiple pregnancy or bleeding rates. Evidence suggested that endometrial injury on the day of oocyte retrieval was associated with a lower live birth or ongoing pregnancy rate.[40]
Intake of antioxidants (such as N-acetyl-cysteine, melatonin, vitamin A, vitamin C, vitamin E, folic acid, myo-inositol, zinc or selenium) has not been associated with a significantly increased live birth rate or clinical pregnancy rate in IVF according to Cochrane reviews.[40] The review found that oral antioxidants given to the sperm donor with male factor or unexplained subfertility may improve live birth rates, but more evidence is needed.[40]
A Cochrane review in 2015 came to the result that there is no evidence identified regarding the effect of preconception lifestyle advice on the chance of a live birth outcome.[40]
Method
This section needs additional citations for verification. (July 2020) |

Theoretically, IVF could be performed by collecting the contents from the fallopian tubes or uterus after natural ovulation, mixing it with sperm, and reinserting the fertilised ova into the uterus. However, without additional techniques, the chances of pregnancy would be extremely small. The additional techniques that are routinely used in IVF include ovarian hyperstimulation to generate multiple eggs, ultrasound-guided transvaginal oocyte retrieval directly from the ovaries, co-incubation of eggs and sperm, as well as culture and selection of resultant embryos before embryo transfer into a uterus.
Ovarian hyperstimulation
Ovarian hyperstimulation is the stimulation to induce development of multiple follicles of the ovaries. It should start with response prediction by e.g. age, antral follicle count and level of anti-Müllerian hormone.[45] The resulting prediction of e.g. poor or hyper-response to ovarian hyperstimulation determines the protocol and dosage for ovarian hyperstimulation.[45]
Ovarian hyperstimulation also includes suppression of spontaneous ovulation, for which two main methods are available: Using a (usually longer) GnRH agonist protocol or a (usually shorter) GnRH antagonist protocol.[45] In a standard long GnRH agonist protocol the day when hyperstimulation treatment is started and the expected day of later oocyte retrieval can be chosen to conform to personal choice, while in a GnRH antagonist protocol it must be adapted to the spontaneous onset of the previous menstruation. On the other hand, the GnRH antagonist protocol has a lower risk of ovarian hyperstimulation syndrome (OHSS), which is a life-threatening complication.[45]
For the ovarian hyperstimulation in itself, injectable gonadotropins (usually FSH analogues) are generally used under close monitoring. Such monitoring frequently checks the estradiol level and, by means of gynecologic ultrasonography, follicular growth. Typically approximately 10 days of injections will be necessary.
When stimulating ovulation after suppressing endogenous secretion, it is necessary to supply exogenous gonadotropines. The most common one is the human menopausal gonadotropin (hMG), which is obtained by donation of menopausal women. Other pharmacological preparations are FSH+LH or coripholitropine alpha.
Natural IVF
There are several methods termed natural cycle IVF:[46]
- IVF using no drugs for ovarian hyperstimulation, while drugs for ovulation suppression may still be used.
- IVF using ovarian hyperstimulation, including gonadotropins, but with a GnRH antagonist protocol so that the cycle initiates from natural mechanisms.
- Frozen embryo transfer; IVF using ovarian hyperstimulation, followed by embryo cryopreservation, followed by embryo transfer in a later, natural, cycle.[47]
IVF using no drugs for ovarian hyperstimulation was the method for the conception of Louise Brown. This method can be successfully used when people want to avoid taking ovarian stimulating drugs with its associated side-effects. HFEA has estimated the live birth rate to be approximately 1.3% per IVF cycle using no hyperstimulation drugs for women aged between 40 and 42.[48]
Mild IVF[49] is a method where a small dose of ovarian stimulating drugs are used for a short duration during a natural menstrual cycle aimed at producing 2–7 eggs and creating healthy embryos. This method appears to be an advance in the field to reduce complications and side-effects for women, and it is aimed at quality, and not quantity of eggs and embryos. One study comparing a mild treatment (mild ovarian stimulation with GnRH antagonist co-treatment combined with single embryo transfer) to a standard treatment (stimulation with a GnRH agonist long-protocol and transfer of two embryos) came to the result that the proportions of cumulative pregnancies that resulted in term live birth after 1 year were 43.4% with mild treatment and 44.7% with standard treatment.[50] Mild IVF can be cheaper than conventional IVF and with a significantly reduced risk of multiple gestation and OHSS.[51]
Final maturation induction
When the ovarian follicles have reached a certain degree of development, induction of final oocyte maturation is performed, generally by an injection of human chorionic gonadotropin (hCG). Commonly, this is known as the "trigger shot."[52] hCG acts as an analogue of luteinising hormone, and ovulation would occur between 38 and 40 hours after a single HCG injection,[53] but the egg retrieval is performed at a time usually between 34 and 36 hours after hCG injection, that is, just prior to when the follicles would rupture. This avails for scheduling the egg retrieval procedure at a time where the eggs are fully mature. HCG injection confers a risk of ovarian hyperstimulation syndrome. Using a GnRH agonist instead of hCG eliminates most of the risk of ovarian hyperstimulation syndrome, but with a reduced delivery rate if the embryos are transferred fresh.[54] For this reason, many centers will freeze all oocytes or embryos following agonist trigger.
Egg retrieval
The eggs are retrieved from the patient using a transvaginal technique called transvaginal ultrasound aspiration involving an ultrasound-guided needle being injected through follicles upon collection. Through this needle, the oocyte and follicular fluid are aspirated and the follicular fluid is then passed to an embryologist to identify ova. It is common to remove between ten and thirty eggs. The retrieval process, which lasts approximately 20 to 40 minutes, is performed under conscious sedation or general anesthesia to ensure patient comfort. Following optimal follicular development, the eggs are meticulously retrieved using transvaginal ultrasound guidance with the aid of a specialised ultrasound probe and a fine needle aspiration technique. The follicular fluid, containing the retrieved eggs, is expeditiously transferred to the embryology laboratory for subsequent processing.[55]
Egg and sperm preparation
In the laboratory, for ICSI treatments, the identified eggs are stripped of surrounding cells (also known as cumulus cells) and prepared for fertilisation. An oocyte selection may be performed prior to fertilisation to select eggs that can be fertilised, as it is required they are in metaphase II. There are cases in which if oocytes are in the metaphase I stage, they can be kept being cultured so as to undergo a posterior sperm injection. In the meantime, semen is prepared for fertilisation by removing inactive cells and seminal fluid in a process called sperm washing. If semen is being provided by a sperm donor, it will usually have been prepared for treatment before being frozen and quarantined, and it will be thawed ready for use.[citation needed]
Co-incubation

The sperm and the egg are incubated together at a ratio of about 75,000:1 in a culture media in order for the actual fertilisation to take place. A review in 2013 came to the result that a duration of this co-incubation of about 1 to 4 hours results in significantly higher pregnancy rates than 16 to 24 hours.[56] In most cases, the egg will be fertilised during co-incubation and will show two pronuclei. In certain situations, such as low sperm count or motility, a single sperm may be injected directly into the egg using intracytoplasmic sperm injection (ICSI). The fertilised egg is passed to a special growth medium and left for about 48 hours until the embryo consists of six to eight cells.
In gamete intrafallopian transfer, eggs are removed from the woman and placed in one of the fallopian tubes, along with the man's sperm. This allows fertilisation to take place inside the woman's body. Therefore, this variation is actually an in vivo fertilisation, not in vitro.[57][58]
Embryo culture
The main durations of embryo culture are until cleavage stage (day two to four after co-incubation) or the blastocyst stage (day five or six after co-incubation).[59] Embryo culture until the blastocyst stage confers a significant increase in live birth rate per embryo transfer, but also confers a decreased number of embryos available for transfer and embryo cryopreservation, so the cumulative clinical pregnancy rates are increased with cleavage stage transfer.[40] Transfer day two instead of day three after fertilisation has no differences in live birth rate.[40] There are significantly higher odds of preterm birth (odds ratio 1.3) and congenital anomalies (odds ratio 1.3) among births having from embryos cultured until the blastocyst stage compared with cleavage stage.[59]
Embryo selection
Laboratories have developed grading methods to judge ovocyte and embryo quality. In order to optimise pregnancy rates, there is significant evidence that a morphological scoring system is the best strategy for the selection of embryos.[60] Since 2009 where the first time-lapse microscopy system for IVF was approved for clinical use, morphokinetic scoring systems has shown to improve to pregnancy rates further.[61] However, when all different types of time-lapse embryo imaging devices, with or without morphokinetic scoring systems, are compared against conventional embryo assessment for IVF, there is insufficient evidence of a difference in live-birth, pregnancy, stillbirth or miscarriage to choose between them.[62] Active efforts to develop a more accurate embryo selection analysis based on Artificial Intelligence and Deep Learning are underway. Embryo Ranking Intelligent Classification Assistant (ERICA),[63] is a clear example. This Deep Learning software substitutes manual classifications with a ranking system based on an individual embryo's predicted genetic status in a non-invasive fashion.[64] Studies on this area are still pending and current feasibility studies support its potential.[65]
Embryo transfer
The number to be transferred depends on the number available, the age of the patient and other health and diagnostic factors. In countries such as Canada, the UK, Australia and New Zealand, a maximum of two embryos are transferred except in unusual circumstances. In the UK and according to HFEA regulations, a woman over 40 may have up to three embryos transferred, whereas in the US, there is no legal limit on the number of embryos which may be transferred, although medical associations have provided practice guidelines. Most clinics and country regulatory bodies seek to minimise the risk of multiple pregnancy, as it is not uncommon for multiple embryos to implant if multiple embryos are transferred. Embryos are transferred to the patient's uterus through a thin, plastic catheter, which goes through their vagina and cervix. Several embryos may be passed into the uterus to improve chances of implantation and pregnancy.[66][67]
Luteal support
Luteal support is the administration of medication, generally progesterone, progestins, hCG, or GnRH agonists, and often accompanied by estradiol, to increase the success rate of implantation and early embryogenesis, thereby complementing and/or supporting the function of the corpus luteum. A Cochrane review found that hCG or progesterone given during the luteal phase may be associated with higher rates of live birth or ongoing pregnancy, but that the evidence is not conclusive.[68] Co-treatment with GnRH agonists appears to improve outcomes,[68] by a live birth rate RD of +16% (95% confidence interval +10 to +22%).[69] On the other hand, growth hormone or aspirin as adjunctive medication in IVF have no evidence of overall benefit.[40]
Expansions
There are various expansions or additional techniques that can be applied in IVF, which are usually not necessary for the IVF procedure itself, but would be virtually impossible or technically difficult to perform without concomitantly performing methods of IVF.
Preimplantation genetic screening or diagnosis
Preimplantation genetic screening (PGS) or preimplantation genetic diagnosis (PGD) has been suggested to be able to be used in IVF to select an embryo that appears to have the greatest chances for successful pregnancy. However, a systematic review and meta-analysis of existing randomised controlled trials came to the result that there is no evidence of a beneficial effect of PGS with cleavage-stage biopsy as measured by live birth rate.[70] On the contrary, for those of advanced maternal age, PGS with cleavage-stage biopsy significantly lowers the live birth rate.[70] Technical drawbacks, such as the invasiveness of the biopsy, and non-representative samples because of mosaicism are the major underlying factors for inefficacy of PGS.[70]
Still, as an expansion of IVF, patients who can benefit from PGS/PGD include:
- Those who have a family history of inherited disease
- Those who want prenatal sex discernment. This can be used to diagnose monogenic disorders with sex linkage. It can potentially be used for sex selection, wherein a fetus is aborted if having an undesired sex.
- Those who already have a child with an incurable disease and need compatible cells from a second healthy child to cure the first, resulting in a "saviour sibling" that matches the sick child in HLA type.[71]
PGS screens for numeral chromosomal abnormalities while PGD diagnosis the specific molecular defect of the inherited disease. In both PGS and PGD, individual cells from a pre-embryo, or preferably trophectoderm cells biopsied from a blastocyst, are analysed during the IVF process. Before the transfer of a pre-embryo back to a person's uterus, one or two cells are removed from the pre-embryos (8-cell stage), or preferably from a blastocyst. These cells are then evaluated for normality. Typically within one to two days, following completion of the evaluation, only the normal pre-embryos are transferred back to the uterus. Alternatively, a blastocyst can be cryopreserved via vitrification and transferred at a later date to the uterus. In addition, PGS can significantly reduce the risk of multiple pregnancies because fewer embryos, ideally just one, are needed for implantation.
Cryopreservation
Cryopreservation can be performed as oocyte cryopreservation before fertilisation, or as embryo cryopreservation after fertilisation.
The Rand Consulting Group has estimated there to be 400,000 frozen embryos in the United States in 2006.[72] The advantage is that patients who fail to conceive may become pregnant using such embryos without having to go through a full IVF cycle. Or, if pregnancy occurred, they could return later for another pregnancy. Spare oocytes or embryos resulting from fertility treatments may be used for oocyte donation or embryo donation to another aspiring parent, and embryos may be created, frozen and stored specifically for transfer and donation by using donor eggs and sperm. Also, oocyte cryopreservation can be used for those who are likely to lose their ovarian reserve due to undergoing chemotherapy.[73]
By 2017, many centres have adopted embryo cryopreservation as their primary IVF therapy, and perform few or no fresh embryo transfers. The two main reasons for this have been better endometrial receptivity when embryos are transferred in cycles without exposure to ovarian stimulation and also the ability to store the embryos while awaiting the results of preimplantation genetic testing.
The outcome from using cryopreserved embryos has uniformly been positive with no increase in birth defects or development abnormalities.[74]
Other expansions
- Intracytoplasmic sperm injection (ICSI) is where a single sperm is injected directly into an egg. Its main usage as an expansion of IVF is to overcome male infertility problems, although it may also be used where eggs cannot easily be penetrated by sperm, and occasionally in conjunction with sperm donation. It can be used in teratozoospermia, since once the egg is fertilised abnormal sperm morphology does not appear to influence blastocyst development or blastocyst morphology.[75]
- Additional methods of embryo profiling. For example, methods are emerging in making comprehensive analyses of up to entire genomes, transcriptomes, proteomes and metabolomes which may be used to score embryos by comparing the patterns with ones that have previously been found among embryos in successful versus unsuccessful pregnancies.[76]
- Assisted zona hatching (AZH) can be performed shortly before the embryo is transferred to the uterus. A small opening is made in the outer layer surrounding the egg in order to help the embryo hatch out and aid in the implantation process of the growing embryo.
- In egg donation and embryo donation, the resultant embryo after fertilisation is inserted in another person than the one providing the eggs. These are resources for those with no eggs due to surgery, chemotherapy, or genetic causes; or with poor egg quality, previously unsuccessful IVF cycles or advanced maternal age. In the egg donor process, eggs are retrieved from a donor's ovaries, fertilised in the laboratory with sperm, and the resulting healthy embryos are returned to the recipient's uterus.
- In oocyte selection, the oocytes with optimal chances of live birth can be chosen. It can also be used as a means of preimplantation genetic screening.
- Embryo splitting can be used for twinning to increase the number of available embryos.[77]
- Cytoplasmic transfer is where the cytoplasm from a donor egg is injected into an egg with compromised mitochondria. The resulting egg is then fertilised with sperm and introduced into a uterus, usually that of the person who provided the recipient egg and nuclear DNA. Cytoplasmic transfer was created to aid those who experience infertility due to deficient or damaged mitochondria, contained within an egg's cytoplasm.
Complications and health effects
Multiple births
The major complication of IVF is the risk of multiple births. This is directly related to the practice of transferring multiple embryos at embryo transfer. Multiple births are related to increased risk of pregnancy loss, obstetrical complications, prematurity, and neonatal morbidity with the potential for long term damage. Strict limits on the number of embryos that may be transferred have been enacted in some countries (e.g. Britain, Belgium) to reduce the risk of high-order multiples (triplets or more), but are not universally followed or accepted. Spontaneous splitting of embryos in the uterus after transfer can occur, but this is rare and would lead to identical twins. A double blind, randomised study followed IVF pregnancies that resulted in 73 infants, and reported that 8.7% of singleton infants and 54.2% of twins had a birth weight of less than 2,500 grams (5.5 lb).[78] There is some evidence that making a double embryo transfer during one cycle achieves a higher live birth rate than a single embryo transfer; but making two single embryo transfers in two cycles has the same live birth rate and would avoid multiple pregnancies.[79]
Sex ratio distortions
Certain kinds of IVF have been shown to lead to distortions in the sex ratio at birth. Intracytoplasmic sperm injection (ICSI), which was first applied in 1991, leads to slightly more female births (51.3% female). Blastocyst transfer, which was first applied in 1984, leads to significantly more male births (56.1% male). Standard IVF done at the second or third day leads to a normal sex ratio.[citation needed]
Epigenetic modifications caused by extended culture leading to the death of more female embryos has been theorised as the reason why blastocyst transfer leads to a higher male sex ratio; however, adding retinoic acid to the culture can bring this ratio back to normal.[80] A second theory is that the male-biased sex ratio may due to a higher rate of selection of male embryos. Male embryos develop faster in vitro, and thus may appear more viable for transfer.[81]
Spread of infectious disease
By sperm washing, the risk that a chronic disease in the individual providing the sperm would infect the birthing parent or offspring can be brought to negligible levels.
If the sperm donor has hepatitis B, The Practice Committee of the American Society for Reproductive Medicine advises that sperm washing is not necessary in IVF to prevent transmission, unless the birthing partner has not been effectively vaccinated.[82][83] In birthing people with hepatitis B, the risk of vertical transmission during IVF is no different from the risk in spontaneous conception.[83] However, there is not enough evidence to say that ICSI procedures are safe in birthing people with hepatitis B in regard to vertical transmission to the offspring.[83]
Regarding potential spread of HIV/AIDS, Japan's government prohibited the use of IVF procedures in which both partners are infected with HIV. Despite the fact that the ethics committees previously allowed the Ogikubo, Tokyo Hospital, located in Tokyo, to use IVF for couples with HIV, the Ministry of Health, Labour and Welfare of Japan decided to block the practice. Hideji Hanabusa, the vice president of the Ogikubo Hospital, states that together with his colleagues, he managed to develop a method through which scientists are able to remove HIV from sperm.[84]
In the United States, people seeking to be an embryo recipient undergo infectious disease screening required by the Food and Drug Administration (FDA), and reproductive tests to determine the best placement location and cycle timing before the actual embryo transfer occurs. The amount of screening the embryo has already undergone is largely dependent on the genetic parents' own IVF clinic and process. The embryo recipient may elect to have their own embryologist conduct further testing.
Other risks to the egg provider/retriever
A risk of ovarian stimulation is the development of ovarian hyperstimulation syndrome, particularly if hCG is used for inducing final oocyte maturation. This results in swollen, painful ovaries. It occurs in 30% of patients. Mild cases can be treated with over the counter medications and cases can be resolved in the absence of pregnancy. In moderate cases, ovaries swell and fluid accumulated in the abdominal cavities and may have symptoms of heartburn, gas, nausea or loss of appetite. In severe cases, patients have sudden excess abdominal pain, nausea, vomiting and will result in hospitalisation.
During egg retrieval, there exists a small chance of bleeding, infection, and damage to surrounding structures such as bowel and bladder (transvaginal ultrasound aspiration) as well as difficulty in breathing, chest infection, allergic reactions to medication, or nerve damage (laparoscopy).
Ectopic pregnancy may also occur if a fertilised egg develops outside the uterus, usually in the fallopian tubes and requires immediate destruction of the foetus.
IVF does not seem to be associated with an elevated risk of cervical cancer, nor with ovarian cancer or endometrial cancer when neutralising the confounder of infertility itself.[85] Nor does it seem to impart any increased risk for breast cancer.[86]
Regardless of pregnancy result, IVF treatment is usually stressful for patients.[87] Neuroticism and the use of escapist coping strategies are associated with a higher degree of distress, while the presence of social support has a relieving effect.[87] A negative pregnancy test after IVF is associated with an increased risk for depression, but not with any increased risk of developing anxiety disorders.[88] Pregnancy test results do not seem to be a risk factor for depression or anxiety among men when the relationships is between two cisgender, heterosexual people.[88] Hormonal agents such as gonadotropin-releasing hormone agonist (GnRH agonist) are associated with depression.[89]
Studies show that there is an increased risk of venous thrombosis or pulmonary embolism during the first trimester of IVF.[90] When looking at long-term studies comparing patients who received or did not receive IVF, there seems to be no correlation with increased risk of cardiac events. There are more ongoing studies to solidify this.[91]
Spontaneous pregnancy has occurred after successful and unsuccessful IVF treatments.[92] Within 2 years of delivering an infant conceived through IVF, subfertile patients had a conception rate of 18%.[93]
Birth defects
A review in 2013 came to the result that infants resulting from IVF (with or without ICSI) have a relative risk of birth defects of 1.32 (95% confidence interval 1.24–1.42) compared to naturally conceived infants.[94] In 2008, an analysis of the data of the National Birth Defects Study in the US found that certain birth defects were significantly more common in infants conceived through IVF, notably septal heart defects, cleft lip with or without cleft palate, esophageal atresia, and anorectal atresia; the mechanism of causality is unclear.[95] However, in a population-wide cohort study of 308,974 births (with 6,163 using assisted reproductive technology and following children from birth to age five) researchers found: "The increased risk of birth defects associated with IVF was no longer significant after adjustment for parental factors."[96] Parental factors included known independent risks for birth defects such as maternal age, smoking status, etc. Multivariate correction did not remove the significance of the association of birth defects and ICSI (corrected odds ratio 1.57), although the authors speculate that underlying male infertility factors (which would be associated with the use of ICSI) may contribute to this observation and were not able to correct for these confounders. The authors also found that a history of infertility elevated risk itself in the absence of any treatment (odds ratio 1.29), consistent with a Danish national registry study[97] and "implicates patient factors in this increased risk." The authors of the Danish national registry study speculate: "our results suggest that the reported increased prevalence of congenital malformations seen in singletons born after assisted reproductive technology is partly due to the underlying infertility or its determinants."
| Condition | Relative risk | 95% confidence interval |
|---|---|---|
| Beckwith–Wiedemann syndrome | 3-4 | |
| congenital anomalies | 1.67 | 1.33–2.09 |
| ante-partum haemorrhage | 2.49 | 2.30–2.69 |
| hypertensive disorders of pregnancy | 1.49 | 1.39–1.59 |
| preterm rupture of membranes | 1.16 | 1.07–1.26 |
| Caesarean section | 1.56 | 1.51–1.60 |
| gestational diabetes | 1.48 | 1.33–1.66 |
| induction of labour | 1.18 | 1.10–1.28 |
| small for gestational age | 1.39 | 1.27–1.53 |
| preterm birth | 1.54 | 1.47–1.62 |
| low birthweight | 1.65 | 1.56–1.75 |
| perinatal mortality | 1.87 | 1.48–2.37 |
Other risks to the offspring
If the underlying infertility is related to abnormalities in spermatogenesis, it is plausible, but too early to examine that male offspring are at higher risk for sperm abnormalities.[clarification needed]
IVF does not seem to confer any risks regarding cognitive development, school performance, social functioning, and behaviour.[99] Also, IVF infants are known to be as securely attached to their parents as those who were naturally conceived, and IVF adolescents are as well-adjusted as those who have been naturally conceived.[100]
Limited long-term follow-up data suggest that IVF may be associated with an increased incidence of hypertension, impaired fasting glucose, increase in total body fat composition, advancement of bone age, subclinical thyroid disorder, early adulthood clinical depression and binge drinking in the offspring.[99][101] It is not known, however, whether these potential associations are caused by the IVF procedure in itself, by adverse obstetric outcomes associated with IVF, by the genetic origin of the children or by yet unknown IVF-associated causes.[99][101] Increases in embryo manipulation during IVF result in more deviant fetal growth curves, but birth weight does not seem to be a reliable marker of fetal stress.[102]
IVF, including ICSI, is associated with an increased risk of imprinting disorders (including Prader–Willi syndrome and Angelman syndrome), with an odds ratio of 3.7 (95% confidence interval 1.4 to 9.7).[103]
An IVF-associated incidence of cerebral palsy and neurodevelopmental delay are believed to be related to the confounders of prematurity and low birthweight.[99] Similarly, an IVF-associated incidence of autism and attention-deficit disorder are believed to be related to confounders of maternal and obstetric factors.[99]
Overall, IVF does not cause an increased risk of childhood cancer.[104] Studies have shown a decrease in the risk of certain cancers and an increased risks of certain others including retinoblastoma,[105] hepatoblastoma[104] and rhabdomyosarcoma.[104]
Controversial cases
Mix-ups
In some cases, laboratory mix-ups (misidentified gametes, transfer of wrong embryos) have occurred, leading to legal action against the IVF provider and complex paternity suits. An example is the case of a woman in California who received the embryo of another couple and was notified of this mistake after the birth of her son.[106] This has led to many authorities and individual clinics implementing procedures to minimise the risk of such mix-ups. The HFEA, for example, requires clinics to use a double witnessing system, the identity of specimens is checked by two people at each point at which specimens are transferred. Alternatively, technological solutions are gaining favour, to reduce the manpower cost of manual double witnessing, and to further reduce risks with uniquely numbered RFID tags which can be identified by readers connected to a computer. The computer tracks specimens throughout the process and alerts the embryologist if non-matching specimens are identified. Although the use of RFID tracking has expanded in the US,[107] it is still not widely adopted.[108]
Preimplantation genetic diagnosis or screening
Pre-implantation genetic diagnosis (PGD) is criticised for giving select demographic groups disproportionate access to a means of creating a child possessing characteristics that they consider "ideal". Many fertile couples[109][110] now demand equal access to embryonic screening so that their child can be just as healthy as one created through IVF. Mass use of PGD, especially as a means of population control or in the presence of legal measures related to population or demographic control, can lead to intentional or unintentional demographic effects such as the skewed live-birth sex ratios seen in China following implementation of its one-child policy.
While PGD was originally designed to screen for embryos carrying hereditary genetic diseases, the method has been applied to select features that are unrelated to diseases, thus raising ethical questions. Examples of such cases include the selection of embryos based on histocompatibility (HLA) for the donation of tissues to a sick family member, the diagnosis of genetic susceptibility to disease, and sex selection.[111]
These examples raise ethical issues because of the morality of eugenics. It becomes frowned upon because of the advantage of being able to eliminate unwanted traits and selecting desired traits. By using PGD, individuals are given the opportunity to create a human life unethically and rely on science and not by natural selection.[112]
For example, a deaf British couple, Tom and Paula Lichy, have petitioned to create a deaf baby using IVF.[113] Some medical ethicists have been very critical of this approach. Jacob M. Appel wrote that "intentionally culling out blind or deaf embryos might prevent considerable future suffering, while a policy that allowed deaf or blind parents to select for such traits intentionally would be far more troublesome."[114]
Industry corruption
Robert Winston, professor of fertility studies at Imperial College London, had called the industry "corrupt" and "greedy" stating that "one of the major problems facing us in healthcare is that IVF has become a massive commercial industry," and that "what has happened, of course, is that money is corrupting this whole technology", and accused authorities of failing to protect couples from exploitation: "The regulatory authority has done a consistently bad job. It's not prevented the exploitation of people, it's not put out very good information to couples, it's not limited the number of unscientific treatments people have access to".[115] The IVF industry has been described as a market-driven construction of health, medicine and the human body.[116]
The industry has been accused of making unscientific claims, and distorting facts relating to infertility, in particular through widely exaggerated claims about how common infertility is in society, in an attempt to get as many couples as possible and as soon as possible to try treatments (rather than trying to conceive naturally for a longer time).[citation needed] This risks removing infertility from its social context and reducing the experience to a simple biological malfunction, which not only can be treated through bio-medical procedures, but should be treated by them.[117][118]
Older patients
All pregnancies can be risky, but there are greater risk for mothers who are older and are over the age of 40. As people get older, they are more likely to develop conditions such as gestational diabetes and pre-eclampsia. If the mother does conceive over the age of 40, their offspring may be of lower birth weight, and more likely to requires intensive care. Because of this, the increased risk is a sufficient cause for concern. The high incidence of caesarean in older patients is commonly regarded as a risk.[119]
Those conceiving at 40 have a greater risk of gestational hypertension and premature birth. The offspring is at risk when being born from older mothers, and the risks associated with being conceived through IVF.[120]
Adriana Iliescu held the record for a while as the oldest woman to give birth using IVF and a donor egg, when she gave birth in 2004 at the age of 66.[citation needed] In September 2019, a 74-year-old woman became the oldest-ever to give birth after she delivered twins at a hospital in Guntur, Andhra Pradesh.[121]
Pregnancy after menopause
Although menopause is a natural barrier to further conception, IVF has allowed people to be pregnant in their fifties and sixties. People whose uteruses have been appropriately prepared receive embryos that originated from an egg donor. Therefore, although they do not have a genetic link with the child, they have a physical link through pregnancy and childbirth. Even after menopause, the uterus is fully capable of carrying out a pregnancy.[122]
Same-sex couples, single and unmarried parents
A 2009 statement from the ASRM found no persuasive evidence that children are harmed or disadvantaged solely by being raised by single parents, unmarried parents, or homosexual parents. It did not support restricting access to assisted reproductive technologies on the basis of a prospective parent's marital status or sexual orientation.[123] A 2018 study found that children's psychological well-being did not differ when raised by either same-sex parents or heterosexual parents, even finding that psychological well-being was better amongst children raised by same-sex parents.[124]
Ethical concerns include reproductive rights, the welfare of offspring, nondiscrimination against unmarried individuals, homosexual, and professional autonomy.[123]
A controversy in California focused on the question of whether physicians opposed to same-sex relationships should be required to perform IVF for a lesbian couple. Guadalupe T. Benitez, a lesbian medical assistant from San Diego, sued doctors Christine Brody and Douglas Fenton of the North Coast Woman's Care Medical Group after Brody told her that she had "religious-based objections to treating her and homosexuals in general to help them conceive children by artificial insemination," and Fenton refused to authorise a refill of her prescription for the fertility drug Clomid on the same grounds.[125][126] The California Medical Association had initially sided with Brody and Fenton, but the case, North Coast Women's Care Medical Group v. Superior Court, was decided unanimously by the California State Supreme Court in favour of Benitez on 19 August 2008.[127][128]
Nadya Suleman came to international attention after having twelve embryos implanted, eight of which survived, resulting in eight newborns being added to her existing six-child family. The Medical Board of California sought to have fertility doctor Michael Kamrava, who treated Suleman, stripped of his licence. State officials allege that performing Suleman's procedure is evidence of unreasonable judgment, substandard care, and a lack of concern for the eight children she would conceive and the six she was already struggling to raise. On 1 June 2011 the Medical Board issued a ruling that Kamrava's medical licence be revoked effective 1 July 2011.[129][130][131]
Transgender parents
The research on transgender reproduction and family planning is limited.[132] A 2020 comparative study of children born to a transgender father and cisgender mother via donor sperm insemination in France showed no significant differences to IVF and naturally conceived children of cisgender parents.[133]
Transgender men can experience challenges in pregnancy and birthing from the cis-normative structure within the medical system,[132] as well as psychological challenges such as renewed gender dysphoria.[134] The effect of continued testosterone therapy during pregnancy and breastfeeding is undetermined.[135] Ethical concerns include reproductive rights, reproductive justice, physician autonomy, and transphobia within the health care setting.[132]
Anonymous donors
Alana Stewart, who was conceived using donor sperm, began an online forum for donor children called AnonymousUS in 2010. The forum welcomes the viewpoints of anyone involved in the IVF process.[136] In May 2012, a court ruled making anonymous sperm and egg donation in British Columbia illegal.[137]
In the U.K., Sweden, Norway, Germany, Italy, New Zealand, and some Australian states, donors are not paid and cannot be anonymous.
In 2000, a website called Donor Sibling Registry was created to help biological children with a common donor connect with each other.[138][139]
Leftover embryos or eggs, unwanted embryos
There may be leftover embryos or eggs from IVF procedures if the person for whom they were originally created has successfully carried one or more pregnancies to term, and no longer wishes to use them. With the patient's permission, these may be donated to help others conceive by means of third party reproduction.
In embryo donation, these extra embryos are given to others for transfer, with the goal of producing a successful pregnancy. Embryo recipients have genetic issues or poor-quality embryos or eggs of their own. The resulting child is considered the child of whoever birthed them, and not the child of the donor, the same as occurs with egg donation or sperm donation. As per The National Infertility Association, typically, genetic parents donate the eggs or embryos to a fertility clinic where they are preserved by oocyte cryopreservation or embryo cryopreservation until a carrier is found for them. The process of matching the donation with the prospective parents is conducted by the agency itself, at which time the clinic transfers ownership of the embryos to the prospective parent(s).[140]
Alternatives to donating unused embryos are destroying them (or having them transferred at a time when pregnancy is very unlikely),[141] keeping them frozen indefinitely, or donating them for use in research (rendering them non-viable).[142] Individual moral views on disposing of leftover embryos may depend on personal views on the beginning of human personhood and the definition and/or value of potential future persons, and on the value that is given to fundamental research questions. Some people believe donation of leftover embryos for research is a good alternative to discarding the embryos when patients receive proper, honest and clear information about the research project, the procedures and the scientific values.[143]
During the embryo selection and transfer phases, many embryos may be discarded in favour of others. This selection may be based on criteria such as genetic disorders or the sex. One of the earliest cases of special gene selection through IVF was the case of the Collins family in the 1990s, who selected the sex of their child.[144]
The ethic issues remain unresolved as no worldwide consensus exists in science, religion, and philosophy on when a human embryo should be recognised as a person. For those who believe that this is at the moment of conception, IVF becomes a moral question when multiple eggs are fertilised, begin development, and only a few are chosen for uterus transfer.[citation needed]If IVF were to involve the fertilisation of only a single egg, or at least only the number that will be transferred, then this would not be an issue. However, this has the chance of increasing costs dramatically as only a few eggs can be attempted at a time. As a result, the couple must decide what to do with these extra embryos. Depending on their view of the embryo's humanity or the chance the couple will want to try to have another child, the couple has multiple options for dealing with these extra embryos. Couples can choose to keep them frozen, donate them to other infertile couples, thaw them, or donate them to medical research.[141] Keeping them frozen costs money, donating them does not ensure they will survive, thawing them renders them immediately unviable, and medical research results in their termination. In the realm of medical research, the couple is not necessarily told what the embryos will be used for, and as a result, some can be used in stem cell research.
In February 2024, the Alabama Supreme Court ruled in LePage v. Center for Reproductive Medicine that cryopreserved embryos were "persons" or "extrauterine children". After Dobbs v. Jackson Women's Health Organization (2022), some antiabortionists had hoped to get a judgement that fetuses and embryos were "person[s]".[145]
Religious response
The Catholic Church opposes all kinds of assisted reproductive technology and artificial contraception, on the grounds that they separate the procreative goal of marital sex from the goal of uniting married couples.The Catholic Church permits the use of a small number of reproductive technologies and contraceptive methods such as natural family planning, which involves charting ovulation times, and allows other forms of reproductive technologies that allow conception to take place from normative sexual intercourse, such as a fertility lubricant. Pope Benedict XVI had publicly re-emphasised the Catholic Church's opposition to in vitro fertilisation, saying that it replaces love between a husband and wife.[146]
The Catechism of the Catholic Church, in accordance with the Catholic understanding of natural law, teaches that reproduction has an "inseparable connection" to the sexual union of married couples.[147] In addition, the church opposes IVF because it might result in the disposal of embryos; in Catholicism, an embryo is viewed as an individual with a soul that must be treated as a person.[148] The Catholic Church maintains that it is not objectively evil to be infertile, and advocates adoption as an option for such couples who still wish to have children.[149]
Hindus welcome IVF as a gift for those who are unable to bear children and have declared doctors related to IVF to be conducting punya as there are several characters who were claimed to be born without intercourse, mainly Kaurav and five Pandavas.[150]
Regarding the response to IVF by Islam, a general consensus from the contemporary Sunni scholars concludes that IVF methods are immoral and prohibited. However, Gad El-Hak Ali Gad El-Hak's ART fatwa includes that:[151]
- IVF of an egg from the wife with the sperm of her husband and the transfer of the fertilised egg back to the uterus of the wife is allowed, provided that the procedure is indicated for a medical reason and is carried out by an expert physician.
- Since marriage is a contract between the wife and husband during the span of their marriage, no third party should intrude into the marital functions of sex and procreation. This means that a third party donor is not acceptable, whether he or she is providing sperm, eggs, embryos, or a uterus. The use of a third party is tantamount to zina, or adultery.
Within the Orthodox Jewish community the concept is debated as there is little precedent in traditional Jewish legal textual sources. Regarding laws of sexuality, religious challenges include masturbation (which may be regarded as "seed wasting"[148]), laws related to sexual activity and menstruation (niddah) and the specific laws regarding intercourse. An additional major issue is that of establishing paternity and lineage. For a baby conceived naturally, the father's identity is determined by a legal presumption (chazakah) of legitimacy: rov bi'ot achar ha'baal – a woman's sexual relations are assumed to be with her husband. Regarding an IVF child, this assumption does not exist and as such Rabbi Eliezer Waldenberg (among others) requires an outside supervisor to positively identify the father.[152] Reform Judaism has generally approved IVF.[148]
Society and culture
Many women of sub-Saharan Africa choose to foster their children to infertile women. IVF enables these infertile women to have their own children, which imposes new ideals to a culture in which fostering children is seen as both natural and culturally important. Many infertile women are able to earn more respect in their society by taking care of the children of other mothers, and this may be lost if they choose to use IVF instead. As IVF is seen as unnatural, it may even hinder their societal position as opposed to making them equal with fertile women. It is also economically advantageous for infertile women to raise foster children as it gives these children greater ability to access resources that are important for their development and also aids the development of their society at large. If IVF becomes more popular without the birth rate decreasing, there could be more large family homes with fewer options to send their newborn children. This could result in an increase of orphaned children and/or a decrease in resources for the children of large families. This would ultimately stifle the children's and the community's growth.[153]
In the US, the pineapple has emerged as a symbol of IVF users, possibly because some people thought, without scientific evidence, that eating pineapple might slightly increase the success rate for the procedure.[154]
Emotional involvement with children
Studies have indicated that IVF mothers show greater emotional involvement with their child, and they enjoy motherhood more than mothers by natural conception. Similarly, studies have indicated that IVF fathers express more warmth and emotional involvement than fathers by adoption and natural conception and enjoy fatherhood more. Some IVF parents become overly involved with their children.[155]
Men and IVF
Research has shown that men largely view themselves as "passive contributors"[156]: 340 since they have "less physical involvement"[157] in IVF treatment. Despite this, many men feel distressed after seeing the toll of hormonal injections and ongoing physical intervention on their female partner.[156]: 344 Fertility was found to be a significant factor in a man's perception of his masculinity, driving many to keep the treatment a secret.[156]: 344 In cases where the men did share that he and his partner were undergoing IVF, they reported to have been teased, mainly by other men, although some viewed this as an affirmation of support and friendship. For others, this led to feeling socially isolated.[156]: 336 In comparison with females, males showed less deterioration in mental health in the years following a failed treatment.[158] However, many men did feel guilt, disappointment and inadequacy, stating that they were simply trying to provide an "emotional rock" for their partners.[156]: 336
Ability to withdraw consent
In certain countries, including Austria, Italy, Estonia, Hungary, Spain and Israel, the male does not have the full ability to withdraw consent to storage or use of embryos once they are fertilised. In the United States, the matter has been left to the courts on a more or less ad hoc basis. If embryos are implanted and a child is born contrary to the wishes of the male, he still has legal and financial responsibilities of a father.[159]
Availability and utilisation
Cost
Costs of IVF can be broken down into direct and indirect costs. Direct costs include the medical treatments themselves, including doctor consultations, medications, ultrasound scanning, laboratory tests, the actual IVF procedure, and any associated hospital charges and administrative costs. Indirect costs includes the cost of addressing any complications with treatments, compensation for the gestational surrogate, patients' travel costs, and lost hours of productivity.[160] These costs can be exaggerated by the increasing age of the woman undergoing IVF treatment (particularly those over the age of 40), and the increase costs associated with multiple births. For instance, a pregnancy with twins can cost up to three times that of a singleton pregnancy.[161] While some insurances cover one cycle of IVF, it takes multiple cycles of IVF to have a successful outcome.[162] A study completed in Northern California reveals that the IVF procedure alone that results in a successful outcome costs $61,377, and this can be more costly with the use of a donor egg.[162]
The cost of IVF rather reflects the costliness of the underlying healthcare system than the regulatory or funding environment,[163] and ranges, on average for a standard IVF cycle and in 2006 United States dollars, between $12,500 in the United States to $4,000 in Japan.[163] In Ireland, IVF costs around €4,000, with fertility drugs, if required, costing up to €3,000.[164] The cost per live birth is highest in the United States ($41,000[163]) and United Kingdom ($40,000[163]) and lowest in Scandinavia and Japan (both around $24,500[163]).
The high cost of IVF is also a barrier to access for disabled individuals, who typically have lower incomes, face higher health care costs, and seek health care services more often than non-disabled individuals.[165]
Navigating insurance coverage for transgender expectant parents presents a unique challenge. Insurance plans are designed to cater towards a specific population, meaning that some plans can provide adequate coverage for gender-affirming care but fail to provide fertility services for transgender patients.[166] Additionally, insurance coverage is constructed around a person's legally recognised sex and not their anatomy; thus, transgender people may not get coverage for the services they need, including transgender men for fertility services.[166]
Use by LGBT individuals
Same-sex couples
In larger urban centres, studies have noted that lesbian, gay, bisexual, transgender and queer (LGBTQ+) populations are among the fastest-growing users of fertility care.[167] IVF is increasingly being used to allow lesbian and other LGBT couples to share in the reproductive process through a technique called reciprocal IVF.[168] The eggs of one partner are used to create embryos which the other partner carries through pregnancy. For gay male couples, many elect to use IVF through gestational surrogacy, where one partner's sperm is used to fertilise a donor ovum, and the resulting embryo is transplanted into a surrogate carrier's womb.[169] There are various IVF options available for same-sex couples including, but not limited to, IVF with donor sperm, IVF with a partner's oocytes, reciprocal IVF, IVF with donor eggs, and IVF with gestational surrogate. IVF with donor sperm can be considered traditional IVF for lesbian couples, but reciprocal IVF or using a partner's oocytes are other options for lesbian couples trying to conceive to include both partners in the biological process. Using a partner's oocytes is an option for partners who are unsuccessful in conceiving with their own, and reciprocal IVF involves undergoing reproduction with a donor egg and sperm that is then transferred to a partner who will gestate. Donor IVF involves conceiving with a third party's eggs. Typically, for gay male couples hoping to use IVF, the common techniques are using IVF with donor eggs and gestational surrogates.[170]
Transgender parents
Many LGBT communities centre their support around cisgender gay, lesbian and bisexual people and neglect to include proper support for transgender people.[171] The same 2020 literature review analyses the social, emotional and physical experiences of pregnant transgender men.[132] A common obstacle faced by pregnant transgender men is the possibility of gender dysphoria. Literature shows that transgender men report uncomfortable procedures and interactions during their pregnancies as well as feeling misgendered due to gendered terminology used by healthcare providers. Outside of the healthcare system, pregnant transgender men may experience gender dysphoria due to cultural assumptions that all pregnant people are cisgender women.[132] These people use three common approaches to navigating their pregnancy: passing as a cisgender woman, hiding their pregnancy, or being out and visibly pregnant as a transgender man.[132] Some transgender and gender diverse patients describe their experience in seeking gynaecological and reproductive health care as isolating and discriminatory, as the strictly binary healthcare system often leads to denial of healthcare coverage or unnecessary revelation of their transgender status to their employer.[172]
Many transgender people retain their original sex organs and choose to have children through biological reproduction. Advances in assisted reproductive technology and fertility preservation have broadened the options transgender people have to conceive a child using their own gametes or a donor's. Transgender men and women may opt for fertility preservation before any gender affirming surgery, but it is not required for future biological reproduction.[132][173] It is also recommended that fertility preservation is conducted before any hormone therapy.[170] Additionally, while fertility specialists often suggest that transgender men discontinue their testosterone hormones prior to pregnancy, research on this topic is still inconclusive.[174][132] However, a 2019 study found that transgender male patients seeking oocyte retrieval via assisted reproductive technology (including IVF) were able to undergo treatment four months after stopping testosterone treatment, on average.[175] All patients experienced menses and normal AMH, FSH and E2 levels and antral follicle counts after coming off testosterone, which allowed for successful oocyte retrieval.[175] Despite assumptions that the long-term androgen treatment negatively impacts fertility, oocyte retrieval, an integral part of the IVF process, does not appear to be affected.
Biological reproductive options available to transgender women include, but are not limited to, IVF and IUI with the trans woman's sperm and a donor or a partner's eggs and uterus. Fertility treatment options for transgender men include, but are not limited to, IUI or IVF using his own eggs with a donor's sperm and/or donor's eggs, his uterus, or a different uterus, whether that is a partner's or a surrogate's.[176]
Use by disabled individuals
People with disabilities who wish to have children are equally or more likely than the non-disabled population to experience infertility,[165] yet disabled individuals are much less likely to have access to fertility treatment such as IVF. There are many extraneous factors that hinder disabled individuals access to IVF, such as assumptions about decision-making capacity, sexual interests and abilities, heritability of a disability, and beliefs about parenting ability.[177][178] These same misconceptions about people with disabilities that once led health care providers to sterilise thousands of women with disabilities now lead them to provide or deny reproductive care on the basis of stereotypes concerning people with disabilities and their sexuality.[165]
Not only do misconceptions about disabled individuals parenting ability, sexuality, and health restrict and hinder access to fertility treatment such as IVF, structural barriers such as providers uneducated in disability healthcare and inaccessible clinics severely hinder disabled individuals access to receiving IVF.[165]
By country
Australia
In Australia, the average age of women undergoing ART treatment is 35.5 years among those using their own eggs (one in four being 40 or older) and 40.5 years among those using donated eggs.[179] While IVF is available in Australia, Australians using IVF are unable to choose their baby's gender.[180]
Cameroon
Ernestine Gwet Bell supervised the first Cameroonian child born by IVF in 1998.[181]
Canada
In Canada, one cycle of IVF treatment can cost between $7,750 to $12,250 CAD, and medications alone can cost between $2,500 to over $7,000 CAD.[182] The funding mechanisms that influence accessibility in Canada vary by province and territory, with some provinces providing full, partial or no coverage.
New Brunswick provides partial funding through their Infertility Special Assistance Fund – a one time grant of up to $5,000. Patients may only claim up to 50% of treatment costs or $5,000 (whichever is less) occurred after April 2014. Eligible patients must be a full-time New Brunswick resident with a valid Medicare card[183] and have an official medical infertility diagnosis by a physician.[184]
In December 2015, the Ontario provincial government enacted the Ontario Fertility Program for patients with medical and non-medical infertility, regardless of sexual orientation, gender or family composition. Eligible patients for IVF treatment must be Ontario residents under the age of 43 and have a valid Ontario Health Insurance Plan card and have not already undergone any IVF cycles. Coverage is extensive, but not universal. Coverage extends to certain blood and urine tests, physician/nurse counselling and consultations, certain ultrasounds, up to two cycle monitorings, embryo thawing, freezing and culture, fertilisation and embryology services, single transfers of all embryos, and one surgical sperm retrieval using certain techniques only if necessary. Drugs and medications are not covered under this Program, along with psychologist or social worker counselling, storage and shipping of eggs, sperm or embryos, and the purchase of donor sperm or eggs.[185]
China
IVF is expensive in China and not generally accessible to unmarried women.[186] In August 2022, China's National Health Authority announced that it will take steps to make assisted reproductive technology more accessible, including by guiding local governments to include such technology in its national medical system.[186]
Croatia
No egg or sperm donations take place in Croatia, however using donated sperm or egg in ART and IUI is allowed. With donated eggs, sperm or embryo, a heterosexual couple and single women have legal access to IVF. Male or female couples do not have access to ART as a form of reproduction. The minimum age for males and females to access ART in Croatia is 18 there is no maximum age. Donor anonymity applies, but the born child can be given access to the donor's identity at a certain age[187]
India
The penetration of the IVF market in India is quite low, with only 2,800 cycles per million infertile people in the reproductive age group (20–44 years), as compared to China, which has 6,500 cycles. The key challenges are lack of awareness, affordability and accessibility.[188] Since 2018, however, India has become a destination for fertility tourism, because of lower costs than in the Western world. In December 2021, the Lok Sabha passed the Assisted Reproductive Technology (Regulation) Bill 2020, to regulate ART services including IVF centres, sperm and egg banks.[189]
Israel
Israel has the highest rate of IVF in the world, with 1,657 procedures performed per million people per year.[citation needed] Couples without children can receive funding for IVF for up to two children. The same funding is available for people without children who will raise up to two children in a single parent home. IVF is available for people aged 18 to 45.[190] The Israeli Health Ministry says it spends roughly $3450 per procedure.[citation needed]
Sweden
One, two or three IVF treatments are government subsidised for people who are younger than 40 and have no children. The rules for how many treatments are subsidised, and the upper age limit for the people, vary between different county councils.[191] Single people are treated, and embryo adoption is allowed. There are also private clinics that offer the treatment for a fee.[192]
United Kingdom
Доступность ЭКО в Англии определяется Клиническими комиссиями (CCG). Национальный институт здравоохранения и совершенствования медицинской помощи (NICE) рекомендует людям до 40 лет пройти до 3 циклов лечения с минимальным успехом зачатия после 2 лет незащищенного секса. Циклы не будут продолжены для людей старше 40 лет. [193] CCG в Эссексе , Бедфордшире и Сомерсете сократили финансирование до одного цикла или вообще не сократили его, и ожидается, что сокращения станут более масштабными. Финансирование может быть доступно в «исключительных обстоятельствах» – например, если партнер-мужчина болен заразной инфекцией или один из партнеров пострадал от лечения рака. По данным группы кампании Fertility Fairness, «в конце 2014 года каждая CCG в Англии финансировала как минимум один цикл ЭКО». [194] Цены, выплачиваемые Национальной службой здравоохранения Англии, в 2014/5 году варьировались от менее 3000 до более чем 6000 фунтов стерлингов. [195] В феврале 2013 года стоимость внедрения рекомендаций NICE по ЭКО наряду с другими методами лечения бесплодия прогнозировалась в размере 236 000 фунтов стерлингов в год на 100 000 человек населения. [196]
ЭКО все чаще фигурирует в черных списках методов лечения Национальной службы здравоохранения (NHS) . [197] В августе 2017 года пять из 208 CCG полностью прекратили финансирование ЭКО, а другие рассматривали возможность сделать это. [198] К октябрю 2017 года только 25 CCG проводили три рекомендованных NHS цикла ЭКО людям в возрасте до 40 лет, имеющим на это право. [199] Политика может противоречить законам о дискриминации , если она будет относиться к однополым парам иначе, чем к гетеросексуальным. [200] В июле 2019 года Джеки Дойл-Прайс заявила, что женщины записывались на операции подальше от собственного дома, чтобы обойти политику нормирования CCG. [ нужна ссылка ]
В сентябре 2018 года Управление по оплодотворению человека и эмбриологии заявило, что родители, которые ограничены одним циклом ЭКО или вынуждены финансировать его самостоятельно, с большей вероятностью предпочтут имплантировать несколько эмбрионов в надежде, что это увеличит шансы на беременность. Это значительно увеличивает вероятность многоплодия и связанных с этим плохих исходов, что приведет к увеличению расходов Национальной службы здравоохранения. Президент Королевского колледжа акушеров и гинекологов заявил, что финансирование трех циклов было «наиболее важным фактором в поддержании низкого уровня многоплодной беременности и уменьшении связанных с ней осложнений». [201]
Соединенные Штаты
В Соединенных Штатах общая доступность ЭКО в 2005 году составляла 2,5 врача ЭКО на 100 000 населения, а использование - 236 циклов ЭКО на 100 000. [202] В год проводится 126 процедур на миллион человек. Использование значительно увеличивается с увеличением доступности и страхового покрытия ЭКО, а также в значительной степени с увеличением доли одиноких людей и среднего дохода. [202] В США средний цикл, от извлечения яйцеклетки до имплантации эмбриона, стоит 12 400 долларов, а страховые компании, которые покрывают лечение, даже частично, обычно ограничивают количество циклов, за которые они платят. [203] По состоянию на 2015 год с помощью технологий ЭКО родилось более 1 миллиона детей. [36]
В США в девятнадцати штатах действуют законы, требующие страхового покрытия при лечении бесплодия, а в тринадцати из них специально предусмотрено ЭКО. [204] К штатам, в которых обязательно проводится ЭКО, относятся: Арканзас, Калифорния, Колорадо, Коннектикут, Делавэр, Гавайи, Иллинойс, Луизиана, Мэриленд, Массачусетс, Монтана, Нью-Гэмпшир, Нью-Джерси, Нью-Йорк, Огайо, Род-Айленд, Техас, Юта и Запад. Вирджиния. [204] Эти законы различаются в зависимости от штата, но многие из них требуют, чтобы яйцеклетка была оплодотворена спермой супруга, и что для того, чтобы получить страховку, вы должны доказать, что не можете забеременеть в результате полового члена и вагинального секса. [204] Этим требованиям не может соответствовать однополая пара. Однако, согласно отчету за 2020 год, ни одна государственная программа Medicaid не покрывает ЭКО. [162]
Многие клиники репродуктивной медицины в США ограничивают максимальный возраст, в котором люди имеют право на ЭКО, до 50 или 55 лет. [205] Эти ограничения затрудняют использование этой процедуры людям старше пятидесяти пяти лет. [205]
Юридический статус
В 2003 году правительственные учреждения Китая ввели запрет на использование ЭКО лицами, не состоящими в браке, или парами с определенными инфекционными заболеваниями. [206]
В Индии использование ЭКО как средства выбора пола ( преимплантационная генетическая диагностика ) запрещено Законом о методах пренатальной диагностики 1994 года . [207] [208] [209]
Мусульманские страны-сунниты обычно разрешают ЭКО между супружескими парами, если оно проводится с их собственными сперматозоидами и яйцеклетками, но не с донорскими яйцеклетками от других пар. Но Иран, который является мусульманином-шиитом, имеет более сложную схему. Иран запрещает донорство спермы, но разрешает донорство как оплодотворенных, так и неоплодотворенных яйцеклеток. Оплодотворенные яйцеклетки передаются супружескими парами другим супружеским парам, а неоплодотворенные яйцеклетки передаются в рамках муты или временного брака с отцом. [210]
К 2012 году Коста-Рика была единственной страной в мире, где был полностью запрещена технология ЭКО. Верховный суд страны признал ее неконституционной, поскольку она «нарушала жизнь». [211] Коста-Рика была единственной страной в западном полушарии, где было запрещено ЭКО. Законопроект, неохотно представленный правительством президента Лауры Чинчилья, был отклонен парламентом. Президент Чиншилла публично не высказала свою позицию по вопросу ЭКО. Однако, учитывая огромное влияние католической церкви в ее правительстве, любое изменение статус-кво кажется маловероятным. [212] [213] Несмотря на правительство Коста-Рики и сильную религиозную оппозицию, запрет на ЭКО был отменен Межамериканским судом по правам человека решением от 20 декабря 2012 года. [214] Суд заявил, что давняя гарантия Коста-Рики защиты каждого человеческого эмбриона нарушает репродуктивную свободу бесплодных пар, поскольку запрещает им использовать ЭКО, которое часто предполагает избавление от эмбрионов, не имплантированных в матку женщины. [215] 10 сентября 2015 года президент Луис Гильермо Солис подписал указ о легализации экстракорпорального оплодотворения. Указ был опубликован в официальном бюллетене страны 11 сентября. Противники этой практики с тех пор подали иск в Конституционный суд страны. [216]
Все основные ограничения на использование ЭКО одинокими, но бесплодными людьми были сняты в Австралии в 2002 году после того, как окончательная апелляция в Высокий суд Австралии была отклонена по процессуальным основаниям по делу Лизы Мелдрам. В 2000 году федеральный суд штата Виктория постановил, что существующий запрет на использование ЭКО всеми одинокими женщинами и лесбиянками представляет собой дискриминацию по признаку пола. [217] Правительство Виктории объявило об изменениях в своем законе об ЭКО в 2007 году, сняв оставшиеся ограничения для одиноких женщин с фертильностью и лесбиянок, оставив Южную Австралию единственным штатом, поддерживающим их. [218]
Федеральные правила в Соединенных Штатах включают требования к скринингу и ограничения на донорство, но обычно не затрагивают интимных партнеров. [219] Однако врачи могут быть обязаны предоставлять лечение в соответствии с законами о недискриминации, как, например, в Калифорнии. [128] В 2009 году американский штат Теннесси предложил законопроект, который определял бы донорское ЭКО как усыновление. [220] На той же сессии в другом законопроекте предлагалось запретить усыновление любой незамужней или сожительствующей паре, а группы активистов заявили, что принятие первого законопроекта фактически помешает незамужним женщинам использовать ЭКО. [221] [222] Ни один из этих законопроектов не был принят. [223]
В 2024 году Верховный суд Алабамы постановил, что эмбрионы, созданные в ходе экстракорпорального оплодотворения, являются «внеутробными детьми» , а закон штата 1872 года, позволяющий родителям подавать в суд в случае смерти несовершеннолетнего, «применяется ко всем нерожденным детям, независимо от их местонахождения». ." [224] [225] Это постановление вызвало обеспокоенность Национальной ассоциации по борьбе с бесплодием и Американского общества репродуктивной медицины по поводу того, что это решение будет означать, что запреты на аборты в Алабаме также запрещают ЭКО. [226] в то время как система здравоохранения Университета Алабамы в Бирмингеме приостановила лечение ЭКО. [227] Восемь дней спустя законодательный орган Алабамы проголосовал за защиту поставщиков ЭКО и пациентов от уголовной или гражданской ответственности. [228] [229]
Лишь немногие американские суды рассматривали вопрос «имущественного» статуса замороженного эмбриона. Этот вопрос может возникнуть в контексте дела о разводе, в котором суд должен будет определить, какой из супругов сможет принять решение о распоряжении эмбрионами. Это также могло возникнуть в контексте спора между донором спермы и донором яйцеклеток, даже если они не состояли в браке. В 2015 году суд штата Иллинойс постановил, что такие споры могут разрешаться на основании любого договора между будущими родителями. В случае отсутствия договора суд будет взвешивать относительные интересы сторон. [230]
Альтернативы
Некоторые альтернативы ЭКО:
- Искусственное оплодотворение , включая внутрицервикальное оплодотворение и внутриматочное оплодотворение спермой. Для этого требуется, чтобы у женщины произошла овуляция , но это относительно простая процедура, и ее можно использовать в домашних условиях для самостоятельного оплодотворения без помощи врача. [231] Бенефициарами искусственного оплодотворения являются люди, желающие родить собственного ребенка, которые могут быть одинокими, люди, состоящие в лесбийских отношениях, или женщины, состоящие в гетеросексуальных партнером-мужчиной отношениях, но с бесплодным или имеющим физические недостатки. что препятствует полноценному половому акту.
- Индукция овуляции (в смысле медикаментозного лечения, направленного на развитие одного или двух овуляторных фолликулов) является альтернативой для людей с ановуляцией или олигоовуляцией , поскольку она дешевле и ее легче контролировать. [12] Обычно он включает в себя антиэстрогены, такие как кломифена цитрат или летрозол , и сопровождается естественным или искусственным оплодотворением.
- Суррогатное материнство — процесс, при котором суррогатная мать соглашается родить ребенка для другого человека или лиц, которые станут родителем (родителями) ребенка после рождения. Люди могут обратиться за помощью к суррогатному материнству, когда беременность невозможна с медицинской точки зрения, когда риск беременности слишком опасен для предполагаемого гестационного носителя или когда одинокий мужчина или мужская пара желают иметь ребенка.
- Усыновление , при котором человек принимает на себя воспитание другого человека, обычно ребенка, от биологического или законного родителя или родителей этого человека.
См. также
- Криоконсервация спермы
- Эванс против Соединенного Королевства , ключевое дело в Европейском суде по правам человека
- Выбор пола
- Споры о стволовых клетках
- Реципрокное ЭКО
- Дети из пробирки (фильм)
Ссылки
- ^ «Луиза Браун: обнародован семейный архив первого в мире ребенка, созданного методом ЭКО» . Новости Би-би-си . 24 июля 2018 года . Проверено 29 июля 2021 г.
- ^ Jump up to: а б Мортон С. (14 января 2007 г.). «У первого в мире ребенка из пробирки Луизы Браун родился собственный ребенок» . Независимый . Лондон . Проверено 21 мая 2010 г.
28-летняя девушка, чье новаторское зачатие с помощью экстракорпорального оплодотворения прославило ее во всем мире. Специалисты по репродукции Патрик Степто и Боб Эдвардс стали первыми, кто успешно провел ЭКО, извлекая яйцеклетку, оплодотворяя ее спермой и подсаживая полученный эмбрион обратно матери.
- ^ Jump up to: а б Госден Р. (июнь 2018 г.). «Жан Мариан Парди вспомнил – скрытую жизнь пионера ЭКО». Человеческая фертильность . 21 (2): 86–89. дои : 10.1080/14647273.2017.1351042 . ПМИД 28881151 . S2CID 5045457 .
- ^ Jump up to: а б «После ЭКО некоторые пары беременеют без посторонней помощи» . Рейтер . 3 мая 2012 года . Проверено 5 ноября 2015 г.
- ^ Электронная клиническая медицина (ноябрь 2023 г.). «Текущее состояние ЭКО: ставим ли мы на первое место потребности человека?» . Электронная клиническая медицина . 65 : 102343. doi : 10.1016/j.eclinm.2023.102343 . ПМЦ 10725012 . ПМИД 38106562 .
- ^ Камат М.С., Маскаренхас М., Франик С., Лю Э., Сункара С.К. (декабрь 2019 г.). «Клинические добавки при экстракорпоральном оплодотворении: растущий список» . Фертильность и бесплодие . 112 (6): 978–986. doi : 10.1016/j.fertnstert.2019.09.019 . ПМИД 31703943 .
- ^ Джаяраман К.С. (19 октября 1978 г.). «В Индии обнаружен ребенок из глубоко замороженной пробирки» . Новый учёный . п. 159 . Проверено 4 сентября 2021 г. [ постоянная мертвая ссылка ]
- ^ «Триумф и трагедия в пробирке – Нобелевская премия британскому ученому пробуждает память о бенгальском докторе» . Телеграф . 5 октября 2010 г. Проверено 22 мая 2012 г.
- ^ Малыш из пробирки . Ютуб . Образовательный мультимедийный исследовательский центр, Калькутта. 23 августа 2013 года . Проверено 4 сентября 2021 г.
- ^ Европейское общество репродукции человека и эмбриологии (3 июля 2018 г.). «Более 8 миллионов детей родились в результате ЭКО с момента первого в мире метода ЭКО в 1978 году» . ScienceDaily . Проверено 8 декабря 2018 г.
- ^ «Фертильность: оценка и лечение людей с проблемами фертильности» . Клиническое руководство NICE . Февраль 2013.
- ^ Jump up to: а б Вайс Н.С., Браам С., Кениг Т.Э., Хендрикс М.Л., Гамильтон С.Дж., Сминк Дж.М. и др. (ноябрь 2014 г.). «Как долго нам следует продолжать применение цитрата кломифена у женщин с ановуляцией?» . Репродукция человека . 29 (11): 2482–2486. дои : 10.1093/humrep/deu215 . ПМИД 25164024 .
- ^ Уэйд Джей-Джей, Маклахлан В., Ковач Дж. (октябрь 2015 г.). «Уровень успеха ЭКО значительно улучшился за последнее десятилетие». Австралийский и новозеландский журнал акушерства и гинекологии . 55 (5): 473–476. дои : 10.1111/ajo.12356 . ПМИД 26174052 . S2CID 22535393 .
- ^ Jump up to: а б «Результаты экстракорпорального оплодотворения (ЭКО) – клиника Мэйо» . www.mayoclinic.org . Проверено 5 ноября 2015 г.
- ^ «Итоговый национальный сводный отчет за 2021 год» . Национальный сводный отчет . Проверено 28 апреля 2024 г.
- ^ Jump up to: а б Брансвелл Х. (15 декабря 2008 г.). «Уровень успеха экстракорпорального оплодотворения растет» . Канадская пресса . Архивировано из оригинала 18 марта 2009 года.
- ^ «Отчет о вспомогательных репродуктивных технологиях (ВРТ) за 2006 год: Раздел 2» . Центры по контролю и профилактике заболеваний . Архивировано из оригинала 31 марта 2009 года . Проверено 25 марта 2009 г.
- ^ Неймонд П. (21 января 2009 г.). «Исследование: шестой раз может оказаться обаянием для in vitro» . Дня в день . Национальное общественное радио.
- ^ «Итоговый национальный сводный отчет за 2021 год» . Национальный сводный отчет . Проверено 28 апреля 2024 г.
- ^ «ВашИВФУспех» . ВашIVFSuccess . Проверено 1 марта 2021 г.
- ^ «Краткий отчет клиники за 2019 год» . Общество вспомогательных репродуктивных технологий . Архивировано из оригинала 4 февраля 2020 года . Проверено 21 апреля 2022 г.
- ^ де Ла Рошброшар Э., Келен С., Пейкришвили Р., Гиберт Дж., Буйе Дж. (июль 2009 г.). «Долгосрочный результат проекта родительства во время экстракорпорального оплодотворения и после прекращения неудачного экстракорпорального оплодотворения» . Фертильность и бесплодие . 92 (1): 149–156. doi : 10.1016/j.fertnstert.2008.05.067 . ПМИД 18706550 . S2CID 207633738 .
- ^ Jump up to: а б «Экстракорпоральное оплодотворение (ЭКО) – Клиника Майо» . www.mayoclinic.org . Проверено 29 октября 2022 г.
- ^ «Выкидыш» . www.marchofdimes.org . Проверено 18 марта 2024 г.
- ^ ван Лондерслут Л.Л., ван Вели М., Лимпенс Дж., Боссайт П.М., Реппинг С., ван дер Вин Ф. (2010). «Прогностические факторы экстракорпорального оплодотворения (ЭКО): систематический обзор и метаанализ» . Обновление репродукции человека . 16 (6): 577–589. дои : 10.1093/humupd/dmq015 . ПМИД 20581128 .
- ^ Jump up to: а б с д и Фертильность: оценка и лечение людей с проблемами фертильности (PDF) . Лондон: RCOG Press. 2004. ISBN 978-1-900364-97-3 . Архивировано из оригинала (PDF) 15 ноября 2010 года.
- ^ Чжао Дж, Чжан Ц, Ли Ю (ноябрь 2012 г.). «Влияние толщины и структуры эндометрия, измеренных с помощью УЗИ, на исходы беременности во время циклов ЭКО-ЭТ» . Репродуктивная биология и эндокринология . 10 (1): 100. дои : 10.1186/1477-7827-10-100 . ПМК 3551825 . ПМИД 23190428 .
- ^ Jump up to: а б Броер С.Л., ван Диссельдорп Дж., Броз К.А., Доллеман М., Опмеер Б.С., Боссайт П. и др. (2012). «Дополнительная ценность тестирования овариального резерва на характеристики пациенток в прогнозировании реакции яичников и продолжающейся беременности: индивидуальный подход к данным пациентки» . Обновление репродукции человека . 19 (1): 26–36. дои : 10.1093/humupd/dms041 . ПМИД 23188168 .
- ^ Илиодромити С., Келси Т.В., Ву О, Андерсон Р.А., Нельсон С.М. (2014). «Прогностическая точность антимюллерова гормона при рождении живого ребенка после искусственного зачатия: систематический обзор и метаанализ литературы» . Обновление репродукции человека . 20 (4): 560–570. дои : 10.1093/humupd/dmu003 . ПМИД 24532220 .
- ^ Саймон Л., Брунборг Г., Стивенсон М., Латтон Д., Макманус Дж., Льюис С.Э. (июль 2010 г.). «Клиническое значение повреждения ДНК сперматозоидов в результатах вспомогательной репродукции» . Репродукция человека . 25 (7): 1594–1608. дои : 10.1093/humrep/deq103 . ПМИД 20447937 .
- ^ Jump up to: а б Глейхер Н. , Вегхофер А., Ли И.Х., Барад Д.Х. (декабрь 2010 г.). «Генотип FMR1 с аутоиммунно-ассоциированным фенотипом, подобным поликистозным яичникам, и сниженной вероятностью беременности» . ПЛОС ОДИН . 5 (12): e15303. Бибкод : 2010PLoSO...515303G . дои : 10.1371/journal.pone.0015303 . ПМК 3002956 . ПМИД 21179569 .
- ^ Jump up to: а б с Венетис К.А., Колибианакис Э.М., Босду Дж.К., Тарлацис Б.К. (2013). «Повышение прогестерона и вероятность беременности после ЭКО: систематический обзор и метаанализ более 60 000 циклов» . Обновление репродукции человека . 19 (5): 433–457. дои : 10.1093/humupd/dmt014 . ПМИД 23827986 .
- ^ Фрагули Э., Лалиоти, доктор медицинских наук, Уэллс Д. (2013). «Транскриптом фолликулярных клеток: биологическое понимание и клиническое значение для лечения бесплодия» . Обновление репродукции человека . 20 (1): 1–11. дои : 10.1093/humupd/dmt044 . ПМЦ 3845680 . ПМИД 24082041 .
- ^ Касиус А., Смит Дж.Г., Торранс Х.Л., Эйкеманс М.Дж., Мол Б.В., Опмеер Б.К., Брукманс Ф.Дж. (2014). «Толщина эндометрия и частота наступления беременности после ЭКО: систематический обзор и метаанализ» . Обновление репродукции человека . 20 (4): 530–541. дои : 10.1093/humupd/dmu011 . ПМИД 24664156 .
- ^ Бейкер В.Л., Люк Б., Браун М.Б., Альверо Р., Фраттарелли Дж.Л., Усади Р. и др. (сентябрь 2010 г.). «Многомерный анализ факторов, влияющих на вероятность беременности и живорождения при экстракорпоральном оплодотворении: анализ системы отчетности о результатах клиник Общества вспомогательных репродуктивных технологий» . Фертильность и бесплодие . 94 (4): 1410–1416. doi : 10.1016/j.fertnstert.2009.07.986 . ПМИД 19740463 .
- ^ Jump up to: а б Центры по контролю и профилактике заболеваний; Американское общество репродуктивной медицины; Общество вспомогательных репродуктивных технологий (2017). Национальный сводный отчет по вспомогательным репродуктивным технологиям за 2015 год (PDF) (Отчет). Министерство здравоохранения и социальных служб США.
- ^ Фраттарелли Дж.Л., Миллер К.А., Миллер Б.Т., Элкинд-Хирш К., Скотт Р.Т. (июль 2008 г.). «Возраст мужчины отрицательно влияет на развитие эмбриона и репродуктивные результаты в циклах репродуктивных технологий с использованием донорских ооцитов» . Фертильность и бесплодие . 90 (1): 97–103. doi : 10.1016/j.fertnstert.2007.06.009 . ПМИД 17765235 .
- ^ Jump up to: а б с «Регулируемые услуги по рождаемости: помощь в вводе в эксплуатацию» . Министерство здравоохранения Великобритании . 18 июня 2009 г. Архивировано из оригинала 3 января 2011 г.
- ^ Келли А.С., Бадон С.Е., Лэнхэм М.С., Фиссеха С., Моравек М.Б. (июнь 2019 г.). «Ограничения индекса массы тела при лечении бесплодия: национальный опрос акушеров-гинекологов» . J Assist Reprod Genet . 36 (6): 1117–1125. дои : 10.1007/s10815-019-01448-3 . ПМК 6603101 . ПМИД 30963351 .
- ^ Jump up to: а б с д и ж г час Фаркуар С., Марджорибанкс Дж. (август 2018 г.). «Вспомогательные репродуктивные технологии: обзор Кокрейновских обзоров» . Кокрановская база данных систематических обзоров . 2018 (8): CD010537. дои : 10.1002/14651858.CD010537.pub5 . ПМЦ 6953328 . ПМИД 30117155 .
- ^ «Факторы, влияющие на успех ЭКО» . ЭКО-бесплодие.com . Февраль 2011.
- ^ Сиристатидис К.С., Басиос Г., Пергиалиотис В., Вогиаци П. (ноябрь 2016 г.). «Аспирин для экстракорпорального оплодотворения» . Кокрановская база данных систематических обзоров . 11 (11): CD004832. дои : 10.1002/14651858.CD004832.pub4 . ПМК 6463901 . ПМИД 27807847 .
- ^ Груневельд Э., Броз К.А., Ламберс М.Дж., Хаапсамо М., Диркс К., Шут BC и др. (2011). «Эффективен ли аспирин у женщин, перенесших экстракорпоральное оплодотворение (ЭКО)? Результаты метаанализа индивидуальных данных пациентов (IPD MA)» . Обновление репродукции человека . 17 (4): 501–509. дои : 10.1093/humupd/dmr007 . ПМИД 21422062 .
- ^ Манхаймер Э., ван дер Виндт Д., Ченг К., Стаффорд К., Лю Дж., Тирни Дж. и др. (2013). «Влияние иглоукалывания на частоту клинической беременности среди женщин, перенесших экстракорпоральное оплодотворение: систематический обзор и метаанализ» . Обновление репродукции человека . 19 (6): 696–713. дои : 10.1093/humupd/dmt026 . ПМЦ 3796945 . ПМИД 23814102 .
- ^ Jump up to: а б с д Ла Марка А, Сункара СК (2014). «Индивидуализация контролируемой стимуляции яичников при ЭКО с использованием маркеров овариального резерва: от теории к практике» . Обновление репродукции человека . 20 (1): 124–140. дои : 10.1093/humupd/dmt037 . ПМИД 24077980 .
- ^ Аллерсма Т., Фаркуар С., Кантино А.Е. (август 2013 г.). «Естественный цикл экстракорпорального оплодотворения (ЭКО) для субфертильных пар» . Кокрановская база данных систематических обзоров . 2013 (8): CD010550. дои : 10.1002/14651858.CD010550.pub2 . ПМК 7390465 . ПМИД 23990351 .
- ^ Эванс Дж., Ханнан Н.Дж., Эджелл Т.А., Волленховен Б.Дж., Лютьен П.Дж., Осианлис Т. и др. (2014). «Перенос свежих и замороженных эмбрионов: обоснование клинических решений научными и клиническими данными» . Обновление репродукции человека . 20 (6): 808–821. дои : 10.1093/humupd/dmu027 . ПМИД 24916455 .
- ^ «Естественный цикл ЭКО» . Управление по оплодотворению человека и эмбриологии . Архивировано из оригинала 12 мая 2012 года.
- ^ Наргунд Г (июль 2009 г.). «Естественные/мягкие вспомогательные репродуктивные технологии: снижение затрат и повышение безопасности» . Женское здоровье . 5 (4): 359–360. дои : 10.2217/whe.09.32 . ПМИД 19586428 .
- ^ Хейнен Э.М., Эйкеманс М.Дж., Де Клерк С., Полиндер С., Беккерс Н.Г., Клинкерт Э.Р. и др. (март 2007 г.). «Мягкая стратегия лечения экстракорпорального оплодотворения: рандомизированное исследование не меньшей эффективности». Ланцет . 369 (9563): 743–749. дои : 10.1016/S0140-6736(07)60360-2 . ПМИД 17336650 . S2CID 25591825 .
- ^ Фаузер Б.К., Наргунд Г., Андерсен А.Н., Норман Р., Тарлацис Б., Бойвин Дж., Леджер В. (ноябрь 2010 г.). «Мягкая стимуляция яичников для ЭКО: 10 лет спустя» . Репродукция человека . 25 (11): 2678–2684. дои : 10.1093/humrep/deq247 . ПМИД 20858698 .
- ^ «Четвертый этап лечения ЭКО: последний ооцит» . Бесплодие.about.com. Архивировано из оригинала 18 ноября 2012 года . Проверено 22 мая 2012 г.
- ^ Ковач П. (23 апреля 2004 г.). «Инъекция ХГЧ после индукции овуляции с помощью цитрата кломифена]» . Медскейп .
- ^ Хумайдан П., Кол С., Папаниколау Э.Г. и др. (Копенгагенская группа по запуску агонистов ГнРГ) (2011). «Агонист ГнРГ, запускающий окончательное созревание ооцитов: время изменить практику?» . Обновление репродукции человека . 17 (4): 510–524. дои : 10.1093/humupd/dmr008 . ПМИД 21450755 .
- ^ Процесс, методы и решения ЭКО https://techxplore.online/ivf-process-methods-and-solutions/. Архивировано 9 июня 2023 г. в Wayback Machine.
- ^ Чжан XD, Лю JX, Лю WW, Гао Ю, Хан В, Сюн С и др. (2013). «Время культуры осеменения и результаты экстракорпорального оплодотворения: систематический обзор и метаанализ» . Обновление репродукции человека . 19 (6): 685–695. дои : 10.1093/humupd/dmt036 . ПМИД 23912477 .
- ^ Абихольм Т., Танбо Т., Дейл П.О., Магнус О. (февраль 1992 г.). «Процедуры экстракорпорального оплодотворения у бесплодных женщин с открытыми фаллопиевыми трубами: сравнение внутриматочного переноса гамет, комбинированного внутриматочного и внутрибрюшинного оплодотворения и только контролируемой гиперстимуляции яичников». Журнал вспомогательной репродукции и генетики . 9 (1): 19–23. дои : 10.1007/BF01204109 . ПМИД 1617244 . S2CID 25057205 .
- ^ Ветчер Ф., Гавличек В., Хубер Т., Жиль М., Тесфай Д., Гриз Дж. и др. (июль 2005 г.). «Внутриматочный перенос гамет и эмбрионов на ранних стадиях для культивирования in vivo у крупного рогатого скота». Териогенология . 64 (1): 30–40. doi : 10.1016/j.theriogenology.2004.11.018 . ПМИД 15935840 .
- ^ Jump up to: а б Дар С., Лазер Т., Шах П.С., Либрах К.Л. (2014). «Неонатальные исходы среди одноплодных родов после переноса эмбрионов на стадии бластоцисты по сравнению с переносом эмбрионов на стадии дробления: систематический обзор и метаанализ» . Обновление репродукции человека . 20 (3): 439–448. дои : 10.1093/humupd/dmu001 . ПМИД 24480786 .
- ^ Ребманн В., Свитала М., Эуэ И., Гросс-Вильде Х. (июль 2010 г.). «Растворимый HLA-G является независимым фактором прогнозирования исхода беременности после АРТ: немецкое многоцентровое исследование» . Репродукция человека . 25 (7): 1691–1698. дои : 10.1093/humrep/deq120 . ПМИД 20488801 .
- ^ Месегер М., Рубио И., Круз М., Базиль Н., Маркос Х., Рекена А. (декабрь 2012 г.). «Инкубация и отбор эмбрионов в системе покадрового мониторинга улучшает исход беременности по сравнению со стандартным инкубатором: ретроспективное когортное исследование» . Фертильность и бесплодие . 98 (6): 1481–9.e10. doi : 10.1016/j.fertnstert.2012.08.016 . ПМИД 22975113 .
- ^ Армстронг С., Бхайд П., Джордан В., Пейси А., Марджорибанкс Дж., Фаркухар К. (май 2019 г.). «Таймлапс-системы для инкубации эмбрионов и оценки их вспомогательной репродукции» . Кокрановская база данных систематических обзоров . 5 (5): CD011320. дои : 10.1002/14651858.CD011320.pub4 . ПМК 6539473 . ПМИД 31140578 .
- ^ «Рейтинг эмбрионов ERICA | Искусственный интеллект для вспомогательных репродуктивных технологий» .
- ^ Чавес-Бадиола А., Фариас А.Ф., Мендисабаль-Руис Дж., Дрейкли А.Дж., Гарсия-Санчес Р., Чжан Дж.Дж. (2019). «Искусственное зрение и машинное обучение, предназначенные для прогнозирования результатов PGT-A» . Фертильность и бесплодие . 112 (3): e231. doi : 10.1016/j.fertnstert.2019.07.715 .
- ^ Чавес-Бадиола А, Флорес-Сайфф Фариас А, Мендисабаль-Руис Дж, Гарсиа-Санчес Р, Дрейкли А.Дж., Гарсия-Сандовал Х.П. (март 2020 г.). «Прогнозирование результатов теста на беременность после переноса эмбрионов путем извлечения и анализа признаков изображения с использованием машинного обучения» . Научные отчеты . 10 (1): 4394. Бибкод : 2020NatSR..10.4394C . дои : 10.1038/s41598-020-61357-9 . ПМК 7064494 . ПМИД 32157183 .
- ^ Тимева Т., Штерев А., Кюркчиев С. (октябрь 2014 г.). «Рецидивирующая неудача имплантации: роль эндометрия» . Журнал репродукции и бесплодия . 15 (4): 173–183. ПМК 4227974 . ПМИД 25473625 .
- ^ «Экстракорпоральное оплодотворение (ЭКО) – Клиника Майо» . www.mayoclinic.org . Проверено 31 августа 2020 г.
- ^ Jump up to: а б ван дер Линден М., Бэкингем К., Фаркухар С., Кремер Дж.А., Метвалли М. (июль 2015 г.). «Поддержка лютеиновой фазы для циклов вспомогательной репродукции» . Кокрановская база данных систематических обзоров . 2015 (7): CD009154. дои : 10.1002/14651858.CD009154.pub3 . hdl : 2066/98072 . ПМК 6461197 . ПМИД 26148507 .
- ^ Киру Д., Колибианакис Э.М., Фатеми Х.М., Тарлатци Т.Б., Деврой П., Тарлатзис Б.К. (2011). «Повышение показателей живорождения при добавлении агонистов ГнРГ для поддержки лютеина в циклах ИКСИ/ЭКО: систематический обзор и метаанализ» . Обновление репродукции человека . 17 (6): 734–740. дои : 10.1093/humupd/dmr029 . ПМИД 21733980 .
- ^ Jump up to: а б с Мастенбрук С., Твиск М., ван дер Вин Ф., Реппинг С. (2011). «Преимплантационный генетический скрининг: систематический обзор и метаанализ РКИ» . Обновление репродукции человека . 17 (4): 454–466. дои : 10.1093/humupd/dmr003 . ПМИД 21531751 .
- ^ Бриттен Н. (7 мая 2011 г.). «Брат-Спаситель исцеляет больного старшего брата» . Дейли Телеграф, Новости здравоохранения . Архивировано из оригинала 10 мая 2011 года . Проверено 8 мая 2011 г.
- ^ Манди Л. (июль – август 2006 г.). «Души на льду: перенасыщение эмбрионами в Америке и напрасные обещания исследований стволовых клеток» . Motherjones.com.
- ^ Порку Э., Фаббри Р., Дамиано Дж., Фратто Р., Джунчи С., Вентуроли С. (апрель 2004 г.). «Криоконсервация ооцитов у онкологических больных». Европейский журнал акушерства, гинекологии и репродуктивной биологии . 113 (Приложение 1): С14–С16. дои : 10.1016/j.ejogrb.2003.11.004 . ПМИД 15041124 .
- ^ «Институт генетики и ЭКО» . Givf.com. Архивировано из оригинала 21 мая 2009 года . Проверено 2 ноября 2016 г. .
- ^ Французский Д.Б., Сабанех Э.С., Гольдфарб Дж., Десаи Н. (март 2010 г.). «Влияет ли тяжелая тератозооспермия на образование бластоцист, частоту живорождения и другие параметры клинических исходов в циклах ИКСИ?» . Фертильность и бесплодие . 93 (4): 1097–1103. doi : 10.1016/j.fertnstert.2008.10.051 . ПМИД 19200957 .
- ^ Фаузер BC, Дидрих К., Бушар П., Домингес Ф., Мацук М., Фрэнкс С. и др. (2011). «Современные генетические технологии и женская репродукция» . Обновление репродукции человека . 17 (6): 829–847. дои : 10.1093/humupd/dmr033 . ПМК 3191938 . ПМИД 21896560 .
- ^ Илмензее К., Левандуски М., Видали А., Хусами Н., Гаудас В.Т. (февраль 2010 г.). «Близнецы человеческих эмбрионов с применением в репродуктивной медицине» . Фертильность и бесплодие . 93 (2): 423–427. doi : 10.1016/j.fertnstert.2008.12.098 . ПМИД 19217091 .
- ^ Оливеннес Ф., Маннартс Б., Стрейс М., Бондюэль М., Деврой П. (август 2001 г.). «Перинатальный исход беременности после лечения антагонистами ГнРГ (ганиреликс) во время стимуляции яичников для обычного ЭКО или ИКСИ: предварительный отчет» . Репродукция человека . 16 (8): 1588–1591. дои : 10.1093/humrep/16.8.1588 . ПМИД 11473947 .
- ^ Камат М.С., Маскаренхас М., Кирубакаран Р., Бхаттачарья С. (август 2020 г.). «Количество эмбрионов для переноса после экстракорпорального оплодотворения или внутрицитоплазматической инъекции спермы» . Кокрановская база данных систематических обзоров . 2020 (8). Cochrane Database Syst Rev. (опубликовано 21 августа 2020 г.): CD003416. дои : 10.1002/14651858.CD003416.pub5 . ПМЦ 8094586 . ПМИД 32827168 .
- ^ Тан К., Ан Л., Мяо К., Рен Л., Хоу З., Тао Л. и др. (март 2016 г.). «Нарушение инактивации импринтированной Х-хромосомы ответственно за искажение соотношения полов после экстракорпорального оплодотворения» . Труды Национальной академии наук Соединенных Штатов Америки . 113 (12): 3197–3202. Бибкод : 2016PNAS..113.3197T . дои : 10.1073/pnas.1523538113 . ПМЦ 4812732 . ПМИД 26951653 .
- ^ Лу Х, Ли Н, Чжан Х, Сунь Л, Ван Х, Хао Д, Цуй С (июль 2020 г.). «Различается ли соотношение полов у одноплодных рождений после переноса замороженной одиночной бластоцисты в зависимости от развития бластоцисты?» . Репродуктивная биология и эндокринология . 18 (1): 72. дои : 10.1186/s12958-020-00623-x . ПМЦ 7362517 . ПМИД 32669110 .
- ^ Практический комитет Американского общества репродуктивной медицины (ноябрь 2008 г.). «Гепатит и репродукция» . Фертильность и бесплодие . 90 (5 доп.): S226–S235. doi : 10.1016/j.fertnstert.2008.08.040 . ПМИД 19007636 .
- ^ Jump up to: а б с Лутгенс С.П., Нелиссен Э.К., ван Лоо И.Х., Кук Г.Х., Дерхааг Дж.Г., Дансельман Г.А. (ноябрь 2009 г.). «Делать или не делать: ЭКО и ИКСИ у хронических носителей вируса гепатита В» . Репродукция человека . 24 (11): 2676–2678. дои : 10.1093/humrep/dep258 . ПМИД 19625309 .
- ^ «Япония запрещает экстракорпоральное оплодотворение для пар с ВИЧ» . Infoniac.com. 21 июля 2008 г. Архивировано из оригинала 19 сентября 2013 г. Проверено 3 августа 2013 г.
- ^ Сиристатидис С., Сергентанис Т.Н., Канавидис П., Тривелла М., Сотираки М., Мавроматис I и др. (2012). «Контролируемая гиперстимуляция яичников для ЭКО: влияние на рак яичников, эндометрия и шейки матки — систематический обзор и метаанализ» . Обновление репродукции человека . 19 (2): 105–123. дои : 10.1093/humupd/dms051 . ПМИД 23255514 . S2CID 10086076 .
- ^ Сергентанис Т.Н., Диамантарас А.А., Перлепе С., Канавидис П., Скалкиду А., Петриду Э.Т. (2013). «ЭКО и рак молочной железы: систематический обзор и метаанализ» . Обновление репродукции человека . 20 (1): 106–123. дои : 10.1093/humupd/dmt034 . ПМИД 23884897 .
- ^ Jump up to: а б Роклифф Х.Э., Лайтман С.Л., Ридиан Э., Бьюкенен Х., Гордон У., Ведхара К. (2014). «Систематический обзор психосоциальных факторов, связанных с эмоциональной адаптацией у пациентов, перенесших экстракорпоральное оплодотворение» . Обновление репродукции человека . 20 (4): 594–613. дои : 10.1093/humupd/dmu010 . ПМИД 24676468 .
- ^ Jump up to: а б Волгстен Х, Скуг Сванберг А, Экселиус Л, Лундквист О, Сундстрем Поромаа I (март 2010 г.). «Факторы риска психических расстройств у бесплодных женщин и мужчин, проходящих лечение методом экстракорпорального оплодотворения» . Фертильность и бесплодие . 93 (4): 1088–1096. doi : 10.1016/j.fertnstert.2008.11.008 . ПМИД 19118826 .
- ^ Боттс С., Райан М. Заболевания, вызванные приемом лекарств. Раздел IV. Психиатрические заболевания, вызванные приемом лекарств. Глава 18. Депрессия . стр. 1–23. Архивировано из оригинала 23 декабря 2010 года.
- ^ Хенрикссон П., Вестерлунд Э., Валлен Х., Брандт Л., Ховатта О., Экбом А. (январь 2013 г.). «Заболеваемость легочной и венозной тромбоэмболией у беременных после экстракорпорального оплодотворения: поперечное исследование» . БМЖ . 346 (3): e8632. дои : 10.1136/bmj.e8632 . ПМК 3546085 . ПМИД 23321489 .
- ^ Даян Н., Филион К.Б., Окано М., Килмартин С., Рейнблатт С., Лэндри Т. и др. (сентябрь 2017 г.). «Сердечно-сосудистый риск после терапии бесплодия: систематический обзор и метаанализ» . Журнал Американского колледжа кардиологов . 70 (10): 1203–1213. дои : 10.1016/j.jacc.2017.07.753 . ПМИД 28859782 .
- ^ Уно К.С., Хаббема Дж.Д., Эйкеманс М.Дж., Коллинз Дж.А., Эверс Дж.Л., те Вельде Э.Р. (сентябрь 2004 г.). «Два новых правила прогнозирования спонтанной беременности, приводящей к живорождению среди субфертильных пар, основанные на синтезе трех предыдущих моделей» . Репродукция человека . 19 (9): 2019–2026. дои : 10.1093/humrep/deh365 . ПМИД 15192070 .
- ^ Симидзу Ю, Кодама Х, Фукуда Дж, Мурата М, Кумагай Дж, Танака Т (январь 1999 г.). «Спонтанное зачатие после рождения детей, зачатых посредством экстракорпорального оплодотворения» . Фертильность и бесплодие . 71 (1): 35–39. дои : 10.1016/S0015-0282(98)00417-8 . ПМИД 9935113 .
- ^ Хансен М., Куринчук Дж. Дж., Милн Э., де Клерк Н., Бауэр С. (2013). «Вспомогательные репродуктивные технологии и врожденные дефекты: систематический обзор и метаанализ» . Обновление репродукции человека . 19 (4): 330–353. дои : 10.1093/humupd/dmt006 . ПМИД 23449641 .
- ^ Рифхейс Дж., Хонейн М.А., Шив Л.А., Корреа А., Хоббс К.А., Расмуссен С.А. (февраль 2009 г.). «Вспомогательные репродуктивные технологии и основные структурные врожденные дефекты в Соединенных Штатах» . Репродукция человека . 24 (2): 360–366. дои : 10.1093/humrep/den387 . ПМИД 19010807 .
- ^ Дэвис М.Дж., Мур В.М., Уилсон К.Дж., Ван Эссен П., Прист К., Скотт Х. и др. (май 2012 г.). «Репродуктивные технологии и риск врожденных дефектов» . Медицинский журнал Новой Англии . 366 (19): 1803–1813. дои : 10.1056/NEJMoa1008095 . ПМИД 22559061 . S2CID 12552533 .
- ^ Чжу Дж.Л., Бассо О., Обель С., Билле С., Олсен Дж. (сентябрь 2006 г.). «Бесплодие, лечение бесплодия и врожденные пороки развития: датская национальная когорта новорожденных» . БМЖ . 333 (7570): 679. doi : 10.1136/bmj.38919.495718.AE . ПМЦ 1584372 . ПМИД 16893903 .
- ^ Панди С., Шетти А., Гамильтон М., Бхаттачарья С., Махешвари А. (2012). «Акушерские и перинатальные исходы при одноплодной беременности в результате ЭКО/ИКСИ: систематический обзор и метаанализ» . Обновление репродукции человека . 18 (5): 485–503. дои : 10.1093/humupd/dms018 . ПМИД 22611174 .
- ^ Jump up to: а б с д и Харт Р., Норман Р.Дж. (2013). «Долгосрочные последствия для здоровья детей, рожденных в результате лечения ЭКО. Часть II — Результаты психического здоровья и развития» . Обновление репродукции человека . 19 (3): 244–250. дои : 10.1093/humupd/dmt002 . ПМИД 23449643 .
- ^ Берк Л.Е. (декабрь 2010 г.). Младенцы, дети и подростки (7-е изд.). Решения Pearson Learning. п. 67. ИСБН 978-0-205-77541-5 – через VitalBook.
- ^ Jump up to: а б Харт Р., Норман Р.Дж. (2013). «Долгосрочные последствия для здоровья детей, рожденных в результате лечения ЭКО: Часть I — Общие последствия для здоровья» . Обновление репродукции человека . 19 (3): 232–243. дои : 10.1093/humupd/dms062 . ПМИД 23449642 .
- ^ Блуаз Э., Фойер С.К., Ринаудо П.Ф. (2014). «Сравнительное внутриутробное развитие и плацентарная функция концепции ВРТ: значение для репродуктивной медицины человека и разведения животных» . Обновление репродукции человека . 20 (6): 822–839. дои : 10.1093/humupd/dmu032 . ПМК 4196686 . ПМИД 24947475 .
- ^ Лазаравичуте Г., Каузер М., Бхаттачарья С., Хаггарти П., Бхаттачарья С. (2014). «Систематический обзор и метаанализ уровней метилирования ДНК и нарушений импринтинга у детей, зачатых с помощью ЭКО/ИКСИ, по сравнению с детьми, зачатыми спонтанно» . Обновление репродукции человека . 20 (6): 840–852. дои : 10.1093/humupd/dmu033 . ПМИД 24961233 .
- ^ Jump up to: а б с Уильямс К.Л., Банч К.Дж., Стиллер К.А., Мерфи М.Ф., Боттинг Б.Дж., Уоллес У.Х. и др. (ноябрь 2013 г.). «Риск рака среди детей, рожденных после искусственного зачатия» . Медицинский журнал Новой Англии . 369 (19): 1819–1827. дои : 10.1056/NEJMoa1301675 . ПМИД 24195549 .
- ^ Марис Т., Доммеринг К.Дж., Имхоф С.М., Корс В.А., Рингенс П.Дж., ван Леувен Ф.Е., Молл AC (декабрь 2009 г.). «Заболеваемость ретинобластомой у голландских детей, зачатых с помощью ЭКО: расширенное исследование» . Репродукция человека . 24 (12): 3220–3224. дои : 10.1093/humrep/dep335 . ПМИД 19783550 .
- ^ Айерс С. (2004). «Мать выиграла 1 миллион долларов за путаницу с ЭКО, но могла потерять сына » Таймс .
- ^ Сведберг С (15 октября 2007 г.). «Репродуктивная клиника использует RFID для подтверждения личности родителей» . RFID-журнал . Архивировано из оригинала 16 июня 2013 года.
- ^ Яшке МЛ (2020). Обмен половыми клетками и эмбрионами - анализ инцидентов в репродуктивной медицине: нормативный контекст, правовые последствия, необходимость регулирования . Исследования по медицинскому и медицинскому праву. Том 2. Мор Зибек. ISBN 9783161591822 .
{{cite book}}:|work=игнорируется ( помогите ) - ^ Стерн HJ (март 2014 г.). «Предимплантационная генетическая диагностика: пренатальное тестирование эмбрионов наконец реализует свой потенциал» . Журнал клинической медицины . 3 (1): 280–309. дои : 10.3390/jcm3010280 . ПМЦ 4449675 . ПМИД 26237262 .
- ^ «Фертильность – это вопрос равных возможностей для пар – Penn Medicine» . www.pennmedicine.org . Проверено 31 августа 2020 г.
- ^ Дамиан Б.Б., Бонетти Т.К., Горовиц Д.Д. (январь 2015 г.). «Практика и этические проблемы в отношении преимплантационной диагностики. Кто регулирует преимплантационную генетическую диагностику в Бразилии?» . Бразильский журнал медицинских и биологических исследований = Revista Brasileira de Pesquisas Medicas e Biologicas . 48 (1): 25–33. дои : 10.1590/1414-431X20144083 . ПМЦ 4288489 . ПМИД 25493379 .
- ^ Эдвардс Р.Г. (март 2005 г.). «Этика и моральная философия начала ЭКО, преимплантационной диагностики и стволовых клеток». Репродуктивная биомедицина онлайн . 10 (Приложение 1): 1–8. дои : 10.1016/S1472-6483(10)62195-5 . ПМИД 15819997 .
- ^ Лоусон Д. (11 марта 2008 г.). «Конечно, глухая пара хочет глухого ребенка» . Независимый . Лондон . Проверено 12 ноября 2009 г.
- ^ Аппель Дж. (12 марта 2009 г.). Больше «дизайнерских» возможностей. The Winnipeg Sun (репортаж).
- ^ Джа А. (31 мая 2007 г.). «Уинстон: клиники ЭКО коррумпированы и жадны» . Хранитель . Лондон.
- ^ Думит Дж (2012). Лекарства на всю жизнь: как фармацевтические компании определяют наше здоровье . Дарем, Северная Каролина: Издательство Университета Дьюка. ISBN 978-0-8223-4860-3 . OCLC 782252371 .
- ^ Дитрих Х (май 1986 г.). ЭКО: что мы можем сделать? . Освобождение или потеря? Канберра.
- ^ Уоррен М.А. (январь 1988 г.). «ЭКО и интересы женщин: анализ феминистских проблем». Биоэтика . 2 (1): 37–57. дои : 10.1111/j.1467-8519.1988.tb00034.x . ПМИД 11649236 .
- ^ Штястна, Анна; Фейт, Томаш; Коцоуркова, Иржина; Вальдауфова, Ева (30 декабря 2022 г.). «Является ли преклонный возраст матери независимым фактором риска кесарева сечения? Общепопуляционное исследование» . Международный журнал экологических исследований и общественного здравоохранения . 20 (1): 668. doi : 10.3390/ijerph20010668 . ISSN 1661-7827 . ПМЦ 9819592 . ПМИД 36612987 .
- ^ Смайдор А (май 2011 г.). «Этика ЭКО старше 40». Матуритас . 69 (1): 37–40. дои : 10.1016/j.maturitas.2011.02.012 . ПМИД 21435805 .
- ^ «В 74 года женщина Андхра стала самой старой женщиной, которая когда-либо рожала» . NDTV.com . 6 сентября 2019 года . Проверено 5 ноября 2015 г.
- ^ Паркс Дж. А. (апрель 1996 г.). «Более пристальный взгляд на репродуктивные технологии и материнство в постменопаузе» . CMAJ . 154 (8): 1189–1191. ПМЦ 1487687 . ПМИД 8612255 .
- ^ Jump up to: а б Комитет по этике Американского общества репродуктивной медицины (октябрь 2009 г.). «Доступ к лечению бесплодия для геев, лесбиянок и лиц, не состоящих в браке» . Фертильность и бесплодие . 92 (4): 1190–1193. doi : 10.1016/j.fertnstert.2009.07.977 . ПМИД 19732884 .
- ^ Мехкатие Э., Розенберг К. (ноябрь 2018 г.). «Никаких вредных последствий для детей однополых родителей» . Американский журнал медсестер . 118 (11): 55. doi : 10.1097/01.NAJ.0000547663.85215.a6 . ISSN 0002-936X . ПМИД 30358598 . S2CID 53028172 .
- ^ Аппель Дж. М. (2006). «Могут ли врачи отказать пациентам-геям в лечении бесплодия?». Отчет Гастингсского центра . 36 (4): 20–21. дои : 10.1353/hcr.2006.0053 . ПМИД 16898357 . S2CID 39694945 .
- ^ Долан М. (29 мая 2008 г.). «Высший суд штата может дать геям еще одну победу» . Лос-Анджелес Таймс .
- ^ Гольдштейн Дж. (19 августа 2008 г.). «Калифорнийские врачи не могут отказать геям в медицинской помощи по религиозным мотивам» . Уолл Стрит Джорнал .
- ^ Jump up to: а б Эгелько Б (19 августа 2008 г.). «Bob Doctors не может использовать предвзятость, чтобы отказать геям в лечении» . Хроники Сан-Франциско .
- ^ Мохаджер СТ (25 октября 2010 г.). «Слушания по выдаче лицензии доктору Octomom возобновляются в Лос-Анджелесе» . Ассошиэйтед Пресс.
- ^ Брейер Х. (22 октября 2010 г.). «Врач Октомамы слезно извиняется, признает ошибку» . Люди . Архивировано из оригинала 4 марта 2016 года . Проверено 22 мая 2012 г.
- ^ «У Михаила Камрава отозвана медицинская лицензия» . Лос-Анджелес Таймс . 1 июня 2011 г.
- ^ Jump up to: а б с д и ж г час Бесс М., Лампе Н.М., Манн Э.С. (сентябрь 2020 г.). «Опыт наступления беременности и родов среди трансгендерных мужчин: обзор литературы» . Йельский журнал биологии и медицины . 93 (4): 517–528. ПМЦ 7513446 . ПМИД 33005116 .
- ^ Кондат А., Маму Г., Лагранж С., Мендес Н., Виларт Дж., Пуарье Ф. и др. (19 ноября 2020 г.). «Отцовство трансгендеров: психологические и семейные последствия для детей» . ПЛОС ОДИН . 15 (11): e0241214. Бибкод : 2020PLoSO..1541214C . дои : 10.1371/journal.pone.0241214 . ПМЦ 7676740 . ПМИД 33211742 .
- ^ Обедин-Маливер и Макадон 2016 , § «Психологические соображения».
- ^ Обедин-Маливер и Макадон 2016 , § «Фертильность и достижение беременности».
- ^ Шеллер КА. «Нерассказанная история детей, зачатых донорами» . Христианство сегодня . Архивировано из оригинала 18 июля 2012 года.
- ^ Мотлюк А (27 мая 2011 г.). «Канадский суд запрещает анонимное донорство спермы и яйцеклеток». Природа . дои : 10.1038/news.2011.329 .
- ^ « Моего папу зовут донор » . ЭНЕРГЕТИЧЕСКИЙ ЯДЕРНЫЙ РЕАКТОР . 16 августа 2010 г.
- ^ «Дети, зачатые донорами, используют Интернет для поиска родственников и обмена информацией» . Вашингтон Пост . 26 сентября 2011 г.
- ^ «Донорский эмбрион: онлайн-руководство для потенциальных доноров» . РЕШАТЬ. Архивировано из оригинала 19 февраля 2013 года . Проверено 3 августа 2013 г.
- ^ Jump up to: а б Бейл Л. (1 сентября 2009 г.). «Что происходит с лишними эмбрионами после ЭКО?» . CNN .
- ^ Дуглас Т., Савулеску Дж. (апрель 2009 г.). «Уничтожение нежелательных эмбрионов в исследованиях. Тема для разговора о морали и исследованиях человеческих эмбрионов» . Отчеты ЭМБО . 10 (4): 307–312. дои : 10.1038/embor.2009.54 . ПМЦ 2672894 . ПМИД 19337299 .
- ^ Хуг К. (февраль 2008 г.). «Мотивация жертвовать или не жертвовать лишние эмбрионы для исследования стволовых клеток: обзор литературы». Фертильность и бесплодие . 89 (2): 263–277. doi : 10.1016/j.fertnstert.2007.09.017 . ПМИД 18166188 .
- ^ Лемоник, доктор медицины (1999). «Дизайнерские малыши» . Журнал «Тайм» . 153 (1): 64–67. ПМИД 11656968 . Архивировано из оригинала 8 марта 2016 года.
- ^ Файнберг, Ребекка С.; Синха, Майкл С.; Коэн, И. Гленн (4 марта 2024 г.). «Решение Алабамы об эмбрионах — политика и реальность признания «внеутробных детей» » . ДЖАМА . 331 (13): 1083–1084. дои : 10.1001/jama.2024.3559 . ISSN 0098-7484 . ПМИД 38436995 .
- ^ «Папа Бенедикт XVI заявляет, что эмбрионы, разработанные для экстракорпорального оплодотворения, имеют право на жизнь» , Медицинские новости сегодня , заархивировано из оригинала 29 декабря 2008 г.
- ^ Папа Павел VI (25 июля 1968 г.). «Humanae Vitae: Энциклика Папы Павла VI о регулировании рождаемости, раздел 12» . Рим: Ватикан . Проверено 25 ноября 2008 г.
- ^ Jump up to: а б с Дейн А. (30 июля 2009 г.). «Примирение религии и бесплодия» . Архивировано из оригинала 4 ноября 2013 года.
- ^ «Катехизис Католической Церкви. Раздел 2377» . Рим: Ватикан. 1993 год . Проверено 25 ноября 2008 г.
- ^ «Наука в индуизме-Дети из пробирки» . 20 октября 2013 года. Архивировано из оригинала 8 октября 2016 года . Проверено 30 мая 2016 г. .
- ^ Inhorn MC (декабрь 2006 г.). «Создание мусульманских детей: ЭКО и донорство гамет в суннитском и шиитском исламе» . Культура, медицина и психиатрия . 30 (4): 427–450. дои : 10.1007/s11013-006-9027-x . ПМК 1705533 . ПМИД 17051430 . Архивировано из оригинала 24 июня 2009 года . Проверено 3 ноября 2013 г.
- ^ Циц Элиэзер 9 стр. 247
- ^ Дра Б. (2012). «Сироты в Африке к югу от Сахары: кризис, вмешательства и антрополог». Африка сегодня . 59 (2 (зима 2012 г., 2012 г.)): 3–21. дои : 10.2979/africatoday.59.2.3 . S2CID 144808526 .
- ^ Лоренц Т. (2 октября 2019 г.). «Как ананас стал символом ЭКО» The New York Times . ISSN 0362-4331 . Проверено 4 октября 2019 г.
- ^ Илиой ЕС, Голомбок С (2014). «Психологическая адаптация подростков, зачатых с помощью вспомогательных репродуктивных технологий: систематический обзор» . Обновление репродукции человека . 21 (1): 84–96. дои : 10.1093/humupd/dmu051 . ПМЦ 4255607 . ПМИД 25281685 .
- ^ Jump up to: а б с д и Тросби К., Гилл Р. (апрель 2004 г.). « Для мужчин все по-другому»: мужественность и ЭКО» (PDF) . Мужчины и мужественность . 6 (4): 330–48. дои : 10.1177/1097184X03260958 . S2CID 145574208 .
- ^ Уиттакер А (2009). «Глобальные технологии и транснациональное воспроизводство в Таиланде». Обзор азиатских исследований . 33 (3): 324. дои : 10.1080/10357820903154101 . S2CID 143676709 .
- ^ Бойтель М., Купфер Дж., Кирхмейер П., Кеде С., Кён Ф.М., Шредер-Принцен И. и др. (январь 1999 г.). «Связанные с лечением стрессы и депрессия у пар, проходящих вспомогательное репродуктивное лечение с помощью ЭКО или ИКСИ» . Андрология . 31 (1): 27–35. дои : 10.1111/j.1439-0272.1999.tb02839.x . ПМИД 9949886 . S2CID 22578866 .
- ^ Торнтон, Рози (21 марта 2008 г.). «Европейский суд по правам человека: Согласие на лечение ЭКО» . Международный журнал конституционного права . 6 (2): 317–330. дои : 10.1093/значок/mon001 . Проверено 7 августа 2023 г.
- ^ Кин М., Лонг Дж., О'Нолан Дж., Фарагер Л. (2017). Вспомогательные репродуктивные технологии: международные подходы к механизмам и критериям государственного финансирования. Обзор доказательств (Отчет). Дублин: Совет по медицинским исследованиям.
- ^ Чемберс ГМ, Адамсон ГД, Эйкеманс МЮ (август 2013 г.). «Приемлемая стоимость для пациента и общества» . Фертильность и бесплодие . 100 (2): 319–27. doi : 10.1016/j.fertnstert.2013.06.017 . ПМИД 23905708 .
- ^ Jump up to: а б с Вейгель Дж., Ранджи Ю., Лонг М. (15 сентября 2020 г.). «Охват и использование услуг по лечению бесплодия в США» KFF . Проверено 30 ноября 2022 г.
- ^ Jump up to: а б с д и Чемберс ГМ, Салливан Э.А., Исихара О, Чепмен М.Г., Адамсон Г.Д. (июнь 2009 г.). «Экономическое воздействие вспомогательных репродуктивных технологий: обзор отдельных развитых стран» . Фертильность и бесплодие . 91 (6): 2281–2294. doi : 10.1016/j.fertnstert.2009.04.029 . ПМИД 19481642 .
- ^ «Призыв к повышению осведомленности о проблемах бесплодия» . Новости РТЭ . 23 сентября 2009 г.
- ^ Jump up to: а б с д «Глава 11: Вспомогательные репродуктивные технологии» . ncd.gov . 3 августа 2015 г. Архивировано из оригинала 25 ноября 2021 г. Проверено 7 декабря 2021 г.
- ^ Jump up to: а б Лермонт С., Вилория Р., Ламберт С., Голдхаммер Х., Кеуроглиан А.С. (сентябрь 2018 г.). «Барьеры для страхового покрытия пациентов-трансгендеров». Американский журнал акушерства и гинекологии . 219 (3): 272.e1–272.e4. дои : 10.1016/j.ajog.2018.04.046 . ПМИД 29733842 . S2CID 205373980 .
- ^ Кирубараджан А., Патель П., Люнг С., Парк Б., Сьерра С. (май 2021 г.). «Культурная компетентность в уходе за бесплодием лесбиянок, геев, бисексуалов, трансгендеров и гомосексуалистов: систематический обзор точек зрения пациентов и поставщиков» . Фертильность и бесплодие . 115 (5): 1294–1301. doi : 10.1016/j.fertnstert.2020.12.002 . ПМИД 33610322 . S2CID 231990647 .
- ^ «Совместное материнство: удивительный способ, которым лесбийские пары рожают детей» . Космополитен . 14 февраля 2018 года . Проверено 21 марта 2018 г.
- ^ Берковиц Д. (2020), Голдберг А.Е., Аллен К.Р. (ред.), «Геи и суррогатное материнство» , ЛГБТК-родительские семьи: инновации в исследованиях и последствия для практики , Чам: Springer International Publishing, стр. 143–160, doi : 10.1007/978-3-030-35610-1_8 , ISBN 978-3-030-35610-1 , получено 30 ноября 2022 г.
- ^ Jump up to: а б Байер С.Р. (2017). Байер С.Р., Альпер М.М., Пензиас А.С. (ред.). Практическое руководство для практикующих врачей, оказывающих помощь бесплодным парам, четвертое издание . ЦРК Пресс. дои : 10.4324/9781351241496 . ISBN 9781351241496 .
- ^ Хоффклинг А., Обедин-Маливер Дж., Севелиус Дж. (ноябрь 2017 г.). «От стирания к возможностям: качественное исследование опыта трансгендерных мужчин в отношении беременности и рекомендации для поставщиков» . BMC Беременность и Роды . 17 (Приложение 2): 332. doi : 10.1186/s12884-017-1491-5 . ПМЦ 5688401 . ПМИД 29143629 .
- ^ Гофранян А., Аарон Д., Фриденталь Дж., Хэнли В.Дж., Ли Дж.А., Данейко М. и др. (2 сентября 2022 г.). «Создание семьи у пациентов-трансгендеров: современные стратегии лечения с использованием вспомогательных репродуктивных технологий» . Здоровье трансгендеров . 9 (1): 76–82. дои : 10.1089/trgh.2021.0210 . ISSN 2688-4887 . PMC 10835155. PMID 38312448 . S2CID 252136338 .
- ^ Максвелл С., Нойес Н., Киф Д., Беркли А.С., Голдман К.Н. (июнь 2017 г.). «Исходы беременности после сохранения фертильности у трансгендерных мужчин». Акушерство и гинекология . 129 (6): 1031–1034. дои : 10.1097/AOG.0000000000002036 . ПМИД 28486372 .
- ^ Обедин-Маливер, Юнона; Макадон, Харви Дж. (март 2016 г.). «Трансгендеры и беременность» . Акушерская медицина . 9 (1): 4–8. дои : 10.1177/1753495X15612658 . ПМК 4790470 . ПМИД 27030799 .
- ^ Jump up to: а б Люнг А., Саккас Д., Панг С., Торнтон К., Решеткова Н. (ноябрь 2019 г.). «Результаты применения вспомогательных репродуктивных технологий у пациентов-трансгендеров из женщины в мужчину по сравнению с цисгендерными пациентами: новый рубеж в репродуктивной медицине» . Фертильность и бесплодие . 112 (5): 858–865. doi : 10.1016/j.fertnstert.2019.07.014 . ПМИД 31594633 . S2CID 203983887 .
- ^ КолоCRM. «Варианты трансгендерной беременности для мужчин и женщин» . CCRM Рождаемость . Проверено 7 декабря 2021 г.
- ^ Сильверс А., Фрэнсис Л., Бадеш Б. (апрель 2016 г.). «Репродуктивные права и доступ к репродуктивным услугам для женщин с ограниченными возможностями» . Журнал этики АМА . 18 (4): 430–437. doi : 10.1001/journalofethics.2016.18.4.msoc1-1604 . ПМИД 27099193 .
- ^ Ачарья К., Лантос Дж.Д. (апрель 2016 г.). «Учет принятия решений и сексуальности при подавлении менструального цикла у подростков и молодых людей с умственными нарушениями» . Журнал этики АМА . 18 (4): 365–372. doi : 10.1001/journalofethics.2016.18.4.ecas2-1604 . ПМИД 27099185 .
- ^ «Больше детей, родившихся в результате ЭКО, но меньше многоплодных детей» . Австралиец . 24 сентября 2009 г. Архивировано из оригинала 24 сентября 2009 г.
- ^ Киппен Р., Эванс А., Грей Э. (апрель 2011 г.). «Австралийское отношение к технологии выбора пола» . Фертильность и бесплодие . 95 (5): 1824–1826. doi : 10.1016/j.fertnstert.2010.11.050 . ПМИД 21163475 .
- ^ Гейтс-младший Х.Л., Акьемпонг Э., Нивен С.Дж. (2 февраля 2012 г.). Словарь африканской биографии . ОУП США. стр. 25–. ISBN 978-0-19-538207-5 .
- ^ «Вспомогательные репродуктивные технологии: международные подходы к механизмам и критериям государственного финансирования» . Совет по медицинским исследованиям . 2017 . Проверено 30 ноября 2019 г.
- ^ «Медикэр и планы лекарств» . Правительство Нью-Брансуика . 19 апреля 2013 года. Архивировано из оригинала 5 декабря 2019 года . Проверено 30 ноября 2019 г.
- ^ «Лечение бесплодия – Фонд специальной помощи» . Сервис Нью-Брансуик . 2018 . Проверено 30 ноября 2019 г.
- ^ «Рождаемость Онтарио: объяснение финансирования» . ТРИО Фертильность . 2016 . Проверено 30 ноября 2019 г.
- ^ Jump up to: а б «Китай будет препятствовать абортам, чтобы повысить низкую рождаемость» . Рейтер . 16 августа 2022 года. Архивировано из оригинала 16 августа 2022 года . Проверено 16 августа 2022 г.
{{cite web}}: CS1 maint: bot: исходный статус URL неизвестен ( ссылка ) - ^ Де Гейтер, К; Кальхас-Хорхе, К; Купка, М.С.; Винс, К; Мокану, Э; Мотренко Т; Скаравелли, Дж; Сминк, Дж; Видакович, С; Гуссенс, В. (2020). «Исправление. АРТ в Европе, 2015 г.: результаты, полученные ESHRE из европейских реестров» . Репродукция человека Открыть . 2020 (3): hoaa038. doi : 10.1093/hropen/hoaa038 . ISSN 2399-3529 . ПМК 7508022 . ПМИД 32995563 .
- ^ Чаттерджи П. «ЭКО: благодатная почва» . BW Деловой мир . Проверено 8 июля 2017 г.
- ^ «Законопроект о вспомогательных репродуктивных технологиях (регулирование), 2020 г.» . Проверено 2 декабря 2021 г.
- ^ «Экстракорпоральное оплодотворение» . health.gov.il . Проверено 1 августа 2019 г.
- ^ «Три попытки ЭКО — двойной шанс» . 14 мая 2024 г.
- ^ «ЭКО, экстракорпоральное оплодотворение» . 1177.se (на шведском языке) . Проверено 23 февраля 2019 г.
- ^ «Проблемы фертильности: оценка и лечение» . 20 февраля 2013 г.
- ^ «RIP IVF? Сокращение расходов Национальной службы здравоохранения на лечение бесплодия «лишит тысячи родительских прав» » . Независимый . 2 ноября 2015 года . Проверено 2 ноября 2015 г.
- ^ «Расходы Национальной службы здравоохранения на ЭКО «должны быть ограничены», - говорит эксперт по рождаемости» . Новости Би-би-си . 29 октября 2015 года . Проверено 30 октября 2015 г.
- ^ Фертильность: оценка и лечение людей с проблемами фертильности (Отчет) (обновленная редакция 2016 г.). Национальный институт здравоохранения и клинического мастерства. Февраль 2013. с. 7. Архивировано из оригинала 17 февраля 2017 года . Проверено 17 февраля 2017 г. .
- ^ «В Англии сокращается доступ Национальной службы здравоохранения к ЭКО» . Новости Би-би-си . 7 августа 2017 г. Проверено 5 сентября 2017 г.
- ^ «CCG предлагают ряд новых сокращений нормирования для восполнения дефицита» . Руководитель здравоохранения. 16 августа 2017 года. Архивировано из оригинала 6 октября 2017 года . Проверено 5 октября 2017 г.
- ^ «Количество CCG, предлагающих рекомендуемые циклы ЭКО, упало на 50% за 4 года» . Руководитель здравоохранения. 30 октября 2017 года. Архивировано из оригинала 26 декабря 2017 года . Проверено 24 декабря 2017 г.
- ^ «CCG предупредили, что политика может нарушить законы о дискриминации» . Журнал службы здравоохранения. 9 ноября 2017 года . Проверено 26 декабря 2017 г.
- ^ «Регулирующий орган утверждает, что сокращение количества ЭКО подвергает риску матерей и детей» . Журнал службы здравоохранения. 4 сентября 2018 года . Проверено 8 октября 2018 г.
- ^ Jump up to: а б Хамуд А.О., Гибсон М., Стэнфорд Дж., Уайт Дж., Каррелл Д.Т., Петерсон М. (май 2009 г.). «Доступность и использование экстракорпорального оплодотворения в Соединенных Штатах: исследование демографических, социальных и экономических факторов» . Фертильность и бесплодие . 91 (5): 1630–1635. doi : 10.1016/j.fertnstert.2007.10.038 . ПМИД 18539275 .
- ^ Крафт Д (17 июля 2011 г.). «Там, где ценят семью, помощь бесплатна» . Нью-Йорк Таймс .
- ^ Jump up to: а б с «Узнайте о покрытии лечения бесплодия в штате США» . РЕШЕНИЕ: Национальная ассоциация по бесплодию . 27 августа 2021 г. Проверено 2 декабря 2021 г.
- ^ Jump up to: а б Appel JS (15 июля 2009 г.). «Материнство: когда-нибудь слишком поздно?» . Нью-Йорк Таймс .
- ^ «Китай запрещает экстракорпоральное оплодотворение во время беременности» . Redorbit.com. 12 ноября 2003 г. Архивировано из оригинала 15 июля 2011 г. Проверено 22 мая 2012 г.
- ^ Шарма, Северная Каролина (5 января 2018 г.). «Министерство здравоохранения получает жалобы на веб-гигантов за нарушения в определении пола» . liveМинт . Проверено 9 июля 2020 г.
- ^ «Чтобы обеспечить себе любимого мальчика, индийцы стекаются в Бангкок | Новости Индии – Times of India» . Таймс оф Индия . 27 декабря 2010 г.
- ^ «Эксперт по ЭКО в Чандигархе помогает полиции арестовать жителя Дели, пытающегося выбрать пол | Новости Чандигарха – Times of India» . Таймс оф Индия . 26 июня 2016 г.
- ^ Инхорн МК. «Ислам, ЭКО и повседневная жизнь на Ближнем Востоке» (PDF) . AIME: Антропология Ближнего Востока . 1 (1): 37–45. Архивировано из оригинала (PDF) 7 июля 2011 года.
- ^ «Запрет ЭКО в Коста-Рике» . Ivfcostworldwide.com. Архивировано из оригинала 3 марта 2017 года . Проверено 22 мая 2012 г.
- ^ Мурильо А (12 июля 2011 г.). «Католическая Коста-Рика застряла на экстракорпоральном оплодотворении» . Страна .
- ^ «CIDH продлевает срок принятия закона об экстракорпоральном оплодотворении в Коста-Рике» . Insidecostarica.com . 24 февраля 2011 г.
- ^ Катандзаро М (28 декабря 2012 г.). «Суд по правам человека постановил отменить последний в мире запрет на ЭКО» . НОВОСТНОЙ БЛОГ . Природа . Проверено 5 января 2017 г.
- ^ «Суд отменил запрет Коста-Рики на экстракорпоральное оплодотворение» . Нью-Йорк Таймс . Ассошиэйтед Пресс. 22 декабря 2012 г.
- ^ «Коста-Рика наконец-то разрешила экстракорпоральное оплодотворение после 15-летнего запрета | Пресс-служба Интер» . ipsnews.net . 15 сентября 2015 г.
- ^ О'Коннор П. (18 апреля 2002 г.). «Австралийский суд одобрил лечение бесплодия для одиноких лесбиянок» . Ассошиэйтед Пресс.
- ^ Хоар Д. (15 декабря 2007 г.). «Лесбийское сообщество приветствует изменения Вик ЭКО» . abc.net.au.
- ^ «21 CFR 1271.90(a)(2)» . Управление по контролю за продуктами и лекарствами США .
- ^ «Бюджетная записка, HB 2159 – SB 2136, от Комитета по финансовому обзору Генеральной Ассамблеи Теннесси» (PDF) . Проверено 22 мая 2012 г.
- ^ «SB 0078 Стэнли, Банч. (HB 0605 ДеБерри Дж., Хенсли.)» . Wapp.capitol.tn.gov. Архивировано из оригинала 23 августа 2014 года . Проверено 22 мая 2012 г.
- ^ «Теннесси стремится запретить ЭКО для лиц, не состоящих в браке» . Eggdonor.com. 31 марта 2009 года . Проверено 22 мая 2012 г.
- ^ «Законодательное обновление» . Tnep.org. Архивировано из оригинала 7 февраля 2008 года . Проверено 22 мая 2012 г.
- ^ Уокер, Адриа Р. (20 февраля 2024 г.). «Верховный суд Алабамы постановил, что замороженные эмбрионы являются «детьми» » . Хранитель . ISSN 0261-3077 . Проверено 22 февраля 2024 г.
- ^ «Суд Алабамы постановил, что замороженные эмбрионы — это дети, что пугает сторонников ЭКО» . США СЕГОДНЯ . Проверено 22 февраля 2024 г.
- ^ «Верховный суд Алабамы постановил, что замороженные эмбрионы являются «детьми» в соответствии с законодательством штата» . ЭНЕРГЕТИЧЕСКИЙ ЯДЕРНЫЙ РЕАКТОР . 20 февраля 2024 г.
- ^ Тэмсетт, Изабель Розалес, Кристина Максурис, Мэг Тиррелл, Крис Юд, Максим (21 февраля 2024 г.). «Через несколько дней после того, как Верховный суд Алабамы постановил, что замороженные эмбрионы являются детьми, одно учреждение приостановило лечение ЭКО» . CNN . Проверено 22 февраля 2024 г.
{{cite web}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Хеннесси-Фиске, Молли (1 марта 2024 г.). «Законодатели Алабамы принимают закон, защищающий лечение ЭКО» . Вашингтон Пост . ISSN 0190-8286 . Проверено 1 марта 2024 г.
- ^ Дэвис, Эрин (1 марта 2024 г.). «Законопроекты о защите экстракорпорального оплодотворения проходят в обеих палатах Законодательного собрания Алабамы» . ВФСА . Проверено 1 марта 2024 г.
- ^ Найт Р.Д. (30 мая 2020 г.). «Замороженные эмбрионы и развод в Иллинойсе» . rdklegal.com . Проверено 11 июня 2020 г.
- ^ «Демистификация IUI, ICI, IVI и ЭКО» . Сиэтлский банк спермы . 4 января 2014 г.
Дальнейшее чтение
- Хениг Р.М. (2004). Ребенок Пандоры: Как первые дети из пробирки вызвали репродуктивную революцию . Нью-Йорк: Хоутон Миффлин . ISBN 978-0-618-22415-9 .
- Хоуп Т., Локвуд Дж., Локвуд М., Бьюли С., Джексон Дж., Крафт I (июнь 1995 г.). «Следует ли пожилым женщинам предлагать экстракорпоральное оплодотворение?» . БМЖ . 310 (6992): 1455–1458. дои : 10.1136/bmj.310.6992.1455 . ПМК 2549820 . ПМИД 7613283 .
- Сенг С.В., Ёнг К.Т., Ло С.Ф., Садхана Н., Ло С.К. (март 2005 г.). «Экстракорпоральное оплодотворение у женщин в возрасте 40 лет и старше» (PDF) . Сингапурский медицинский журнал . 46 (3): 132–136. ПМИД 15735878 .
Внешние ссылки
- «Клиники ЭКО и статистика Великобритании]» . Управление по оплодотворению человека и эмбриологии . Архивировано из оригинала 7 августа 2009 года.
- «Информация, статистика и списки США по вспомогательным репродуктивным технологиям» . Центры по контролю и профилактике заболеваний . Архивировано из оригинала 23 марта 2005 года.