Лимфоидная ткань, связанная с кишечником
| Лимфоидная ткань, связанная с кишечником | |
|---|---|
| Подробности | |
| Система | Лимфатическая система |
| Идентификаторы | |
| Акроним(ы) | НЕПРАВИЛЬНЫЙ |
| ФМА | 62820 |
| Анатомическая терминология | |
Лимфоидная ткань, связанная с кишечником ( GALT ) [1] является компонентом лимфоидной ткани, связанной со слизистой оболочкой (MALT), которая работает в иммунной системе, защищая организм от вторжения в кишечник .
Благодаря своей физиологической функции по поглощению пищи поверхность слизистой оболочки тонкая и действует как проницаемый барьер для внутренних органов тела. Точно так же его хрупкость и проницаемость создают уязвимость для инфекции, и фактически подавляющее большинство инфекционных агентов, проникающих в организм человека, используют этот путь. [2] Функциональное значение GALT в защите организма зависит от его большой популяции плазматических клеток , которые являются продуцентами антител , количество которых превышает количество плазматических клеток в селезенке , лимфатических узлах и костном мозге вместе взятых. [3] GALT составляет около 70% иммунной системы по весу; нарушенный GALT может существенно повлиять на силу иммунной системы в целом. [4]
Структура
[ редактировать ]Лимфоидная ткань, связанная с кишечником, расположена по всему кишечнику, занимая площадь примерно 260–300 м². 2 . [5] С целью увеличения площади поверхности всасывания слизистую оболочку кишечника составляют пальцеобразные выросты ( ворсинки ), покрытые монослоем эпителиальных клеток , отделяющим ГАЛТ от просвета кишечника и его содержимого. Эти эпителиальные клетки покрыты слоем гликокаликса на своей просветной поверхности, чтобы защитить клетки от кислого pH. [ нужна ссылка ]
На дне кишечных желез постоянно образуются новые эпителиальные клетки, полученные из стволовых клеток , регенерирующие эпителий ( время обновления эпителиальных клеток составляет менее одной недели). [2] [6] Хотя в этих криптах обычные энтероциты преобладают клетки Панета , также можно обнаружить . Они расположены на дне крипт и выделяют ряд антибактериальных веществ, в том числе лизоцим, которые, как полагают, участвуют в борьбе с инфекциями. [ нужна ссылка ]
Под ними находится нижележащий слой рыхлой соединительной ткани, называемый собственной пластинкой . Существует также лимфатическая циркуляция через ткани, связанные с брыжеечными лимфатическими узлами .
И GALT, и мезентериальные лимфатические узлы являются местами, где запускается иммунный ответ из-за присутствия иммунных клеток через эпителиальные клетки и собственную пластинку слизистой оболочки .
GALT также включает пейеровы бляшки , тонкой кишки изолированные лимфоидные фолликулы, присутствующие по всему кишечнику и в аппендиксе у человека. [2]
Следующие примеры включают лимфоидные ткани, которые действуют как интерфейсы между иммунной системой и поступающими антигенами либо в качестве пищевых антигенов, либо в качестве антигенов патогенной или комменсальной микробиоты: [ нужна ссылка ]
- Тонзиллярное кольцо Вальдейера
- Мелкие лимфоидные скопления в пищеводе
- Лимфоидная ткань, накапливающаяся с возрастом в желудке
- Пейеровы бляшки в тонком кишечнике
- Диффузно распределенные лимфоидные клетки и плазматические клетки в собственной пластинке кишечника.
- Внутриэпителиальные лимфоциты ( ИЭЛ ), рассеянные в эпителиальном слое поверхностей слизистых оболочек.
- Лимфоидные скопления в аппендиксе и толстой кишке
- Мезентериальные лимфатические узлы, дренирующие лимфу, поступающую из тканей кишечника.
GALT также можно разделить на две категории, учитывая структуру, из которой возникает функция. Там можно найти 1.) организованный ГАЛТ, состоящий из фолликулов, таких как пейеровы бляшки, брыжеечные лимфатические узлы и еще более организованный аппендикс. Его основная функция – вызвать иммунную реакцию. 2.) диффузный ГАЛТ с единичными Т- и В-клетками, макрофагами, эозинофилами, базофилами и тучными клетками, преимущественно обнаруживаемыми в собственной пластинке слизистой оболочки. Эта часть GALT состоит из зрелых эффекторных клеток, готовых выполнять свои действия. [ нужна ссылка ]
GALT был описан у взрослого восточного серого кенгуру ( Macropus giganteus ). [7] таммарский валлаби ( Notamacropus eugenii ), [8] даннарт полосолицый ( Sminthopsis macroura ), [9] и фаскогал краснохвостый ( Phascogale Calura ). [10] взрослого северного бурого бандикута ( Isoudon macrourus ) имеется как организованный, так и диффузный GALT. Описано, что у [11]
Развитие GALT также описано у нескольких видов сумчатых. [12] включая таммарских валлаби, [13] даннарты полосатые ( Sminthopsis macroura ), [14] [15] и краснохвостые фаскогалы [16]
пластыри Пейера
[ редактировать ]Пейерова бляшка представляет собой совокупность лимфоидных клеток, выступающих в просвет кишечника и действующую как очень важный участок для инициации иммунного ответа. Он образует субэпителиальный купол, в котором обнаруживается большое количество В-клеточных фолликулов с зародышевыми центрами, в меньшем количестве между ними находятся Т-клеточные области и дендритные клетки. В этой области субэпителиальный купол отделен от просвета кишечника слоем фолликул-ассоциированного эпителия . Он содержит обычные эпителиальные клетки кишечника и небольшое количество специализированных эпителиальных клеток, называемых клетками микроскладок (М-клетки) между ними. В отличие от энтероцитов, эти М-клетки имеют складчатую просветную поверхность вместо микроворсинок, не секретируют пищеварительные ферменты или слизь и не имеют толстой поверхности гликокаликса, поэтому они могут контактировать с микробиотой и антигенами, присутствующими в содержимом кишечника. [ нужна ссылка ]
Функция
[ редактировать ]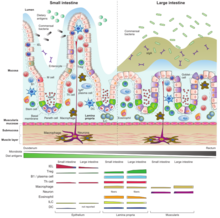
В нормальных условиях иммунная система всего организма нуждается в кишечном источнике антигенов для обучения и регулирования развития различных иммунных клеток. Без такой стимуляции многие свойства иммунной системы не развиваются, как это показано на примере стерильных животных. Поскольку иммунные клетки находятся в постоянном контакте с бактериальными и пищевыми антигенами, первичный ответ считается толерогенным. Тем не менее, должна быть надежная защита на случай, если патогены пересекают границу эпителия или производят вредные вещества, такие как бактериальные токсины. Такое хождение по острию ножа обеспечивают разнообразные типы иммунных клеток:
B-лимфоциты
[ редактировать ]Плазменные В-клетки, находящиеся в собственной пластинке, продуцируют высокие уровни специфических секреторных антител IgA (sIgA). Эти IgA секретируются в просвет кишечника через эпителиальный слой путем трансцитоза. Сначала эпителиальная клетка связывает димер IgA через полимерный рецептор Ig на базолатеральной стороне и транспортирует его в пузырьке в просветное пространство. Затем рецептор протеолитически расщепляется и высвобождается димер IgA вместе с частью рецептора, называемой секреторным компонентом . Секреторный компонент защищает секретируемые антитела от пищеварительной среды кишечника. [17]
Высокий уровень секреторного IgA является результатом взаимодействия В-клеток и кишечных антиген-представляющих дендритных клеток (ДК) во взаимодействии с фолликулярными Т-хелперными клетками (Тфх) в зародышевых центрах (ГЦ) пейеровых бляшек. [18] Существует два основных пути продукции IgA: 1) зависимый от Т-клеток, приводящий к образованию sIgA с высокой аффинностью и специфичностью, и 2) независимая от Т-клеток генерация sIgA, которая использует дендритные клетки и продуцирует ими цитокины BAFF и APRIL. sIgA, независимо продуцируемые Т-клетками, имеют более низкую аффинность и покрывают в основном комменсалов. [19] [20] Общие функции секреторных IgA заключаются в том, чтобы покрывать любые кишечные бактерии (комменсальные или патогенные), нарушая их подвижность и предотвращая их длительный и прямой контакт с эпителием кишечника и иммунной системой кишечника хозяина. Это называется иммунным исключением. Секретируемые IgA связываются с бактериальными токсинами и также нейтрализуют их. [18] [19] [20]
Т-лимфоциты
[ редактировать ]Наивные CD4+Т-клетки дифференцируются в Treg или различные субпопуляции Т-хелперов (Th1, Th2, Th17 или Tfh). В лимфоидной ткани, связанной с кишечником, процесс дифференцировки происходит посредством презентации антигенов, полученных из микробиоты кишечника, антигенпредставляющими клетками, такими как дендритные клетки или М-клетки в пейеровых бляшках. [18] Типичный процесс оральной толерантности к поступившим в пищу пищевым антигенам можно описать как непрерывный отбор антигенов в просвете ДК и их последующую миграцию с последующим праймированием наивных Т-клеток в мезентериальных лимфатических узлах для превращения в иммуносупрессивные Т-клетки (Treg). [21] Полученные таким образом антигены обеспечивают толерантность к ним. Комменсальная микробиота также активирует иммунный ответ, защищая ткани кишечника хозяина от повреждения реакциями иммунных клеток. Результат развития популяций Т-клеток у здоровых людей отличается от спектра Т-клеток, возникающих в результате острой инфекции или хронического воспаления. Несоответствующая стимуляция (обычно сегментированными нитчатыми бактериями - SFB ) хронического клеточного ответа Th1 или Th17 играет решающую роль в патологическом повреждении хозяина. [22]
Описано несколько новых лимфоидных клеток, ассоциированных с кишечником. Они имеют разное происхождение и следуют разным процессам созревания, но выполняют одну и ту же роль GALT – быстро реагировать на патогены и секретировать эффекторные цитокины. Такие многоуровневые системы защиты подчеркивают восприимчивость участков слизистой оболочки к вторгающимся агентам. Слизистый путь является наиболее частым путем проникновения патогенных инфекций в организм хозяина. [23] Активное взаимодействие различных лимфоидных клеток, патрулирующих эпителиальный слой, также отражает эволюционное давление и гонку вооружений между иммунными системами и патогенами, ускользающими от ее контроля. [24]
Интраэпителиальные лимфоциты (ИЭЛ)
[ редактировать ]Долгоживущие и резидентные интраэпителиальные лимфоциты (ИЭЛ) представляют собой одну из крупнейших популяций Т-лимфоцитов в организме. [24] В отличие от других периферических лимфоцитов, ИЭЛ не циркулируют в кровотоке или лимфатической системе, а локализуются в эпителиальном слое кишечника. [25] Такое расположение само по себе является особенным – ИЭЛ патрулируют состояние внутри одного слоя клеток и имеют дендритный вид. [26] Они обеспечивают первую линию защиты в случае проникновения возбудителя через эпителиальный барьер. IEL охватывают удивительное разнообразие происхождения и делятся на две основные категории – традиционные и нетрадиционные. Он основан на свойствах молекулярной поверхности и месте, где они приобретают свою окончательную эффекторную цитотоксическую программу. [24]
Обычные ИЭЛ несут классический рецептор TCR, состоящий из субъединиц α и β вместе с корецепторами CD4 или CD8. Они составляют относительное меньшинство от общего количества кишечных IEL по сравнению с нетрадиционными IEL. Они происходят из наивных Т-клеток, которые сталкиваются с антигенами на периферии (обычно с антигенами, представленными ДК в пейеровых бляшках). После этой активации обычные IEL экспрессируют молекулы, тропные к кишечнику, что позволяет им проникать в ткани кишечника после прохождения через поток лимфы и последующего кровотока. Таким образом, обычные интраэпителиальные клетки представляют собой тканерезидентные эффекторные Т-клетки памяти, способные быстро реагировать цитолитической активностью и высвобождать цитокины, такие как INFγ и TNF. [24]
Нетрадиционные IEL представляют большинство клеток IEL в эпителиальном слое кишечника и приобретают свою эффекторную программу после выхода из тимуса в виде наивных клеток и встречи с антигенами в GALT. После такой стимуляции нетрадиционные ИЭЛ (в основном γδ Т-клетки ) остаются в эпителии кишечника. [24] γδ Т-клетки экспрессируют рецептор TCR, состоящий из субъединиц γ и δ, и не распознают антигенные пептиды, представленные в MHC-связанной форме. Процесс их активации до сих пор во многом неизвестен. Основным свойством γδ Т-клеток является формирование популяций долгоживущей памяти в барьерных тканях, таких как кишечный эпителий или кожа. Они осуществляют иммунную память в конкретной ткани даже после элиминации возбудителя или стихания воспаления. [25]
Врожденные лимфоидные клетки (ILC)
[ редактировать ]Врожденные лимфоидные клетки (ILC) представляют собой последнее открытое семейство врожденных иммунных клеток, и термин «врожденные» означает, что им не требуется перестройка генов антигенных рецепторов. Благодаря разработке нового метода, такого как секвенирование одноклеточной РНК, описаны подтипы врожденных лимфоидных клеток. На основании профиля транскрипции, установленного основными факторами транскрипции, ILC делятся на пять отдельных подмножеств: NK-клетки, ILC1, ILC2, ILC3 и клетки LTi. ILCs преобладают на поверхности слизистых оболочек, играя ключевую роль в иммунитете и гомеостазе слизистой оболочки из-за их способности быстро секреции иммунорегуляторных цитокинов и, таким образом, связываться с другими иммунными клетками. [27]
Врожденный иммунитет
[ редактировать ]Помимо адаптивного специфического иммунитета, важную роль в ГАЛТ играет врожденный иммунитет, поскольку он обеспечивает более быстрый ответ. Распознавание несобственной микробной сигнатуры происходит с помощью рецепторов распознавания образов (PRR), которые можно обнаружить на дендритных клетках, макрофагах, моноцитах, нейтрофилах и эпителиальных клетках. PRR связываются с консервативным микробным паттерном, таким как компоненты клеточных стенок ( ЛПС , тейхоевая кислота , флагеллин , пептидогликан ) или вирусные или бактериальные нуклеиновые кислоты. PRR локализуются внеклеточно в виде мембраносвязанных рецепторов (Toll-подобные рецепторы) или внутриклеточно (NOD-подобные и RIG-подобные рецепторы). [22] Разнообразная палитра рецепторов распознавания образов активируется различными сигналами, называемыми PAMP (молекулярные паттерны, связанные с патогеном), или сигналами, связанными с повреждением тканей, называемыми DAMP (молекулярные паттерны, связанные с повреждением).
Макрофаги
[ редактировать ]Большинство антигенпредставляющих клеток (АПК) в кишечнике происходят из макрофагов, которые имеют очень быстрый оборот. Макрофаги преобладают в собственной пластинке слизистой оболочки и более глубоких слоях подслизистой оболочки, таких как мышечный слой. Макрофаги могут использовать свои трансэпителиальные дендриты (длинные цитоплазматические отростки) и напрямую контактировать с эпителиальным слоем и брать образцы просветных бактерий. [26] В здоровых условиях макрофаги поглощают комменсальные бактерии и окружающие клеточные остатки, секретируют IL-10, стимулируют созревание Treg и способствуют гомеостазу тканей. Из-за низкой экспрессии врожденных ответных рецепторов и костимулирующих поверхностных молекул кишечные макрофаги не инициируют воспаление. Но при инфекции или воспалении профиль макрофагов меняется, и они начинают секретировать большое количество TNF- α и становятся провоспалительными эффекторными клетками. [28]
Дендритные клетки
[ редактировать ]DC составляют менее 10% APC собственной пластинки и обычно не располагаются в нижних слоях. Природное производство ретиноевой кислоты и TGF-β (типичное для DC, связанных с кишечником), индуцирует экспрессию молекул, направляющихся в кишечник, и способствует переключению IgA во время созревания B-клеток в фолликулах. ДК также направляют Treg и обычные IEL на получение окончательного фенотипа зрелых эффекторных клеток в кишечнике. [26]
Другие животные
[ редактировать ]Адаптивный иммунитет , опосредованный антителами и Т-клетками , встречается только у позвоночных . Хотя все они имеют лимфоидную ткань, связанную с кишечником, а подавляющее большинство имеют разновидность селезенки и тимуса , не у всех позвоночных есть костный мозг , лимфатические узлы или зародышевые центры , а это означает, что не все позвоночные могут генерировать лимфоциты в костном мозге. [3] Такое различное распределение адаптивных органов у разных групп позвоночных позволяет предположить, что GALT является самой первой частью адаптивной иммунной системы у позвоночных. Было высказано предположение, что из-за этого существующего GALT и из-за давления, оказываемого комменсальными бактериями в кишечнике, которые эволюционировали одновременно с позвоночными, более поздние специализации в виде тимуса, селезенки или лимфатических узлов появились как часть адаптивной иммунной системы . [2]
Дополнительные изображения
[ редактировать ]- Лимфатика толстой кишки.
- Раздел пищевода человека.
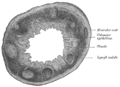
- Поперечный срез червеобразного отростка человека. Х 20.
- Разрез слизистой оболочки прямой кишки человека. Х 60.
Ссылки
[ редактировать ]- ^ Джейнвей-младший, Калифорния, Трэверс П., Уолпорт М., Шломчик М.Дж. (2001). «Имунная система слизистой оболочки» . Иммунобиология: Иммунная система в здоровье и болезнях (5-е изд.). Нью-Йорк: Garland Science. ISBN 978-0-8153-3642-6 .
- ^ Jump up to: а б с д Мерфи К., Джейнвей-младший, Калифорния (2011). Иммунобиология Джейнвей (Иммунобиология: Иммунная система (Джейнвей)) . Гирляндная наука. ISBN 978-0-8153-4243-4 . OCLC 733935898 .
- ^ Jump up to: а б Голдсби Р.А., Осборн Б.А., Киндт Т.Дж., Куби Дж. (2007). Куби Иммунология . У. Х. Фриман. ISBN 978-0-7167-6764-0 . ОСЛК 68207318 .
- ^ Виги Дж., Маркуччи Ф., Сенси Л., Ди Кара Дж., Фрати Ф. (сентябрь 2008 г.). «Аллергия и желудочно-кишечная система» . Клиническая и экспериментальная иммунология . 153 (Приложение 1): 3–6. дои : 10.1111/j.1365-2249.2008.03713.x . ПМК 2515351 . ПМИД 18721321 .
- ^ Хеландер Х.Ф., Фяндрикс Л. (июнь 2014 г.). «Площадь поверхности пищеварительного тракта - еще раз». Скандинавский журнал гастроэнтерологии . 49 (6): 681–9. дои : 10.3109/00365521.2014.898326 . ПМИД 24694282 . S2CID 11094705 .
- ^ Сломянка Л. «Голубая гистология - Желудочно-кишечный тракт» . Школа анатомии и биологии человека . Университет Западной Австралии . Проверено 30 января 2017 г.
- ^ Старый Дж. М., Дин Э. М. (2001). «Гистология и иммуногистохимия лимфоидной ткани, связанной с кишечником восточного серого кенгуру Macropus giganteus » . Журнал анатомии . 199 (6): 657–662. дои : 10.1046/j.1469-7580.2001.19960657.x . ПМЦ 1468383 . ПМИД 11787819 .
- ^ Старый Дж. М., Дин Э. М. (2002). «Иммуногистохимия лимфоидной ткани таммарового валлаби Macropus eugenii » . Журнал анатомии . 203 (3): 257–266. дои : 10.1046/j.1469-7580.2002.00090.x . ПМК 1570915 . ПМИД 12363276 .
- ^ Олд Дж. М., Селвуд Л., Дин Э. М. (2003). «Гистологическое исследование лимфоидной и иммуногемопоэтической тканей взрослого полосатого даннарта ( Sminthopsis macroura )». Клетки Ткани Органы . 173 (2): 115–121. дои : 10.1159/000068946 . ПМИД 12649589 . S2CID 46354564 .
- ^ Олд Дж. М., Карман Р. Л., Фрай Дж., Дин Э. М. (2001). «Иммунные ткани находящегося под угрозой исчезновения краснохвостого фаскогала ( Phascogale Calura )» . Журнал анатомии . 208 (3): 381–387. дои : 10.1111/j.1469-7580.2006.00530.x . ПМК 2100243 . ПМИД 16533320 .
- ^ Старый Дж. М., Дин Э. М. (2002). «Лимфоидные ткани, связанные с кишечником северного бурого бандикута ( Isooodon macrourus )». Развивающая и сравнительная иммунология . 26 (9): 841–848. дои : 10.1016/S0145-305X(02)00031-9 . ПМИД 12377223 .
- ^ Бортвик CR, Молодой LJ, Старый JM (2013). «Развитие иммунных тканей и у сумчатой молодняка». Журнал морфологии . 275 (4): 822–839. дои : 10.1111/vcp.12094 . ПМИД 24152200 .
- ^ Старый Дж.М., Дин Э.М. (2003). «Обнаружение зрелых Т- и В-клеток при развитии лимфоидных тканей таммарного валлаби ( Macropus eugenii )» . Журнал анатомии . 203 (1): 123–131. дои : 10.1046/j.1469-7580.2003.00207.x . ПМЦ 1571143 . ПМИД 12892411 .
- ^ Олд Дж. М., Селвуд Л., Дин Э. М. (2004). «Развитие лимфоидной ткани полосатого даннарта ( Sminthopsis macroura )» . Клетки Ткани Органы . 175 (4): 192–201. дои : 10.1111/j.0021-8782.2004.00310.x . ПМК 1571326 . ПМИД 15255959 .
- ^ Олд Дж. М., Селвуд Л., Дин Э. М. (2004). «Появление и распределение зрелых Т- и В-клеток в развивающихся иммунных тканях полосатого даннарта ( Sminthopsis macroura )» . Журнал анатомии . 205 (1): 25–33. дои : 10.1111/j.0021-8782.2004.00310.x . ПМК 1571326 . ПМИД 15255959 .
- ^ Бортвик CR, Old JM (2016). «Гистологическое развитие иммунных тканей сумчатого краснохвостого фаскогала ( Phascogale Calura )» . Анатомическая запись . 299 (2): 207–219. дои : 10.1002/ar.23297 . ПМИД 26599205 . S2CID 26070813 .
- ^ Иммунология . Мале, Дэвид К., 1954- (8-е изд.). [США]: Эльзевир/Сондерс. 2013. ISBN 978-0-7020-5028-2 . OCLC 814034128 .
{{cite book}}: CS1 maint: другие ( ссылка ) - ^ Jump up to: а б с Ван Л, Чжу Л, Цинь С (октябрь 2019 г.). «Модуляция кишечной микробиоты на адаптивный иммунитет слизистой оболочки кишечника» . Журнал иммунологических исследований . 2019 : 4735040. doi : 10.1155/2019/4735040 . ПМК 6794961 . ПМИД 31687412 .
- ^ Jump up to: а б Чжан Х, Луо XM (март 2015 г.). «Контроль комменсальной микробиоты адаптивной иммунной системой» . Кишечные микробы . 6 (2): 156–60. дои : 10.1080/19490976.2015.1031946 . ПМЦ 4615846 . ПМИД 25901893 .
- ^ Jump up to: а б Стивенс WZ, Round JL (сентябрь 2014 г.). «IgA нацелен на нарушителей спокойствия» . Клетка-хозяин и микроб . 16 (3): 265–7. дои : 10.1016/j.chom.2014.08.012 . ПМИД 25211066 .
- ^ Маккой К.Д., Келлер Ю. (август 2015 г.). «Новые разработки, дающие механистическое понимание влияния микробиоты на аллергические заболевания» . Клиническая иммунология . 159 (2): 170–6. дои : 10.1016/j.clim.2015.05.007 . ПМЦ 4553911 . ПМИД 25988860 .
- ^ Jump up to: а б Палм СЗ, де Зете М.Р., Флавелл Р.А. (август 2015 г.). «Взаимодействие иммунитета и микробиоты в здоровье и болезни» . Клиническая иммунология . 159 (2): 122–127. дои : 10.1016/j.clim.2015.05.014 . ПМЦ 4943041 . ПМИД 26141651 .
- ^ Тласкалова-Хогенова Х., Степанкова Р., Козакова Х., Худкович Т., Ваннуччи Л., Тучкова Л. и др. (март 2011 г.). «Роль кишечной микробиоты (комменсальных бактерий) и слизистого барьера в патогенезе воспалительных и аутоиммунных заболеваний и рака: вклад бесмикробных и гнотобиотических животных моделей заболеваний человека» . Клеточная и молекулярная иммунология . 8 (2): 110–20. дои : 10.1038/cmi.2010.67 . ПМК 4003137 . ПМИД 21278760 .
- ^ Jump up to: а б с д и Макдональд Б.Д., Джабри Б., Бенделак А. (август 2018 г.). «Разнообразные пути развития кишечных интраэпителиальных лимфоцитов» . Обзоры природы. Иммунология . 18 (8): 514–525. дои : 10.1038/s41577-018-0013-7 . ПМК 6063796 . ПМИД 29717233 .
- ^ Jump up to: а б Хайралла С., Чу Т.Х., Шеридан Б.С. (ноябрь 2018 г.). «Тканевая адаптация памяти и тканерезидентных гамма-дельта-Т-клеток» . Границы в иммунологии . 9 : 2636. дои : 10.3389/fimmu.2018.02636 . ПМК 6277633 . ПМИД 30538697 .
- ^ Jump up to: а б с Фариа А.М., Рейс Б.С., Муцида Д. (май 2017 г.). «Адаптация тканей: последствия для кишечного иммунитета и толерантности» . Журнал экспериментальной медицины . 214 (5): 1211–1226. дои : 10.1084/jem.20162014 . ПМЦ 5413340 . ПМИД 28432200 .
- ^ Цзяо Ю, Ву Л, Хантингтон Н.Д., Чжан Икс (февраль 2020 г.). «Перекресток между кишечной микробиотой и врожденным иммунитетом и его влияние на аутоиммунные заболевания» . Границы в иммунологии . 11 : 282. дои : 10.3389/fimmu.2020.00282 . ПМК 7047319 . ПМИД 32153586 .
- ^ Ван С., Е Ц., Цзэн Икс, Цяо С. (18 марта 2019 г.). «Функции макрофагов в поддержании гомеостаза кишечника» . Журнал иммунологических исследований . 2019 : 1512969. дои : 10.1155/2019/1512969 . ПМК 6442305 . ПМИД 31011585 .
Внешние ссылки
[ редактировать ]- Гистологическое изображение: 12502loa - Система обучения гистологии в Бостонском университете - «Пищеварительная система: пищеварительный канал: толстая кишка , taenia coli »
- Гистологическое изображение: 11102loa - Система обучения гистологии в Бостонском университете - «Пищеварительная система: пищеварительный канал: соединение пищевода и желудка»