Дефенсин
| Дефенсин | |
|---|---|
 | |
| Идентификаторы | |
| Символ | Дефенсин |
| Пфам Клан | CL0075 |
| Суперсемейство OPM | 54 |
| белок OPM | 6cs9 |
Дефенсины — это небольшие цистеином богатые катионные белки, , которые присутствуют в клеточной жизни, включая позвоночных. [1] и беспозвоночные [2] животные, растения , [3] [4] и грибки . [5] Они представляют собой пептиды защиты хозяина , члены которых проявляют либо прямую антимикробную активность , либо иммунную сигнальную активность, либо и то, и другое. Они по-разному активны против бактерий , грибов и многих вирусов с оболочкой и без оболочки . Обычно они состоят из 18–45 аминокислот с тремя или четырьмя высококонсервативными дисульфидными связями .
У животных они продуцируются клетками врожденной иммунной системы и эпителиальными клетками , тогда как у растений и грибов они продуцируются самыми разными тканями. Организм обычно вырабатывает множество различных дефенсинов, некоторые из которых хранятся внутри клеток (например, в нейтрофильных гранулоцитах для уничтожения фагоцитированных бактерий), а другие секретируются во внеклеточную среду. Механизм действия тех, которые непосредственно убивают микробы, варьируется от разрушения мембраны микробных клеток до нарушения метаболизма.
Разновидности
[ редактировать ]Название «дефенсин» было придумано в середине 1980-х годов, хотя белки называли, среди прочего, «катионными антимикробными белками», «нейтрофильными пептидами», «гамма-тионинами». [6]
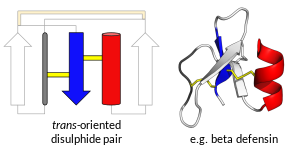
Белки, называемые «дефенсинами», не все эволюционно связаны друг с другом. [7] Вместо этого они делятся на два обширных суперсемейства , каждое из которых содержит несколько семейств . [7] [8] Одно суперсемейство, транс -дефенсины, содержит дефенсины, обнаруженные у человека и других позвоночных животных. [9] [10] а также некоторые беспозвоночные. [11] [12] Другое суперсемейство, цис -дефенсины, содержит дефенсины, обнаруженные у беспозвоночных, растений и грибов. [13] [14] [15] Суперсемейства и семейства определяются общей третичной структурой, и каждое семейство обычно имеет консервативный характер дисульфидных связей. [9] [16] Все дефенсины образуют небольшие и компактные складчатые структуры, обычно с высоким положительным зарядом, которые очень стабильны благодаря множественным дисульфидным связям. Во всех семьях основные гены, ответственные за выработку дефенсина, высоко полиморфны . [ нужна ссылка ]
Транс-дефенсины
[ редактировать ]Дефензины позвоночных – это в первую очередь α-дефензины и β-дефензины . Некоторые приматы также имеют гораздо меньшие по размеру θ-дефензины . В общем, как α-, так и β-дефензины кодируются двухэкзонными генами , где первый экзон кодирует гидрофобную лидерную последовательность (удаляемую после трансляции ) и богатую цистеином последовательность (зрелый пептид). Было высказано предположение, что дисульфидные связи, образуемые цистеинами, необходимы для активности, связанной с врожденным иммунитетом у млекопитающих, но не обязательно необходимы для антимикробной активности. [17] [18] Тета-дефензины образуют единую структуру бета-шпильки и представляют собой отдельную группу. У человека экспрессируются только альфа- и бета-дефенсины. [19]
Хотя наиболее хорошо изучены дефензины позвоночных, существует семейство транс-дефенсинов, называемое Большие дефенсины обнаружены у моллюсков , членистоногих и ланцетников . [7] [8]
Цис-дефензины
[ редактировать ]Дефензины членистоногих являются наиболее изученными дефензинами беспозвоночных (особенно насекомых). [23] Другие беспозвоночные, которые, как известно, производят дефенсины из этого суперсемейства белков, включают моллюсков , кольчатых червей и книдарий . [24]
Дефензины растений были открыты в 1990 году и впоследствии были обнаружены в большинстве растительных тканей, обладающих антимикробной активностью, причем примеры их применения были как противогрибковыми, так и антибактериальными. [25] Они были обнаружены во всех основных группах сосудистых растений , но не у папоротников, мхов и водорослей. [25]
Грибковые дефензины были впервые идентифицированы в 2005 году. [26] Изученные образцы в основном обладают антибактериальной активностью и были обнаружены в обоих основных подразделениях грибов ( Ascomycota и Basidiomycota ), а также в более базальных группах Zygomycota и Glomeromycota . [27]
Бактериальные дефензины также были идентифицированы, но они наименее изучены. Они включают варианты только с четырьмя цистеинами, тогда как дефенсины из дефенсинов эукариот почти все имеют шесть или восемь. [28]
Родственные дефенсинподобные белки
[ редактировать ]Помимо дефенсинов, участвующих в защите хозяина, существует ряд родственных дефенсин-подобных пептидов (DLP), которые в ходе эволюции приобрели другие виды активности.
Токсины
[ редактировать ]По-видимому, в ходе эволюции произошло множество рекрутингов дефензинов в качестве белков-токсинов, используемых в ядах животных; [29] они действуют по совершенно иному механизму, чем их антимикробные родственники: от прямого связывания с ионными каналами до нарушения нервных сигналов . Примеры включают токсин кротамина в змеином яде . [30] много токсинов скорпионов , [31] некоторые токсины морских анемонов , [10] и один из токсинов яда утконоса . [29] Действительно, дефенсин насекомых был экспериментально преобразован в токсин путем удаления небольшой петли, которая в противном случае стерически препятствовала взаимодействию с ионными каналами. [32]
Сигнализация
[ редактировать ]У позвоночных некоторые α- и β-дефензины участвуют в передаче сигналов между врожденной и адаптивной иммунной системами. [33] [34] У растений специализированное семейство DLP участвует в передаче сигналов, чтобы определить, ли самоопыление произошло , и вызвать самонесовместимость для предотвращения инбридинга. [35]
Ингибиторы ферментов
[ редактировать ]Некоторые антимикробные дефензины также обладают ингибирующей активностью в отношении ферментов, а некоторые DLP действуют в первую очередь как ингибиторы ферментов, действуя как антифиданты (отговаривая животных от их употребления в пищу). [36] [37] [38]
Функция
[ редактировать ]У неполовозрелых сумчатых , поскольку их иммунная система на момент рождения недостаточно развита, дефенсины играют важную роль в защите от патогенов . [ нужна ссылка ] Они производятся в молоке матери, а также молодого сумчатого животного.
В грудном молоке человека дефенсины играют центральную роль в иммунитете новорожденного. [39]
Геном человека содержит гены тета-дефенсина, но у них есть преждевременный стоп-кодон , препятствующий их экспрессии. Искусственный человеческий тета-дефенсин, [40] ретроциклин был создан путем «исправления» псевдогена , и было показано, что он эффективен против ВИЧ. [41] и другие вирусы, включая вирус простого герпеса и гриппа А. Они действуют в первую очередь, предотвращая проникновение этих вирусов в клетки-мишени.
Также интересно влияние альфа-дефензинов на экзотоксин, вырабатываемый сибирской язвой ( Bacillus anthracis ). Чун Ким и др. показали, как сибирская язва, которая вырабатывает белок металлопротеазы летального фактора (LF) для воздействия на MAPKK , уязвима для человеческого нейтрофильного белка-1 (HNP-1). Эта группа показала, что HNP-1 ведет себя как обратимый неконкурентный ингибитор LF. [42]
Обычно считается, что они способствуют здоровью слизистых оболочек; однако возможно, что эти пептиды можно считать биологическими факторами, активность которых можно активировать с помощью биологически активных соединений, присутствующих в грудном молоке человека. В этом смысле кишечная продукция антимикробных пептидов, таких как hBD2 и hBD4, трилистником из молока может играть важную роль в колонизации новорожденных, тем самым усиливая иммунный ответ новорожденных против патогенов, с которыми они могут вступить в контакт. [39] [43]
Патология
[ редактировать ]Уровень пептидов альфа-дефенсина увеличивается при хронических воспалительных состояниях.
Уровень альфа-дефенсина увеличивается при некоторых видах рака, включая колоректальный рак. [44]
Дисбаланс дефенсинов в коже может способствовать появлению прыщей. [45]
Снижение уровня дефенсинов подвздошной кишки может предрасполагать к болезни Крона . [46] [47]
В одном небольшом исследовании значительное увеличение уровней альфа-дефенсина было обнаружено в Т-клеток лизатах пациентов с шизофренией ; в дискордантных парах близнецов у здоровых близнецов также наблюдалось увеличение, хотя и не такое высокое, как у их больных братьев и сестер. Авторы предположили, что уровни альфа-дефензина могут оказаться полезным маркером риска шизофрении. [48]
Дефенсины обнаруживаются в коже человека при воспалительных состояниях, таких как псориаз. [49] а также во время заживления ран .
Приложения
[ редактировать ]Дефенсины
[ редактировать ]В настоящее время широкое распространение антибиотикорезистентности требует поиска и разработки новых противомикробных препаратов. С этой точки зрения большой интерес представляют дефенсины (как и антимикробные пептиды в целом). Показано, что дефензины обладают выраженной антибактериальной активностью в отношении широкого спектра возбудителей. [50] Кроме того, дефенсины могут повысить эффективность обычных антибиотиков. [50]
Дефенсин-миметики
[ редактировать ]дефенсина Миметики , также называемые миметиками пептидов защиты хозяина (HDP), представляют собой полностью синтетические, непептидные, низкомолекулярные структуры, которые имитируют дефенсины по структуре и активности. [51] Подобные молекулы, такие как брилацидин , разрабатываются в качестве антибиотиков . [52] противовоспалительные средства при оральном мукозите , [53] [54] и противогрибковые средства , особенно при кандидозе . [55] [56] [57]
См. также
[ редактировать ]- Пептиды защиты хозяина , к которым относятся дефенсины.
Ссылки
[ редактировать ]- ^ Хэзлетт Л., Ву М (январь 2011 г.). «Дефензины во врожденном иммунитете». Исследования клеток и тканей . 343 (1): 175–88. дои : 10.1007/s00441-010-1022-4 . ПМИД 20730446 . S2CID 2234617 .
- ^ Тассанакаджон А., Сомбуниват К., Ампарюп П. (февраль 2015 г.). «Разнообразие последовательностей и эволюция антимикробных пептидов у беспозвоночных». Развивающая и сравнительная иммунология . Специфический иммунитет у беспозвоночных. 48 (2): 324–41. дои : 10.1016/j.dci.2014.05.020 . ПМИД 24950415 .
- ^ Томма Б.П., Камму Б.П., Тевиссен К. (декабрь 2002 г.). «Дефенсины растений» Завод 216 (2): 193–202. Бибкод : 2002Завод.216..193Т . дои : 10.1007/ s00425-002-0902-6 ПМИД 12447532 . S2CID 19356421 .
- ^ Сатхофф А.Е., Самац Д.А. (май 2019 г.). «Антибактериальная активность дефенсинов растений» . Молекулярные растительно-микробные взаимодействия . 32 (5): 507–514. doi : 10.1094/mpmi-08-18-0229-cr . ПМИД 30501455 .
- ^ Ву Дж, Гао Б, Чжу С (август 2014 г.). «Семейство грибковых дефенсинов расширилось» . Фармацевтика . 7 (8): 866–80. дои : 10.3390/ph7080866 . ПМК 4165938 . ПМИД 25230677 .
- ^ Лерер Р.И. (сентябрь 2004 г.). «Дефенсины приматов». Обзоры природы. Микробиология . 2 (9): 727–38. дои : 10.1038/nrmicro976 . ПМИД 15372083 . S2CID 8774156 .
- ^ Перейти обратно: а б с Шафи Т.М., Лэй Ф.Т., Хьюлетт, М.Д., Андерсон, М.А. (сентябрь 2016 г.). «Дефенсины состоят из двух независимых, конвергентных белковых суперсемейств» . Молекулярная биология и эволюция . 33 (9): 2345–56. дои : 10.1093/molbev/msw106 . ПМИД 27297472 .
- ^ Перейти обратно: а б Шафи Т.М., Лэй Ф.Т., Фан Т.К., Андерсон М.А., Хьюлетт, доктор медицины (февраль 2017 г.). «Конвергентная эволюция последовательности, структуры и функции дефенсина» . Клеточные и молекулярные науки о жизни . 74 (4): 663–682. дои : 10.1007/s00018-016-2344-5 . ПМЦ 11107677 . ПМИД 27557668 . S2CID 24741736 .
- ^ Перейти обратно: а б Холлокс Э.Дж., Абуджабер Р. (2017). «Эволюция и разнообразие дефенсинов у позвоночных». В Понтаротти П. (ред.). Эволюционная биология: эволюция «Я/Чужое», эволюция видов и сложных признаков, методы и концепции . Международное издательство Спрингер. стр. 27–50. дои : 10.1007/978-3-319-61569-1_2 . ISBN 978-3-319-61569-1 .
- ^ Перейти обратно: а б Митчелл М.Л., Шафи Т., Папенфусс А.Т., Нортон Р.С. (июль 2019 г.). «Эволюция книдарийных трансдефенсинов: последовательность, структура и исследование химического пространства» . Белки . 87 (7): 551–560. дои : 10.1002/прот.25679 . hdl : 11343/285595 . ПМИД 30811678 . S2CID 73469576 .
- ^ Чжу С, Гао Б (2013). «Эволюционное происхождение β-дефенсинов». Развивающая и сравнительная иммунология . 39 (1–2): 79–84. дои : 10.1016/j.dci.2012.02.011 . ПМИД 22369779 .
- ^ Монтеро-Алехо В, Корсо Г, Порро-Суардиас Х, Пардо-Руис З, Перера Е, Родригес-Вьера Л, Санчес-Диас Г, Эрнандес-Родригес ЭВ, Альварес С, Пеньер С, Титгат Х, Пердомо-Моралес Р ( февраль 2017). «Панузин представляет собой новое семейство β-дефенсинподобных пептидов у беспозвоночных». Развивающая и сравнительная иммунология . 67 : 310–321. дои : 10.1016/j.dci.2016.09.002 . ПМИД 27616720 . S2CID 19734223 .
- ^ Диас Р.Д., Франко ОЛ (октябрь 2015 г.). «Цистеин-стабилизированные αβ-дефензины: от общей складки к антибактериальной активности» . Пептиды . Festschrift, посвященный карьере Аббы Дж. Кастин как редактора-основателя, исследователя и преподавателя в области пептидов. 72 : 64–72. doi : 10.1016/j.peptides.2015.04.017 . ПМИД 25929172 . S2CID 17846143 .
- ^ Шафи Т., Андерсон Массачусетс (март 2019 г.). «Количественная карта пространства белковых последовательностей суперсемейства цис-дефенсинов» (PDF) . Биоинформатика . 35 (5): 743–752. doi : 10.1093/биоинформатика/bty697 . ПМИД 30102339 . S2CID 51968286 .
- ^ Чжу С (февраль 2008 г.). «Открытие шести семейств грибковых дефенсин-подобных пептидов дает представление о происхождении и эволюции дефенсинов CSalphabeta». Молекулярная иммунология . 45 (3): 828–38. дои : 10.1016/j.molimm.2007.06.354 . ПМИД 17675235 .
- ^ Ван Ю.П., Лай Р. (февраль 2010 г.). «[Антимикробные пептиды насекомых: структуры, свойства и регуляция генов]» . Дун У Сюэ Янь Цзю = Зоологические исследования . 31 (1): 27–34. дои : 10.3724/sp.j.1141.2010.01027 . hdl : 1807/64439 . ПМИД 20446450 . S2CID 4692675 .
- ^ Варки Дж., Сингх С., Нагарадж Р. (ноябрь 2006 г.). «Антибактериальная активность линейных пептидов, охватывающих карбокси-концевой домен бета-листа дефензинов членистоногих». Пептиды . 27 (11): 2614–23. doi : 10.1016/j.peptides.2006.06.010 . ПМИД 16914230 . S2CID 21104756 .
- ^ Варки Дж., Нагарадж Р. (ноябрь 2005 г.). «Антибактериальная активность аналогов дефенсина нейтрофилов человека HNP-1 без цистеинов» . Антимикробные средства и химиотерапия . 49 (11): 4561–6. doi : 10.1128/AAC.49.11.4561-4566.2005 . ПМК 1280114 . ПМИД 16251296 .
- ^ Допле В., Крукемейер А., Рамамурти А. (сентябрь 2006 г.). «Человеческий бета-дефенсин-3, антибактериальный пептид с множеством биологических функций». Biochimica et Biophysical Acta (BBA) – Биомембраны . 1758 (9): 1499–512. дои : 10.1016/j.bbamem.2006.07.007 . ПМИД 16978580 . S2CID 36461159 .
- ^ Тран Д., Тран П., Робертс К., Осапай Г., Шаал Дж., Уэллетт А., Селстед М.Э. (март 2008 г.). «Микробицидные свойства и цитоцидная селективность тета-дефензинов макаки-резус» . Антимикробные средства и химиотерапия . 52 (3): 944–53. дои : 10.1128/AAC.01090-07 . ПМК 2258523 . ПМИД 18160518 .
- ^ Гарсия А.Е., Селстед М. (март 2008 г.). «θ-дефензины оливкового павиана» . Журнал ФАСЭБ . 22 (1 дополнение): 673.11. дои : 10.1096/fasebj.22.1_supplement.673.11 . S2CID 89807163 .
- ^ Гарсия А.Е., Осапай Г., Тран П.А., Юань Дж., Селстед М.Э. (декабрь 2008 г.). «Выделение, синтез и антимикробная активность встречающихся в природе изоформ тета-дефензина из лейкоцитов павиана» . Инфекция и иммунитет . 76 (12): 5883–91. дои : 10.1128/IAI.01100-08 . ПМЦ 2583559 . ПМИД 18852242 .
- ^ Кобах Дж. (2017). «Связь между структурой и активностью дефенсинов насекомых» . Границы в химии . 5 : 45. Бибкод : 2017FrCh....5...45K . дои : 10.3389/fchem.2017.00045 . ПМК 5506212 . ПМИД 28748179 .
- ^ Греко С., Гердол М., Эдоми П., Паллавичини А. (январь 2020 г.). «Молекулярное разнообразие митилинподобных защитных пептидов у Mytilidae (Mollusca, Bivalvia)» . Антибиотики . 9 (1): 37. doi : 10.3390/antibiotics9010037 . ПМК 7168163 . ПМИД 31963793 .
- ^ Перейти обратно: а б Паризи К., Шафи Т.М., Куимбар П., ван дер Верден Н.Л., Бликли М.Р., Андерсон М.А. (апрель 2019 г.). «Эволюция, функции и механизмы действия дефенсинов растений» . Семинары по клеточной биологии и биологии развития . 88 : 107–118. дои : 10.1016/j.semcdb.2018.02.004 . ПМИД 29432955 . S2CID 3543741 .
- ^ Мигинд П.Х., Фишер Р.Л., Шнорр К.М., Хансен М.Т., Сёнксен К.П., Людвигсен С., Равентос Д., Бусков С., Кристенсен Б., Де Мария Л., Табуро О., Явер Д., Элвиг-Йоргенсен С.Г., Соренсен М.В., Кристенсен Б.Е., Кьерульф С. , Фримодт-Моллер Н., Лерер Р.И., Заслов М., Кристенсен Х.Х. (октябрь 2005 г.). «Плектазин - это пептидный антибиотик с терапевтическим потенциалом из сапрофитного гриба». Природа . 437 (7061): 975–80. Бибкод : 2005Природа.437..975М . дои : 10.1038/nature04051 . ПМИД 16222292 . S2CID 4423851 .
- ^ Ву Дж, Гао Б, Чжу С (август 2014 г.). «Семейство грибковых дефенсинов расширилось» . Фармацевтика . 7 (8): 866–80. дои : 10.3390/ph7080866 . ПМК 4165938 . ПМИД 25230677 .
- ^ Дэш Т.С., Шафи Т., Харви П.Дж., Чжан С., Пеньер С., Деуи-младший, Веттер И., Титгат Дж., Андерсон М.А., Крейк DJ, Дурек Т., Ундхейм Е.А. (февраль 2019 г.). «Семейство токсинов многоножек определяет древний класс дефенсинов CSαβ» . Структура . 27 (2): 315–326.e7. дои : 10.1016/j.str.2018.10.022 . ПМИД 30554841 .
- ^ Перейти обратно: а б Уиттингтон СМ, Папенфусс А.Т., Бансал П., Торрес А.М., Вонг Э.С., Дикин Дж.Э., Грейвс Т., Олсоп А., Шацкамер К., Кремицки С., Понтинг С.П., Темпл-Смит П., Уоррен В.К., Кучел П.В., Белов К. (июнь 2008 г.) . «Дефензины и конвергентная эволюция генов яда утконоса и рептилий» . Геномные исследования . 18 (6): 986–94. дои : 10.1101/гр.7149808 . ПМК 2413166 . ПМИД 18463304 .
- ^ Батиста да Кунья Д., Пупо Сильвестрини А.В., Гомес да Силва АС, Мария де Паула Эстевам Д., Поллеттини Ф.Л., де Оливейра Наварро Х., Алвес А.А., Ремедио Зени Беретта А.Л., Анникино Биззакки Х.М., Перейра Л.К., Мацци М.В. (май 2018 г.). «Механистическое понимание функциональных характеристик нативного кротамина». Токсикон . 146 :1–12. дои : 10.1016/j.токсикон.2018.03.007 . hdl : 11449/170828 . ПМИД 29574214 . S2CID 205440053 .
- ^ Поссани Л.Д., Бесерриль Б., Делепьер М., Титгат Дж. (сентябрь 1999 г.). «Токсины скорпиона, специфичные для Na+-каналов» . Европейский журнал биохимии . 264 (2): 287–300. дои : 10.1046/j.1432-1327.1999.00625.x . ПМИД 10491073 .
- ^ Чжу С., Пеньер С., Гао Б., Уметсу Ю., Оки С., Титгат Дж. (март 2014 г.). «Экспериментальное превращение дефенсина в нейротоксин: значение для возникновения токсической функции» . Молекулярная биология и эволюция . 31 (3): 546–59. дои : 10.1093/molbev/msu038 . ПМИД 24425781 .
- ^ Петров В., Фундербург Н., Вайнберг А., Зиг С. (декабрь 2013 г.). «Человеческий β-дефенсин-3 индуцирует хемокины из моноцитов и макрофагов: снижение активности в клетках ВИЧ-инфицированных людей» . Иммунология . 140 (4): 413–20. дои : 10.1111/imm.12148 . ПМЦ 3839645 . ПМИД 23829433 .
- ^ Семпл Ф, Дорин-младший (2012). «β-Дефенсины: многофункциональные модуляторы инфекции, воспаления и многого другого?» . Журнал врожденного иммунитета . 4 (4): 337–48. дои : 10.1159/000336619 . ПМК 6784047 . ПМИД 22441423 .
- ^ Фобис-Луази И, Иванов Р, Гауд Т (2012). «БЕЛОК, БОГАТЫЙ ЦИСТЕИНОМ S-LOCUS (SCR): небольшой пептид, оказывающий большое влияние на эволюцию цветковых растений». Сигнальные пептиды растений . Сигнализация и связь у растений. Том. 16. Шпрингер Берлин Гейдельберг. стр. 77–92. дои : 10.1007/978-3-642-27603-3_5 . ISBN 978-3-642-27602-6 .
- ^ Уильямс Л.К., Брайер Г.Д. (25 ноября 2015 г.). «Альфа-амилаза поджелудочной железы свиньи в комплексе с гелиантамидом, новым белковым ингибитором». дои : 10.2210/pdb4x0n/pdb .
- ^ Чжао Кью, Че Ю.К., Маркли Дж.Л. (7 января 2003 г.). «Минимизированная ЯМР-структура АТТ, ингибитора трипсина/химотрипсина Arabidopsis». дои : 10.2210/pdb1jxc/pdb .
- ^ Пелегрини П.Б., Лэй Ф.Т., Мурад А.М., Андерсон М.А., Франко О.Л. (ноябрь 2008 г.). «Новые сведения о механизме действия ингибиторов альфа-амилазы из семейства растительных дефенсинов». Белки . 73 (3): 719–29. дои : 10.1002/prot.22086 . ПМИД 18498107 . S2CID 28378146 .
- ^ Перейти обратно: а б Баррера Дж.Дж., Санчес Дж., Гонсалес Х.Э. (ноябрь 2012 г.). «Фактор трилистника 3, выделенный из человеческого грудного молока, подавляет цитокины (IL8 и IL6) и способствует экспрессии бета-дефенсина человека (hBD2 и hBD4) в эпителиальных клетках кишечника HT-29» . Боснийский журнал фундаментальных медицинских наук . 12 (4): 256–64. дои : 10.17305/bjbms.2012.2448 . ПМЦ 4362502 . ПМИД 23198942 .
- ^ ретроциклин в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)
- ^ Мунк С., Вэй Г., Ян О.О., Уоринг А.Дж., Ван В., Хонг Т., Лерер Р.И., Ландау Н.Р., Коул А.М. (октябрь 2003 г.). «Тета-дефенсин, ретроциклин, ингибирует проникновение ВИЧ-1». Исследования СПИДа и ретровирусы человека . 19 (10): 875–81. дои : 10.1089/088922203322493049 . ПМИД 14585219 .
- ^ Ким С., Гаджендран Н., Миттрукер Х.В., Вейвад М., Сонг Й.Х., Гурвиц Р., Вильманс М., Фишер Г., Кауфманн С.Х. (март 2005 г.). «Альфа-дефенсины человека нейтрализуют смертельный токсин сибирской язвы и защищают от его фатальных последствий» . Труды Национальной академии наук Соединенных Штатов Америки . 102 (13): 4830–5. Бибкод : 2005PNAS..102.4830K . дои : 10.1073/pnas.0500508102 . ПМК 555714 . ПМИД 15772169 .
- ^ Баррера Г.Дж., Тортолеро Г.С. (2016). «Фактор трилистника 3 (TFF3) из грудного молока человека активирует рецепторы PAR-2 эпителиальных клеток кишечника HT-29, регулируя цитокины и дефенсины» . Братиславские Лекарские Листы . 117 (6): 332–9. дои : 10.4149/bll_2016_066 . ПМИД 27546365 .
- ^ Альбретсен Дж., Бегебо Р., Гаммельтофт С., Олсен Дж., Винтер Б., Расков Х. (январь 2005 г.). «Повышенная экспрессия человеческих нейтрофильных пептидов 1, 2 и 3 (HNP 1-3) в сыворотке и опухолях рака толстой кишки: исследование биомаркеров» . БМК Рак . 5 :8. дои : 10.1186/1471-2407-5-8 . ПМК 548152 . ПМИД 15656915 .
- ^ Член парламента Филпотта (ноябрь 2003 г.). «Дефенсины и прыщи». Молекулярная иммунология . 40 (7): 457–62. дои : 10.1016/S0161-5890(03)00154-8 . ПМИД 14568392 .
- ^ «Исследователи обнаруживают возможную причину хронических воспалений болезни Крона». Genomics & Genetics Weekly : 72. 11 августа 2006 г.
- ^ Векамп Дж., Зальцман Н.Х., Портер Э., Нудинг С., Вайхенталь М., Пятрас Р.Э., Шен Б., Шеффелер Е., Шваб М., Линцмайер Р., Фезерс Р.В., Чу Х., Лима Х., Феллерманн К., Ганц Т., Штанге Э.Ф., Бевинс К.Л. (декабрь 2005 г.). «Снижение альфа-дефенсинов клеток Панета при болезни Крона подвздошной кишки» . Труды Национальной академии наук Соединенных Штатов Америки . 102 (50): 18129–34. Бибкод : 2005PNAS..10218129W . дои : 10.1073/pnas.0505256102 . ПМЦ 1306791 . ПМИД 16330776 .
- ^ Крэддок Р.М., Хуанг Дж.Т., Джексон Э., Харрис Н., Торри Э.Ф., Герберт М., Бан С. (июль 2008 г.). «Повышение уровня альфа-дефензинов как маркера предрасположенности к шизофрении в крови» . Молекулярная и клеточная протеомика . 7 (7): 1204–13. дои : 10.1074/mcp.M700459-MCP200 . ПМИД 18349140 . S2CID 35381828 .
- ^ Хардер Дж., Бартельс Дж., Кристоферс Э., Шредер Дж.М. (февраль 2001 г.). «Выделение и характеристика человеческого бета-дефензина-3, нового человеческого индуцируемого пептидного антибиотика» . Журнал биологической химии . 276 (8): 5707–13. дои : 10.1074/jbc.M008557200 . ПМИД 11085990 . S2CID 9516726 .
- ^ Перейти обратно: а б Болатчиев А (25.11.2020). «Антибактериальная активность дефенсинов человека в отношении золотистого стафилококка и кишечной палочки» . ПерДж . 8 : е10455. дои : 10.7717/peerj.10455 . ПМЦ 7698690 . ПМИД 33304659 .
- ^ «Пресс-релиз: PolyMedix» (Пресс-релиз). 09.05.2008. Деловой провод
- ^ «PMX-30063 — первый и единственный системный антибиотик, миметик дефенсина, прошедший клинические испытания на людях» . 2008.
- ^ Номер клинического исследования NCT02324335 «Исследование фазы 2 по оценке безопасности и эффективности полоскания для полости рта с брилацидином у пациентов с раком головы и шеи (брилацидин)» на сайте ClinicalTrials.gov.
- ^ «Страница Брилацидин-ОМ» . Целлцеутикс. Архивировано из оригинала 7 февраля 2015 г. Проверено 2 марта 2015 г.
- ^ «Кандидоз» . Целлцеутикс. Архивировано из оригинала 7 февраля 2015 г. Проверено 2 марта 2015 г.
- ^ Даймонд Дж., Скотт Р. «Новое лекарство от инвазивного кандиоза» . Грантоме . Центр химического разнообразия Фокса Чейза.
- ^ Райан Л.К., Фриман К.Б., Массо-Сильва Дж.А., Фальковский К., Алоюни А., Марковиц К., Хайс А.Г., Фатахзаде М., Скотт Р.В., Даймонд Дж. (июль 2014 г.). «Активность мощных и селективных миметиков пептидов защиты хозяина на мышиных моделях кандидоза полости рта» . Антимикробные средства и химиотерапия . 58 (7): 3820–7. дои : 10.1128/AAC.02649-13 . ПМК 4068575 . ПМИД 24752272 .
Внешние ссылки
[ редактировать ]- База данных Defensins, Сингапур. Архивировано 24 апреля 2008 г. на Wayback Machine.
- Врожденный (неспецифический) иммунитет в Университете Западного Кентукки
- UMich Ориентация белков в мембранах семейств/суперсемейства-56 - Дефенсины позвоночных и родственные токсины натриевых каналов морских анемонов
- UMich Ориентация белков в мембранах семейства/суперсемейства-61 - Дефензины насекомых и растений и токсины скорпионов
- Дефенсины в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)