Кротамин
| Кротамин | |||
|---|---|---|---|
 | |||
| Идентификаторы | |||
| Организм | ? | ||
| Символ | Cro2 | ||
| Uniprot | Q9PWF3 | ||
| |||
Кротамин - это токсин присутствующий в ядке южноамериканской , гремучей змеи ( Crotalus durissus tesrificus ). Это белок длиной из 42 остатков, содержащий 11 основных остатков (девять лизинов , два аргинина ) и шесть цистеинов . Он также был выделен из яда североамериканской прерии гремучей змеи, Crotalus viridis viridis . Сначала он был изолирован и очищен бразильским ученым Хосе Морой Гонсалвесом , а затем интенсивно изучал его группу сотрудников в Медицинской школе Рибейрао Прето в Университете Сан -Паулу .
Биологическая функция
[ редактировать ]Кротамин имеет ряд биологических действий: он действует на натриевых каналах клеточной мембраны , немного анальгетическим и является миотоксичным, то есть он проникает в клетки мышц и способствует некрозу . [ 1 ] Кротамин гомологичен с другими миотоксинами яда и похож на α-, β- дефенсины .
Биохимия и механизм
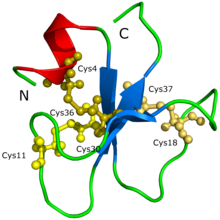
[ редактировать ]Аминокислотная ( последовательность Ykqchkkgggcfpkekiclppssdfgkmdcrwkccckkgsg , Cys4-Cys36, Cys11-Cys30, Cys18-Cys37) и трехмерная молекулярная структура кротамина уже определены.
Структура белка кротамина не может быть изначально определена с помощью кристаллизации белка или рентгеновской дифракции . [ 2 ] Предполагалось, что сложность заключалась в том, что кротамин имеет так много изоформ, что приводит к образованию агрегатов и различным возможным конформациям белка. Структура и форма белка были предложены через трехмерную модель, генерируемую Siqueira et al. (2002) на основе вычислительных расчетов, которые были подтверждены интенсивным моделированием молекулярной динамики и процедурами моделирования гомологии. После этого Nicastro et al. (2003) обнаружили структуру кротамина с помощью ядерной магнитно -резонансной спектроскопии . Кротамин имеет топологию, которую никогда не видели в активных токсинах, которые нацелены на ионные каналы; Белок состоит из короткой N-концевой альфа-спирали , типа образования белка и небольшого антипараллельного тройного бета-листа, еще одного типа образования белка, расположенного в топологии AB1B2B3. Кротамин имеет сходные структурные конформации с семейством β-дефенсина человека , а также идентичное расположение трех дисульфидных мостов . [ 2 ]
Местоположение гена , и хромосомы ответственное за его синтез, было идентифицировано группой во главе с Ганди Радис-Баптиста , работая в Институте Бутантана , в Сан-Паулу, Бразилия. МРНК и имеет около 340 нуклеотидов кодифицирует пре-кротамин, включая сигнальный пептид , зрелый кротамин и последний лизин.
Ген кротамина был первым геном, который был нанесен на карту на хромосоме змеи. [ 2 ] Ген, ответственный за кодирование белка кротамина, помечено как CRT-P1, а его длина последовательности пары оснований составляет около 1,1 кбит-килограмма или 1100 п.н. Сообщалось, что ген кротамина был выделен дважды из двух разных образцов, один из методов, который приводил к размеру гена 1,8 кбитч, а в другом образец размером гена 1,1 кбитч. [ 3 ] Ген ранее был выделен в геноме C. durissus Terrificus , а сам белок принадлежит группе небольших основных полипептидных миотоксинов (SBPM). Содержание ядов Crotalus может варьироваться в зависимости от подвида и географического положения. [ 4 ] Ген CRT-P1, как описано Radis-Bastista et al. 2003, состоит из примерно трех экзонов, разделенных одной короткой фазой 2 (140 п.н.) и одного длинного интрона фазы 1 (900 п.н.). Коды экзона 1 для первых 19 аминокислот сигнального пептида и включает в себя 5'-Untransled Region. Экзон 2 кодирует 39 аминокислот зрелого кротомина и трех сигнальных пептидных аминокислот. Коды экзона 3 для терминального лизина и последних трех аминокислот зрелого токсина. Исследования аминокислотных последовательностей SBPM среди различных видов Crotalus выявили высокую степень сходства от 83% до 98%. [ 3 ]
Аминокислотный код белков в маленьком основном семействе миотоксинов полипептида, который включает в себя кротамин, был секвенирован. Было обнаружено, что они похожи в среднем с дивергенцией 83%. Последовательность аминокислот кротаминовой аминокислоты сравнивалась с последовательностью клонированной ДНК миотоксина А (миотоксин, используемый для моделирования того, как работают SBPMS). Для сравнения, области кодирования экзонов, включая зрелый миотоксин и сигнальный пептид, были 98% и 100% сходными соответственно. Нетрансляционные области в течение 5 'и 3' между образцом и кДНК миотоксина А составляли 60% и 80% соответственно. При сравнении аминокислотных последовательностей других белков не в семействе SBPM, обнаруженных в ядобах змеи, обычно существует большая дивергенция. При рассмотрении белков SBPM они имеют высокое сходство между различными подвидом рода Crotalus и между разными людьми одного и того же подвида. Это указывает, согласно Radis-Batista et al. Исследование 2003 года, что ген кротамина и другие гены SBPM недавно развились.
Ссылки
[ редактировать ]- ^ Oliveira AL, Viegas MF, Da Silva SL, Soares AM, Ramos MJ, Fernandes PA (2022-06-10). «Химия змеиного яда и его лекарственный потенциал» . Природные обзоры. Химия . 6 (7): 451–469. Doi : 10.1038/s41570-022-00393-7 . PMC 9185726 . PMID 35702592 .
- ^ Подпрыгнуть до: а беременный в Oguiura N, Boni-Mitake M, Rádis-Baptista G (сентябрь 2005 г.). «Новый взгляд на кротомина, небольшой основной полипептидный миотоксин из яда гремучей змеи Южной Америки». Токсикона . 46 (4): 363–370. doi : 10.1016/j.toxicon.2005.06.009 . PMID 16115660 . S2CID 40142037 .
- ^ Подпрыгнуть до: а беременный Somejima Y, Aoki Y, Mebs D (1991). «Аминокислотная последовательность миотоксина из яда Восточного Алмаза Гремучей змеи (Crotalus Adamanteus)». Токсикона . 29 (4–5): 461–468. doi : 10.1016/0041-0101 (91) 90020-r . PMID 1862521 .
- ^ Schenberg S (май 1959). «Географическая схема распределения кротамина в тех же подвиде гремучей змеи». Наука . 129 (3359): 1361–1363. doi : 10.1126/science.129.3359.1361 . PMID 13658964 .
Дальнейшее чтение
[ редактировать ]- Goncalves JM, Deutsch HF (февраль 1956 г.). «Ультрацентрифугальные и зоны исследований электрофореза некоторых ядров Crotalidae». Архивы биохимии и биофизики . 60 (2): 402–411. doi : 10.1016/0003-9861 (56) 90444-1 . PMID 13292919 .
- Гильо -младший (ноябрь 1975 г.). «Аналитические исследования гидрохлорида кротомина». Аналитическая биохимия . 69 (1): 207–221. doi : 10.1016/0003-2697 (75) 90581-3 . PMID 2030 .
- Laure CJ (февраль 1975 г.). «Первичная структура кротамина (автора перевода)]». Журнал Hoppe-Seyler по физиологической химии (на немецком языке). 356 (2): 213–215. PMID 1176086 .
- Де Лукка Ф.Л., Имайзуми М.Т., Хаддад А (апрель 1974 г.). «Характеристика рибонуклеиновых кислот из ядных желез Crotalus durissus terrifucus (Ophidia, Reptilia) после ручной экстракции яда. Исследования по активности шаблона и состава базового состава» . Биохимический журнал . 139 (1): 151–156. doi : 10.1042/bj1390151 . PMC 1166261 . PMID 4463939 .
- Ownby Cl, Cameron D, Tu at (октябрь 1976 г.). «Выделение миотоксического компонента из яда гремучей змеи (Crotalus viridis viridis). Электронный микроскопический анализ повреждения мышц» . Американский журнал патологии . 85 (1): 149–166. PMC 2032543 . PMID 970437 .
- Радис-Баптиста Г., Огуиура Н., Хаяси М.А., Камарго М.Е., Грего К.Ф., Оливейра Э.Б., Ямане Т (июль 1999 г.). «Нуклеотидная последовательность предшественников изоформ кротамина из одного южноамериканского гремучей змеи (Crotalus durissus Terrificus)» . Токсикона . 37 (7): 973–984. doi : 10.1016/s0041-0101 (98) 00226-8 . PMID 10484745 .
- Керкис А., Керкис I, Радис-Баптиста Г., Оливейра Э.Б., Вина-Морганте А.М., Перейра Л.В., спасибо Т (сентябрь 2004 г.). «Кротамин-это новый белок, проникающий клетками из яда гремучей змеи Crotalus durissussus Tearificus » FASEB Journal 18 (12): 1407–1 Doi : 10.1096/fj.03-1459fje . PMID 15231729 S2CID 20510076
- Радис-Баптиста Г., Кубо Т., Огуура Н., Премия Сильва А.Р., Хаяси М.А., Оливейра Э.Б., спасибо (июнь 2004 г.). «Идентификация кротазина, связанного с кротапином геном Crotalus durissus Tearificus » Токсикона 43 (7): 751–7 Doi : 10.1016/ j.toxicon.2004.02.0 PMID 15284009 S2CID 16350991 .
- Радис-Баптиста Г., Кубо Т., Огуиура Н., Свартман М., Алмейда Т.М., Батистическая Р.Ф. и др. (Декабрь 2003 г.). «Структура и хромосомная локализация гена для кротамина, токсина из южноамериканской гремучей змеи, Crotalus durissus Terrificus» . Токсикона . 42 (7): 747–752. doi : 10.1016/j.toxicon.2003.10.019 . PMID 14757205 .
- Nicastro G, Franzoni L, De Chiara C, Mancin AC, Giglio Jr, Spisni A (май 2003). «Структура раствора кротамина, канал Na+, влияющий на токсин из Crotalus durissus Terrificus Venom» . Европейский журнал биохимии . 270 (9): 1969–1979. doi : 10.1046/j.1432-1033.2003.03563.x . PMID 12709056 . S2CID 20601072 .
- Mouhat S, Jouirou B, Mosbah A, De Waard M, Sabatier JM (март 2004 г.). «Разнообразие складок в токсинах животных, действующих на ионных каналах» . Биохимический журнал . 378 (Pt 3): 717–726. doi : 10.1042/bj20031860 . PMC 1224033 . PMID 14674883 .
Внешние ссылки
[ редактировать ]- Нуклеотидная последовательность и трансляция для кротазина . База данных Entrez. Национальный центр информации о биотехнологии.