Тетрафторборат ферроцения
 | |
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК Тетрафторборат ферроцения | |
| Идентификаторы | |
3D model ( JSmol ) | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.156.161 |
| Номер ЕС |
|
ПабХим CID |
|
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| С 10 Н 10 БФеФ 4 | |
| Молярная масса | 272.84 g/mol |
| Появление | темно-синий порошок |
| Температура плавления | 178 ° C (352 ° F, 451 К) (разлагается) |
| Растворимость в ацетонитриле | Растворимый [ нужна ссылка ] |
| Опасности [1] | |
| СГС Маркировка : | |
 | |
| Опасность | |
| H314 | |
| П280 , П305+П351+П338 , П310 | |
| Паспорт безопасности (SDS) | Внешний паспорт безопасности материалов |
| Родственные соединения | |
Родственные соединения | Ферроцен |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
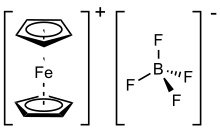
Тетрафторборат ферроцения представляет собой металлоорганическое соединение формулы [Fe(C 5 H 5 ) 2 ]BF 4 . Эта соль состоит из катиона [Fe(C 5 H 5 ) 2 ] + и тетрафторборат- анион ( BF −
4 ). Родственный гексафторфосфат также является популярным реагентом с аналогичными свойствами. Катион ферроцения часто обозначают сокращенно Fc. + или Cp 2 Fe + . Соль темно-синего цвета и парамагнитна .Соли ферроцения иногда используются в качестве одноэлектронных окислителей, а продукт восстановления — ферроцен — инертен и легко отделяется от ионных продуктов. Пара ферроцен-ферроцений часто используется в качестве эталона в электрохимии. Стандартный потенциал ферроцен-ферроцения зависит от конкретных электрохимических условий. [2]
Подготовка
[ редактировать ]Коммерчески доступное это соединение можно получить путем окисления ферроцена, как правило, солями трехвалентного железа с последующим добавлением фторборной кислоты . [2] Также хорошо работают различные другие окислители, такие как нитрозилтетрафторборат . [3] Известно множество аналогичных солей ферроцения. [4]
Структура
[ редактировать ]По данным рентгеновской кристаллографии , структуры металлоценового компонента FcBF 4 и исходного ферроцена очень схожи. Расстояния Fe-C в катионе составляют 209,5 пм , что примерно на 2% длиннее, чем расстояния Fe-C в ферроцене. [5]
Ссылки
[ редактировать ]- ^ «Ферроцения тетрафторборат 482358» . Сигма-Олдрич .
- ^ Jump up to: а б Коннелли, Нью-Йорк; Гейгер, МЫ (1996). «Химические окислительно-восстановительные агенты для металлоорганической химии». Химические обзоры . 96 (2): 877–910. дои : 10.1021/cr940053x . ПМИД 11848774 .
- ^ Нильсон, Роджер М.; МакМанис, Джордж Э.; Саффорд, Лэнс К.; Уивер, Майкл Дж. (1989). «Влияние растворителя и электролита на кинетику самообмена ферроцений-ферроцен. Переоценка». Дж. Физ. хим. 93 (5): 2152. doi : 10.1021/j100342a086 .
- ^ Ле Бра, Ж.; Цзяо, Х.; Мейер, МЫ; Хэмпель, Ф.; Гладыш, Ю.А. (2000). «Синтез, кристаллическая структура и реакции метилового комплекса рения с 17 валентными электронами [( η 5 -C 5 Me 5 )Re(NO)(P(4-C 6 H 4 CH 3 ) 3 )(CH 3 )] + Б(3,5-С
66Ч
3 (КФ
3 )
2 ) −
4 : Экспериментальные и расчетные сравнения связей с 18-электронными метиловыми и метилиденовыми комплексами». J. Organomet. Chem. 616 : 54–66. doi : 10.1016/S0022-328X(00)00531-3 . - ^ Шольц, Стефан; Шайбиц, Матиас; Шедель, Фрауке; Болте, Майкл; Вагнер, Матиас; Лернер, Ханс Вольфрам (2007). «Разница в реакционной способности триэль-галогенидов EX 3 по отношению к ферроцену». Неорганика Химика Акта . 360 (10): 3323–3329. дои : 10.1016/j.ica.2007.03.049 .