Бромид железа(II)
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК Бромид железа(II) | |
| Другие имена Бромид железа | |
| Идентификаторы | |
| |
3D model ( JSmol ) | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.029.244 |
ПабХим CID | |
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| февраля 2 | |
| Молярная масса | 215.65 g mol −1 |
| Появление | желто-коричневое твердое вещество |
| Плотность | 4,63 г см −3 , твердый |
| Температура плавления | 684 ° C (1263 ° F, 957 К) (безводный) 27 ° C (гексагидрат) |
| Точка кипения | 934 ° C (1713 ° F; 1207 К) |
| 117 г/100 мл | |
| Растворимость в других растворителях | ТГФ , метанол , этанол |
| +13,600·10 −6 см 3 /моль | |
| Структура | |
| Ромбоэдрический , hP3 , SpaceGroup=P-3m1, №164 | |
| октаэдрический | |
| Опасности | |
| Безопасность и гигиена труда (OHS/OSH): | |
Основные опасности | никто |
| Родственные соединения | |
Другие анионы | Фторид железа(II) Хлорид железа(II) Йодид железа(II) |
Другие катионы | Бромид марганца(II) Бромид кобальта(II) |
Родственные соединения | Бромид ванадия(II) Бромид железа(III) |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |

Бромид железа(II) относится к неорганическим соединениям с химической формулой FeBr 2 (H 2 O) x . Безводное соединение (х = 0) представляет собой парамагнитное твердое вещество желтого или коричневатого цвета. цвета . Также известен тетрагидрат, представляющий собой твердые вещества бледного Они являются распространенными предшественниками других соединений железа.
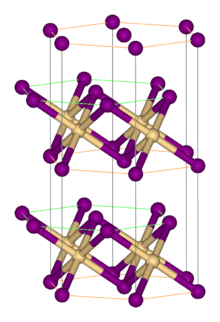
Структура
[ редактировать ]Как и большинство галогенидов металлов, FeBr 2 имеет полимерную структуру, состоящую из изолированных металлических центров, сшитых галогенидами. Он кристаллизуется со структурой CdI 2 , характеризующейся плотноупакованными слоями бромид-ионов, между которыми расположены ионы Fe(II) в октаэдрических пустотах. [1] Упаковка галогенидов немного отличается от упаковки FeCl 2 , в которой используется мотив CdCl 2 . Тетрагидраты FeX 2 (H 2 O) 4 (X = Cl, Br) имеют схожее строение с октаэдрическими металлоцентрами и взаимно трансгалогенидами. [2]
Синтез и реакции
[ редактировать ]FeBr 2 синтезируют с использованием метанольного раствора концентрированной бромистоводородной кислоты и порошка железа. Он добавляет метанольный сольват [Fe(MeOH) 6 ]Br 2 вместе с газообразным водородом. Нагревание метанольного комплекса в вакууме дает чистый FeBr 2 . [3]
FeBr 2 реагирует с двумя эквивалентами бромида тетраэтиламмония с образованием [(C 2 H 5 ) 4 N] 2 FeBr 4 . [4] FeBr 2 реагирует с бромидом и бромом с образованием интенсивно окрашенных частиц смешанной валентности [FeBr 3 Br 9 ] − . [5]
Магнетизм
[ редактировать ]FeBr 2 обладает сильным метамагнетизмом при 4,2 К и уже давно изучается как прототип метамагнитного соединения. [6] [7]
Ссылки
[ редактировать ]- ^ Хаберехт, Дж.; Боррманн, Й.; Книп, Р. (2001). «Уточнение кристаллической структуры дибромида железа FeBr2» . Журнал кристаллографии - Новые кристаллические структуры . 216 (1-4). дои : 10.1524/ncrs.2001.216.14.544 .
- ^ Вайзуми, Кендзи; Масуда, Хидеки; Отаки, Хитоши (1992). «Рентгеноструктурные исследования FeBr 2 ·4H 2 O, CoBr 2 · 4H 2 O, NiCl 2 · 4H 2 O и CuBr 2 ·4H 2 O. Цис/транс-селективность в тетрагидрате дигалогенида переходного металла (II)». Неорганика Химика Акта . 192 (2): 173–181. дои : 10.1016/S0020-1693(00)80756-2 .
- ^ Винтер, Г. (1973). «Галогениды железа (II)». Неорганические синтезы . Том. 14. С. 99–104. дои : 10.1002/9780470132456.ch20 . ISBN 9780470132456 .
- ^ Н. С. Гилл, Ф. Б. Неорганический синтез Тейлора, 1967, том 9, страницы 136-142. два : 10.1002/9780470132401.ch37
- ^ Холлеман, А.Ф.; Виберг, Э. «Неорганическая химия» Academic Press: Сан-Диего, 2001. ISBN 0-12-352651-5
- ^ Уилкинсон, МК; Кейбл, JW; Воллан, Э.О.; Келер, WC (15 января 1959 г.). "Нейтронографические исследования магнитного упорядочения в FeBr 2 , CoBr 2 , FeCl 2 и CoCl 2 ". Физический обзор . 113 (2): 497–507. Бибкод : 1959PhRv..113..497W . дои : 10.1103/PhysRev.113.497 .
- ^ Джейкобс, И.С.; Лоуренс, ЧП (10 декабря 1967 г.). «Метамагнитные фазовые переходы и гистерезис в FeCl 2 ». Физический обзор . 164 (2): 866–878. Бибкод : 1967PhRv..164..866J . дои : 10.1103/PhysRev.164.866 .