CIS - Транс -изомеризм


CIS - Транс -изомерия , также известная как геометрическая изомерия , описывает определенные расположения атомов в молекулах. Префиксы « цис » и « транс » от латыни: «эта сторона» и «другая сторона» соответственно. [ 1 ] В контексте химии CIS указывает на то, что функциональные группы (заместители) находятся на одной и той же стороне некоторой плоскости, в то время как транс передает, что они находятся на противоположных (поперечных) сторонах. CIS - Транс- изомеры-это стереоизомеры , то есть пары молекул, которые имеют одинаковую формулу, но функциональные группы, в разных ориентациях в трехмерном пространстве. CIS и транс -изомеры встречаются как в органических молекулах, так и в неорганических координационных комплексах. CIS и TRANS Дескрипторы не используются для случаев конформационной изомерии , где две геометрические формы легко взаимосвязаны, такие как большинство конструкций с одновязой с открытой цепью; термины « syn » и « anti Вместо этого используются ».
Согласно IUPAC , «геометрический изомерия» является устаревшим синонимом « цис -транс изомерии ». [ 2 ]
Цис -транс или геометрический изомерия классифицируется как один тип конфигурационного изомеризма . [ 3 ]
Органическая химия
[ редактировать ]Очень часто CIS - транс -стереоизомеры содержат двойные связи или кольцевые структуры. В обоих случаях вращение связей ограничено или предотвращено. [ 4 ] Когда заместительные группы ориентированы в том же направлении, диастереомер называется CIS , тогда как заместители ориентированы в противоположных направлениях, диастереомер называется транс . Пример небольшого углеводорода, демонстрирующего CIS - транс- изомеризм, но--2-ene . 1,2-дихлорциклогексан является еще одним примером.
  |
 
|
| Транс -1,2 -дихлорциклогексан | Ци -1,2 -дихлорциклогексан |
Сравнение физических свойств
[ редактировать ]CIS и Trans Isomers обладают различными физическими свойствами. Их различные формы влияют на дипольные моменты , кипячение и особенно точки плавления.
 |

|
| Цис -2 -пентен | транс -2 -пен |
 |

|
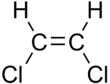
| Ци -1,2 -дихлорэтена | Транс -1,2 -дихлорэтена |
Эти различия могут быть очень малыми, как в случае точки кипения алкенов с прямой цепью, таких как пент-2-ene , которая составляет 37 ° C в изомере цис и 36 ° C в транс- изомере. [ 5 ] Различия между цис и транс -изомерами могут быть больше, если присутствуют полярные связи, как и в 1,2-дихлорэтенах . Изомер CIS в этом случае имеет температуру кипения 60,3 ° C, в то время как транс -изомер имеет температуру кипения 47,5 ° C. [ 6 ] В Изомере CIS два дипольных момента полярной связи C -CL объединяются, чтобы получить общий молекулярный диполь, так что существуют межмолекулярные диполь -дипольные силы (или силы Кисом), которые добавляют к лондонскому дисперсионному силу и поднимают точку кипения. С другой стороны, в транс- изомере это не происходит потому, что два момента C-CL отменяются, а молекула имеет чистый нулевой дипольный момент (однако, у нее есть ненулевой квадрупольный момент ).
 |

|
| цис -бутеноэновая кислота ( Малеиновая кислота ) |
Транс -бутеноэновая кислота ( Фумариновая кислота ) |
 |

|
| цис -9 -октадекеновая кислота ( олеиновая кислота ) |
Транс -9 -октадекеновая кислота ( Элайдская кислота ) |
Различные свойства двух изомеров бутуеноевой кислоты часто очень разные.
| Малеиновая кислота | Фумариновая кислота | |
|---|---|---|
| цвет | белый | белый |
| температура плавления, ° C. | 130 | 286 |
| Растворимость воды, г/л | 788 | 7 |
| Константа кислотной диссоциации , PK A1 | 1.90 | 3.03 |
Полярность является ключевой в определении относительной точки кипения, поскольку прочные межмолекулярные силы повышают точку кипения. Точно так же симметрия является ключевой в определении относительной температуры плавления, поскольку она позволяет лучше упаковать в твердом состоянии, даже если она не изменяет полярность молекулы. Другим примером этого является взаимосвязь между олеиновой кислотой и элайдской кислотой ; Олеиновая кислота, изомер цис , имеет температуру плавления 13,4 ° C, что делает ее жидкостью при комнатной температуре, в то время как транс -изомер, элайдскую кислоту, имеет гораздо более высокую температуру плавления 43 ° C из -за более прямой транс -изомер способен упаковать более плотно и солидно при комнатной температуре.
Таким образом, транс -алкены, которые являются менее полярными и более симметричными, имеют более низкие точки кипения и более высокие точки плавления, а CIS -алкены, которые, как правило, более полярные и менее симметричные, имеют более высокие точки кипения и более низкие точки плавления.
В случае геометрических изомеров, которые являются следствием двойных связей, и, в частности, когда оба заместителя одинаковы, обычно придерживаются некоторые общие тенденции. Эти тенденции можно объяснить тем фактом, что диполи заместителей в цис -изомере будут складываться, чтобы получить общий молекулярный диполь. В транс -изомере диполи заместителей отменяются [ 7 ] из -за находятся на противоположных сторонах молекулы. Транс -изомеры также имеют тенденцию иметь более низкие плотности, чем их аналоги CIS . [ Цитация необходима ]
Как общая тенденция, транс -алкены имеют тенденцию иметь более высокие точки плавления и более низкую растворимость в инертных растворителях, поскольку транс -алкены, как правило, более симметричны, чем Alkenes CIS . [ 8 ]
Константы вицинальной связи ( 3 J HH ), измеренный с помощью ЯМР -спектроскопии , больше для транс (диапазон: 12–18 Гц; типичный: 15 Гц), чем для цис (диапазон: 0–12 Гц; типичные: 8 Гц) изомеры. [ 9 ]
Стабильность
[ редактировать ]Обычно для ациклических систем транс -изомеры более стабильны, чем изомеры CIS . Эта разница объясняется неблагоприятным стерическим взаимодействием заместителей в изомере цис . Следовательно, транс- изомеры имеют менее экспотермическую теплоту сгорания , что указывает на более высокую термохимическую стабильность. [ 8 ] В Heat Heat of Fommation Group Additivity наборе данных изомеры CIS страдают штраф в 1,10 ккал/мол. Существуют исключения из этого правила, такие как 1,2-дифтоороэтилен , 1,2-дифтородиаза (fn = nf), и несколько других галогеновых и кислородных обожженных этилен. В этих случаях изомер CIS более стабилен, чем транс -изомер. [ 10 ] Это явление называется CIS -эффектом . [ 11 ]
E - z обозначения
[ редактировать ]
В принципе, CIS - транс -нотация не должна использоваться для алкенов с двумя или более разными заместителями. Вместо этого нотация E - z используется на основе приоритета заместителей с использованием приоритетных правил приоритета CAHN -Engold -ProLog (CIP) для абсолютной конфигурации. Стандартные обозначения IUPAC E и Z являются однозначными во всех случаях и, следовательно, особенно полезны для три- и тетрасбированных алкенов, чтобы избежать путаницы в отношении того, какие группы идентифицируются как цис или транс друг с другом.
Z (от немецкого Zusammen ) означает «вместе». E (от немецкого EntgeGen ) означает «противоположный» в смысле «противоположного». То есть Z имеет более высокоприоритетные группы CIS друг к другу, и E имеет более высокие группы, трансводящиеся друг на друга. Определяется ли молекулярная конфигурация E или z, определяется правилами CIP; Более высокие атомные числа получают более высокий приоритет. Для каждого из двух атомов в двойной связи необходимо определить приоритет каждого заместителя. Если оба заместителя более высокого приоритета находятся на одной стороне, расположение составляет z ; Если на противоположных сторонах, расположение e .
Поскольку системы CIS - TRANS и E - Z сравнивают различные группы на алкене, не строго верно, что Z соответствует CIS и E, соответствует транс . Например, транс -2-хлорбут-2-en-ene (две метильные группы, C1 и C4, на основе но-2-en-ene транс друг на друга) составляет ( z ) -2-хлорбут-2-ene (The Хлор и C4 вместе, потому что C1 и C4 противоположны).
Неопределенная алкеновая стереохимия
[ редактировать ]Волнистые отдельные связи - это стандартный способ представления неизвестной или неопределенной стереохимии или смесь изомеров (как в случае с тетраэдрическими стереоцентрами). Скрещенная двойная связь иногда использовалась; Это больше не считается приемлемым стилем для общего использования IUPAC , но все же может потребоваться компьютерным программным обеспечением. [ 12 ]

Неорганическая химия
[ редактировать ]CIS - Транс -изомеризм также может происходить в неорганических соединениях.
Диазена
[ редактировать ]Диазины (и связанные с ним ) также могут демонстрировать цис -изомеризм дифхосфен . Как и в случае с органическими соединениями, цис -изомер, как правило, более реактивным для двух, является единственным изомером, который может уменьшить алкены и алкины до алканов , но по другой причине: транс -изомер не может выровнять свои гидрогины, чтобы уменьшить алкен, Но Изомер цис , формированный по -разному, может.
  |
 
|
| Транс -диазен | цис -диазен |
Координационные комплексы
[ редактировать ]Координационные комплексы с октаэдрической или квадратной плоской геометрией также могут демонстрировать цис-транс- изомеризм.

Например, существуют два изомера квадратной плоской PT (NH 3 ) 2 Cl 2 , как объяснено Альфредом Вернером в 1893 году. Изомер CIS , полное название CIS -Diammedichloroplatinum (II) было показано в 1969 году Розенбергом Барнеттом иметь противоопухолевую активность и в настоящее время является химиотерапевтическим препаратом, известным под коротким названием цисплатина . Напротив, транс -изомер ( трансплатин ) не имеет полезной противоопухолевой активности. Каждый изомер может быть синтезирован с использованием транс -эффекта для контроля, который производится изомер.
Для октаэдрических комплексов формулы MX 4 Y 2 также существуют два изомера. (Здесь m - атом металла, а x и y - два разных типа лигандов .) В изомере цис два лиганда Y примыкают друг к другу при 90 °, как и для двух атомов хлора, показанных зелеными в CIS -[CO (NH 3 ) 4 CL 2 ] + , слева. В транс -изомере, показанном справа, два атома CL находятся на противоположных сторонах центрального атома CO.
Связанный тип изомеризма в октаэдрических MX 3 Y 3 комплексах Лицевой меридиональный (или FAC - MER ) изомеризм, при котором различные числа лигандов являются цис или транс друг на друга. Металлические карбонильные соединения можно охарактеризовать как FAC или MER с использованием инфракрасной спектроскопии .
Смотрите также
[ редактировать ]Ссылки
[ редактировать ]- ^ словарь (Clarendon Press, 1879) . Чарлтон Т. Льюис, Чарльз Шорт, латинский
- ^ Iupac , сборник химической терминологии , 2 -е изд. («Золотая книга») (1997). Онлайн -исправленная версия: (2006–) « Геометрическая изомерия ». doi : 10.1351/goldbook.g02620
- ^ Охота, Ян. «Стереохимия» . Университет Калгари . Получено 3 ноября 2023 года .
- ^ Реуш, Уильям (2010). «Стереоизомеры, часть I» . Виртуальный учебник по органической химии . Мичиганский государственный университет . Получено 7 апреля 2015 года .
- ^ "Chemicalland значения" . Chemicalland21.com . Получено 2010-06-22 .
- ^ Справочник по химии и физике CRC (60 -е изд.). 1979–1980. п. C-298.
- ^ Ouellette, Robert J.; Rawn, J. David (2015). «Алкены и алкины». Принципы органической химии . С. 95–132. doi : 10.1016/b978-0-12-802444-7.00004-5 . ISBN 978-0-12-802444-7 .
- ^ Jump up to: а беременный Март, Джерри (1985). Расширенная органическая химия, реакции, механизмы и структура (3 -е изд.). п. 111. ISBN 978-0-471-85472-2 .
- ^ Уильямс, Дадли Х.; Флеминг, Ян (1989). «Таблица 3.27». Спектроскопические методы в органической химии (4th Rev. Ed.). МакГроу-Хилл. ISBN 978-0-07-707212-4 .
- ^ Бингхэм, Ричард С. (1976). «Стереохимические последствия электронной делокализации в расширенных π-системах. Интерпретация эффекта цис , демонстрируемой 1,2-резитуальными этиленами и связанными с ними явлениями». J. Am. Химический Соц 98 (2): 535–540. doi : 10.1021/ja00418a036 .
- ^ Крейг, Северная Каролина; Чен, А.; Су, Кх; Klee, S.; Mellau, GC; Winnewisser, BP; Winnewisser, M. (1997). «Вклад в изучение эффекта гоше. Полная структура антилотератора 1,2 -дифторэтана». J. Am. Химический Соц 119 (20): 4789. doi : 10.1021/ja963819e .
- ^ Брехер, Джонатан (2006). «Графическое представление стереохимической конфигурации (рекомендации IUPAC 2006)» (PDF) . Чистая и прикладная химия . 78 (10): 1897–1970. doi : 10.1351/pac200678101897 . S2CID 97528124 .

