Связь углерод-фтор
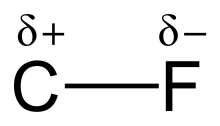
Связь углерод-фтор представляет собой полярную ковалентную связь между углеродом и фтором , которая является компонентом всех фторорганических соединений . Это одна из самых прочных одинарных связей в химии (после одинарной связи B-F , одинарной связи Si-F и одинарной связи H-F) и относительно короткая из-за ее частичного ионного характера. добавляется больше фтора Связь также усиливается и укорачивается по мере того, как к одному и тому же углероду в химическом соединении . Таким образом, фторалканы , такие как тетрафторметан (тетрафторид углерода), являются одними из наиболее нереакционноспособных органических соединений.
Электроотрицательность и прочность связи
[ редактировать ]Высокая электроотрицательность фтора (4,0 для фтора против 2,5 для углерода) придает связи углерод-фтор значительную полярность или дипольный момент . Электронная плотность концентрируется вокруг фтора, в результате чего углерод остается относительно бедным электронами. Это придает связи ионный характер за счет частичных зарядов (C д+ —Ф д- ). Частичные заряды фтора и углерода притягиваются, что способствует необычной прочности связи углерод-фтор. Эта связь названа «самой прочной в органической химии». [1] потому что фтор образует самую прочную одинарную связь с углеродом. Связи углерод-фтор могут иметь энергию диссоциации связи (БДЭ) до 130 ккал/моль. [2] BDE (прочность связи) C–F выше, чем у других углерод– галоген и углерод –водород связей . Например, БДЭ связи C–X в молекуле CH 3 –X составляет 115, 104,9, 83,7, 72,1 и 57,6 ккал/моль для X = фтор, водород , хлор , бром и йод соответственно. [3]
Длина связи
[ редактировать ]Длина связи углерод-фтор обычно составляет около 1,35 ангстрема (1,39 Å во фторметане ). [1] Она короче любой другой связи углерод-галоген и короче одиночных связей углерод- азот и углерод- кислород . Короткую длину связи можно также объяснить ионным характером связи (электростатическим притяжением между частичными зарядами углерода и фтора). Длина связи углерод-фтор варьируется на несколько сотых ангстрема в зависимости от гибридизации атома углерода и присутствия других заместителей на углероде или даже в более удаленных атомах. Эти флуктуации можно использовать как индикатор тонких гибридизационных изменений и стереоэлектронных взаимодействий . В таблице ниже показано, как варьируется средняя длина связи в различных средах связи (атомы углерода расположены sp 3 -гибридизированный, если не указано иное для sp 2 или ароматический углерод).
Связь Средняя длина связи (Å) [4] КСН 2 Ж, К 2 Швейцарских франка 1.399 С 3 КФ 1.428 С 2 CF 2 , H 2 CF 2 , CCHF 2 1.349 ККФ 3 1.346 ФКНО 2 1.320 FCCF 1.371 С сп2 F 1.340 С воздух F 1.363 FC ar Car ar F 1.340
Изменчивость длин связей и укорочение связей с фтором из-за их частичного ионного характера наблюдаются также для связей между фтором и другими элементами и являются источником трудностей с выбором подходящего значения ковалентного радиуса фтора . Лайнус Полинг первоначально предложил 64 пм , но это значение в конечном итоге было заменено на 72 пм, что составляет половину длины связи фтор-фтор. Однако 72 часа слишком долго, чтобы отражать длину связей между фтором и другими элементами, поэтому другие авторы предложили значения между 54 и 60 часами вечера. [5] [6] [7] [8]
Эффект прочности геминальных связей
[ редактировать ]С увеличением числа атомов фтора на одном и том же ( геминальном ) углероде другие связи становятся прочнее и короче. Это можно увидеть по изменениям длины и прочности связи (БДЭ) для ряда фторметана, как показано в таблице ниже; кроме того, парциальные заряды ( q C и q F ) атомов изменяются внутри ряда. [2] Частичный заряд углерода становится более положительным по мере добавления фторов, увеличивая электростатические взаимодействия и ионный характер между фторами и углеродом.
Сложный Длина связи CF (Å) БДЭ (ккал/моль) q С q Ф CHCH3F F 1.385 109.9 ± 1 0.01 −0.23 Ч 2 Ф 2 1.357 119.5 0.40 −0.23 CHF3 швейцарских франка 1.332 127.5 0.56 −0.21 КФ 4 1.319 130.5 ± 3 0.72 −0.18
Левый эффект
[ редактировать ]
Когда два атома фтора находятся в вицинальных (т.е. соседних) атомах углерода, как в 1,2-дифторэтане (H 2 FCCFH 2 ), гош -конформер более стабилен, чем антиконформер – это противоположно тому, что обычно можно было бы ожидать, и тому, что наблюдается для большинства 1,2-дизамещенных этанов; это явление известно как эффект гоша . [9] В 1,2-дифторэтане гош-конформация более устойчива, чем анти-конформация, на 2,4–3,4 кДж/моль в газовой фазе. Однако этот эффект не уникален для галогена и фтора; Гош-эффект наблюдается и для 1,2-диметоксиэтана . Родственным эффектом является алкен-цис-эффект . Например, цис-изомер 1,2-дифторэтилена более стабилен, чем транс-изомер. [10]
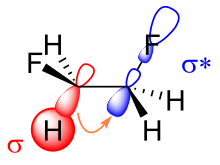
Существует два основных объяснения эффекта гоша: гиперконъюгация и изогнутые связи . В модели гиперсопряжения передача электронной плотности со связывающей σ-орбитали углерода-водорода на σ-орбиталь углерода-фтора * разрыхляющая орбиталь считается источником стабилизации гош-изомера. Из-за большей электроотрицательности фтора σ-орбиталь углерод-водород является лучшим донором электронов, чем σ-орбиталь углерод-фтор, а σ-орбиталь углерод-фтор * орбиталь является лучшим акцептором электронов, чем углеродно-водородная σ * орбитальный. Только конформация гош допускает хорошее перекрытие между лучшим донором и лучшим акцептором. [11]
Ключевым моментом в объяснении эффекта гош в дифторэтане изогнутыми связями является повышенный характер p-орбитали обеих связей углерод-фтор из-за большой электроотрицательности фтора. В результате электронная плотность увеличивается сверху и снизу слева и справа от центральной связи углерод-углерод. Получающееся в результате уменьшенное перекрытие орбиталей может быть частично компенсировано, если принять конформацию гош, образующую изогнутую связь. Из этих двух моделей гиперконъюгация обычно считается основной причиной эффекта гоша в дифторэтане. [1] [12]
Спектроскопия
[ редактировать ]Растяжение связи углерод-фтор проявляется в инфракрасном спектре между 1000 и 1360 см-1. −1 . Широкий диапазон обусловлен чувствительностью частоты растяжения к другим заместителям в молекуле. Монофторированные соединения имеют сильную полосу между 1000 и 1110 см-1. −1 ; при наличии более чем одного атома фтора полоса распадается на две полосы: одну для симметричной моды и одну для асимметричной. [13] Полосы углерод-фтор настолько сильны, что могут затмить любые возможные полосы углерод-водород. [14]
Фторорганические соединения также можно охарактеризовать с помощью ЯМР-спектроскопии с использованием углерода-13 , фтора-19 (единственный природный изотоп фтора) или водорода-1 (если он присутствует). Химические сдвиги в 19 F ЯМР появляются в очень широком диапазоне, в зависимости от степени замещения и функциональной группы. В таблице ниже показаны диапазоны для некоторых основных классов. [15]
Тип соединения Диапазон химического сдвига (ppm) относительно чистого CFCl 3 F – C=O от −70 до −20 CFCF3 от +40 до +80 КФ 2 от +80 до +140 CF от +140 до +250 АрФ от +80 до +170
Разрыв связей C – F
[ редактировать ]Разрыв связей C–F представляет интерес как способ разложения и разрушения фторорганических « вечных химикатов », таких как ПФОК и перфторированные соединения (ПФУ). Возможные методы включают катализаторы, такие как атомы платины; [16] фотокатализаторы; УФ, йодид и сульфит, [17] радикалы; и т. д.
См. также
[ редактировать ]- Флюорокарбон
- Фторорганическая химия
- Углеродно-водородная связь
- Углерод-углеродная связь
- Связь углерод-азот
- Связь углерод-кислород
Ссылки
[ редактировать ]- ^ Перейти обратно: а б с О'Хаган Д. (февраль 2008 г.). «Понимание фторорганической химии. Знакомство со связью C – F». Chem Soc Rev. 37 (2): 308–19. дои : 10.1039/b711844a . ПМИД 18197347 .
- ^ Перейти обратно: а б Лемаль, Дэвид М. (2004). «Взгляд на фторуглеродную химию» . J Орг. хим . 69 (1): 1–11. дои : 10.1021/jo0302556 . ПМИД 14703372 .
- ^ Бланксби С.Дж., Эллисон ГБ (апрель 2003 г.). «Энергии диссоциации связей органических молекул». Акк. хим. Рез . 36 (4): 255–63. CiteSeerX 10.1.1.616.3043 . дои : 10.1021/ar020230d . ПМИД 12693923 .
- ^ Ф. Х. Аллен, О. Кеннард, Д. Г. Уотсон, Л. Браммер, А. Г. Орпен. Таблицы длин связей, определенных методами рентгеновской и нейтронной дифракции. Часть 1. Длины связей в органических соединениях. Дж. Хим. Соц. Перкин Транс. II 1987 г. , С1–С19.
- ^ Гиллеспи Рональд; Робинсон Эдвард (1992). «Длины связей в ковалентных фторидах. Новое значение ковалентного радиуса фтора». Неорганическая химия . 31 (10): 1960–1963. дои : 10.1021/ic00036a045 .
- ^ Робинсон Эдвард; Джонсон Сэмюэл; Тан Тин-Хуа; Гиллеспи Рональд (1997). «Переинтерпретация длин связей с фтором с точки зрения почти ионной модели». Неорганическая химия . 36 (14): 3022–3030. дои : 10.1021/ic961315b . ПМИД 11669953 .
- ^ Кордеро Беатрис; Гомес Вероника; Платеро-Прац Ана Э; обратная марка; Эчеверрия Хорхе; Кремадес Эдуард; Барраган Флавия; Альварес Сантьяго (2008). «Возвращение к ковалентным радиусам». Далтон Транс . 2008 (21): 2832–2838. дои : 10.1039/b801115j . ПМИД 18478144 . S2CID 244110 .
- ^ Пюиккё П.; Ацуми М. (2009). «Молекулярные ковалентные радиусы одинарных связей для элементов 1-118». Химия: Европейский журнал . 15 (1): 186–197. дои : 10.1002/chem.200800987 . ПМИД 19058281 .
- ^ Крейг, Норман К.; Чен, Энтони; Со, Ки Хван; Клее, Стефан; Меллау, Георг К.; Винневиссер, Бренда П.; Винневиссер, Манфред (1997). «Вклад в изучение эффекта Гоша. Полная структура антиротамера 1,2 -дифторэтана». Дж. Ам. хим. Соц. 119 (20): 4789–4790. дои : 10.1021/ja963819e .
- ^ Бингхэм, Ричард К. (1976). «Стереохимические последствия делокализации электронов в расширенных пи-системах. Интерпретация цис-эффекта, проявляемого 1,2-дизамещенными этиленами, и связанных с ним явлений» . Дж. Ам. хим. Соц. 98 (2): 535–540. дои : 10.1021/ja00418a036 .
- ^ Алабугин, И.В. Стереоэлектронные эффекты: мост между структурой и реактивностью. John Wiley & Sons Ltd, Чичестер, Великобритания, 2016 г.
- ^ Гудман, Л.; Гу, Х.; Пофристик, В (2005). «Эффект Гоша в 1,2-дифторэтане. Гиперконъюгация, изогнутые связи, стерическое отталкивание». Дж. Физ. хим. А. 109 (6): 1223–1229. Бибкод : 2005JPCA..109.1223G . дои : 10.1021/jp046290d . ПМИД 16833433 .
- ^ Джордж Сократ; Сократ (2001). Характеристические групповые частоты инфракрасного и комбинационного рассеяния света: таблицы и диаграммы . Джон Уайли и сыновья. п. 198. ИСБН 978-0-470-09307-8 .
- ^ Барбара Х. Стюарт (2004). Инфракрасная спектроскопия: основы и приложения . Джон Уайли и сыновья. п. 82. ИСБН 978-0-470-85428-0 .
- ^ «Химические сдвиги 19F и константы взаимодействия» . 2 апреля 1998 г. Архивировано из оригинала 25 июня 2010 г. Проверено 9 ноября 2008 г.
- ^ «Отдельные атомы разрывают самую прочную связь углерода» . ScienceDaily .
- ^ «Всего 3 ингредиента могут быстро уничтожить широко используемые «вечные химикаты» ПФАС » . Новости науки . 3 июня 2022 г.