Левый эффект
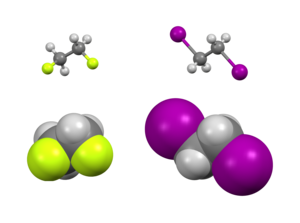
При изучении конформационной изомерии эффект гош представляет собой нетипичную ситуацию, когда конформация гош (группы, разделенные торсионным углом примерно 60°) более стабильна, чем антиконформация (180°). [2]

Существуют как стерические , так и электронные эффекты , влияющие на относительную стабильность конформеров. Обычно при расположении больших заместителей далеко друг от друга преобладают стерические эффекты. Однако это не относится к некоторым заместителям, обычно сильно электроотрицательным . Вместо этого существует электронное предпочтение, чтобы эти группы были неуклюжими. Обычно изучаемые примеры включают 1,2-дифторэтан (H 2 FCCFH 2 ), этиленгликоль и вициналь-дифторалкильные структуры.
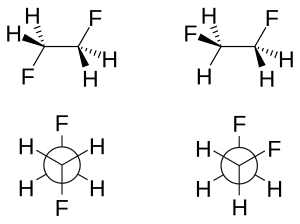
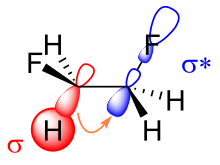
Существует два основных объяснения эффекта гоша: гиперконъюгация и изогнутые связи . В модели гиперсопряжения передача электронной плотности со связующей орбитали C-H σ на C-F σ * разрыхляющая орбиталь считается источником стабилизации гош-изомера. Из-за большей электроотрицательности фтора орбиталь C-H σ является лучшим донором электронов, чем орбиталь C-F σ, а орбиталь C-F σ * орбиталь является лучшим акцептором электронов, чем CH σ * орбитальный. Только конформация гош допускает хорошее перекрытие между лучшим донором и лучшим акцептором.
Ключевым моментом в объяснении эффекта гош в дифторэтане изогнутыми связями является усиление p-орбитального характера обеих связей CF из-за большой электроотрицательности фтора. В результате электронная плотность увеличивается сверху и снизу слева и справа от центральной связи C-C. Получающееся в результате уменьшенное перекрытие орбиталей может быть частично компенсировано, если принять конформацию гош, образующую изогнутую связь. Из этих двух моделей гиперконъюгация обычно считается основной причиной эффекта гоша в дифторэтане. [5] [6]
Молекулярная геометрия обоих ротамеров может быть получена экспериментально с помощью инфракрасной спектроскопии высокого разрешения , дополненной работой in silico . [2] В соответствии с описанной выше моделью длина связи углерод-углерод больше у антиротамера (151,4 пм против 150 пм). Стерическое отталкивание между атомами фтора в ротамере Гоша приводит к увеличению валентных углов CCF (на 3,2 °) и увеличению двугранных углов FCCF (от 60 ° до 71 ° по умолчанию).
В родственном соединении 1,2-дифтор-1,2-дифенилэтане ) трео- обнаружено (по данным рентгеновской дифракции ЯМР и констант взаимодействия изомер , который имеет анти-конформацию между двумя фенильными группами и двумя группами фтора и изомера обнаружена конформация гош Для обеих групп эритро- . [7] По результатам in silico эта конформация стабильнее на 0,21 ккал/моль (880 Дж/моль).
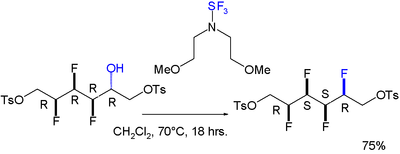
Сообщалось также о гош-эффекте для молекулы, содержащей полностью син-матрицу из четырех последовательных фторзаместителей. Реакция на установку четвертого стереоселективна : [8]
Эффект гош также наблюдается в 1,2-диметоксиэтане. [ нужна ссылка ] и некоторые вицинальные динитроалкильные соединения.
Алкен -цис-эффект представляет собой аналогичную атипичную стабилизацию некоторых алкенов.
Внешние воздействия
[ редактировать ]Эффект Гоша очень чувствителен к эффектам растворителя из-за большой разницы в полярности между двумя конформерами. Например, 2,3-динитро-2,3-диметилбутан, который в твердом состоянии существует только в гош-конформации, в растворе бензола предпочитает гош-конформер в соотношении 79:21, а в четыреххлористом углероде - антиконформер в соотношении 58:42. [9] Другой случай - транс -1,2-дифторциклогексан, который в более полярных растворителях отдает большее предпочтение диэкваториальному конформеру, чем антидиаксиальному конформеру. [6]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Флорис Аккерман; Юрген Бушманн; Дитер Ленц; Питер Люгер; Ева Рёдель (2003). «Кристаллическая и молекулярная структура 1,2-дифторэтана и 1,2-дииодэтана». Журнал химической кристаллографии . 33 (12): 969–975. дои : 10.1023/А:1027494101785 . S2CID 94249439 .
- ^ Jump up to: а б Вклад в изучение эффекта Гоша. Полная структура антиротамера 1,2-дифторэтана . Норман К. Крейг, Энтони Чен, Ки Хван Су, Стефан Клее, Георг К. Меллау, Бренда П. Винневиссер и Манфред Винневиссер, Дж. Ам. хим. Соц. ; 1997 год ; 119(20) стр. 4789–4790; (Коммуникация) дои : 10.1021/ja963819e .
- ^ Дж., Макмерри (2012). Органическая химия (8-е изд.). Бельмонт, Калифорния: Брукс/Коул. п. 98. ИСБН 978-0-8400-5444-9 .
- ^ Мосс, врач общей практики (1 января 1996 г.). «Основная терминология стереохимии (Рекомендации ИЮПАК 1996 г.)» . Чистая и прикладная химия . 68 (12): 2193–2222. дои : 10.1351/pac199668122193 . ISSN 1365-3075 . S2CID 98272391 .
- ^ Гудман, Л.; Гу, Х.; Пофристик В.. Эффект Гоша в 1,2-дифторэтане. Гиперконъюгация, изогнутые связи, стерическое отталкивание. Дж. Физ. хим. А. 2005 , 109 , 1223–1229. два : 10.1021/jp046290d .
- ^ Jump up to: а б Дэвид О'Хаган. Понимание фторорганической химии. Знакомство со связью CF. хим. Соц. Версия 2008 г. два : 10.1039/b711844a .
- ^ Вицинальный дифтормотив: Синтез и конформация эритро- и трео-диастереоизомеров 1,2-дифтордифенилэтанов, 2,3-дифторянтарных кислот и их производных . О'Хаган Д., Рзепа Х., Шулер М., Славин А. Журнал органической химии Бейльштейна , 2006 2:19 (2 октября 2006 г.). дои : 10.1186/1860-5397-2-19 .
- ^ Энантиоселективный синтез полностью синового четырехвицинального фтористого мотива . Люк Хантер, Дэвид О'Хаган и Александра М.З. Славин . Дж. Ам. хим. Соц. ; 2006 год ; 128(51), стр. 16422–16423; (Коммуникация) два : 10.1021/ja066188p .
- ^ Смит, Майкл. Б.; Марч, Передовая органическая химия Дж. Марча, 5-е издание. Уайли, 2001. ISBN 0-471-58589-0 .