Карбонилдиимидазол

| |

| |
| Имена | |
|---|---|
| Предпочтительное название ИЮПАК
Ди(1H - имидазол-1-ил)метанон | |
| Другие имена
N,N'-карбонилдиимидазол
CDI Реагент Стааба | |
| Идентификаторы | |
3D model ( JSmol )
|
|
| ХимическийПаук | |
| Информационная карта ECHA | 100.007.718 |
| Номер ЕС |
|
ПабХим CID
|
|
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA )
|
|
| Характеристики | |
| С 7 Н 6 Н 4 О | |
| Молярная масса | 162.152 g·mol −1 |
| Появление | Белый мелкий порошок |
| Температура плавления | 119 ° С (246 ° F; 392 К) |
| Реагирует с водой | |
| Опасности | |
| Безопасность и гигиена труда (OHS/OSH): | |
Основные опасности
|
Разъедает некоторые металлы. вызывает серьезные химические ожоги При попадании в глаза или на кожу . |
| СГС Маркировка : | |
 
| |
| Опасность | |
| Х302 , Х314 , Х315 , Х319 | |
| P260 , P264 , P270 , P280 , P301+P312 , P301+P330+P331 , P302+P352 , P303+P361+P353 , P304+P340 , P305+P351+P338 , P310 , P321 , П330 , П332+П313 , П337+П313 , П362 , П363 , П405 , П501 | |
| Паспорт безопасности (SDS) | Внешний паспорт безопасности материалов |
| Родственные соединения | |
Родственные соединения
|
фосген , имидазол |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
1,1'-Карбонилдиимидазол ( CDI ) представляет собой органическое соединение с молекулярной формулой (С 3 Н 3 Н 2 ) 2 СО . Это белое кристаллическое твердое вещество . Его часто используют для связывания аминокислот при синтезе пептидов и в качестве реагента в органическом синтезе .
Подготовка
[ редактировать ]CDI можно получить непосредственно реакцией фосгена с четырьмя эквивалентами имидазола в безводных условиях. [ 1 ] Удаление побочного продукта, хлорида имидазолия и растворителя приводит к получению кристаллического продукта с выходом ~90%. [ 2 ]
- 4 C 3 H 4 N 2 + C(O)Cl 2 → (C 3 H 3 N 2 ) 2 CO + 2 [C 3 H 3 N 2 H 2 ]Cl
В этом превращении имидазол служит как нуклеофилом, так и основанием. Альтернативный предшественник 1-(триметилсилил)имидазол требует дополнительных усилий по приготовлению, поскольку побочный продукт триметилсилилхлорид является летучим.
CDI легко гидролизуется с образованием имидазола:
- (C 3 H 3 N 2 ) 2 CO + H 2 O → 2 C 3 H 4 N 2 + CO 2
Чистоту CDI можно определить по количеству CO 2 , образующийся при гидролизе. [ 3 ]
Использование в синтезе
[ редактировать ]CDI в основном используется для превращения аминов в амиды , карбаматы , мочевины . Его также можно использовать для превращения спиртов в сложные эфиры . [ 1 ]
Производные кислоты
[ редактировать ]Образованию амида способствует CDI. Хотя реакционная способность CDI меньше, чем у хлорангидридов , с ним легче обращаться, и он позволяет избежать использования тионилхлорида при образовании хлорангидридов, что может вызвать побочные реакции. [ 3 ] Раннее применение этого типа реакций отмечено при образовании пептидных связей ( CO 2 движущей силой является образование ). Предлагаемый механизм реакции между карбоновой кислотой и CDI представлен ниже. [ 4 ]
В области синтеза пептидов этот продукт можно обработать амином, таким как тот, который содержится в аминокислоте, для высвобождения имидазольной группы и связывания пептидов. Побочные продукты, диоксид углерода и имидазол, относительно безобидны. [ 5 ] Рацемизация аминокислот также имеет тенденцию быть минимальной, что отражает мягкие условия реакции.
CDI также можно использовать для этерификации , хотя алкоголиз требует нагревания или присутствия таких мощных нуклеофилов, как этоксид натрия. [ 1 ] [ 3 ] или другие сильные основания, такие как NaH. Эта реакция обычно имеет хороший выход и широкую область применения, хотя образование сложного эфира из третичных спиртов, когда кислотный реагент имеет относительно кислый α-протон, является затруднительным, поскольку может происходить конденсация CC , хотя сама по себе эта реакция может быть желательной. [ 1 ] Подобная реакция с участием тиолов и селенолов может привести к получению соответствующих эфиров. [ 6 ] Спиртовую реакцию также можно использовать для образования гликозидных связей. [ 7 ]
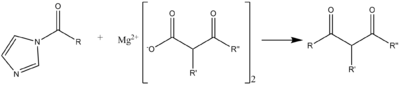
Точно так же вместо спирта можно использовать кислоту для образования ангидрида , хотя дициклогексилкарбодиимид является более типичным реагентом. Равновесие . можно сместить в пользу ангидрида, используя кислоту в соотношении 2:1, которая образует нерастворимую соль с имидазолом Типичными кислотами являются трифтор- и трихлоруксусная кислоты . Таким образом, симметричные ангидриды могут быть получены путем замены этой трифтор- или трихлорацетильной группы кислотой, которая использовалась для образования исходного реагента.
Другой родственной реакцией является реакция муравьиной кислоты с CDI с образованием формилизованного имидазола. Этот реагент является хорошим формилирующим агентом и способен регенерировать незамещенный имидазол (с образованием оксида углерода) при нагревании.
Еще одна реакция включает ацилирование трифенилалкелинфосфоранов.
- (C 6 H 5 ) 3 P=CHR + R'−CO−Im → (C 6 H 5 ) 3 P + −CHR-COR' + Im −
- (С 6 Н 5 ) 3 П + −CHR-COR' + (C 6 H 5 ) 3 P=CHR → (C 6 H 5 ) 3 P=CR-COR' + (C 6 H 5 ) 3 P + −СН 2 Р
Они могут подвергаться реакции Виттига с образованием α,β ненасыщенных кетонов или альдегидов.
Реагент может даже вступать в реакцию с пероксидом с образованием пероксикарбоновой кислоты , которая может вступать в дальнейшую реакцию с образованием диацилпероксидов. Имидазольная группа также восстанавливается LiAlH 4 с образованием альдегидов из карбоновой кислоты (а не аминов или спиртов). Реагент также может вступать в реакцию с реактивами Гриньяра с образованием кетонов. [ 1 ]
Реакция CC-ацилирования может происходить с соединением типа малонового эфира по следующей схеме, применимой для синтеза макролидных антибиотиков. [ 8 ]
Другие реакции
[ редактировать ]N-фенилиминопроизводное CDI может быть образовано в реакции типа Виттига с трифенилфосфинфенилимидом . [ 1 ]
- OCim 2 + Ph 3 P=NPh → PhN=CIm 2 + Ph 3 PO
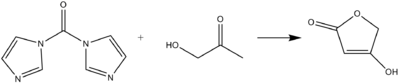
CDI может выступать в качестве карбонильного эквивалента при образовании тетроновых кислот или пульвинонов из гидроксикетонов и дикетонов в основных условиях. [ 9 ]
Спирт, обработанный по меньшей мере 3 эквивалентами активированного галогенида (такого как аллилбромид или йодметан) и CDI, дает соответствующий галогенид с хорошим выходом. Лучше всего действуют бромирование и йодирование, хотя эта реакция не сохраняет стереохимию спирта. В аналогичном контексте CDI часто используется в реакциях дегидратации. [ 3 ]
Поскольку CDI является эквивалентом фосгена , его можно использовать в аналогичной реакции, однако с повышенной селективностью: он позволяет синтезировать асимметрические бисалкилкарбонаты. [ 10 ]
Безопасность
[ редактировать ]Характеристики безопасности CDI были исследованы в рамках более широкой оценки реагентов, образующих амидные связи. Было продемонстрировано, что CDI вызывает разъедание кожи и раздражение глаз. [ 11 ] CDI Было показано, что потенциал сенсибилизации низок по сравнению с другими распространенными агентами, образующими амидные связи (несенсибилизирующий потенциал составляет 1% при тестировании LLNA в соответствии с OECD 429) . [ 12 ] ). Анализ термической опасности с помощью дифференциальной сканирующей калориметрии (ДСК) показывает, что CDI представляет минимальный риск взрыва. [ 13 ]
См. также
[ редактировать ]- Тиокарбонилдиимидазол (TCDI) аналог тиомочевины.
Ссылки
[ редактировать ]- ^ Jump up to: а б с д и ж Х.А. Стааб (1962). «Синтез с использованием гетероциклических амидов (азолидов)». Международное издание «Прикладная химия» на английском языке . 1 (7): 351–367. дои : 10.1002/anie.196203511 .
- ^ Х.А. Стааб и К. Вендель (1973). «1,1'-Карбонилдиимидазол» . Органические синтезы ; Сборник томов , т. 5, с. 201 .
- ^ Jump up to: а б с д А. Армстронг; Вэньцзюй Ли (2007). «N,N'-Карбонилдиимидазол». Энциклопедия реагентов для органического синтеза . дои : 10.1002/9780470842898.rc024.pub2 .
- ^ Стааб, Хайнц А.; Малек, Герхард (1966). «О механизме реакции NN'-карбонилдиазолов с карбоновыми кислотами с образованием азолидов карбоновых кислот» . Химические отчеты (на немецком языке). 99 (9): 2955–2961. дои : 10.1002/cber.19660990931 .
- ^ Р. Пол и Г. В. Андерсон (1960). «N,N'-Карбонилдиимидазол, новый реагент, образующий пептид» . Журнал Американского химического общества . 82 (17): 4596–4600. дои : 10.1021/ja01502a038 .
- ^ Х.-Ж. Гайс (1977). «Синтез эфиров тиола и селенола из карбоновых кислот и тиолов или селенолов соответственно». Angewandte Chemie International Edition на английском языке . 16 (4): 244–246. дои : 10.1002/anie.197702441 .
- ^ М.Дж. Форд и С.В. Лей (1990). «Простая процедура гликозидирования в одной емкости с помощью (1-имидазолилкаронил) гликозидов и бромида цинка». Синлетт . 1990 (5): 255–256. дои : 10.1055/с-1990-21053 .
- ^ Д. У. Брукс; и др. (1979). «С-ацилирование в практически нейтральных условиях». Angewandte Chemie International Edition на английском языке . 18 : 72–74. дои : 10.1002/anie.197900722 .
- ^ Пи Джей Джеррис; и др. (1979). «Простой синтез простых тетроновых кислот и пульвинонов». Буквы тетраэдра . 20 (47): 4517–4520. дои : 10.1016/S0040-4039(01)86637-5 .
- ^ Стив П. Раннард, Никола Дж. Дэвис (1999). «Контролируемый синтез асимметричных диалкилов и циклических карбонатов с использованием высокоселективных реакций имидазолкарбоновых эфиров». Органические письма . 1 (6): 933–936. дои : 10.1021/ol9908528 .
- ^ Грэм, Джессика С.; Трехо-Мартен, Алехандра; Чилтон, Мартин Л.; Косталь, Якуб; Берку, Джоэл; Бютнер, Грегори Л.; Бруен, Ума С.; Долан, Дэвид Г.; Гомес, Стивен; Хиллегасс, Джедд; Николетт, Джон; Шмитц, Мэтью (20 июня 2022 г.). «Оценка вреда для здоровья, связанного с пептидными соединениями» . Химические исследования в токсикологии . 35 (6): 1011–1022. doi : 10.1021/acs.chemrestox.2c00031 . ISSN 0893-228X . ПМЦ 9214767 . ПМИД 35532537 .
- ^ ОЭСР (2010). Тест № 429: Сенсибилизация кожи: анализ местных лимфатических узлов . Париж: Организация экономического сотрудничества и развития.
- ^ Сперри, Джеффри Б.; Минтир, Кристофер Дж.; Тао, ЦзинЯ; Джонсон, Ребекка; Дузгунер, Ремзи; Хоксворт, Майкл; Хорошо, Саманта; Ричардсон, Пол Ф.; Барнхарт, Ричард; Билл, Дэвид Р.; Джусто, Роберт А.; Уивер, Джон Д. (21 сентября 2018 г.). «Оценка термической стабильности реагентов, связывающих пептиды, обычно используемых в фармацевтическом производстве» . Исследования и разработки органических процессов . 22 (9): 1262–1275. дои : 10.1021/acs.oprd.8b00193 . ISSN 1083-6160 .