Формилирование
Было предложено разделить эту статью на статьи под названием «Формилирование» и «Формилирование в биологии» . ( обсудить ) ( февраль 2023 г. ) |

Формилирование относится к любым химическим процессам, в которых соединение функционализируется формильной группой (-CH=O). В органической химии этот термин чаще всего используется в отношении ароматических соединений (например, превращение бензола в бензальдегид в реакции Гаттермана-Коха ). В биохимии реакция катализируется такими ферментами, как формилтрансферазы .
Формилирование обычно включает использование агентов формилирования, реагентов, которые приводят к образованию группы CHO. Среди многих реагентов формилирования особенно важны муравьиная кислота и окись углерода . [ 1 ] Реакция формилирования в органической химии относится к органическим реакциям , в которых органическое соединение функционализируется формильной группой (-CH=O). Реакция ведет к образованию альдегидов ( C -CH=O), формамидов ( N -CH=O) и формиатных эфиров ( O -CH=O).
Агенты формилирования
[ редактировать ]Реагент, доставляющий формильную группу, называется формилирующим агентом . [ 2 ]
- Муравьиная кислота
- Диметилформамид и оксихлорид фосфора в реакции Вильсмайера-Хаака . [ 3 ]
- Гексаметилентетрамин в реакции Даффа и реакции Соммле.
- Оксид углерода и соляная кислота в реакции Гаттермана-Коха.
- Цианиды в реакции Гаттермана . В этом методе ароматические альдегиды синтезируются с использованием хлористого водорода и цианида водорода (или другого цианида металла, такого как цианид цинка ) в присутствии катализаторов на основе кислот Льюиса:
- Хлороформ в реакции Реймера-Тимана
- Дихлорметилметиловый эфир при обонятельном формилировании
Особенно важным процессом формилирования является гидроформилирование , которое превращает алкены в гомологированный альдегид.
Ароматическое формилирование
[ редактировать ]
Реакции формилирования представляют собой форму электрофильного ароматического замещения и поэтому лучше всего работают с исходными материалами, богатыми электронами. Фенолы являются распространенным субстратом, поскольку они легко депротонируются до превосходных феноксидных нуклеофилов. Можно ожидать , что другие богатые электронами субстраты, такие как мезитилен , пиррол или конденсированные ароматические кольца, также вступят в реакцию. Бензол будет реагировать в агрессивных условиях, но дезактивированные кольца, такие как пиридин, трудно эффективно формилировать.
Многие реакции формилирования будут выбирать только орто- продукт (например, салициловый альдегид ), что объясняется притяжением между феноксидом и формилирующим реагентом. Ионные взаимодействия были задействованы для катионных азотных центров в реакции Вильсмайера-Хаака и реакции Даффа , а также для электронодефицитного карбена в реакции Реймера-Тимана ; координация с металлами с высокой степенью окисления была задействована в формилированиях Казираги и Рича (ср. Реакцию Кольбе-Шмитта ).
Прямая реакция между фенолом и параформальдегидом возможна посредством формилирования Казираги. [ 4 ] но в других методах применяются замаскированные формы формальдегида, отчасти для ограничения образования фенолформальдегидных смол . Альдегиды сильно дезактивируют, поэтому фенолы обычно реагируют только один раз. Однако некоторые реакции, такие как реакция Даффа , могут давать двойное присоединение. [ 5 ]
Формилирование можно применять и к другим ароматическим кольцам. Поскольку процесс обычно начинается с нуклеофильной атаки ароматической группы, важным фактором является электронная плотность кольца. Известно, что некоторые ароматические соединения, такие как пиррол, региоселективно формилируют. [ 6 ]
Формилирование бензольных колец может быть достигнуто с помощью реакции Гаттермана и реакции Гаттермана-Коха . Они включают катализ сильной кислотой и протекают аналогично реакции Фриделя-Крафтса .
Алифатическое формилирование
[ редактировать ]Гидроформилирование алкенов — важнейший метод получения алифатических формилов (т. е. альдегидов). Реакция в основном ограничивается промышленными условиями. Существует несколько специальных методов синтеза в лабораторных масштабах, включая реакцию Соммле , синтез альдегидов Буво или синтез альдегидов Бодру-Чичибабина .
Реакции формилирования в биологии
[ редактировать ]В биохимии добавление формильной функциональной группы называется «формилированием». Формильная функциональная группа состоит из карбонила, связанного с водородом. При присоединении к группе R формильная группа называется альдегидом .
Формилирование было обнаружено в нескольких критических биологических процессах. Формилирование метионина было впервые обнаружено в E. coli. Маркером и Сэнгером в 1964 году [ 7 ] и позже было установлено, что он участвует в инициации синтеза белка в бактериях и органеллах. [ 8 ] Образование N -формилметионина катализируется ферментом метионил-тРНК. Из трансформилаза . [ 9 ] происходят две реакции формилирования Кроме того, при биосинтезе пуринов de novo . Эти реакции катализируются ферментами глицинамидрибонуклеотидной (GAR) трансформилазой и 5-аминоимидазол-4-карбоксиамидириботидной (AICAR) трансформилазой . [ 10 ] Совсем недавно было обнаружено, что формилирование представляет собой модификацию гистонов , которая может модулировать экспрессию генов.
Метаногенез
[ редактировать ]
Формилирование метанофурана инициирует цикл метаногенеза . Формильная группа образуется из углекислого газа и превращается в метан .
Формилирование в синтезе белка
[ редактировать ]
В бактериях и органеллах начало синтеза белка сигнализируется образованием формил-метионил-тРНК (тРНК fMet ). Эта реакция зависит от 10-формилтетрагидрофолата и фермента метионил-тРНК формилтрансферазы. [ 9 ] Эта реакция не используется эукариотами или архей, так как наличие тРНК fMet в небактериальных клетках считается интрузивным материалом и быстро элиминируется. После образования тРНК fMet доставляется к 30S-субъединице рибосомы , чтобы начать синтез белка. fMet имеет ту же последовательность кодонов, что и метионин. Однако fMet используется только для инициации синтеза белка и поэтому обнаруживается только на N-конце белка. Метионин используется во время остальной трансляции. В E. coli тРНК fMet специфически распознается фактором инициации IF-2 , поскольку формильная группа блокирует образование пептидной связи на N-конце метионина. [ 9 ]
После завершения синтеза белка формильная группа метионина может быть удалена пептидной деформилазой . Остаток метионина может быть дополнительно удален ферментом метионинаминопептидазой .

Реакции формилирования при биосинтезе пуринов
[ редактировать ]Две реакции формилирования необходимы для одиннадцатиэтапного синтеза de novo инозинмонофосфата (ИМФ) , предшественника пуриновых рибонуклеотидов АМФ и ГМФ. Трансформилаза глицинамидрибонуклеотида (GAR) катализирует образование GAR в формилглицинамидинриботид (FGAR) в четвертой реакции пути. На предпоследнем этапе биосинтеза пуринов de novo 5-аминоимидазол-4-карбоксиамид риботид (AICAR) формилируется до 5-формаминоимидазол-4-карбоксамид риботида (FAICAR) трансформилазой AICAR . [ 10 ]
GAR-трансформилаза
[ редактировать ]Трансформилаза PurN GAR обнаружена у эукариот и прокариот. Однако вторая GAR-трансформилаза, PurT GAR-трансформилаза, была идентифицирована в E. coli . Хотя эти два фермента не имеют консервативной последовательности и требуют разных доноров формила, удельная активность и Km для GAR одинаковы как для трансформилазы PurT, так и для PurN GAR.
PurNGAR трансформилаза
[ редактировать ]Трансформилаза PurN GAR 1CDE использует кофермент N10-формилтетрагидрофолат (N10-формил-ТГФ) в качестве донора формила для формилирования α-аминогруппы GAR. У эукариот трансформилаза PurN GAR является частью большого многофункционального белка, но у прокариот обнаруживается в виде единственного белка. [ 12 ]
Механизм
[ редактировать ]
Предполагается, что реакция формилирования происходит посредством реакции прямого переноса, в которой аминогруппа GAR нуклеофильно атакует N10-формил-ТГФ, создавая тетраэдрическое промежуточное соединение. [ 10 ] Поскольку α-аминогруппа GAR относительно реакционноспособна, предполагается, что депротонирование нуклеофила происходит под действием растворителя. В активном сайте Asn 106, His 108 и Asp 144 расположены для содействия переносу формила. [ 12 ] Однако исследования мутагенеза показали, что эти остатки по отдельности не важны для катализа, поскольку только мутации двух или более остатков ингибируют фермент. Судя по структуре, считается, что отрицательно заряженный Asp144 увеличивает pKa His108, позволяя протонированной имидазолиевой группе His108 усиливать электрофильность формильной группы N10-формил-ТГФ. Кроме того, считается, что His108 и Asn106 стабилизируют оксианион, образующийся в переходном состоянии. [ 13 ]

Трансформилаза PurT GAR
[ редактировать ]Трансформилаза PurT GAR требует формиата в качестве донора формила и АТФ для катализа. Было подсчитано, что трансформилаза PurT GAR осуществляет 14-50% формилирования GAR в E. coli . Фермент является членом суперсемейства белков АТФ-захвата. [ 14 ]
Механизм
[ редактировать ]Для трансформилазы PurT GAR был предложен последовательный механизм, в котором предположительно сначала образуется короткоживущий промежуточный формилфосфат. Этот промежуточный формилфосфат затем подвергается нуклеофильной атаке со стороны амина GAR для переноса формильной группы. Промежуточный формилфосфат был обнаружен в экспериментах по мутагенезу, в которых мутантная трансформилаза PurT GAR имела слабое сродство к формиату. [ 12 ] Инкубация трансформилазы PurT GAR с формилфосфатом, ADP и GAR дает как АТФ, так и FGAR. Это дополнительно указывает на то, что формилфосфат может быть промежуточным соединением, поскольку он кинетически и химически способен осуществлять реакцию формилирования в ферменте. [ 15 ] На основании исследований позиционного изотопного обмена также было предложено образовать промежуточный фермент-фосфат, предшествующий промежуточному формилфосфату. [ 15 ] Однако структурные данные показывают, что формиат может быть расположен для прямой атаки на γ-фосфат АТФ в активном центре фермента с образованием промежуточного формилфосфата. [ 14 ]

AICAR трансформилаза
[ редактировать ]Трансформилазе AICAR требуется кофермент N10-формилтетрагидрофолат (N10-формил-ТГФ) в качестве донора формила для формилирования AICAR в FAICAR. Однако трансформилаза AICAR и трансформилаза GAR не имеют высокого сходства последовательностей или структурной гомологии. [ 13 ]
Механизм
[ редактировать ]
Амин на AICAR гораздо менее нуклеофилен, чем его аналог на GAR, из-за делокализации электронов в AICAR посредством конъюгации. Следовательно, для того, чтобы произошла реакция формилирования, нуклеофил N5 AIRCAR должен быть активирован. Было обнаружено, что гистидин 268 и лизин 267 необходимы для катализа и консервативны во всех трансформилазах AICAR. Гистидин 268 участвует в депротонировании нуклеофила N5 AICAR, тогда как лизин 267, как предполагается, стабилизирует тетраэдрический интермедиат. [ 13 ]
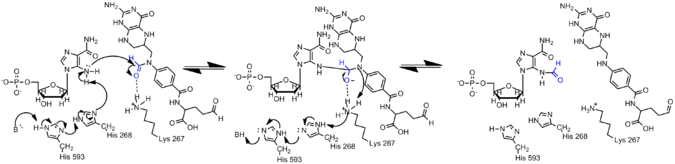
Формилирование в белках-гистонах
[ редактировать ]
ε-формилирование — одна из многих посттрансляционных модификаций , происходящих в гистоновых белках, которая, как было показано, модулирует конформацию хроматина и активацию генов.

Формилирование было идентифицировано по Nε остатков лизина в гистонах и белках. Эта модификация наблюдалась в линкерных гистонах и белках групп с высокой подвижностью , она широко распространена и, как полагают, играет роль в эпигенетике функции хроматина. Было показано, что формилированные лизины играют роль в связывании ДНК. Кроме того, формилирование было обнаружено на лизинах гистонов, которые, как известно, также ацетилированы и метилированы. Таким образом, формилирование может блокировать другие посттрансляционные модификации. [ 16 ] Формилирование чаще всего обнаруживается в 19 различных сайтах модификации гистона H1. Генетическая экспрессия клетки сильно нарушается формилированием, которое может вызвать такие заболевания, как рак. Развитие этих модификаций может быть обусловлено окислительным стрессом. [ 16 ]
В гистоновых белках лизин обычно модифицируется гистон-ацетилтрансферазами (HAT) и гистондеацетилазами (HDAC или KDAC). Ацетилирование лизина имеет основополагающее значение для регуляции и экспрессии определенных генов. Окислительный стресс создает совершенно иную среду, в которой ацетиллизин может быстро вытесняться за счет образования формиллизина из-за высокой реакционной способности формилфосфатов. В настоящее время считается, что эта ситуация вызвана окислительным повреждением ДНК. Был предложен механизм образования формилфосфата, который в значительной степени зависит от окислительно поврежденной ДНК и в основном обусловлен радикальной химией внутри клетки. [ 17 ] Полученный формилфосфат затем можно использовать для формилирования лизина. Считается, что окислительный стресс играет роль в наличии остатков лизина на поверхности белков и возможности формилирования.

Формилирование в медицине
[ редактировать ]Реакции формилирования как мишень лекарственного средства
[ редактировать ]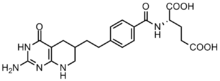
Ингибирование ферментов, участвующих в биосинтезе пуринов, использовалось в качестве потенциальной мишени для химиотерапии.
Раковые клетки требуют высоких концентраций пуринов для облегчения деления. [ 12 ] и склонны полагаться на синтез de novo, а не на путь спасения нуклеотидов . [ 13 ] [ 18 ] Было разработано несколько ингибиторов на основе фолата для ингибирования реакций формилирования трансформилазой GAR и трансформилазой AICAR. [ 19 ] Первый ингибитор GAR-трансформилазы лометрексол [(6R)5,10-дидеазатетрагидрофолат] был разработан в 1980-х годах в результате сотрудничества компании Eli Lilly и академических лабораторий. [ 20 ] Хотя лометрексол по структуре похож на N10-формил-ТГФ, он не способен осуществлять реакции переноса одного углерода. [ 19 ] Кроме того, также было синтезировано несколько ингибиторов GAR-трансформилазы на основе GAR. [ 19 ] Было обнаружено, что разработка ингибиторов на основе фолата является особенно сложной, поскольку ингибиторы также подавляют фермент фолиполиглутаматсинтазу , который добавляет дополнительные γ-глутаматы к моноглутаматным фолатам и антифолатам после проникновения в клетку для повышения сродства к ферменту. Это повышенное сродство может привести к устойчивости к антифолатам. [ 18 ]
синдром Ли
[ редактировать ]Синдром Ли — нейродегенеративное заболевание, связанное с дефектом ферментативной реакции формилирования. Синдром Ли обычно связан с дефектами окислительного фосфорилирования, которое происходит в митохондриях. [ 21 ] Секвенирование экзома использовалось для выявления мутации в гене, кодирующем митохондриальную метионил-тРНК-формилтрансферазу (MTFMT) у пациентов с синдромом Лея. Считается, что мутация c.626C>T, выявленная при MTFMT, вызывающая симптомы синдрома Ли, изменяет сплайсинг экзонов, что приводит к мутации сдвига рамки считывания и преждевременному стоп-кодону. Было обнаружено, что у людей с мутацией c.626C>T MTFMT наблюдаются пониженные уровни fMet-tRNAMet и изменения в уровне формилирования митохондриально транслируемого COX1. Эта ссылка доказывает необходимость формилированного метионина в инициации экспрессии определенных митохондриальных генов. [ 22 ]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Ола, Джордж А.; Оганесян, Лена; Арванаги, Масуд. (1987). «Формилирующие агенты». Химические обзоры . 87 (4): 671–686. дои : 10.1021/cr00080a001 .
- ^ Ола, Джорджия ; Оганесян, Л.; Арванаги, М. (1987). «Формилирующие агенты». хим. Преподобный . 87 (4): 671–686. дои : 10.1021/cr00080a001 .
- ^ Дин, С.; Цзяо, Н. (2012). « N,N -Диметилформамид: многоцелевой строительный блок». Энджью. хим. Межд. Эд . 51 (37): 9226–9237. дои : 10.1002/anie.201200859 . ПМИД 22930476 .
- ^ Казираги, Джованни; Каснати, Джузеппе; Апулия, Джузеппе; Сартори, Джованни; Теренги, Джулиана (1980). «Селективные реакции между фенолами и формальдегидом. Новый путь к салициловым альдегидам». Журнал Химического общества, Perkin Transactions 1 : 1862. doi : 10.1039/P19800001862 .
- ^ Линдой, Леонард Ф. (июль 1998 г.). «Моно- и диформилирование 4-замещенных фенолов: новое применение реакции Даффа». Синтез . 1998 (7): 1029–1032. дои : 10.1055/с-1998-2110 .
- ^ Варашина, Такуя; Мацуура, Дайсуке; Сэнгоку, Тецуя; Такахаши, Масаки; Йода, Хидеми; Кимура, Ёсиказу (16 октября 2018 г.). «Региоселективное формилирование пиррол-2-карбоксилата: кристаллический реагент Вильсмайера в сравнении с дихлорметилалкиловым эфиром». Исследования и разработки органических процессов . 23 (4): 614–618. дои : 10.1021/acs.oprd.8b00233 . S2CID 106209464 .
- ^ Маркер, К; Сэнгер, Ф. (1964). «N-формил-метионил-S-РНК». Дж. Мол. Биол . 8 (6): 835–840. дои : 10.1016/S0022-2836(64)80164-9 . ПМИД 14187409 .
- ^ Адамс, Дж. М.; Капечки, MR (1966). «N-Формилметионил-сРНК как инициатор синтеза белка» . ПНАС . 55 (1): 147–155. Бибкод : 1966ПНАС...55..147А . дои : 10.1073/pnas.55.1.147 . ПМК 285768 . ПМИД 5328638 .
- ^ Jump up to: а б с Козак, М (1983). «Сравнение инициации синтеза белка у прокариот, эукариот и органелл» . Микробиологические обзоры . 47 (1): 1–45. дои : 10.1128/ММБР.47.1.1-45.1983 . ПМК 281560 . ПМИД 6343825 .
- ^ Jump up to: а б с Воэт и Воэт (2008). Основы биохимии 3-е издание . Нью-Йорк: Уайли.
- ^ Тауэр, РК (1998). «Биохимия метаногенеза: дань уважения Марджори Стивенсон» . Микробиология . 144 : 2377–2406. дои : 10.1099/00221287-144-9-2377 . ПМИД 9782487 .
- ^ Jump up to: а б с д Уоррен, MS; К.М. Маттиа; А.Е. Маролевский; С. Дж. Бенкович (1996). «Ферменты трансформилазы биосинтеза пуринов de novo» (PDF) . Чистое приложение. Хим . 68 (11): 2029–2036. дои : 10.1351/pac199668112029 . S2CID 39555269 . Проверено 24 февраля 2013 г.
- ^ Jump up to: а б с д Волан, Д; Грисли, ЮВ; Бердсли, П.; Уилсон, Айова (2002). «Структурные данные о механизме птичьей трансформилазы AICAR». Биохимия . 41 (52): 15505–15513. дои : 10.1021/bi020505x . ПМИД 12501179 .
- ^ Jump up to: а б Тоден, Дж.Б.; Файерстин, С.; Никсон, А.; Бенкович, С.Дж.; Холден, HM (2000). «Молекулярная структура глицинамидрибонуклеотидтрансформилазы, кодируемой PurT Escherichia coli». Биохимия . 39 (30): 8791–8802. дои : 10.1021/bi000926j . ПМИД 10913290 .
- ^ Jump up to: а б Маролевский, А.Е.; Маттиа, КМ; Уоррен, MS; Бенкович, С.Дж. (1997). «Формилфосфат: предлагаемый промежуточный продукт в реакции, катализируемой трансформилазой PurT GAR Escherichia coli». Биохимия . 36 (22): 6709–6716. дои : 10.1021/bi962961p . ПМИД 9184151 .
- ^ Jump up to: а б Вишневский-младший; Зугман, А.; Манн, М. (2002). «N-Формилирование лизина представляет собой широко распространенную посттрансляционную модификацию ядерных белков, происходящую в остатках, участвующих в регуляции функции хроматина» . Исследования нуклеиновых кислот . 36 (2): 570–577. дои : 10.1093/нар/gkm1057 . ПМК 2241850 . ПМИД 18056081 .
- ^ Цзян, Т; Чжоу, X.; Тагизаде, К.; Донг, М.; Дедон, ПК. (2007). «N-формилирование лизина в белках-гистонах как вторичная модификация, возникающая в результате окислительного повреждения ДНК» . ПНАС . 104 (1): 60–65. Бибкод : 2007PNAS..104...60J . дои : 10.1073/pnas.0606775103 . ПМЦ 1765477 . ПМИД 17190813 .
- ^ Jump up to: а б ДеМартино, Дж. К.; Хван, И.; Сюй, Л.; Уилсон, Айова; Богер, Д.Л. (2006). «Открытие мощного неполиглутаматного ингибитора глицинамидрибонуклеотидтрансформилазы» . Журнал медицинской химии . 49 (10): 2998–3002. дои : 10.1021/jm0601147 . ПМЦ 2531195 . ПМИД 16686541 .
- ^ Jump up to: а б с Кристоферсон, Род-Айленд; Лайонс, Южная Дакота; Уилсон, ПК (2002). «Ингибиторы биосинтеза новонуклеотидов как лекарства». Акк. хим. Рез . 35 (11): 961–971. дои : 10.1021/ar0000509 . ПМИД 12437321 .
- ^ Ван, Л; Демулен, СК; Чериан, К.; Полин, Л.; Уайт, К.; Кушнер Дж.; Фултерер, А.; Чанг, М.; Митчелл, С.; Стаут, М.; Ромеро, МФ; Хоу, З.; Мазерли, Л.Х.; Ганджи, А. (2011). «Синтез, биологическая и противоопухолевая активность высокоэффективного 6-замещенного пирроло[2,3-d]пиримидинтиеноилантифолатного ингибитора с протон-связанным переносчиком фолата и селективностью к рецептору фолата по сравнению с восстановленным переносчиком фолата, который ингибирует β-глицинамидрибонуклеотидформилтрансферазу» . Журнал медицинской химии . 54 (20): 7150–7164. дои : 10.1021/jm200739e . ПМК 3209708 . ПМИД 21879757 .
- ^ «Синдром Ли» . Интернет-менделевское наследование у человека . Проверено 24 февраля 2013 г.
- ^ Такер Э.Дж., Хершман С.Г., Кёрер С., Белчер-Тимме К.А., Патель Дж., Гольдбергер О.А., Христодулу Дж., Зильберштейн Дж.М., Маккензи М., Райан М.Т., Комптон А.Г., Джаффе Дж.Д., Карр С.А., Кальво С.Е., РаджБхандари У.Л., Торберн Д.Р., Моота В.К. (2011). «Мутации в MTFMT лежат в основе нарушения формилирования у человека, вызывающего нарушение трансляции митохондрий» . Клеточные метаб . 14 (3): 428–434. дои : 10.1016/j.cmet.2011.07.010 . ПМЦ 3486727 . ПМИД 21907147 .