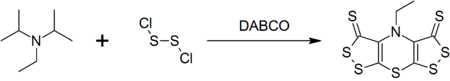N , N -Диизопропилэтиламин
| |||
| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название ИЮПАК
N -Этил- N- (пропан-2-ил)пропан-2-амин | |||
Другие имена
| |||
| Идентификаторы | |||
3D model ( JSmol )
|
|||
| ХимическийПаук | |||
| Информационная карта ECHA | 100.027.629 | ||
| Номер ЕС |
| ||
| МеШ | N,N-диизопропилэтиламин | ||
ПабХим CID
|
|||
| НЕКОТОРЫЙ | |||
| Число | 2733 | ||
Панель управления CompTox ( EPA )
|
|||
| Характеристики | |||
| С 8 Ч 19 Н | |||
| Молярная масса | 129.247 g·mol −1 | ||
| Появление | Бесцветная жидкость | ||
| Запах | Рыбный, аммиачный | ||
| Плотность | 0,742 г мл −1 | ||
| Температура плавления | от -50 до -46 ° C (от -58 до -51 ° F; от 223 до 227 К) | ||
| Точка кипения | 126,6 °С; 259,8 °Ф; 399,7 К | ||
| 4,01 г/л (при 20 °C) | |||
| Давление пара | 4,1 кПа (при 37,70 °С) | ||
Показатель преломления ( n D )
|
1.414 | ||
| Опасности | |||
| СГС Маркировка : | |||
  
| |||
| Опасность | |||
| Х225 , Х301 , Х314 , Х412 | |||
| П210 , П273 , П280 , П301+П310 , П305+П351+П338 , П310 | |||
| точка возгорания | 10 ° C (50 ° F; 283 К) | ||
| Взрывоопасные пределы | 0.7–6.3% | ||
| Летальная доза или концентрация (LD, LC): | |||
ЛД 50 ( средняя доза )
|
200–500 мг кг −1 (оральный, крыса) | ||
| Родственные соединения | |||
Родственные амины
|
|||
Родственные соединения
|
|||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |||
N , N -Диизопропилэтиламин , или основание Хюнига , представляет собой органическое соединение , представляющее собой третичный амин . Он назван в честь немецкого химика Зигфрида Хюнига . Используется в органической химии как ненуклеофильное основание . Обычно его обозначают сокращенно DIPEA, DIEA или i -Pr 2 NET .
Структура
[ редактировать ]DIPEA состоит из центрального атома азота , связанного с этильной группой , и двух изопропильных групп. У атома азота находится неподеленная пара электронов, которая может реагировать с электрофилами. Однако три алкильные группы на атоме азота создают стерические препятствия , поэтому только небольшие электрофилы , такие как протоны, могут реагировать с неподеленной парой азота.
Возникновение и подготовка
[ редактировать ]DIPEA коммерчески доступен. Его алкилированием диизопропиламина диэтилсульфатом получают . традиционно [ 1 ]
Чистый ДИПЭА существует в виде бесцветной жидкости, хотя коммерческие образцы могут иметь слегка желтый цвет. При необходимости соединение можно очистить перегонкой от гидроксида калия. [ 2 ] или гидрид кальция . [ 3 ]
Использование и реакции
[ редактировать ]ДИПЭА представляет собой стерически затрудненное органическое основание, которое обычно используется в качестве поглотителя протонов. Таким образом, подобно 2,2,6,6-тетраметилпиперидину и триэтиламину , ДИПЭА является хорошим основанием, но плохим нуклеофилом . ДИПЭА имеет низкую растворимость в воде, что делает его очень легко извлекаемым в коммерческих процессах. полезный органический реагент. [ 4 ]
Амидная связь
[ редактировать ]Его обычно используют в качестве затрудненного основания в реакциях сочетания амидов между карбоновой кислотой (обычно активированной, например, в виде хлорангидрида, как показано ниже) и нуклеофильным амином. [ 5 ] Поскольку ДИПЭА затруднен и плохо нуклеофилен, он не конкурирует с нуклеофильным амином в реакции сочетания.
Алкилирование
[ редактировать ]DIPEA исследовался на предмет его использования в качестве селективного реагента при вторичных аминов в третичные амины алкилгалогенидами алкилировании . Этому часто препятствует нежелательная реакция Меншуткина с образованием четвертичной аммониевой соли , но она отсутствует в присутствии ДИПЭА. [ 6 ]
Реакции кросс-сочетания, катализируемые переходными металлами
[ редактировать ]DIPEA может использоваться в качестве основания в ряде переходными металлами , катализируемых реакций кросс-сочетания , таких как сочетание Хека и сочетание Соногаширы (как показано ниже). [ 7 ]
Окисление Сверна
[ редактировать ]Хотя триэтиламин традиционно используется в качестве затрудненного основания при окислении Сверна , вместо него можно использовать структурно аналогичный DIPEA, как показано ниже. [ 8 ]
Примеры использования DIPEA в качестве субстрата
[ редактировать ]DIPEA образует сложное гетероциклическое соединение, называемое скорпионином (бис([1,2]дитиоло)-[1,4]тиазин) при реакции с дихлоридом дисеры , которая катализируется DABCO в однореакторном синтезе . [ 9 ]
Сравнение с триэтиламином
[ редактировать ]ДИПЭА и триэтиламин структурно очень похожи, причем оба соединения считаются затрудненными органическими основаниями. Благодаря структурному сходству DIPEA и триэтиламин в большинстве случаев можно использовать как взаимозаменяемые. Атом азота в ДИПЭА более затруднен, чем атом азота в триэтиламине. Однако триэтиламин является немного более сильным основанием, чем ДИПЭА; значения p в K a соответствующих сопряженных кислот составляют 9,0 и 8,5 диметилсульфоксиде соответственно. [ 10 ]
Ссылки
[ редактировать ]- ^ Хюниг, С.; Киссель, М. (1958). «Специфические акцепторы протонов как вспомогательные основания в реакциях алкилирования и дегидрогалогенирования». Химические отчеты . 91 (2): 380–392. дои : 10.1002/cber.19580910223 .
- ^ Армарего, WLF (17 октября 2012 г.). Очистка лабораторных химикатов . Чай, Кристина Ли Линь (Седьмое изд.). Амстердам. ISBN 9780123821621 . OCLC 820853648 .
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка ) - ^ Кейпер, Соня; Вайл, Джозеф С. (12 мая 2006 г.). «Обратимый фотоконтроль катализируемого дезоксирибозимом расщепления РНК в условиях множественного оборота» . Angewandte Chemie, международное издание . 45 (20): 3306–3309. дои : 10.1002/anie.200600164 . ISSN 1433-7851 . ПМИД 16619331 . S2CID 21242501 .
- ^ Сорги, КЛ (2001). «Диизопропилэтиламин». Энциклопедия реагентов для органического синтеза . дои : 10.1002/047084289X.rd254 . ISBN 978-0471936237 .
- ^ Дунец, Джошуа Р.; Магано, Хавьер; Вайзенбургер, Джеральд А. (05 февраля 2016 г.). «Масштабное применение амидных связующих реагентов для синтеза фармацевтических препаратов». Исследования и разработки органических процессов . 20 (2): 140–177. дои : 10.1021/op500305s . ISSN 1083-6160 .
- ^ Мур, Дж.Л.; Тейлор, С.М.; Солошонок, В.А. (2005). «Эффективный и удобный в эксплуатации общий синтез третичных аминов путем прямого алкилирования вторичных аминов алкилгалогенидами в присутствии основания Хюнига» . Аркивок . 2005 (часть VI): 287–292. дои : 10.3998/ark.5550190.0006.624 . hdl : 2027/spo.5550190.0006.624 . EJ-1549C.
- ^ Шиншилла, Рафаэль; Нахера, Кармен (2011). «Последние достижения в реакциях Соногаширы» . Обзоры химического общества . 40 (10): 5084–5121. дои : 10.1039/c1cs15071e . ISSN 0306-0012 . ПМИД 21655588 .
- ^ Вальба, Дэвид М.; Термс, Уильям Н.; Халтивангер, Р. Кертис (1988). «Высоко стереоконтролируемый путь к кольцевой системе спирокеталов моненсина». Журнал органической химии . 53 (5): 1046–1056. дои : 10.1021/jo00240a022 . ISSN 0022-3263 .
- ^ Рис, В.; Маркос, CF; Поло, К.; Торроба, Т.; О.А. Ракитин (1997). «От основания Хюнига к бис([1,2]дитиоло)-[1,4]тиазинам в одном горшке: быстрый путь к высокосульфурированным гетероциклам». Angewandte Chemie, международное издание . 36 (3): 281–283. дои : 10.1002/anie.199702811 .
- ^ Лепор, Сальваторе Д.; Хорам, Анита; Бромфилд, Дебора К.; Кон, Памела; Джайрадж, Винод; Сильвестри, Максимилиан А. (2005). «Исследования марганцево-опосредованной изомеризации алкинилкарбонилов в алленилкарбонилы». Журнал органической химии . 70 (18): 7443–7446. дои : 10.1021/jo051040u . ISSN 0022-3263 . ПМИД 16122274 .