Пероксидикарбонат
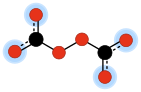
В химии пероксидикарбонат пероксодикарбонат (иногда с ) — двухвалентный анион химической формулой C.
22О 2−
6 . Это один из оксоуглеродных анионов , которые состоят исключительно из углерода и кислорода . Его молекулярную структуру можно рассматривать как соединение двух карбонатных анионов, образующих перекисный мостик –O–O–.
Анион образуется вместе с пероксокарбонатом CO. 2−
4 , на отрицательном электроде во время электролиза расплавленного карбоната лития . [1] Анион также можно получить электролизом насыщенного раствора карбоната рубидия в воде. [2]
Кроме того, пероксодикарбонат-анион можно получить электросинтезом на алмазе, легированном бором (BDD) при водном окислении. [3] [4] формальное окисление На аноде происходит двух карбонат-ионов. Из-за высокого окислительного потенциала пероксодикарбонат-аниона необходим высокий анодный перенапряжение. Это тем более важно, если гидроксильные радикалы в процессе образования участвуют . Недавние публикации показывают, что концентрация пероксодикарбоната 282 ммоль/л может быть достигнута в неделимой клетке с карбонатом натрия в качестве исходного материала при плотностях тока 720 мА/см. 2 . [5] Описанный процесс пригоден для опытно-промышленного производства пероксодикарбоната натрия.
Пероксидикарбонат калия K 2 C 2 O 6 был получен Констамом и фон Хансеном в 1895 г.; [6] его кристаллическая структура была определена только в 2002 году. [7] Его также можно получить электролизом насыщенного раствора карбоната калия при температуре -20 ° C. Это светло-голубое кристаллическое твердое вещество, которое разлагается при 141 °C с выделением кислорода и углекислого газа и медленно разлагается при более низких температурах. [7]
Пероксодикарбонат рубидия представляет собой светло-голубое кристаллическое твердое вещество, разлагающееся при 424 К (151 °С). Его структура была опубликована в 2003 году. [2] В обеих солях каждое из двух карбонатных звеньев плоское. В соли рубидия вся молекула плоская, тогда как в соли калия эти две единицы лежат в разных и почти перпендикулярных плоскостях, каждая из которых содержит связь O–O. [2]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Чен, Ли-Цзян; Линь, Чан-Цзянь; Цзо, Хуан; Сун, Лин-Чун; Хуан, Чао-Мин (2004). «Первое спектроскопическое наблюдение пероксокарбоната/пероксодикарбоната в расплавленном карбонате». Журнал физической химии Б. 108 (23): 7553–7556. дои : 10.1021/jp035749l .
- ^ Jump up to: а б с Диннебье, Роберт Э.; Венский, Саша; Янсен, Мартин (2003). «Кристаллическая и молекулярная структура пероксодикарбоната рубидия Rb 2 [C 2 O 6 ]». Химия: Европейский журнал . 9 (18): 4391–4395. дои : 10.1002/chem.200304914 . ПМИД 14502625 .
- ^ Маврикис, Сотириос; Гельц, Максимилиан; Розивал, Стефан; Ван, Линг; Понсе де Леон, Карлос (18 февраля 2022 г.). «Карбонат-индуцированный электросинтез перекиси водорода посредством двухэлектронного окисления воды» . ChemSusChem . 15 (4). дои : 10.1002/cssc.202102137 . ISSN 1864-5631 . ПМИД 34935302 . S2CID 245384604 .
- ^ Зейтц, Анн-Катрин; Кольпайнтнер, Филипп Дж.; Линген, Тим; Дыга, Марко; Спранг, Фиона; Зирбес, Майкл; Вальдфогель, Зигфрид Р.; Гуссен, Лукас Дж. (25 апреля 2022 г.). «Концентрированный водный пероксодикарбонат: эффективный электросинтез и использование в качестве окислителя при эпоксидировании, S- и N-окислении» . Angewandte Chemie, международное издание . 61 (25). дои : 10.1002/anie.202117563 . ISSN 1433-7851 . ПМЦ 9324847 . ПМИД 35384198 .
- ^ Шардон, Хлоя П.; Матти, Торстен; Нойбер, Рике; Фрида, Матиас; Комнинеллис, Христос (23 января 2017 г.). «Эффективное электрохимическое производство пероксодикарбоната с применением алмазных электродов DIACHEM®». ХимияВыбрать . 2 (3): 1037–1040. дои : 10.1002/slct.201601583 . ISSN 2365-6549 .
- ^ Констам, Э.Дж.; Хансен А. (1896). «Электролитическое представление нового класса окислителей» . Журнал электрохимии . 3 (7): 137–144. дои : 10.1002/bbpc.189600032 . S2CID 179087570 .
- ^ Jump up to: а б Диннебье, Роберт Э.; Венский, Саша; Стивенс, Питер В.; Янсен, Мартин (2002). «Кристаллическая структура K 2 [C 2 O 6 ]». Angewandte Chemie, международное издание . 41 (11): 1922–1924. doi : 10.1002/1521-3773(20020603)41:11<1922::AID-ANIE1922>3.0.CO;2-T .