окситетрафторид ксенона
 | |
 | |
| Идентификаторы | |
|---|---|
3D model ( JSmol ) | |
| ЧЭБИ | |
| ХимическийПаук | |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| КсеОФ 4 | |
| Молярная масса | 223.23 g/mol |
| Появление | бесцветная жидкость |
| Плотность | 3,17 г/см 3 , жидкость |
| Температура плавления | -46,2 ° C (-51,2 ° F; 227,0 К) |
| Реагирует с водой | |
| Структура | |
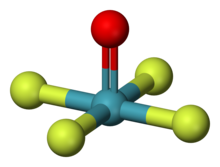
| квадратно-пирамидальный [1] [2] | |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
ксенона ( Xe OF окситетрафторид
4 ) представляет собой неорганическое химическое соединение . Это нестабильная бесцветная жидкость. [2] [3] с температурой плавления -46,2 ° C (-51,2 ° F; 227,0 К) [4] можно синтезировать путем частичного гидролиза XeF который
6 , или реакция XeF
6 с кремнеземом [3] или NaNO
3 : [5]
Высокопроизводительный синтез протекает по реакции XeF
6 с ПОФ
3 при -196 ° C (-320,8 ° F; 77,1 К). [6]
Как и большинство оксидов ксенона, он чрезвычайно реакционноспособен и гидролизуется в воде с образованием опасных и коррозийных продуктов, включая фтороводород :
Кроме того, некоторое количество озона образуется и фтора.
Реакции
[ редактировать ]XeOF
4 реагирует с H
2 О, выполнив следующие действия:
КсеО
Образовавшийся 3 представляет собой опасное взрывчатое вещество, взрывно разлагающееся на Xe и O.
2 :
- 2 КсеО
3 → 2Хе + 3О
2
В жидкой форме XeOF
4 демонстрирует амфотерное поведение, образуя комплексы как с сильными основаниями Льюиса, такими как CsF , так и с сильными кислотами Льюиса, такими как SbF.
5 . [7] Образует аддукт 1:1 с XeF.
2 , изоструктурно XeF
2 · ЕСЛИ
5 , [8] а также различные тяжелых щелочных металлов . фториды [4]
Реакция XeOF
4 с XeO
3 обеспечивает удобный путь синтеза XeO.
22F
2 . [9]
См. также
[ редактировать ]Внешние ссылки
[ редактировать ]- Оксид тетрафторида ксенона в Линстроме, Питере Дж.; Маллард, Уильям Г. (ред.); Интернет-книга NIST по химии , Справочная база данных стандартов NIST № 69 , Национальный институт стандартов и технологий, Гейтерсбург (Мэриленд) (получено 13 апреля 2022 г.)
Ссылки
[ редактировать ]- ^ Мартинс, Джозеф; Уилсон, Э. Брайт-младший (1964). «Микроволновой спектр окситетрафторида ксенона». Журнал химической физики . 41 (570): 570–571. Бибкод : 1964ЖЧФ..41..570М . дои : 10.1063/1.1725910 . ISSN 0021-9606 .
- ^ Jump up to: а б Смит, Д.Ф. (24 мая 1963 г.). «Оксифторид ксенона». Наука . 140 (3569): 899–900. Бибкод : 1963Sci...140..899S . дои : 10.1126/science.140.3569.899 . ISSN 0036-8075 . JSTOR 00368075 . LCCN 17024346 . OCLC 1644869 . ПМИД 17810680 . S2CID 42752536 .
- ^ Jump up to: а б Иберс, Джеймс А. (октябрь 1965 г.). «Молекулярная структура». Ежегодный обзор физической химии . 16 : 375–396. Бибкод : 1965ARPC...16..375I . дои : 10.1146/annurev.pc.16.100165.002111 . ISSN 0066-426X . LCCN а51001658 . ОСЛК 1373069 .
- ^ Jump up to: а б Селиг, Генри (1 февраля 1966 г.). «Комплексы тетрафторида оксида ксенона». Неорганическая химия . 5 (2): 183–186. дои : 10.1021/ic50036a004 . ISSN 0020-1669 .
- ^ Кристе, Карл О .; Уилсон, Уильям В. (апрель 1988 г.). «Удобный синтез тетрафторида оксида ксенона». Неорганическая химия . 27 (7): 1296–1297. дои : 10.1021/ic00280a043 . ISSN 0020-1669 .
- ^ Нильсен, Джон Б.; Кинкед, Скотт А.; Эллер, П. Гэри (1 сентября 1990 г.). «Новый синтез окситетрафторида ксенона, XeOF 4 ». Неорганическая химия . 29 (18): 3621–3622. дои : 10.1021/ic00343a063 . ISSN 0020-1669 .
- ^ Мартин-Рове, Д.; Анжели, К.; Кошетье, М.; Шробильген, Г.Дж. (сентябрь 1982 г.). «Различные аспекты реакционной способности оксифторида ксенона (VI): XeOF4». Журнал химии фтора . 21 (1): 10. doi : 10.1016/S0022-1139(00)85330-0 . ISSN 0022-1139 .
- ^ Бартлетт, Н.; Вексберг, М. (октябрь 1971 г.). «Комплексы дифторида ксенона XeF2 · XeOF4; Журнал неорганической и общей химии . 385 (1): 5–17. дои : 10.1002/zaac.19713850103 . ISSN 0044-2313 . OCLC 1770423 .
- ^ Хьюстон, Джон Л. (сентябрь 1967 г.). «Дифторид ксенона: выделение и некоторые свойства». Журнал физической химии А. 71 (10): 3339–3341. дои : 10.1021/j100869a035 . ISSN 1089-5639 .