Аммиак
 | |||
| |||
| Имена | |||
|---|---|---|---|
| Название ИЮПАК Аммиак [1] | |||
| Систематическое название ИЮПАК Ну давай же | |||
Other names
| |||
| Identifiers | |||
3D model (JSmol) | |||
| 3DMet | |||
| 3587154 | |||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| ECHA InfoCard | 100.028.760 | ||
| EC Number |
| ||
| 79 | |||
| KEGG | |||
| MeSH | Ammonia | ||
PubChem CID | |||
| RTECS number |
| ||
| UNII | |||
| UN number | 1005 | ||
CompTox Dashboard (EPA) | |||
| Properties | |||
| NH3 | |||
| Molar mass | 17.031 g·mol−1 | ||
| Appearance | Colourless gas | ||
| Odor | Strong pungent odour | ||
| Density |
| ||
| Melting point | −77.73 °C (−107.91 °F; 195.42 K) (Triple point at 6.060 kPa, 195.4 K) | ||
| Boiling point | −33.34 °C (−28.01 °F; 239.81 K) | ||
| Critical point (T, P) | 132.4 °C (405.5 K), 111.3 atm (11,280 kPa) | ||
| |||
| Solubility | soluble in chloroform, ether, ethanol, methanol | ||
| Vapor pressure | 857.3 kPa | ||
| Acidity (pKa) | 32.5 (−33 °C),[6] 9.24 (of ammonium) | ||
| Basicity (pKb) | 4.75 | ||
| Conjugate acid | Ammonium | ||
| Conjugate base | Amide | ||
| −18.0×10−6 cm3/mol | |||
Refractive index (nD) | 1.3327 | ||
| Viscosity |
| ||
| Structure | |||
| C3v | |||
| Trigonal pyramid | |||
| 1.42 D | |||
| Thermochemistry | |||
Std molar entropy (S⦵298) | 193 J/(mol·K)[8] | ||
Std enthalpy of formation (ΔfH⦵298) | −46 kJ/mol[8] | ||
| Hazards | |||
| GHS labelling:[11] | |||
    | |||
| Danger | |||
| H280, H314, H331, H410 | |||
| P260, P273, P280, P303+P361+P353, P304+P340+P311, P305+P351+P338+P310 | |||
| NFPA 704 (fire diamond) | |||
| 651 °C (1,204 °F; 924 K) | |||
| Explosive limits | 15.0–33.6% | ||
| Lethal dose or concentration (LD, LC): | |||
LD50 (median dose) | 350 mg/kg (rat, oral)[9] | ||
LC50 (median concentration) |
| ||
LCLo (lowest published) | 5000 ppm (mammal, 5 min) 5000 ppm (human, 5 min)[10] | ||
| NIOSH (US health exposure limits):[12] | |||
PEL (Permissible) | 50 ppm (25 ppm ACGIH- TLV; 35 ppm STEL) | ||
REL (Recommended) | TWA 25 ppm (18 mg/m3) ST 35 ppm (27 mg/m3) | ||
IDLH (Immediate danger) | 300 ppm | ||
| Safety data sheet (SDS) | ICSC 0414 (anhydrous) | ||
| Related compounds | |||
Related nitrogen hydrides | Hydrazine Hydrazoic acid | ||
Related compounds | |||
| Supplementary data page | |||
| Ammonia (data page) | |||
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa). | |||
Аммиак – неорганическое химическое соединение азота , и водорода имеющее формулу Н Н 3 . Стабильный бинарный гидрид и простейший гидрид пниктогена , аммиак представляет собой бесцветный газ с характерным резким запахом. С биологической точки зрения это обычные азотистые отходы , которые вносят значительный вклад в удовлетворение потребностей в питании наземных организмов, служа предшественником удобрений . [13] Около 70% аммиака, производимого промышленным способом, используется для производства удобрений. [14] в различных формах и составе, например мочевина и диаммонийфосфат . Аммиак в чистом виде также вносится непосредственно в почву.
Аммиак прямо или косвенно также является строительным материалом для синтеза многих химических веществ.
Ammonia occurs in nature and has been detected in the interstellar medium. In many countries it is classified as an extremely hazardous substance.[15]
Ammonia is produced biologically in a process called nitrogen fixation, but even more is generated industrially by the Haber process. The process helped revolutionize agriculture by providing cheap fertilizers. The global industrial production of ammonia in 2021 was 235 million tonnes.[16][17] Industrial ammonia is transported in tank cars or cylinders.[18]
NH3 boils at −33.34 °C (−28.012 °F) at a pressure of one atmosphere, but the liquid can often be handled in the laboratory without external cooling. Household ammonia or ammonium hydroxide is a solution of NH3 in water.
Etymology
[edit]Pliny, in Book XXXI of his Natural History, refers to a salt named hammoniacum, so called because of the proximity of its source to the Temple of Jupiter Amun (Greek Ἄμμων Ammon) in the Roman province of Cyrenaica.[19] However, the description Pliny gives of the salt does not conform to the properties of ammonium chloride. According to Herbert Hoover's commentary in his English translation of Georgius Agricola's De re metallica, it is likely to have been common sea salt.[20] In any case, that salt ultimately gave ammonia and ammonium compounds their name.
Natural occurrence (abiological)
[edit]Traces of ammonia/ammonium are found in rainwater. Ammonium chloride (sal ammoniac), and ammonium sulfate are found in volcanic districts. Crystals of ammonium bicarbonate have been found in Patagonia guano.[21]
Ammonia is found throughout the Solar System on Mars, Jupiter, Saturn, Uranus, Neptune, and Pluto, among other places: on smaller, icy bodies such as Pluto, ammonia can act as a geologically important antifreeze, as a mixture of water and ammonia can have a melting point as low as −100 °C (−148 °F; 173 K) if the ammonia concentration is high enough and thus allow such bodies to retain internal oceans and active geology at a far lower temperature than would be possible with water alone.[22][23] Substances containing ammonia, or those that are similar to it, are called ammoniacal.[24]
Properties
[edit]Ammonia is a colourless gas with a characteristically pungent smell. It is lighter than air, its density being 0.589 times that of air. It is easily liquefied due to the strong hydrogen bonding between molecules. Gaseous ammonia turns to a colourless liquid, which boils at −33.1 °C (−27.58 °F), and freezes to colourless crystals[21] at −77.7 °C (−107.86 °F). Little data is available at very high temperatures and pressures, but the liquid-vapor critical point occurs at 405 K and 11.35 MPa.[25]
Solid
[edit]The crystal symmetry is cubic, Pearson symbol cP16, space group P213 No.198, lattice constant 0.5125 nm.[26]
Liquid
[edit]Liquid ammonia possesses strong ionising powers reflecting its high ε of 22 at −35 °C (−31 °F).[27] Liquid ammonia has a very high standard enthalpy change of vapourization (23.5 kJ/mol;[28] for comparison, water's is 40.65 kJ/mol, methane 8.19 kJ/mol and phosphine 14.6 kJ/mol) and can be transported in pressurized or refrigerated vessels; however, at standard temperature and pressure liquid anhydrous ammonia will vaporize.[29]
Solvent properties
[edit]Ammonia readily dissolves in water. In an aqueous solution, it can be expelled by boiling. The aqueous solution of ammonia is basic, and may be described as aqueous ammonia or ammonium hydroxide.[30] The maximum concentration of ammonia in water (a saturated solution) has a specific gravity of 0.880 and is often known as '.880 ammonia'.[31]
| Temperature (°C) | Density (kg/m3) | Specific heat (kJ/(kg·K)) | Kinematic viscosity (m2/s) | Thermal conductivity (W/(m·K)) | Thermal diffusivity (m2/s) | Prandtl Number | Bulk modulus (K−1) |
|---|---|---|---|---|---|---|---|
| −50 | 703.69 | 4.463 | 4.35×10−7 | 0.547 | 1.74×10−7 | 2.6 | |
| −40 | 691.68 | 4.467 | 4.06×10−7 | 0.547 | 1.78×10−7 | 2.28 | |
| −30 | 679.34 | 4.476 | 3.87×10−7 | 0.549 | 1.80×10−7 | 2.15 | |
| −20 | 666.69 | 4.509 | 3.81×10−7 | 0.547 | 1.82×10−7 | 2.09 | |
| −10 | 653.55 | 4.564 | 3.78×10−7 | 0.543 | 1.83×10−7 | 2.07 | |
| 0 | 640.1 | 4.635 | 3.73×10−7 | 0.54 | 1.82×10−7 | 2.05 | |
| 10 | 626.16 | 4.714 | 3.68×10−7 | 0.531 | 1.80×10−7 | 2.04 | |
| 20 | 611.75 | 4.798 | 3.59×10−7 | 0.521 | 1.78×10−7 | 2.02 | 2.45×10−3 |
| 30 | 596.37 | 4.89 | 3.49×10−7 | 0.507 | 1.74×10−7 | 2.01 | |
| 40 | 580.99 | 4.999 | 3.40×10−7 | 0.493 | 1.70×10−7 | 2 | |
| 50 | 564.33 | 5.116 | 3.30×10−7 | 0.476 | 1.65×10−7 | 1.99 |
| Temperature (K) | Density (kg/m3) | Specific heat (kJ/(kg·K)) | Dynamic viscosity (kg/(m·s)) | Kinematic viscosity (m2/s) | Thermal conductivity (W/(m·K)) | Thermal diffusivity (m2/s) | Prandtl Number |
|---|---|---|---|---|---|---|---|
| 273 | 0.7929 | 2.177 | 9.35×10−6 | 1.18×10−5 | 0.022 | 1.31×10−5 | 0.9 |
| 323 | 0.6487 | 2.177 | 1.10×10−5 | 1.70×10−5 | 0.027 | 1.92×10−5 | 0.88 |
| 373 | 0.559 | 2.236 | 1.29×10−5 | 1.30×10−5 | 0.0327 | 2.62×10−5 | 0.87 |
| 423 | 0.4934 | 2.315 | 1.47×10−5 | 2.97×10−5 | 0.0391 | 3.43×10−5 | 0.87 |
| 473 | 0.4405 | 2.395 | 1.65×10−5 | 3.74×10−5 | 0.0467 | 4.42×10−5 | 0.84 |
| 480 | 0.4273 | 2.43 | 1.67×10−5 | 3.90×10−5 | 0.0492 | 4.74×10−5 | 0.822 |
| 500 | 0.4101 | 2.467 | 1.73×10−5 | 4.22×10−5 | 0.0525 | 5.19×10−5 | 0.813 |
| 520 | 0.3942 | 2.504 | 1.80×10−5 | 4.57×10−5 | 0.0545 | 5.52×10−5 | 0.827 |
| 540 | 0.3795 | 2.54 | 1.87×10−5 | 4.91×10−5 | 0.0575 | 5.97×10−5 | 0.824 |
| 560 | 0.3708 | 2.577 | 1.93×10−5 | 5.20×10−5 | 0.0606 | 6.34×10−5 | 0.827 |
| 580 | 0.3533 | 2.613 | 2.00×10−5 | 5.65×10−5 | 0.0638 | 6.91×10−5 | 0.817 |
Liquid ammonia is a widely studied nonaqueous ionising solvent. Its most conspicuous property is its ability to dissolve alkali metals to form highly coloured, electrically conductive solutions containing solvated electrons. Apart from these remarkable solutions, much of the chemistry in liquid ammonia can be classified by analogy with related reactions in aqueous solutions. Comparison of the physical properties of NH3 with those of water shows NH3 has the lower melting point, boiling point, density, viscosity, dielectric constant and electrical conductivity. These differences are attributed at least in part to the weaker hydrogen bonding in NH3. The ionic self-dissociation constant of liquid NH3 at −50 °C is about 10−33.

| Solubility (g of salt per 100 g liquid NH3) | |
|---|---|
| Ammonium acetate | 253.2 |
| Ammonium nitrate | 389.6 |
| Lithium nitrate | 243.7 |
| Sodium nitrate | 97.6 |
| Potassium nitrate | 10.4 |
| Sodium fluoride | 0.35 |
| Sodium chloride | 157.0 |
| Sodium bromide | 138.0 |
| Sodium iodide | 161.9 |
| Sodium thiocyanate | 205.5 |
Liquid ammonia is an ionising solvent, although less so than water, and dissolves a range of ionic compounds, including many nitrates, nitrites, cyanides, thiocyanates, metal cyclopentadienyl complexes and metal bis(trimethylsilyl)amides.[32] Most ammonium salts are soluble and act as acids in liquid ammonia solutions. The solubility of halide salts increases from fluoride to iodide. A saturated solution of ammonium nitrate (Divers' solution, named after Edward Divers) contains 0.83 mol solute per mole of ammonia and has a vapour pressure of less than 1 bar even at 25 °C (77 °F). However, few oxyanion salts with other cations dissolve.[34]
Liquid ammonia will dissolve all of the alkali metals and other electropositive metals such as Ca,[35] Sr, Ba, Eu and Yb (also Mg using an electrolytic process[33]). At low concentrations (<0.06 mol/L), deep blue solutions are formed: these contain metal cations and solvated electrons, free electrons that are surrounded by a cage of ammonia molecules.
These solutions are strong reducing agents. At higher concentrations, the solutions are metallic in appearance and in electrical conductivity. At low temperatures, the two types of solution can coexist as immiscible phases.
Redox properties of liquid ammonia
[edit]
| E° (V, ammonia) | E° (V, water) | |
|---|---|---|
| Li+ + e− ⇌ Li | −2.24 | −3.04 |
| K+ + e− ⇌ K | −1.98 | −2.93 |
| Na+ + e− ⇌ Na | −1.85 | −2.71 |
| Zn2+ + 2 e− ⇌ Zn | −0.53 | −0.76 |
| 2 [NH4]+ + 2 e− ⇌ H2 + 2 NH3 | 0.00 | — |
| Cu2+ + 2 e− ⇌ Cu | +0.43 | +0.34 |
| Ag+ + e− ⇌ Ag | +0.83 | +0.80 |
The range of thermodynamic stability of liquid ammonia solutions is very narrow, as the potential for oxidation to dinitrogen, E° (N2 + 6 [NH4]+ + 6 e− ⇌ 8 NH3), is only +0.04 V. In practice, both oxidation to dinitrogen and reduction to dihydrogen are slow. This is particularly true of reducing solutions: the solutions of the alkali metals mentioned above are stable for several days, slowly decomposing to the metal amide and dihydrogen. Most studies involving liquid ammonia solutions are done in reducing conditions; although oxidation of liquid ammonia is usually slow, there is still a risk of explosion, particularly if transition metal ions are present as possible catalysts.
Structure
[edit]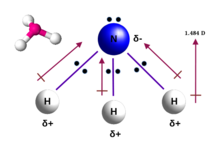

The ammonia molecule has a trigonal pyramidal shape, as predicted by the valence shell electron pair repulsion theory (VSEPR theory) with an experimentally determined bond angle of 106.7°.[36] The central nitrogen atom has five outer electrons with an additional electron from each hydrogen atom. This gives a total of eight electrons, or four electron pairs that are arranged tetrahedrally. Three of these electron pairs are used as bond pairs, which leaves one lone pair of electrons. The lone pair repels more strongly than bond pairs; therefore, the bond angle is not 109.5°, as expected for a regular tetrahedral arrangement, but 106.8°.[36] This shape gives the molecule a dipole moment and makes it polar. The molecule's polarity, and especially its ability to form hydrogen bonds, makes ammonia highly miscible with water. The lone pair makes ammonia a base, a proton acceptor. Ammonia is moderately basic; a 1.0 M aqueous solution has a pH of 11.6, and if a strong acid is added to such a solution until the solution is neutral (pH = 7), 99.4% of the ammonia molecules are protonated. Temperature and salinity also affect the proportion of ammonium [NH4]+. The latter has the shape of a regular tetrahedron and is isoelectronic with methane.
The ammonia molecule readily undergoes nitrogen inversion at room temperature; a useful analogy is an umbrella turning itself inside out in a strong wind. The energy barrier to this inversion is 24.7 kJ/mol, and the resonance frequency is 23.79 GHz, corresponding to microwave radiation of a wavelength of 1.260 cm. The absorption at this frequency was the first microwave spectrum to be observed [37] and was used in the first maser.
Amphotericity
[edit]One of the most characteristic properties of ammonia is its basicity. Ammonia is considered to be a weak base. It combines with acids to form ammonium salts; thus, with hydrochloric acid it forms ammonium chloride (sal ammoniac); with nitric acid, ammonium nitrate, etc. Perfectly dry ammonia gas will not combine with perfectly dry hydrogen chloride gas; moisture is necessary to bring about the reaction.[38][39]
As a demonstration experiment under air with ambient moisture, opened bottles of concentrated ammonia and hydrochloric acid solutions produce a cloud of ammonium chloride, which seems to appear 'out of nothing' as the salt aerosol forms where the two diffusing clouds of reagents meet between the two bottles.
- NH3 + HCl → [NH4]Cl
The salts produced by the action of ammonia on acids are known as the ammonium salts and all contain the ammonium ion ([NH4]+).[38]
Although ammonia is well known as a weak base, it can also act as an extremely weak acid. It is a protic substance and is capable of formation of amides (which contain the NH−2 ion). For example, lithium dissolves in liquid ammonia to give a blue solution (solvated electron) of lithium amide:
- 2 Li + 2 NH3 → 2 LiNH2 + H2
Self-dissociation
[edit]Like water, liquid ammonia undergoes molecular autoionisation to form its acid and base conjugates:
- 2 NH3 ⇌ NH+4 + NH−2
Ammonia often functions as a weak base, so it has some buffering ability. Shifts in pH will cause more or fewer ammonium cations (NH+4) and amide anions (NH−2) to be present in solution. At standard pressure and temperature,
- K = [NH+4] × [NH−2] = 10−30.
Combustion
[edit]Ammonia does not burn readily or sustain combustion, except under narrow fuel-to-air mixtures of 15–28% ammonia by volume in air.[40] When mixed with oxygen, it burns with a pale yellowish-green flame. Ignition occurs when chlorine is passed into ammonia, forming nitrogen and hydrogen chloride; if chlorine is present in excess, then the highly explosive nitrogen trichloride (NCl3) is also formed.
The combustion of ammonia to form nitrogen and water is exothermic:
- 4 NH3 + 3 O2 → 2 N2 + 6 H2O(g), ΔH°r = −1267.20 kJ (or −316.8 kJ/mol if expressed per mol of NH3)
The standard enthalpy change of combustion, ΔH°c, expressed per mole of ammonia and with condensation of the water formed, is −382.81 kJ/mol. Dinitrogen is the thermodynamic product of combustion: all nitrogen oxides are unstable with respect to N2 and O2, which is the principle behind the catalytic converter. Nitrogen oxides can be formed as kinetic products in the presence of appropriate catalysts, a reaction of great industrial importance in the production of nitric acid:
- 4 NH3 + 5 O2 → 4 NO + 6 H2O
A subsequent reaction leads to NO2:
- 2 NO + O2 → 2 NO2
The combustion of ammonia in air is very difficult in the absence of a catalyst (such as platinum gauze or warm chromium(III) oxide), due to the relatively low heat of combustion, a lower laminar burning velocity, high auto-ignition temperature, high heat of vapourization, and a narrow flammability range. However, recent studies have shown that efficient and stable combustion of ammonia can be achieved using swirl combustors, thereby rekindling research interest in ammonia as a fuel for thermal power production.[41] The flammable range of ammonia in dry air is 15.15–27.35% and in 100% relative humidity air is 15.95–26.55%.[42][clarification needed] For studying the kinetics of ammonia combustion, knowledge of a detailed reliable reaction mechanism is required, but this has been challenging to obtain.[43]
Precursor to organonitrogen compounds
[edit]Ammonia is a direct or indirect precursor to most manufactured nitrogen-containing compounds. It is the precursor to nitric acid, which is the source for most N-substituted aromatic compounds.
Amines can be formed by the reaction of ammonia with alkyl halides or, more commonly, with alcohols:
- CH3OH + NH3 → CH3NH2 + H2O
Its ring-opening reaction with ethylene oxide give ethanolamine, diethanolamine, and triethanolamine.
Amides can be prepared by the reaction of ammonia with carboxylic acid and their derivatives. For example, ammonia reacts with formic acid (HCOOH) to yield formamide (HCONH2) when heated. Acyl chlorides are the most reactive, but the ammonia must be present in at least a twofold excess to neutralise the hydrogen chloride formed. Esters and anhydrides also react with ammonia to form amides. Ammonium salts of carboxylic acids can be dehydrated to amides by heating to 150–200 °C as long as no thermally sensitive groups are present.
- Amino acids, using Strecker amino-acid synthesis
- Acrylonitrile, in the Sohio process
Other organonitrogen compounds include alprazolam, ethanolamine, ethyl carbamate and hexamethylenetetramine.
Precursor to inorganic nitrogenous compounds
[edit]Nitric acid is generated via the Ostwald process by oxidation of ammonia with air over a platinum catalyst at 700–850 °C (1,292–1,562 °F), ≈9 atm. Nitric oxide and nitrogen dioxide are intermediate in this conversion:[44]
- NH3 + 2 O2 → HNO3 + H2O
Nitric acid is used for the production of fertilisers, explosives, and many organonitrogen compounds.
The hydrogen in ammonia is susceptible to replacement by a myriad substituents. Ammonia gas reacts with metallic sodium to give sodamide, NaNH2.[38]
With chlorine, monochloramine is formed.
Pentavalent ammonia is known as λ5-amine, nitrogen pentahydride decomposes spontaneously into trivalent ammonia (λ3-amine) and hydrogen gas at normal conditions. This substance was once investigated as a possible solid rocket fuel in 1966.[45]
Ammonia is also used to make the following compounds:
- Hydrazine, in the Olin Raschig process and the peroxide process
- Hydrogen cyanide, in the BMA process and the Andrussow process
- Hydroxylamine and ammonium carbonate, in the Raschig process
- Urea, in the Bosch–Meiser urea process and in Wöhler synthesis
- ammonium perchlorate, ammonium nitrate, and ammonium bicarbonate
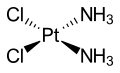
Ammonia is a ligand forming metal ammine complexes. For historical reasons, ammonia is named ammine in the nomenclature of coordination compounds. One notable ammine complex is cisplatin (Pt(NH3)2Cl2, a widely used anticancer drug. Ammine complexes of chromium(III) formed the basis of Alfred Werner's revolutionary theory on the structure of coordination compounds. Werner noted only two isomers (fac- and mer-) of the complex [CrCl3(NH3)3] could be formed, and concluded the ligands must be arranged around the metal ion at the vertices of an octahedron.
Ammonia forms 1:1 adducts with a variety of Lewis acids such as I2, phenol, and Al(CH3)3. Ammonia is a hard base (HSAB theory) and its E & C parameters are EB = 2.31 and CB = 2.04. Its relative donor strength toward a series of acids, versus other Lewis bases, can be illustrated by C-B plots.
Detection and determination
[edit]Ammonia in solution
[edit]Ammonia and ammonium salts can be readily detected, in very minute traces, by the addition of Nessler's solution, which gives a distinct yellow colouration in the presence of the slightest trace of ammonia or ammonium salts. The amount of ammonia in ammonium salts can be estimated quantitatively by distillation of the salts with sodium (NaOH) or potassium hydroxide (KOH), the ammonia evolved being absorbed in a known volume of standard sulfuric acid and the excess of acid then determined volumetrically; or the ammonia may be absorbed in hydrochloric acid and the ammonium chloride so formed precipitated as ammonium hexachloroplatinate, [NH4]2[PtCl6].[46]
Gaseous ammonia
[edit]Sulfur sticks are burnt to detect small leaks in industrial ammonia refrigeration systems. Larger quantities can be detected by warming the salts with a caustic alkali or with quicklime, when the characteristic smell of ammonia will be at once apparent.[46] Ammonia is an irritant and irritation increases with concentration; the permissible exposure limit is 25 ppm, and lethal above 500 ppm by volume.[47] Higher concentrations are hardly detected by conventional detectors, the type of detector is chosen according to the sensitivity required (e.g. semiconductor, catalytic, electrochemical). Holographic sensors have been proposed for detecting concentrations up to 12.5% in volume.[48]
In a laboratorial setting, gaseous ammonia can be detected by using concentrated hydrochloric acid or gaseous hydrogen chloride. A dense white fume (which is ammonium chloride vapor) arises from the reaction between ammonia and HCl(g).[49]
Ammoniacal nitrogen (NH3–N)
[edit]Ammoniacal nitrogen (NH3–N) is a measure commonly used for testing the quantity of ammonium ions, derived naturally from ammonia, and returned to ammonia via organic processes, in water or waste liquids. It is a measure used mainly for quantifying values in waste treatment and water purification systems, as well as a measure of the health of natural and man-made water reserves. It is measured in units of mg/L (milligram per litre).
History
[edit]

The ancient Greek historian Herodotus mentioned that there were outcrops of salt in an area of Libya that was inhabited by a people called the 'Ammonians' (now the Siwa oasis in northwestern Egypt, where salt lakes still exist).[50][51] The Greek geographer Strabo also mentioned the salt from this region. However, the ancient authors Dioscorides, Apicius, Arrian, Synesius, and Aëtius of Amida described this salt as forming clear crystals that could be used for cooking and that were essentially rock salt.[52] Hammoniacus sal appears in the writings of Pliny,[53] although it is not known whether the term is equivalent to the more modern sal ammoniac (ammonium chloride).[21][54][55]
The fermentation of urine by bacteria produces a solution of ammonia; hence fermented urine was used in Classical Antiquity to wash cloth and clothing, to remove hair from hides in preparation for tanning, to serve as a mordant in dying cloth, and to remove rust from iron.[56] It was also used by ancient dentists to wash teeth.[57][58][59]
In the form of sal ammoniac (نشادر, nushadir), ammonia was important to the Muslim alchemists. It was mentioned in the Book of Stones, likely written in the 9th century and attributed to Jābir ibn Hayyān.[60] It was also important to the European alchemists of the 13th century, being mentioned by Albertus Magnus.[21] It was also used by dyers in the Middle Ages in the form of fermented urine to alter the colour of vegetable dyes. In the 15th century, Basilius Valentinus showed that ammonia could be obtained by the action of alkalis on sal ammoniac.[61] At a later period, when sal ammoniac was obtained by distilling the hooves and horns of oxen and neutralizing the resulting carbonate with hydrochloric acid, the name 'spirit of hartshorn' was applied to ammonia.[21][62]
Gaseous ammonia was first isolated by Joseph Black in 1756 by reacting sal ammoniac (ammonium chloride) with calcined magnesia (magnesium oxide).[63][64] It was isolated again by Peter Woulfe in 1767,[65][66] by Carl Wilhelm Scheele in 1770[67] and by Joseph Priestley in 1773 and was termed by him 'alkaline air'.[21][68] Eleven years later in 1785, Claude Louis Berthollet ascertained its composition.[69][21]
The production of ammonia from nitrogen in the air (and hydrogen) was invented by Fritz Haber and Robert LeRossignol. The patent was sent in 1909 (USPTO Nr 1,202,995) and awarded in 1916. Later, Carl Bosch developed the industrial method for ammonia production (Haber–Bosch process). It was first used on an industrial scale in Germany during World War I,[70] following the allied blockade that cut off the supply of nitrates from Chile. The ammonia was used to produce explosives to sustain war efforts.[71] The Nobel Prize in Chemistry 1918 was awarded to Fritz Haber "for the synthesis of ammonia from its elements".
Before the availability of natural gas, hydrogen as a precursor to ammonia production was produced via the electrolysis of water or using the chloralkali process.
With the advent of the steel industry in the 20th century, ammonia became a byproduct of the production of coking coal.
Applications
[edit]Fertiliser
[edit]In the US as of 2019[update], approximately 88% of ammonia was used as fertilisers either as its salts, solutions or anhydrously.[72] When applied to soil, it helps provide increased yields of crops such as maize and wheat.[73] 30% of agricultural nitrogen applied in the US is in the form of anhydrous ammonia, and worldwide, 110 million tonnes are applied each year.[74]Solutions of ammonia ranging from 16% to 25% are used in the fermentation industry as a source of nitrogen for microorganisms and to adjust pH during fermentation.[75]
Refrigeration–R717
[edit]Because of ammonia's vapourization properties, it is a useful refrigerant.[70] It was commonly used before the popularisation of chlorofluorocarbons (Freons). Anhydrous ammonia is widely used in industrial refrigeration applications and hockey rinks because of its high energy efficiency and low cost. It suffers from the disadvantage of toxicity, and requiring corrosion resistant components, which restricts its domestic and small-scale use. Along with its use in modern vapour-compression refrigeration it is used in a mixture along with hydrogen and water in absorption refrigerators. The Kalina cycle, which is of growing importance to geothermal power plants, depends on the wide boiling range of the ammonia–water mixture.
Ammonia coolant is also used in the radiators aboard the International Space Station in loops that are used to regulate the internal temperature and enable temperature-dependent experiments.[76][77] The ammonia is under sufficient pressure to remain liquid throughout the process. Single-phase ammonia cooling systems also serve the power electronics in each pair of solar arrays.
The potential importance of ammonia as a refrigerant has increased with the discovery that vented CFCs and HFCs are potent and stable greenhouse gases.[78]
Antimicrobial agent for food products
[edit]As early as in 1895, it was known that ammonia was 'strongly antiseptic ... it requires 1.4 grams per litre to preserve beef tea (broth).'[79] In one study, anhydrous ammonia destroyed 99.999% of zoonotic bacteria in three types of animal feed, but not silage.[80][81] Anhydrous ammonia is currently used commercially to reduce or eliminate microbial contamination of beef.[82][83]Lean finely textured beef (popularly known as 'pink slime') in the beef industry is made from fatty beef trimmings (c. 50–70% fat) by removing the fat using heat and centrifugation, then treating it with ammonia to kill E. coli. The process was deemed effective and safe by the US Department of Agriculture based on a study that found that the treatment reduces E. coli to undetectable levels.[84] There have been safety concerns about the process as well as consumer complaints about the taste and smell of ammonia-treated beef.[85]
Fuel
[edit]
Ammonia has been used as fuel, and is a proposed alternative to fossil fuels and hydrogen. Being liquid at ambient temperature under its own vapour pressure and having high volumetric and gravimetric energy density, ammonia is considered a suitable carrier for hydrogen,[86] and may be cheaper than direct transport of liquid hydrogen.[87]
Compared to hydrogen, ammonia is easier to store. Compared to hydrogen as a fuel, ammonia is much more energy efficient, and could be produced, stored and delivered at a much lower cost than hydrogen, which must be kept compressed or as a cryogenic liquid.[88][89] The raw energy density of liquid ammonia is 11.5 MJ/L,[88] which is about a third that of diesel.
Ammonia can be converted back to hydrogen to be used to power hydrogen fuel cells, or it may be used directly within high-temperature solid oxide direct ammonia fuel cells to provide efficient power sources that do not emit greenhouse gases.[90][91] Ammonia to hydrogen conversion can be achieved through the sodium amide process[92] or the catalytic decomposition of ammonia using solid catalysts.[93]

Ammonia engines or ammonia motors, using ammonia as a working fluid, have been proposed and occasionally used.[94] The principle is similar to that used in a fireless locomotive, but with ammonia as the working fluid, instead of steam or compressed air. Ammonia engines were used experimentally in the 19th century by Goldsworthy Gurney in the UK and the St. Charles Avenue Streetcar line in New Orleans in the 1870s and 1880s,[95] and during World War II ammonia was used to power buses in Belgium.[96]
Ammonia is sometimes proposed as a practical alternative to fossil fuel for internal combustion engines.[96][97][98][99] However, ammonia cannot be easily used in existing Otto cycle engines because of its very narrow flammability range. Despite this, several tests have been run.[100][101][102] Its high octane rating of 120[103] and low flame temperature[104] allows the use of high compression ratios without a penalty of high NOx production. Since ammonia contains no carbon, its combustion cannot produce carbon dioxide, carbon monoxide, hydrocarbons, or soot.
Ammonia production currently creates 1.8% of global CO2 emissions. 'Green ammonia' is ammonia produced by using green hydrogen (hydrogen produced by electrolysis), whereas 'blue ammonia' is ammonia produced using blue hydrogen (hydrogen produced by steam methane reforming where the carbon dioxide has been captured and stored).[105]
Rocket engines have also been fueled by ammonia. The Reaction Motors XLR99 rocket engine that powered the X-15 hypersonic research aircraft used liquid ammonia. Although not as powerful as other fuels, it left no soot in the reusable rocket engine, and its density approximately matches the density of the oxidiser, liquid oxygen, which simplified the aircraft's design.
In 2020, Saudi Arabia shipped 40 metric tons of liquid 'blue ammonia' to Japan for use as a fuel.[106] It was produced as a by-product by petrochemical industries, and can be burned without giving off greenhouse gases. Its energy density by volume is nearly double that of liquid hydrogen. If the process of creating it can be scaled up via purely renewable resources, producing green ammonia, it could make a major difference in avoiding climate change.[107] The company ACWA Power and the city of Neom have announced the construction of a green hydrogen and ammonia plant in 2020.[108]
Green ammonia is considered as a potential fuel for future container ships. In 2020, the companies DSME and MAN Energy Solutions announced the construction of an ammonia-based ship, DSME plans to commercialize it by 2025.[109] The use of ammonia as a potential alternative fuel for aircraft jet engines is also being explored.[110]
Japan intends to implement a plan to develop ammonia co-firing technology that can increase the use of ammonia in power generation, as part of efforts to assist domestic and other Asian utilities to accelerate their transition to carbon neutrality.[111]In October 2021, the first International Conference on Fuel Ammonia (ICFA2021) was held.[112][113]
In June 2022, IHI Corporation succeeded in reducing greenhouse gases by over 99% during combustion of liquid ammonia in a 2,000-kilowatt-class gas turbine achieving truly CO2-free power generation.[114]In July 2022, Quad nations of Japan, the U.S., Australia and India agreed to promote technological development for clean-burning hydrogen and ammonia as fuels at the security grouping's first energy meeting.[115] As of 2022[update], however, significant amounts of NOx are produced.[116] Nitrous oxide may also be a problem.[117]
At high temperature and in the presence of a suitable catalyst ammonia decomposes into its constituent elements.[118] Decomposition of ammonia is a slightly endothermic process requiring 23 kJ/mol (5.5 kcal/mol) of ammonia, and yields hydrogen and nitrogen gas.
Other
[edit]Remediation of gaseous emissions
[edit]Ammonia is used to scrub SO2 from the burning of fossil fuels, and the resulting product is converted to ammonium sulfate for use as fertiliser. Ammonia neutralises the nitrogen oxide (NOx) pollutants emitted by diesel engines. This technology, called SCR (selective catalytic reduction), relies on a vanadia-based catalyst.[119]
Ammonia may be used to mitigate gaseous spills of phosgene.[120]
Stimulant
[edit]
Ammonia, as the vapour released by smelling salts, has found significant use as a respiratory stimulant. Ammonia is commonly used in the illegal manufacture of methamphetamine through a Birch reduction.[122] The Birch method of making methamphetamine is dangerous because the alkali metal and liquid ammonia are both extremely reactive, and the temperature of liquid ammonia makes it susceptible to explosive boiling when reactants are added.[123]
Textile
[edit]Liquid ammonia is used for treatment of cotton materials, giving properties like mercerisation, using alkalis. In particular, it is used for prewashing of wool.[124]
Lifting gas
[edit]At standard temperature and pressure, ammonia is less dense than atmosphere and has approximately 45–48% of the lifting power of hydrogen or helium. Ammonia has sometimes been used to fill balloons as a lifting gas. Because of its relatively high boiling point (compared to helium and hydrogen), ammonia could potentially be refrigerated and liquefied aboard an airship to reduce lift and add ballast (and returned to a gas to add lift and reduce ballast).[125]
Fuming
[edit]Ammonia has been used to darken quartersawn white oak in Arts & Crafts and Mission-style furniture. Ammonia fumes react with the natural tannins in the wood and cause it to change colour.[126]
Safety
[edit]
The US Occupational Safety and Health Administration (OSHA) has set a 15-minute exposure limit for gaseous ammonia of 35 ppm by volume in the environmental air and an 8-hour exposure limit of 25 ppm by volume.[128] The National Institute for Occupational Safety and Health (NIOSH) recently reduced the IDLH (Immediately Dangerous to Life and Health, the level to which a healthy worker can be exposed for 30 minutes without suffering irreversible health effects) from 500 to 300 based on recent more conservative interpretations of original research in 1943. Other organisations have varying exposure levels. US Navy Standards [U.S. Bureau of Ships 1962] maximum allowable concentrations (MACs): for continuous exposure (60 days) is 25 ppm; for exposure of 1 hour is 400 ppm.[129]
Ammonia vapour has a sharp, irritating, pungent odor that acts as a warning of potentially dangerous exposure. The average odor threshold is 5 ppm, well below any danger or damage. Exposure to very high concentrations of gaseous ammonia can result in lung damage and death.[128] Ammonia is regulated in the US as a non-flammable gas, but it meets the definition of a material that is toxic by inhalation and requires a hazardous safety permit when transported in quantities greater than 3,500 US gallons (13,000 L; 2,900 imp gal).[130]
Liquid ammonia is dangerous because it is hygroscopic and because it can cause caustic burns. See Gas carrier § Health effects of specific cargoes carried on gas carriers for more information.
Toxicity
[edit]The toxicity of ammonia solutions does not usually cause problems for humans and other mammals, as a specific mechanism exists to prevent its build-up in the bloodstream. Ammonia is converted to carbamoyl phosphate by the enzyme carbamoyl phosphate synthetase, and then enters the urea cycle to be either incorporated into amino acids or excreted in the urine.[131] Fish and amphibians lack this mechanism, as they can usually eliminate ammonia from their bodies by direct excretion. Ammonia even at dilute concentrations is highly toxic to aquatic animals, and for this reason it is classified as dangerous for the environment. Atmospheric ammonia plays a key role in the formation of fine particulate matter.[132]
Ammonia is a constituent of tobacco smoke.[133]
Coking wastewater
[edit]Ammonia is present in coking wastewater streams, as a liquid by-product of the production of coke from coal.[134] In some cases, the ammonia is discharged to the marine environment where it acts as a pollutant. The Whyalla Steelworks in South Australia is one example of a coke-producing facility that discharges ammonia into marine waters.[135]
Aquaculture
[edit]Ammonia toxicity is believed to be a cause of otherwise unexplained losses in fish hatcheries. Excess ammonia may accumulate and cause alteration of metabolism or increases in the body pH of the exposed organism. Tolerance varies among fish species.[136] At lower concentrations, around 0.05 mg/L, un-ionised ammonia is harmful to fish species and can result in poor growth and feed conversion rates, reduced fecundity and fertility and increase stress and susceptibility to bacterial infections and diseases.[137] Exposed to excess ammonia, fish may suffer loss of equilibrium, hyper-excitability, increased respiratory activity and oxygen uptake and increased heart rate.[136] At concentrations exceeding 2.0 mg/L, ammonia causes gill and tissue damage, extreme lethargy, convulsions, coma, and death.[136][138] Experiments have shown that the lethal concentration for a variety of fish species ranges from 0.2 to 2.0 mg/L.[138]
During winter, when reduced feeds are administered to aquaculture stock, ammonia levels can be higher. Lower ambient temperatures reduce the rate of algal photosynthesis so less ammonia is removed by any algae present. Within an aquaculture environment, especially at large scale, there is no fast-acting remedy to elevated ammonia levels. Prevention rather than correction is recommended to reduce harm to farmed fish[138] and in open water systems, the surrounding environment.
Storage information
[edit]Similar to propane, anhydrous ammonia boils below room temperature when at atmospheric pressure. A storage vessel capable of 250 psi (1.7 MPa) is suitable to contain the liquid.[139] Ammonia is used in numerous different industrial applications requiring carbon or stainless steel storage vessels. Ammonia with at least 0.2% by weight water content is not corrosive to carbon steel. NH3 carbon steel construction storage tanks with 0.2% by weight or more of water could last more than 50 years in service.[140] Experts warn that ammonium compounds not be allowed to come in contact with bases (unless in an intended and contained reaction), as dangerous quantities of ammonia gas could be released.
Laboratory
[edit]
The hazards of ammonia solutions depend on the concentration: 'dilute' ammonia solutions are usually 5–10% by weight (< 5.62 mol/L); 'concentrated' solutions are usually prepared at >25% by weight. A 25% (by weight) solution has a density of 0.907 g/cm3, and a solution that has a lower density will be more concentrated. The European Union classification of ammonia solutions is given in the table.
| Concentration by weight (w/w) | Molarity | Concentration mass/volume (w/v) | GHS pictograms | H-phrases |
|---|---|---|---|---|
| 5–10% | 2.87–5.62 mol/L | 48.9–95.7 g/L |  | H314 |
| 10–25% | 5.62–13.29 mol/L | 95.7–226.3 g/L |   | H314, H335, H400 |
| >25% | >13.29 mol/L | >226.3 g/L |    | H314, H335, H400, H411 |
The ammonia vapour from concentrated ammonia solutions is severely irritating to the eyes and the respiratory tract, and experts warn that these solutions only be handled in a fume hood. Saturated ('0.880'–see § Properties) solutions can develop a significant pressure inside a closed bottle in warm weather, and experts also warn that the bottle be opened with care. This is not usually a problem for 25% ('0.900') solutions.
Experts warn that ammonia solutions not be mixed with halogens, as toxic and/or explosive products are formed. Experts also warn that prolonged contact of ammonia solutions with silver, mercury or iodide salts can also lead to explosive products: such mixtures are often formed in qualitative inorganic analysis, and that it needs to be lightly acidified but not concentrated (<6% w/v) before disposal once the test is completed.
Laboratory use of anhydrous ammonia (gas or liquid)
[edit]Anhydrous ammonia is classified as toxic (T) and dangerous for the environment (N). The gas is flammable (autoignition temperature: 651 °C) and can form explosive mixtures with air (16–25%). The permissible exposure limit (PEL) in the United States is 50 ppm (35 mg/m3), while the IDLH concentration is estimated at 300 ppm. Repeated exposure to ammonia lowers the sensitivity to the smell of the gas: normally the odour is detectable at concentrations of less than 50 ppm, but desensitised individuals may not detect it even at concentrations of 100 ppm. Anhydrous ammonia corrodes copper- and zinc-containing alloys, which makes brass fittings not appropriate for handling the gas. Liquid ammonia can also attack rubber and certain plastics.
Ammonia reacts violently with the halogens. Nitrogen triiodide, a primary high explosive, is formed when ammonia comes in contact with iodine. Ammonia causes the explosive polymerisation of ethylene oxide. It also forms explosive fulminating compounds with compounds of gold, silver, mercury, germanium or tellurium, and with stibine. Violent reactions have also been reported with acetaldehyde, hypochlorite solutions, potassium ferricyanide and peroxides.
Production
[edit]Graphs are unavailable due to technical issues. There is more info on Phabricator and on MediaWiki.org. |
Ammonia has one of the highest rates of production of any inorganic chemical. Production is sometimes expressed in terms of 'fixed nitrogen'. Global production was estimated as being 160 million tonnes in 2020 (147 tons of fixed nitrogen).[142] China accounted for 26.5% of that, followed by Russia at 11.0%, the United States at 9.5%, and India at 8.3%.[142]
Before the start of World War I, most ammonia was obtained by the dry distillation[143] of nitrogenous vegetable and animal waste products, including camel dung, where it was distilled by the reduction of nitrous acid and nitrites with hydrogen; in addition, it was produced by the distillation of coal, and also by the decomposition of ammonium salts by alkaline hydroxides[144] such as quicklime:[21]
For small scale laboratory synthesis, one can heat urea and calcium hydroxide or sodium hydroxide:
- (NH2)2CO + Ca(OH)2 → CaCO3 + 2 NH3
Haber–Bosch
[edit]
The Haber process,[145] also called the Haber–Bosch process, is the main industrial procedure for the production of ammonia.[146][147] It converts atmospheric nitrogen (N2) to ammonia (NH3) by a reaction with hydrogen (H2) using a finely divided iron metal catalyst:
This reaction is slightly favorable in terms of enthalpy, but is disfavored in terms of entropy because four equivalents of reactant gases are converted into two equivalents of product gas. As a result, high pressures and moderately high temperatures are needed to drive the reaction forward.
The German chemists Fritz Haber and Carl Bosch developed the process in the first decade of the 20th century, and its improved efficiency over existing methods such as the Birkeland-Eyde and Frank-Caro processes was a major advancement in the industrial production of ammonia.[148][149][150] The Haber process can be combined with steam reforming to produce ammonia with just three chemical inputs: water, natural gas, and atmospheric nitrogen. Both Haber and Bosch were eventually awarded the Nobel Prize in Chemistry: Haber in 1918 for ammonia synthesis specifically, and Bosch in 1931 for related contributions to high-pressure chemistry.Electrochemical
[edit]Ammonia can be synthesized electrochemically. The only required inputs are sources of nitrogen (potentially atmospheric) and hydrogen (water), allowing generation at the point of use. The availability of renewable energy creates the possibility of zero emission production.[151][152]
'Green Ammonia' is a name for ammonia produced from hydrogen that is in turn produced from carbon-free sources such as electrolysis of water. Ammonia from this source can be used as a liquid fuel with zero contribution to global climate change.
Another electrochemical synthesis mode involves the reductive formation of lithium nitride, which can be protonated to ammonia, given a proton source, which can be hydrogen. In the early years of the development of this process, ethanol has been used as such a source. The first use of this chemistry was reported in 1930, where lithium solutions in ethanol were used to produce ammonia at pressures of up to 1000 bar.[153] In 1994, Tsuneto et al. used lithium electrodeposition in tetrahydrofuran to synthesize ammonia at more moderate pressures with reasonable Faradaic efficiency.[154] Other studies have since used the ethanol–tetrahydrofuran system for electrochemical ammonia synthesis.[155][156] In 2019, Lazouski et al. proposed a mechanism to explain observed ammonia formation kinetics.[155]
In 2020, Lazouski et al. developed a solvent-agnostic gas diffusion electrode to improve nitrogen transport to the reactive lithium. The study observed NH3 production rates of up to 30 ± 5 nmol/s/cm2 and Faradaic efficiencies of up to 47.5 ± 4% at ambient temperature and 1 bar pressure.[157]
In 2021, Suryanto et al. replaced ethanol with a tetraalkyl phosphonium salt. This cation can stably undergo deprotonation–reprotonation cycles, while it enhances the medium's ionic conductivity.[158] The study observed NH3 production rates of 53 ± 1 nmol/s/cm2 at 69 ± 1% faradaic efficiency experiments under 0.5-bar hydrogen and 19.5-bar nitrogen partial pressure at ambient temperature.[158]
In 2022, Fu et al. reported the production of ammonia via the lithium mediated process in a continuous-flow electrolyzer also demonstrating the hydrogen gas as proton source. The study synthesized ammonia at 61 ± 1% Faradaic efficiency at a current density of −6 mA/cm2 at 1 bar and room temperature.[159]
Biochemistry and medicine
[edit]
Ammonia is essential for life.[161] For example, it is required for the formation of amino acids and nucleic acids, fundamental building blocks of life. Ammonia is however quite toxic. Nature thus uses carriers for ammonia. Within a cell, glutamate serves this role. In the bloodstream, glutamine is a source of ammonia.[162]
Ethanolamine, required for cell membranes, is the substrate for ethanolamine ammonia-lyase, which produces ammonia:[163]
- H2NCH2CH2OH → NH3 + CH3CHO
Ammonia is both a metabolic waste and a metabolic input throughout the biosphere. It is an important source of nitrogen for living systems. Although atmospheric nitrogen abounds (more than 75%), few living creatures are capable of using atmospheric nitrogen in its diatomic form, N2 gas. Therefore, nitrogen fixation is required for the synthesis of amino acids, which are the building blocks of protein. Some plants rely on ammonia and other nitrogenous wastes incorporated into the soil by decaying matter. Others, such as nitrogen-fixing legumes, benefit from symbiotic relationships with rhizobia bacteria that create ammonia from atmospheric nitrogen.[164]
Для человека вдыхание аммиака в высоких концентрациях может быть смертельным. Воздействие аммиака может вызвать головные боли , отеки , нарушение памяти, судороги и кому, поскольку он нейротоксичен по своей природе. [165]
Биосинтез
[ редактировать ]У некоторых организмов аммиак вырабатывается из атмосферного азота с помощью ферментов, называемых нитрогеназами . Общий процесс называется азотфиксацией . Интенсивные усилия были направлены на понимание механизма биологической фиксации азота. Научный интерес к этой проблеме обусловлен необычной структурой активного центра фермента, состоящего из Fe 7 MoS 9 вместе. [166]
Аммиак также является метаболическим продуктом аминокислот дезаминирования , катализируемого такими ферментами, как глутаматдегидрогеназа 1 . Выделение аммиака характерно для водных животных. У человека он быстро превращается в мочевину (в печени ), которая гораздо менее токсична, особенно менее щелочна . Эта мочевина является основным компонентом сухой массы мочи . Большинство рептилий, птиц, насекомых и улиток выделяют мочевую кислоту исключительно в виде азотистых отходов.
Физиология
[ редактировать ]Аммиак играет роль как в нормальной, так и в аномальной физиологии животных . Он биосинтезируется в ходе нормального метаболизма аминокислот и токсичен в высоких концентрациях. Печень цикл преобразует аммиак в мочевину посредством серии реакций, известных как мочевины . Дисфункция печени, например, наблюдаемая при циррозе печени , может привести к повышению количества аммиака в крови ( гипераммониемии ). Аналогичным образом, дефекты ферментов, ответственных за цикл мочевины, таких как орнитинтранскарбамилаза , приводят к гипераммониемии . Гипераммониемия способствует спутанности сознания и коме при печеночной энцефалопатии , а также неврологических заболеваниях, часто встречающихся у людей с нарушениями цикла мочевины и органической ацидурией . [167]
Аммиак важен для нормального кислотно-щелочного баланса животных. После образования аммония из глутамина может α-кетоглутарат разлагаться с образованием двух ионов бикарбоната , которые затем становятся буферами для пищевых кислот. Аммоний выводится с мочой, что приводит к чистой потере кислоты. Аммиак сам может диффундировать через почечные канальцы , соединяться с ионами водорода и, таким образом, способствовать дальнейшему выведению кислоты . [168]
Экскреция
[ редактировать ]Ионы аммония являются токсичными отходами обмена веществ у животных . У рыб и водных беспозвоночных он выделяется непосредственно в воду. У млекопитающих, акул и земноводных он превращается в цикле мочевины в мочевину , которая менее токсична и может храниться более эффективно. У птиц, рептилий и наземных улиток метаболический аммоний превращается в мочевую кислоту , которая является твердой и поэтому может выводиться из организма с минимальной потерей воды. [169]
Внеземное явление
[ редактировать ]
Аммиак был обнаружен в атмосферах планет-гигантов Юпитера , Сатурна , Урана и Нептуна , наряду с другими газами, такими как метан , водород и гелий . Недра Сатурна могут содержать замороженные кристаллы аммиака. [170] Он находится на Деймосе и Фобосе — двух спутниках Марса . [ нужна ссылка ]
Межзвездное пространство
[ редактировать ]Аммиак был впервые обнаружен в межзвездном пространстве в 1968 году по микроволновому излучению со стороны ядра галактики . [171] Это была первая многоатомная молекула, обнаруженная таким образом.Чувствительность молекулы к широкому диапазону возбуждений и легкость ее наблюдения в ряде областей сделали аммиак одной из важнейших молекул для изучения молекулярных облаков . [172] Относительная интенсивность линий аммиака может быть использована для измерения температуры излучающей среды.
Были обнаружены следующие изотопные виды аммиака: НХ3 , 15 НХ3 , НХ 2 Д , НХД 2 и НД 3 . Обнаружение трижды дейтерированного аммиака считалось неожиданностью, поскольку дейтерия относительно мало. Считается, что низкотемпературные условия позволяют этой молекуле выживать и накапливаться. [173]
С момента своего межзвездного открытия, NH 3 оказался бесценным спектроскопическим инструментом при изучении межзвездной среды. При большом количестве переходов, чувствительных к широкому диапазону условий возбуждения, NH 3 был широко обнаружен в астрономии – о его обнаружении сообщалось в сотнях журнальных статей. Ниже приведен образец журнальных статей, в которых освещается диапазон детекторов, которые использовались для идентификации аммиака.
Изучение межзвездного аммиака имело важное значение для ряда областей исследований в последние несколько десятилетий. Некоторые из них описаны ниже и в основном связаны с использованием аммиака в качестве межзвездного термометра.
Механизмы межзвездного образования
[ редактировать ]Межзвездное содержание аммиака было измерено для различных сред. [ NH 3 ]/[ H 2 ] находится в диапазоне от 10 По оценкам, соотношение −7 в маленьких темных облаках [174] до 10 −5 в плотном ядре комплекса молекулярных облаков Ориона . [175] Хотя всего было предложено 18 маршрутов производства, [176] основной механизм образования межзвездных NH 3 – реакция:
- [НХ 4 ] + + и − → NH 3 + Н
Константа скорости k этой реакции зависит от температуры окружающей среды и составляет величину и 10 К. [177] Константу скорости рассчитывали по формуле . Для реакции первичного образования a = 1,05 × 10 −6 и В = -0,47 . Предполагая NH + 4 обилия и содержание электронов 10 −7 типично для молекулярных облаков, формирование будет происходить со скоростью 1,6 × 10 −9 см −3 с −1 в молекулярном облаке общей плотностью 10 5 см −3 . [178]
Все остальные предполагаемые реакции образования имеют константы скорости на 2–13 порядков меньше, что делает их вклад в содержание аммиака относительно незначительным. [179] В качестве примера незначительного вклада других реакций образования можно привести реакцию:
- Н 2 + NH 2 → NH 3 + Н
имеет константу скорости 2,2 × 10 −15 . Предполагая H 2 плотности 10 5 и [ NH 2 ]/[ H 2 ] соотношение 10 −7 , эта реакция протекает со скоростью 2,2 × 10 −12 , более чем на три порядка медленнее, чем первичная реакция, описанная выше.
Некоторые из других возможных реакций образования:
- ЧАС − + [НН 4 ] + → NH 3 + H 2
- [ПНХ 3 ] + + и − → П + NH 3
Механизмы межзвездного разрушения
[ редактировать ]Всего предложено 113 реакций, ведущих к разрушению НХ 3 . Из них 39 были сведены в обширные таблицы химии соединений C, N и O. [180] В обзоре межзвездного аммиака в качестве основных механизмов диссоциации указаны следующие реакции: [172]
| NH3 ] + H3 [ + → [NH 4 ] + + Ч 2 | ( 1 ) |
| NH 3 + HCO + → [NH 4 ] + + СО | ( 2 ) |
с константами скорости 4,39×10 −9 [181] и 2,2×10 −9 , [182] соответственно. Вышеупомянутые уравнения ( 1 , 2 ) выполняются со скоростью 8,8×10 −9 и 4,4×10 −13 , соответственно. В этих расчетах предполагались заданные константы скорости и содержания [ NH 3 ]/[ Ч 2 ] = 10 −5 , [ [Ч 3 ] + ]/[ Ч 2 ] = 2×10 −5 , [ ОЗС + ]/[ Ч 2 ] = 2×10 −9 , а полные плотности n = 10 5 , типичный для холодных, плотных молекулярных облаков. [183] Очевидно, что среди этих двух первичных реакций уравнение ( 1 ) является доминирующей реакцией разрушения со скоростью в ≈10 000 раз быстрее, чем уравнение ( 2 ). Это связано с относительно высокой численностью [Ч 3 ] + .
Обнаружение одной антенны
[ редактировать ]Радионаблюдения NH 3 на 100-метровом радиотелескопе Эффельсберг показывает, что линия аммиака разделена на два компонента — фоновый гребень и неразрешенное ядро. Фон хорошо соответствует местам, ранее обнаруженным CO. [184] 25-метровый телескоп Чилболтона в Англии обнаружил радиосигналы аммиака в областях H II , HNH 2 O мазеры , объекты H–H и другие объекты, связанные со звездообразованием. Сравнение ширины эмиссионных линий показывает, что турбулентные или систематические скорости не увеличиваются в центральных ядрах молекулярных облаков. [185]
Микроволновое излучение аммиака наблюдалось в нескольких галактических объектах, включая W3(OH), Орион А , W43 , W51 и пяти источниках в галактическом центре. Высокая скорость обнаружения указывает на то, что это обычная молекула в межзвездной среде и что в галактике распространены области с высокой плотностью. [186]
Интерферометрические исследования
[ редактировать ]ВЛА за наблюдения NH 3 в семи регионах с высокоскоростными газовыми истечениями выявил конденсации менее 0,1 пк в L1551, S140 и Цефее А. В Цефее А обнаружено три отдельных сгущения, одно из них имеет сильно вытянутую форму. Они могут сыграть важную роль в создании биполярного оттока в регионе. [187]
Внегалактический аммиак был получен с помощью VLA в IC 342 . Горячий газ имеет температуру выше 70 К, что было установлено по соотношению линий аммиака и, по-видимому, тесно связано с самыми внутренними частями ядерного бара, наблюдаемого в CO. [188] NH 3 также отслеживался с помощью VLA по выборке из четырех галактических ультракомпактных областей HII: G9.62+0.19, G10.47+0.03, G29.96-0.02 и G31.41+0.31. На основании диагностики температуры и плотности делается вывод, что в целом такие сгустки, вероятно, являются местами массивного звездообразования на ранней стадии эволюции, до развития ультракомпактной области HII. [189]
Инфракрасные обнаружения
[ редактировать ]Поглощение на длине волны 2,97 микрометра, обусловленное твердым аммиаком, было зарегистрировано в межзвездных зернах объекта Беклина-Нойгебауэра и, вероятно, также в NGC 2264-IR. Это обнаружение помогло объяснить физическую форму ранее плохо изученных и связанных с ними линий поглощения льда. [190]
Спектр диска Юпитера был получен из Воздушной обсерватории Койпера и охватывает диапазон от 100 до 300 см. −1 спектральный диапазон. Анализ спектра предоставляет информацию о глобальных средних свойствах газообразного аммиака и аммиачной ледяной дымки. [191]
Всего было исследовано 149 позиций темных облаков на предмет наличия «плотных ядер» с использованием вращающейся инверсионной линии (J,K) = (1,1) NH 3 . Как правило, ядра не имеют сферической формы, а соотношение сторон варьируется от 1,1 до 4,4. Также обнаружено, что ядра со звездами имеют более широкие линии, чем ядра без звезд. [192]
Аммиак был обнаружен в туманности Дракон и в одном или, возможно, двух молекулярных облаках, которые связаны с высокоширотными галактическими инфракрасными перистыми облаками . Это открытие важно, поскольку они могут представлять собой места рождения звезд B-типа с металличностью Популяции I в галактическом гало, которые могли возникнуть в галактическом диске. [193]
Наблюдения близлежащих темных облаков
[ редактировать ]Балансируя вынужденное излучение со спонтанным излучением, можно построить связь между температурой возбуждения и плотностью. Более того, поскольку переходные уровни аммиака при низких температурах можно аппроксимировать двухуровневой системой, этот расчет достаточно прост. Это предположение можно применить к темным облакам, областям, предположительно имеющим чрезвычайно низкие температуры, и возможным местам будущего звездообразования. Обнаружения аммиака в темных облаках показывают очень узкие линии, что указывает не только на низкие температуры, но и на низкий уровень турбулентности внутри облаков. Расчеты соотношения линий обеспечивают измерение температуры облаков, которое не зависит от предыдущих наблюдений CO. Наблюдения за аммиаком согласуются с измерениями CO при температурах вращения ≈10 К. Благодаря этому можно определить плотности, которые, по расчетам, находятся в диапазоне от 10 4 и 10 5 см −3 в темных облаках. Картирование NH 3 дает типичные размеры облаков 0,1 пк и массу около 1 солнечной массы. Эти холодные, плотные ядра являются местами будущего звездообразования.
Регионы UC HII
[ редактировать ]Ультракомпактные регионы HII являются одними из лучших индикаторов звездообразования большой массы. Плотный материал, окружающий области UCHII, вероятно, в основном молекулярный. Поскольку полное изучение процесса формирования массивных звезд обязательно включает в себя облако, из которого образовалась звезда, аммиак является бесценным инструментом в понимании окружающего ее молекулярного материала. Поскольку этот молекулярный материал можно пространственно разрешить, можно ограничить источники нагрева/ионизации, температуру, массу и размеры областей. Компоненты скорости с доплеровским сдвигом позволяют разделить отдельные области молекулярного газа, которые могут отслеживать потоки и горячие ядра, возникающие из формирующихся звезд.
Внегалактическое обнаружение
[ редактировать ]Аммиак был обнаружен во внешних галактиках. [194] [195] а, измеряя одновременно несколько линий, можно напрямую измерить температуру газа в этих галактиках. Соотношения линий подразумевают, что температура газа теплая (≈50 К), происходящая из плотных облаков размером в десятки парсеков. Эта картина согласуется с картиной внутри нашей галактики Млечный Путь – вокруг вновь формирующихся звезд формируются горячие плотные молекулярные ядра, заключенные в более крупные облака молекулярного материала размером в несколько сотен парсеков (гигантские молекулярные облака; GMC).
См. также
[ редактировать ]- Аммиак (страница данных) – Страница химических данных
- Фонтан аммиака - Тип химической демонстрации.
- Производство аммиака – Обзор истории и методов производства NH 3
- Раствор аммиака – химическое соединение
- Стоимость электроэнергии по источникам – Сравнение стоимости различных источников производства электроэнергии.
- Формирующий газ – Смесь водорода и азота.
- Процесс Габера - Промышленный процесс производства аммиака.
- Гидразин – бесцветная легковоспламеняющаяся жидкость с запахом аммиака.
- Очистка воды - процесс удаления примесей из воды.
Ссылки
[ редактировать ]- ^ «НОМЕНКЛАТУРА НЕОРГАНИЧЕСКОЙ ХИМИИ, Рекомендации ИЮПАК 2005 г.» (PDF) . Архивировано (PDF) из оригинала 9 октября 2022 года.
- ^ «Газы – Плотности» . Проверено 3 марта 2016 г.
- ^ Йост, Дон М. (2007). «Аммиак и растворы жидкого аммиака» . Систематическая неорганическая химия . ЧИТАЙТЕ КНИГИ. п. 132. ИСБН 978-1-4067-7302-6 .
- ^ Блюм, Александр (1975). «О кристаллическом характере прозрачного твердого аммиака». Радиационные эффекты и дефекты в твердых телах . 24 (4): 277. Бибкод : 1975РадЭф..24..277Б . дои : 10.1080/00337577508240819 .
- ^ «Аммиак» . Американское химическое общество. 8 февраля 2021 г. Проверено 20 марта 2024 г.
- ^ Перрин, Д.Д., Константы ионизации неорганических кислот и оснований в водном растворе ; 2-е изд., Pergamon Press: Оксфорд, 1982 .
- ^ Ивасаки, Хиродзи; Такахаси, Мицуо (1968). «Исследование транспортных свойств жидкостей при высоком давлении». Обзор физической химии Японии . 38 (1).
- ^ Перейти обратно: а б Зумдал, Стивен С. (2009). Химические принципы 6-е изд . Компания Хоутон Миффлин. п. А22. ISBN 978-0-618-94690-7 .
- ^ «Паспорт безопасности безводного аммиака» (PDF) . Университет Флориды . Проверено 19 апреля 2024 г.
- ^ Перейти обратно: а б «Аммиак» . Непосредственно опасные для жизни и здоровья концентрации (IDLH) . Национальный институт охраны труда и здоровья (NIOSH).
- ^ Sigma-Aldrich Co. , Аммиак .
- ^ Карманный справочник NIOSH по химическим опасностям. «#0028» . Национальный институт охраны труда и здоровья (NIOSH).
- ^ Ричи, Ханна . «Сколько людей кормят синтетическими удобрениями?» . Наш мир в данных . Проверено 4 сентября 2021 г.
- ^ «Дорожная карта технологии производства аммиака – анализ» . 11 октября 2021 г.
- ^ «40 CFR: Приложение A к Части 355 — Список чрезвычайно опасных веществ и их пороговые плановые количества» . Государственная типография .
- ^ «Годовая мощность мирового производства аммиака» .
- ^ «Mitsubishi Heavy Industries BrandVoice: масштабирование производства аммиака для обеспечения мирового производства продовольствия» . Форбс .
- ^ Р. Норрис Шрив ; Джозеф Бринк (1977). Химическая перерабатывающая промышленность (4-е изд.). МакГроу-Хилл. п. 276. ИСБН 978-0-07-057145-7 . См. также Газовоз и Газ в баллонах .
- ^ «Плиний Старший, Естественная история, КНИГА XXXI. СРЕДСТВА, ПОЛУЧЕННЫЕ ИЗ ВОДНОЙ ПРОИЗВОДСТВА, ГЛАВА 39. (7) — РАЗЛИЧНЫЕ ВИДЫ СОЛИ; МЕТОДЫ ЕГО ПРИГОТОВЛЕНИЯ И СРЕДСТВА, ПОЛУЧЕННЫЕ ИЗ НЕЙ. ДВЕСТИ И ЧЕТЫРЕ НАБЛЮДЕНИЯ ПО ТАМ» . www.perseus.tufts.edu .
- ^ Гувер, Герберт (1950). Георгиус Агрикола Де Ре Металлика — Перевод первого латинского издания 1556 года . Нью-Йорк: Dover Publications. п. 560. ИСБН 978-0486600062 .
- ^ Перейти обратно: а б с д и ж г час Чисхолм 1911 , с. 861.
- ^ Шеннон, Фрэнсис Патрик (1938) Таблицы свойств аквааммиачных растворов. Часть 1 Термодинамики абсорбционного охлаждения . Обучение в Университете Лихай. Серия «Наука и технологии»
- ↑ Под ледяной поверхностью Плутона может циркулировать аммиачно-водная суспензия . Университет Пердью (9 ноября 2015 г.)
- ^ «аммиачный (прилаг.)» . Оксфордский словарь английского языка . Июль 2023 г. doi : 10.1093/OED/3565252514 .
- ^ Пимпуткар, Сиддха; Накамура, Сюдзи (январь 2016 г.). «Разложение сверхкритического аммиака и моделирование сверхкритических аммиачно-азотно-водородных растворов с применимостью к аммонотермическим условиям» . Журнал сверхкритических жидкостей . 107 : 17–30. дои : 10.1016/j.supflu.2015.07.032 .
- ^ Хьюат, AW; Рикель, К. (1979). «Кристаллическая структура дейтероаммиака в диапазоне температур от 2 до 180 К путем уточнения профиля нейтронного порошка». Acta Crystallographica Раздел А. 35 (4): 569. Бибкод : 1979AcCrA..35..569H . дои : 10.1107/S0567739479001340 .
- ^ Бийо, Жерар; Демортье, Антуан (декабрь 1975 г.). «Диэлектрическая проницаемость жидкого аммиака от -35 до +50 град. и ее влияние на ассоциацию сольватированных электронов с катионом» . Журнал физической химии . 79 (26): 3053–3055. дои : 10.1021/j100593a053 . ISSN 0022-3654 .
- ^ Аммиак в Линстреме, Питер Дж.; Маллард, Уильям Г. (ред.); Интернет-книга NIST по химии , справочная база данных NIST № 69 , Национальный институт стандартов и технологий, Гейтерсбург (Мэриленд)
- ^ Джепсен, С. Ди; Макгуайр, Кент (27 ноября 2017 г.). «Безопасное обращение с безводным аммиаком» . Расширение Университета штата Огайо .
- ^ «Руководство по медицинскому обращению с аммиаком» . Агентство по регистрации токсичных веществ и заболеваний . 12 января 2017 г.
- ^ Хокинс, Неемия (1909). Механический словарь Хокинса: циклопедия слов, терминов, фраз и данных, используемых в механических искусствах, профессиях и науках . Т. Одель. п. 15.
- ^ Перейти обратно: а б с Нойфельд, Р.; Мишель, Р.; Хербст-Ирмер, Р.; Шёне, Р.; Сталке, Д. (2016). «Введение донора водородной связи в слабонуклеофильное основание Бренстеда: гексаметилдисилазиды щелочных металлов (MHMDS, M = Li, Na, K, Rb и Cs) с аммиаком». хим. Евро. Дж. 22 (35): 12340–12346. дои : 10.1002/chem.201600833 . ПМИД 27457218 .
- ^ Перейти обратно: а б с Комбеллас, К; Кануфи, Ф; Тибо, А (2001). «Растворы сольватированных электронов в жидком аммиаке». Журнал электроаналитической химии . 499 : 144–151. дои : 10.1016/S0022-0728(00)00504-0 .
- ^ Одриет, Людвиг Ф.; Кляйнберг, Джейкоб (1953). Неводные растворители . Нью-Йорк: Джон Уайли и сыновья. п. 45. LCCN 52-12057 .
- ^ Эдвин М. Кайзер (2001). «Кальций-Аммиак». Энциклопедия реагентов для органического синтеза . дои : 10.1002/047084289X.rc003 . ISBN 978-0471936237 .
- ^ Перейти обратно: а б Хейнс, Уильям М., изд. (2013). Справочник CRC по химии и физике (94-е изд.). ЦРК Пресс . стр. 9–26. ISBN 9781466571143 .
- ^ Клитон, CE; Уильямс, Нью-Хэмпшир (1934). «Электромагнитные волны 1,1 см (0 дюймов). Длина волны и спектр поглощения аммиака». Физический обзор . 45 (4): 234. Бибкод : 1934PhRv...45..234C . дои : 10.1103/PhysRev.45.234 .
- ^ Перейти обратно: а б с Чисхолм 1911 , с. 862.
- ^ Бейкер, HB (1894). «Влияние влаги на химические изменения» . Дж. Хим. Соц . 65 : 611–624. дои : 10.1039/CT8946500611 .
- ^ «Аммиак» . ПабХим .
- ^ Кобаяши, Хидеаки; Хаякава, Акихиро; Сомаратне, К.Д. Кункума А.; Окафор, Экенечукву К. (2019). «Наука и техника сжигания аммиака» . Труды Института горения . 37 (1): 109–133. Бибкод : 2019PComI..37..109K . дои : 10.1016/j.proci.2018.09.029 .
- ^ Хан, А.С.; Келли, РД; Чепмен, Канзас; Фентон, Д.Л. (1995). Пределы воспламеняемости аммиачно-воздушных смесей . США: Управление научной и технической информации Министерства энергетики США. ОСТИ 215703 .
- ^ Шреста, Кришна П.; Зейдель, Ларс; Цойх, Томас; Мосс, Фабиан (7 июля 2018 г.). «Подробный кинетический механизм окисления аммиака, включая образование и восстановление оксидов азота» (PDF) . Энергетика и топливо . 32 (10): 10202–10217. doi : 10.1021/acs.energyfuels.8b01056 . ISSN 0887-0624 . S2CID 103854263 . Архивировано (PDF) из оригинала 9 октября 2022 года.
- ^ Холлеман, А.Ф.; Виберг, Э. (2001). Неорганическая химия . Сан-Диего: Академическая пресса. ISBN 978-0-12-352651-9 .
- ^ Стерретт, К.Ф.; Кэрон, AP (1966). «Химия водородосодержащих топлив высокого давления» . Космические лаборатории Нортропа. Архивировано из оригинала 23 августа 2011 года . Проверено 24 декабря 2009 г.
- ^ Перейти обратно: а б Чисхолм 1911 , с. 863.
- ^ (OSHA) Источник: Сакс, Н. Ирвинг (1984) Опасные свойства промышленных материалов . 6-е изд. Ван Ностранд Рейнхольд. ISBN 0-442-28304-0 .
- ^ Уртадо, Х. Л. Мартинес; Лоу, ЧР (2014). «Чувствительные к аммиаку фотонные структуры, изготовленные в нафионовых мембранах с помощью лазерной абляции». Прикладные материалы и интерфейсы ACS . 6 (11): 8903–8908. дои : 10.1021/am5016588 . ISSN 1944-8244 . ПМИД 24803236 .
- ^ Холлеман, А.Ф.; Виберг, Эгон; Виберг, Нильс; Иглсон, Мэри; Брюэр, Уильям; Эйлетт, Бернхард Дж., ред. (2001). Неорганическая химия Холлемана-Вайберга . Сан-Диего, Калифорния. Лондон: Академический. ISBN 978-0-12-352651-9 .
- ^ Геродот с Джорджем Роулинсоном, пер., История Геродота (Нью-Йорк, Нью-Йорк: Tandy-Thomas Co., 1909), том 2, Книга 4, § 181, стр. 304–305.
- ↑ Земля аммониев упоминается в другом месте в « Истории » Геродота и в » Павсания «Описании Греции :
- Геродот с Джорджем Роулинсоном, пер., История Геродота (Нью-Йорк, Нью-Йорк: Tandy-Thomas Co., 1909), том. 1, книга 2, § 42, с. 245 , том. 2, книга 3, § 25, с. 73 и том. 2, книга 3, § 26, с. 74.
- Павсаний с WHS Jones, пер., Описание Греции (Лондон, Англия: William Heinemann Ltd., 1979), том. 2, Книга 3, Гл. 18, § 3, стр. 109 и 111 и т. 18, § 3, с. 4, книга 9, гл. 16, § 1, с. 239.
- ^ Копп, Герман, История химии (Брауншвейг, (Германия): Фридрих Видег и сын, 1845), Часть 3, с. 237. [на немецком языке]
- ^ Чисхолм 1911 цитирует Плиния Нат. Хист. xxxi. 39. См.: Плиний Старший с Джоном Бостоком и Х.Т. Райли, ред., The Natural History (Лондон, Англия: HG Bohn, 1857), vol. 5, книга 31, § 39, с. 502.
- ^ «Сал-аммиак» . Вебминерал . Проверено 7 июля 2009 г.
- ^ Плиний также упомянул, что, когда некоторые образцы того, что якобы было натроном (лат. nitrum , нечистый карбонат натрия), обрабатывались известью (карбонатом кальция) и водой, натрон издавал резкий запах, который некоторые авторы интерпретировали как означающий что натрон либо был хлоридом аммония, либо был им загрязнен. Видеть:
- Плиний с WHS Jones, пер., Естественная история (Лондон, Англия: William Heinemann Ltd., 1963), том. 8, книга 31, § 46, стр. 448–449. Со стр. 448–449: «Adulteratur in Aegypto Calce, deprehenditur gusto. Sinrum enim statim resolvitur, Adulteratum Calce pungit et asperum [или aspersum ] Reddit odorem vehementer». (В Египте его [т. е. натрон] подмешивают известью, что можно определить по вкусу; ибо чистый натрон сразу плавится, а фальсифицированный натрон жалит из-за извести и издает сильный горький запах [или: при разбрызгивании [( aspersum ) с водой] испускает резкий запах])
- Кидд, Джон, Очерки минералогии (Оксфорд, Англия: Н. Блисс, 1809), том. 2, с. 6.
- Мур, Натаниэль Фиш, Древняя минералогия: или Исследование о минеральных веществах, упомянутых древними: ... (Нью-Йорк, Нью-Йорк: G. & C. Carvill & Co., 1834), стр. 96–97.
- ^ См.:
- Форбс, Р.Дж., Исследования в области древних технологий , том. 5, 2-е изд. (Лейден, Нидерланды: Э. Дж. Брилл, 1966), стр. 19 , 48 и 65 .
- Мёллер, Уолтер О., Торговля шерстью в древних Помпеях (Лейден, Нидерланды: EJ Brill, 1976), с. 20.
- Фабер, Джорджия (псевдоним: Гольдшмидт, Гюнтер) (май 1938 г.) «Крашение и дубление в классической древности», Ciba Review , 9 : 277–312. Доступно: Елизаветинский костюм.
- Смит, Уильям, Словарь греческих и римских древностей (Лондон, Англия: Джон Мюррей, 1875 г.), статья: «Фулло» (т. е. фуллеры или отмыватели), стр. 551–553.
- Руссе, Анри (31 марта 1917 г.) «Прачечные древних», Scientific American Supplement , 83 (2152): 197.
- Бонд, Сара Э., Торговля и табу: профессии с сомнительной репутацией в римском Средиземноморье (Анн-Арбор, Мичиган: University of Michigan Press, 2016), с. 112.
- Бинц, Артур (1936) «Древняя и современная [информация] о технологическом использовании мочи», Журнал прикладной химии , 49 (23): 355–360. [на немецком языке]
- Витти, Майкл (декабрь 2016 г.) «Химия мочи в Древнем Риме», Acta Archaeologica , 87 (1): 179–191. Уитти предполагает, что римляне получали аммиак в концентрированной форме, добавляя древесную золу (нечистый карбонат калия ) к моче, ферментированной в течение нескольких часов. При этом струвит (фосфат магния-аммония) осаждается, и выход струвита можно увеличить, обработав раствор выпьем , раствором, богатым магнием, который является побочным продуктом производства соли из морской воды. При обжиге струвита выделяются пары аммиака.
- ^ Ленкейт, Роберта Эдвардс (23 октября 2018 г.). Высокие каблуки и связанные ступни: и другие очерки по повседневной антропологии, второе издание . Уэйвленд Пресс. п. 72. ИСБН 978-1-4786-3841-4 .
- ^ Пердигао, Хорхе (3 августа 2016 г.). Отбеливание зубов: научно обоснованная точка зрения . Спрингер. п. 170. ИСБН 978-3-319-38849-6 .
- ^ Бониц, Майкл; Лопес, Хосе; Беккер, Курт; Томсен, Хауке (9 апреля 2014 г.). Сложная плазма: научные проблемы и технологические возможности . Springer Science & Business Media. п. 465. ИСБН 978-3-319-05437-7 .
- ^ Хак, Сайед Номанул (1995). Имена, природа и вещи: алхимик Джабир ибн Хайян и его Китаб аль-Ахжар (Книга камней) . Спрингер. ISBN 978-0-7923-3254-1 .
- ^ Spiritus salis urinae . карбонат аммония), по-видимому, производился до Валентина, хотя он представил в своей книге новый, более простой метод его приготовления: Valentinus, Basilius, Vier Tractätlein Fr. (дух соли мочи, т. е .. [Четыре очерка брата Василия Валентина...] (Франкфурт-на-Майне, (Германия): Лука Йеннис, 1625), «Supplementum or add» (Дополнение или приложение), стр. 80–81: «Путь к универсальное «Чтобы три камня сошлись». (Путь к Вселенскому, чтобы три камня сошлись.). Из стр. 81: «Дух salis Urinæ готовится долго / но этот процесс легче и ближе к соли Армении, ... Теперь возьмите чистую, красивую армянскую соль армоничную, ничего не сублимируя / поместите ее в колбу / налейте oleum tartari, чтобы/чтобы оно стало похоже на маст или Брей/пусть это произойдет поскорее/для этого тоже был большой/тогда дух Salis Urinaæ скоро будет помещен в шлем Crystallisch..." (Дух соли мочи [т.е. карбонат аммония] требует длительного метода [т.е. процедуры] приготовления; однако этот [т.е. Валентиновский] процесс [начинается] с соли из Армении [т.е. хлорида аммония], однако несколько проще и короче... Теперь возьмите чистую хорошую армянскую соль, не сублимируя всю [ее] и положите ее в [перегонную] колбу, налейте масло винного камня [т. е. углекислый калий, растворившийся только в той воде, которая у него есть; всасывается из воздуха] на него, [чтобы] он [т. е. смесь] стал похож на кашу или пасту; соберите его [т. е. перегонный аппарат ( перегонный куб )] быстро для того [цели] соедините большую приемную колбу; затем вскоре дух соли мочи откладывается в виде кристаллов в «шлеме» [т. е. в отверстии для паров, которое находится наверху перегонной колбы] ...)
См. также: Копп, Герман, Geschichte der Chemie [История химии] (Брауншвейг, (Германия): Фридрих Видег и Зон, 1845), Часть 3, с. 243. [на немецком языке] - ^ Морис П. Кросланд (2004). Исторические исследования на языке химии . Публикации Courier Dover. п. 72. ИСБН 978-0-486-43802-3 .
- ^ Блэк, Джозеф (1893) [1755]. Опыты с белой магнезией, негашеной известью и другими щелочными веществами . Эдинбург: WF Clay.
- ^ Джейкобсон, Марк З. (23 апреля 2012 г.). Загрязнение воздуха и глобальное потепление: история, наука и решения . Издательство Кембриджского университета. ISBN 9781107691155 .
- ^ «Бутылка Вульфа» . Химический мир . Проверено 1 июля 2017 года .
- ^ Вулф, Питер (1 января 1767 г.). «Эксперименты по перегонке кислот, летучих щелочей и т. д., показывающие, как их можно конденсировать без потерь и как таким образом мы можем избежать неприятных и вредных паров: в письме г-на Питера Вулфа, FRS, Джону Эллису, эсквайру; FRS « Философские труды » . 57 : 517–536. Бибкод : 1767RSPT...57..517W . дои : 10.1098/rstl.1767.0052 . ISSN 0261-0523 .
- ^ Урданг, Джордж (1942). Иллюстрированная история жизни аптекаря-химика Карла Вильгельма Шееле . Американский институт истории фармацевтики. hdl : 1811/28946/Pictorial%20Life%20History_Scheele.pdf .
- ^ См.:
- Пристли, Джозеф (1773) «Отрывок из письма мистера Пристли от 14 октября 1773 года» , Observations sur la Physique …, 2 : 389.
- Пристли, Джозеф, Эксперименты и наблюдения над различными видами воздуха , том. 1, 2-е изд. (Лондон, Англия: 1775 г.), Часть 2, § 1: Наблюдения за щелочным воздухом, стр. 163–177.
- Шофилд, Роберт Э., Просвещенный Джозеф Пристли: исследование его жизни и деятельности с 1773 по 1804 год (Университетский парк, Пенсильвания: издательство Пенсильванского государственного университета, 2004), стр. 93–94.
- К 1775 году Пристли заметил, что электричество может разлагать аммиак («щелочной воздух») с образованием легковоспламеняющегося газа (водорода). См.: Пристли, Джозеф, Эксперименты и наблюдения над различными видами воздуха , т. 1, с. 2 (Лондон, Англия: Дж. Джонсон, 1775), стр. 239–240.
- ^ Бертолле (1785) «Анализ летучих щелочей» , Mémoires de l'Académie Royale des Sciences , 316–326.
- ^ Перейти обратно: а б Макс Аппл (2006). «Аммиак». Аммиак, в Энциклопедии промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a02_143.pub2 . ISBN 978-3527306732 .
- ^ Смит, Роланд (2001). Победа над химией . Сидней: МакГроу-Хилл. ISBN 978-0-07-470146-1 .
- ^ «Обзор минеральных товаров за 2020 год, стр. 117 – Азот» (PDF) . Геологическая служба США . 2020. Архивировано (PDF) из оригинала 9 октября 2022 года . Проверено 12 февраля 2020 г.
- ^ Лассалетта, Луис; Биллен, Жиль; Гриззетти, Бруна; Англаде, Джульетта; Гарнье, Жозетт (2014). «50-летние тенденции эффективности использования азота в мировых системах земледелия: взаимосвязь между урожайностью и поступлением азота в пахотные земли» . Письма об экологических исследованиях . 9 (10): 105011. Бибкод : 2014ERL.....9j5011L . дои : 10.1088/1748-9326/9/10/105011 . ISSN 1748-9326 .
- ^ Дэвид Браун (18 апреля 2013 г.). «Безводное аммиачное удобрение: распространено, важно, опасно» . Вашингтон Пост . Проверено 23 апреля 2013 г.
- ^ «Применение безводного аммиака и водного аммиака» . www.mysoreammonia.com . Проверено 2 февраля 2022 г.
- ^ Райт, Джерри (13 апреля 2015 г.). «Система охлаждения обеспечивает безопасность и производительность космической станции» . НАСА . Архивировано из оригинала 12 января 2017 года . Проверено 1 июля 2017 года .
- ^ «Система охлаждения Международной космической станции: как она работает (инфографика)» . Space.com . Проверено 1 июля 2017 года .
- ^ «Сокращение использования и выбросов гидрофторуглеродов (ГФУ) в федеральном секторе посредством SNAP» (PDF) . Архивировано (PDF) из оригинала 9 октября 2022 года . Проверено 2 декабря 2018 г.
- ^ Сэмюэл Ридал (1895). Дезинфекция и дезинфицирующие средства: введение в изучение . Лондон: Чарльз Гриффин и компания. п. 109 .
- ^ Таджкарими, Мехрдад; Риман, HP; Хаджмир, Миннесота; Гомес, Эль; Разавилар, В.; Кливер, DO; и др. (2008). «Обеззараживание кормов для животных аммиаком. Лабораторное исследование». Международный журнал пищевой микробиологии . 122 (1–2): 23–28. doi : 10.1016/j.ijfoodmicro.2007.11.040 . ПМИД 18155794 .
- ^ Ким, Дж.С.; Ли, ГГ; Ким, TH (январь 2016 г.). «Обзор технологии предварительной щелочной обработки биоконверсии лигноцеллюлозной биомассы». Биоресурсные технологии . 199 : 42–48. Бибкод : 2016BiTec.199...42K . doi : 10.1016/j.biortech.2015.08.085 . ПМИД 26341010 .
- ^ « Оценка методов лечения для уменьшения количества бактерий в текстурированной говядине », Дженсен, Джин Л. и др. , Американского общества инженеров сельского хозяйства и биологии , 2009 г. Ежегодное собрание
- ^ Справочный документ: Антимикробные вмешательства в отношении говядины , Дауна Винклер и Керри Б. Харрис, Центр безопасности пищевых продуктов, факультет зоотехники, Техасский университет A&M , май 2009 г., стр. 12
- ^ Мосс, Майкл (3 октября 2009 г.). «Бургер, который разрушил ее жизнь» . Нью-Йорк Таймс .
- ^ Мосс, Майкл (31 декабря 2009 г.). «Безопасность метода переработки говядины поставлена под сомнение» . Нью-Йорк Таймс .
- ^ «MOL изучает концепцию FSRU по аммиаку» . Оффшорная энергетика . 3 февраля 2022 г. Проверено 3 февраля 2022 г.
- ^ Коллинз (l_collins), Ли (27 января 2022 г.). «СПЕЦИАЛЬНЫЙ РЕПОРТАЖ | Почему доставка чистого водорода по всему миру уже может быть мертва в воде | Перезарядка» . Пополнить | Последние новости возобновляемой энергетики . Проверено 3 февраля 2022 г.
- ^ Перейти обратно: а б Лан, Ронг; Тао, Шаньвэнь (28 августа 2014 г.). «Аммиак как подходящее топливо для топливных элементов» . Границы энергетических исследований . 2:35 . дои : 10.3389/fenrg.2014.00035 .
- ^ Линдзон, Джаред (27 февраля 2019 г.). «Он создает новое топливо из воздуха – по 85 центов за галлон» . ОЗЫ . Архивировано из оригинала 26 апреля 2019 года . Проверено 26 апреля 2019 г.
- ^ Гидди, С.; Бадвал, СПС; Маннингс, К.; Долан, М. (10 октября 2017 г.). «Аммиак как средство транспортировки возобновляемой энергии». ACS Устойчивая химия и инженерия . 5 (11): 10231–10239. doi : 10.1021/acssuschemeng.7b02219 .
- ^ Афиф, Ахмед; Раденахмад, Никдилила; Чеок, Квентин; Шамс, Шахриар; Хён Ким, Юнг; Азад, Абул (12 февраля 2016 г.). «Топливные элементы с аммиаком: всесторонний обзор» . Обзоры возобновляемой и устойчивой энергетики . 60 : 822–835. Бибкод : 2016RSERv..60..822A . дои : 10.1016/j.rser.2016.01.120 . Проверено 1 января 2021 г.
- ^ Дэвид, Уильям ИФ; Мейкпис, Джошуа В.; Каллир, Саманта К.; Хантер, Хейзел, Массачусетс; Тейлор, Джеймс Д.; Вуд, Томас Дж.; Джонс, Мартин О. (24 сентября 2014 г.). «Производство водорода из аммиака с использованием амида натрия» . Журнал Американского химического общества . 136 (38): 13082–13085. дои : 10.1021/ja5042836 . ISSN 0002-7863 . ПМИД 24972299 .
- ^ Лучентини, Илария; Гарсиа Колли, Герман; Лузи, Карлос Д.; Серрано, Изабель; Мартинес, Освальдо М.; Лорка, Хорди (5 июня 2021 г.). «Каталитическое разложение аммиака на Ni–Ru, нанесенном на CeO 2 , для производства водорода: влияние загрузки металла и кинетический анализ» . Прикладной катализ Б: Экология . 286 : 119896. Бибкод : 2021AppCB.28619896L . дои : 10.1016/j.apcatb.2021.119896 . hdl : 2117/364129 . ISSN 0926-3373 . S2CID 233540470 .
- ^ Дуглас Селф (1 октября 2007 г.). «Аммиак Моторс» . Проверено 28 ноября 2010 г.
- ^ Луи К. Хенник; Элбридж Харпер Чарльтон (1965). Трамваи Нового Орлеана . Пеликан Паблишинг. стр. 14–16. ISBN 9781455612598 .
- ^ Перейти обратно: а б «Аммиак как транспортное топливо IV» (PDF) . Норм Олсон – Энергетический центр Айовы. 15–16 октября 2007 г. Архивировано из оригинала (PDF) 7 февраля 2012 г.
- ^ Ли, Донын; Мин, Хёнын; Пак, Хёнхо; Сон, Хан Хо (1 ноября 2017 г.). «Разработка новой стратегии сгорания двигателя внутреннего сгорания, работающего на чистом аммиаке» (PDF) . Сеульский национальный университет, факультет машиностроения. Архивировано (PDF) из оригинала 9 октября 2022 года . Проверено 29 января 2019 г.
- ^ Брохи, Эмтиаз Али (2014). «Аммиак как топливо для двигателей внутреннего сгорания?» (PDF) . Технологический университет Чалмерса. Архивировано (PDF) из оригинала 9 октября 2022 года . Проверено 29 января 2019 г.
- ^ Элюсидаре (2 февраля 2008 г.). «Аммиак: Новые возможности хранения и транспортировки водорода» (PDF) . Элюсидаре Лимитед . Архивировано (PDF) из оригинала 8 октября 2010 года.
- ^ Автомобиль с аммиачным двигателем на YouTube
- ^ «Смотрите «Аммиачное топливо» » . Грег Везина . Проверено 7 июля 2009 г.
- ^ «Добро пожаловать в автомобиль NH3» . NH3Car.com .
- ^ «Аммиак» . chm.bris.ac.uk. Проверено 3 марта 2016 г.
- ^ Захаракис-Ютц, Джордж; Конг, Сон-Чарнг (2013). «Характеристики двигателя SI с прямым впрыском аммиака» (PDF) . Департамент машиностроения Университета штата Айова. Архивировано (PDF) из оригинала 9 октября 2022 года . Проверено 29 января 2019 г.
- ^ «Зеленый аммиак | Королевское общество» . royalsociety.org .
- ^ «Саудовская Аравия впервые в мире отправила в Японию синий аммиак» . Bloomberg.com . 27 сентября 2020 г. Проверено 28 сентября 2020 г.
- ^ Сервис, Роберт Ф. (12 июля 2018 г.). «Аммиак — возобновляемое топливо, получаемое из солнца, воздуха и воды — может обеспечить энергией земной шар без углерода» . Наука | АААС . Проверено 28 сентября 2020 г.
- ^ «Построит ли Саудовская Аравия крупнейший в мире завод по производству экологически чистого водорода и аммиака?» . Energypost.eu . 17 сентября 2020 г. Проверено 9 октября 2020 г.
- ^ «DSME получила LR AIP для контейнеровоза вместимостью 23 000 TEU, работающего на аммиаке» . Оффшорная энергетика . 6 октября 2020 г. Проверено 9 октября 2020 г.
- ^ «Какие двигатели будут использоваться в самолетах будущего?» . Авиабудущее . 30 марта 2022 г. Проверено 24 мая 2022 г.
- ^ «Япония продвигает технологию совместного сжигания аммиака» . Аргус Медиа . 24 июня 2021 г. Проверено 8 ноября 2021 г.
- ^ «Первая международная конференция по топливному аммиаку 2021» . ИКФА . 6 октября 2021 года. Архивировано из оригинала 7 ноября 2021 года . Проверено 7 ноября 2021 г.
- ^ «Состоялась Первая международная конференция по топливному аммиаку» . МЕТИ, Япония . 12 октября 2021 г. Проверено 7 ноября 2021 г.
- ^ «Выработка электроэнергии без выбросов CO 2 достигнута с помощью первой в мире газовой турбины, использующей 100% жидкий аммиак» (пресс-релиз). Корпорация IHI . 16 июня 2022 г. Проверено 1 июля 2022 г.
- ^ Масая Като (14 июля 2022 г.). «Члены Quad соглашаются продвигать технологию водородного и аммиачного топлива» . Никкей . Проверено 14 июля 2022 г.
- ^ «Об использовании аммиака в качестве топлива – перспектива» (PDF) .
- ^ «Оксиды азота как побочный продукт режимов сгорания аммиака и водорода» (PDF) .
- ^ Уайт, Альфред Х.; Мелвилл, У.М. (апрель 1905 г.). «Разложение аммиака при высоких температурах» . Журнал Американского химического общества . 27 (4): 373–386. дои : 10.1021/ja01982a005 . ISSN 0002-7863 .
- ^ «Дизель: экологичнее, чем вы думаете» . Архивировано из оригинала 10 мая 2008 года . Проверено 7 июля 2009 г.
- ^ «Фосген: Руководство по охране труда и технике безопасности» . Международная программа по химической безопасности . 1998.
- ^ «Затворы резервуаров с безводным аммиаком имеют недостатки» . Газета Сидар-Рапидс . 6 октября 2009 г.
- ^ «Генеральный прокурор штата Иллинойс | Основные понятия о метамфетамине» . Illinoisattorneygeneral.gov. Архивировано из оригинала 10 сентября 2010 года . Проверено 21 мая 2011 г.
- ^ Гринберг, Майкл И. (1 января 2003 г.). Профессиональная, промышленная и экологическая токсикология . Elsevier Науки о здоровье. ISBN 978-0323013406 .
- ^ Влохович, А.; Стельмасиак, Э. (1983). «Изменение тепловых свойств шерсти после обработки нашатырным спиртом». Журнал термического анализа и калориметрии . 26 (1): 17. дои : 10.1007/BF01914084 . S2CID 96930751 .
- ^ Хоркхаймер, Дональд (2005). «Аммиак – решение для дирижаблей, требующих быстрого изменения чистой плавучести» . 5-я конференция AIAA ATIO и 16-я конференция по технологиям систем легче воздуха. И конференции по баллонным системам . дои : 10.2514/6.2005-7393 . ISBN 978-1-62410-067-3 . Проверено 27 октября 2022 г.
- ^ Дымящийся белый дуб . woodweb.com
- ^ Ежегодник полезных ископаемых, том. 3
- ^ Перейти обратно: а б «Часто задаваемые вопросы по токсичному аммиаку» (PDF) . Агентство по регистрации токсичных веществ и заболеваний (ATSDR). Сентябрь 2004 г. Архивировано (PDF) из оригинала 9 октября 2022 г.
- ^ Аммиак , Документация IDLH
- ^ Подпадает ли безводный аммиак под действие Программы разрешений на использование опасных материалов? с сайта Министерства транспорта США (DOT)
- ^ Берг, Дж. М.; Тимочко, Дж.Л.; Страйер, Л. (2002). «23.4: Ион аммония превращается в мочевину у большинства наземных позвоночных». Биохимия (5-е изд.).
- ^ Ван, Минъи; Конг, Вэймэн; Мартен, Руби; Он, Сюй-Чэн; Чен, Дексиан; Пфайфер, Йошка; Хейтто, Арто; Контканен, Дженни; Дада, Лубна; Кюртен, Андреас; Юли-Юути, Тайна (13 мая 2020 г.). «Быстрый рост новых атмосферных частиц за счет конденсации азотной кислоты и аммиака» . Природа . 581 (7807): 184–189. Бибкод : 2020Natur.581..184W . дои : 10.1038/s41586-020-2270-4 . ISSN 1476-4687 . ПМЦ 7334196 . ПМИД 32405020 .
- ^ Тальхаут, Рейнске; Шульц, Томас; Флорек, Ева; Ван Бентем, Ян; Вестер, Пит; Опперхейзен, Антон (2011). «Опасные соединения в табачном дыме» . Международный журнал экологических исследований и общественного здравоохранения . 8 (12): 613–628. дои : 10.3390/ijerph8020613 . ISSN 1660-4601 . ПМК 3084482 . ПМИД 21556207 .
- ^ «Передовые решения по повторному использованию сточных вод коксования в соответствии со стандартами циркуляционных систем охлаждения» . www.wateronline.com . Проверено 16 января 2016 г. .
- ^ Васудеван Раджарам; Субиджой Дутта; Кришна Парамешваран (30 июня 2005 г.). Устойчивая практика горнодобывающей промышленности: глобальная перспектива . ЦРК Пресс. п. 113. ИСБН 978-1-4398-3423-7 .
- ^ Перейти обратно: а б с Орам, Брайан. «Аммиак в подземных водах, стоках и ручьях» . Водный центр . Проверено 3 декабря 2014 г.
- ^ Харгривз, Дж.А.; Такер, CS (2004). Управление аммиаком в рыбных прудах . Южный региональный центр аквакультуры.
- ^ Перейти обратно: а б с Сержант Крис (5 февраля 2014 г.). «Регулирование уровня аммиака в среде аквакультуры» . Вода/Сточные воды . Проверено 3 декабря 2014 г.
- ^ Электронный свод федеральных правил: Архивировано 4 ноября 2011 г. в Wayback Machine . Ecfr.gpoaccess.gov. Проверено 22 декабря 2011 г.
- ^ «Аммиачные резервуары – конструкция из углеродистой и нержавеющей стали» . www.ammoniatanks.com . Проверено 28 июня 2021 г.
- ^ «Статистика и информация по азоту Геологическая служба США» . www.usgs.gov . Проверено 24 января 2023 г.
- ^ Перейти обратно: а б «Азот (фиксированный) – аммиак (2022 г.)» (PDF) . Национальный информационный центр США по минералам . Проверено 24 января 2023 г.
- ^ «Нобелевская премия по химии (1918 г.) – процесс Габера-Боша» . Проверено 7 июля 2009 г.
- ^ «Химия элементов 2 группы – Be, Mg, Ca, Sr, Ba, Ra» . BBC.co.uk. Проверено 7 июля 2009 г.
- ^ Габерс – химический процесс . Индия: публикации Ариханта. 2018. с. 264. ИСБН 978-93-131-6303-9 .
- ^ Аппл, М. (1982). «Процесс Габера-Боша и развитие химической технологии». Век химической инженерии . Нью-Йорк: Пленум Пресс. стр. 29–54. ISBN 978-0-306-40895-3 .
- ^ Аппл, Макс (2006). «Аммиак». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a02_143.pub2 . ISBN 978-3527306732 .
- ^ Смиль, Вацлав (2004). Обогащение Земли: Фриц Хабер, Карл Бош и трансформация мирового производства продуктов питания (1-е изд.). Кембридж, Массачусетс: Массачусетский технологический институт. ISBN 978-0-262-69313-4 .
- ^ Хагер, Томас (2008). Алхимия воздуха: еврейский гений, обреченный магнат и научное открытие, которое накормило мир, но способствовало возвышению Гитлера (1-е изд.). Нью-Йорк, Нью-Йорк: Книги Гармонии. ISBN 978-0-307-35178-4 .
- ^ Ситтиг, Маршалл (1979). Промышленность удобрений: процессы, контроль загрязнения и энергосбережение . Noyes Data Corp. Парк-Ридж, Нью-Джерси: ISBN 978-0-8155-0734-5 .
- ^ Лаварс, Ник (30 ноября 2021 г.). «Прорыв в области электролиза зеленого аммиака может окончательно убить Хабера-Боша» . Новый Атлас . Архивировано из оригинала 30 ноября 2021 года . Проверено 3 декабря 2021 г.
- ^ Блейн, Лоз (19 ноября 2021 г.). «FuelPositive обещает, что зеленый аммиак будет стоить 60% от стоимости сегодняшнего серого» . Новый Атлас . Архивировано из оригинала 19 ноября 2021 года . Проверено 3 декабря 2021 г.
- ^ Фихтер, г-жа; Жирар, Пьер; Эрленмейер, Ганс (1 декабря 1930 г.). «Электролитическое связывание сжатого азота при обычной температуре» . Helvetica Chimica Acta . 13 (6): 1228–1236. дои : 10.1002/hlca.19300130604 .
- ^ Цунето, Акира; Кудо, Акихико; Саката, Тадаёси (4 марта 1994 г.). «Литий-опосредованное электрохимическое восстановление N2 под высоким давлением до NH3» . Журнал электроаналитической химии . 367 (1): 183–188. дои : 10.1016/0022-0728(93)03025-К . ISSN 1572-6657 .
- ^ Перейти обратно: а б Лазовский, Никифар; Шиффер, Закари Дж.; Уильямс, Киндл; Мантирам, Картиш (17 апреля 2019 г.). «Понимание непрерывного электрохимического восстановления азота, опосредованного литием» . Джоуль . 3 (4): 1127–1139. Бибкод : 2019Джоуль...3.1127L . дои : 10.1016/j.joule.2019.02.003 . ISSN 2542-4351 . S2CID 107985507 .
- ^ Андерсен, Сюзанна З.; Чолич, Виктор; Ян, Сунгын; Швальбе, Джей А.; Ниландер, Адам С.; Макинани, Джошуа М.; Энемарк-Расмуссен, Каспер; Бейкер, Джон Г.; Сингх, Ааюш Р.; Рор, Брайан А.; Статт, Майкл Дж. (июнь 2019 г.). «Строгий протокол электрохимического синтеза аммиака с количественными изотопными измерениями» . Природа . 570 (7762): 504–508. Бибкод : 2019Natur.570..504A . дои : 10.1038/s41586-019-1260-x . hdl : 10044/1/72812 . ISSN 1476-4687 . ПМИД 31117118 . S2CID 162182383 .
- ^ Лазовский, Никифар; Чунг, Минджу; Уильямс, Киндл; Гала, Михал Л.; Мантирам, Картиш (1 мая 2020 г.). «Неводные газодиффузионные электроды для быстрого синтеза аммиака из азота и водорода, полученного расщеплением воды» . Природный катализ . 3 (5): 463–469. дои : 10.1038/s41929-020-0455-8 . ISSN 2520-1158 . S2CID 218495730 .
- ^ Перейти обратно: а б Сурианто, Брайан Х.Р.; Матушек, Каролина; Чой, Дже Чоль; Ходжеттс, Ребекка Ю.; Ду, Хоанг-Лонг; Баккер, Хасинта М.; Канг, Колин С.М.; Черепанов Павел Владимирович; Симонов Александр Н.; Макфарлейн, Дуглас Р. (11 июня 2021 г.). «Восстановление азота до аммиака с высокой эффективностью и скоростью на основе фосфониевого протонного челнока» . Наука . 372 (6547): 1187–1191. Бибкод : 2021Sci...372.1187S . дои : 10.1126/science.abg2371 . ISSN 0036-8075 . ПМИД 34112690 . S2CID 235396282 .
- ^ Фу, Сяньбяо; Педерсен, Якоб Б.; Чжоу, Юаньюань; Саккоччо, Маттиа; Ли, Шаофэн; Сажинас, Рокас; Ли, Катя; Андерсен, Сюзанна З.; Сюй, Аони; Дайслер, Никлас Х.; Майгинд, Джон Бьярке Валбек; Вэй, Чао; Кибсгаард, Якоб; Весборг, Питер С.К.; Норсков, Йенс К.; Чоркендорфф, Иб (16 февраля 2022 г.). «Непрерывный электросинтез аммиака восстановлением азота и окислением водорода» . Наука . 379 (6633): 707–712. doi : 10.1126/science.adf4403 . ПМИД 36795804 .
- ^ Рот, Карл С. «Специализации электронной медицины> Метаболические заболевания> Гипераммониемия» . Проверено 7 июля 2009 г.
- ^ Мохиуддин, СС; Хаттар, Д. (2023). «Биохимия, аммиак» . СтатПерлс . Остров сокровищ. ПМИД 31082083 .
- ^ Нельсон, Дэвид Л.; Кокс, Майкл М. (2005). Принципы биохимии (4-е изд.). Нью-Йорк: WH Freeman. п. 632-633. ISBN 0-7167-4339-6 .
- ^ Сибата, Наоки; Тамагаки, Хироко; Хиеда, Наоки; Акита, Кейта; Комори, Хирофуми; Сёмура, Ясухито; Тераваки, Син-Ичи; Мори, Коичи; Ясуока, Норитаке; Хигучи, Йошики; Торая, Тецуо (2010). «Кристаллические структуры этаноламин-аммиак-лиазы в комплексе с аналогами и субстратами коэнзима B12» . Журнал биологической химии . 285 (34): 26484–26493. дои : 10.1074/jbc.M110.125112 . ПМЦ 2924083 . ПМИД 20519496 .
- ^ Аджей, МБ; Кезенберри, Х.; Шамбли, CG (июнь 2002 г.). «Азотфиксация и инокуляция кормовых бобовых культур» . Расширение МФСА Университета Флориды. Архивировано из оригинала 20 мая 2007 года.
- ^ Выявление прямого воздействия аммиака на мозг - PubMed.
- ^ Игараси, Роберт Ю.; Ларюхин Михаил; Дос Сантос, Патрисия К.; Ли, Хонг-Ин; Дин, Деннис Р.; Зеефельдт, Лэнс К.; Хоффман, Брайан М. (май 2005 г.). «Захват H-, связанного с активным сайтом FeMo-кофактора нитрогеназы во время эволюции H2: характеристика с помощью ENDOR-спектроскопии». Журнал Американского химического общества . 127 (17): 6231–6241. дои : 10.1021/ja043596p . ПМИД 15853328 .
- ^ Зшоке, Йоханнес; Хоффман, Джордж (2004). Метаболизм вадемекума . Шаттауэр Верлаг. ISBN 978-3794523856 .
- ^ Роуз, Бертон; Хельмут Реннке (1994). Почечная патофизиология . Балтимор: Уильямс и Уилкинс. ISBN 978-0-683-07354-6 .
- ^ Кэмпбелл, Нил А .; Джейн Б. Рис (2002). «44» . Биология (6-е изд.). Сан-Франциско: Pearson Education, Inc., стр. 937–938 . ISBN 978-0-8053-6624-2 .
- ^ Под редакцией Кирка Манселла. Страница изображения предоставлена Лунным и Планетарным институтом. НАСА. « Исследование Солнца НАСА: Мультимедиа: Галерея: Интерьеры газовых гигантов. Архивировано 20 февраля 2006 г. в Wayback Machine ». Проверено 26 апреля 2006 г.
- ^ Чунг, AC; Ранг, DM; Таунс, Швейцария; Торнтон, Д.Д.; Уэлч, WJ (1968). «Обнаружение молекул NH 3 в межзвездной среде по их микроволновому излучению». Физ. Преподобный Летт . 21 (25): 1701. Бибкод : 1968PhRvL..21.1701C . doi : 10.1103/PhysRevLett.21.1701 .
- ^ Перейти обратно: а б Хо, ПТП; Таунс, Швейцария (1983). «Межзвездный аммиак». Анну. Преподобный Астрон. Астрофизика . 21 (1): 239–70. Бибкод : 1983ARA&A..21..239H . дои : 10.1146/annurev.aa.21.090183.001323 .
- ^ Миллар, Ти Джей (2003). «Фракционирование дейтерия в межзвездных облаках». Обзоры космической науки . 106 (1): 73–86. Бибкод : 2003ССРв..106...73М . дои : 10.1023/А:1024677318645 . S2CID 189793190 .
- ^ Унгерехтс, Х.; Уолмсли, CM; Винневиссер, Г. (1980). «Наблюдения за аммиаком и цианоацетиленом в ядре высокой плотности L-183 (L-134-N)» . Астрон. Астрофизика . 88 : 259. Бибкод : 1980A&A....88..259U .
- ^ Гензель, Р.; Даунс, Д.; Хо, ПТП (1982). «NH 3 в Орион-КЛ – новая интерпретация». Астрофизический журнал . 259 : Л103. Бибкод : 1982ApJ...259L.103G . дои : 10.1086/183856 .
- ^ «Данные UMIST по астрохимии» . Проверено 7 июля 2009 г.
- ^ Викор, Л.; Аль-Халили, А.; Данаред, Х.; Джурич, Н.; Данн, GH; Ларссон, М.; Ле Паделлек, А.; Розен, С.; Аф Угглас, М. (1999). «Разветвленные фракции диссоциативной рекомбинации молекулярных ионов NH4+ и NH2+» . Астрономия и астрофизика . 344 : 1027. Бибкод : 1999A&A...344.1027V .
- ^ ван Дишок, EF; Блэк, Дж. Х. (1986). «Комплексные модели диффузных межзвездных облаков - Физические условия и содержание молекул» (PDF) . Астрофиз. J. Приложение. Сер . 62 : 109–145. Бибкод : 1986ApJS...62..109V . дои : 10.1086/191135 . HDL : 1887/1980 .
- ^ «astrochemistry.net» . astrochemistry.net . Проверено 21 мая 2011 г.
- ^ Прасад, СС; Охотница, WT (1980). «Модель химии газовой фазы в межзвездных облаках» . Серия дополнений к астрофизическому журналу . 43 : 1. Бибкод : 1980ApJS...43....1P . дои : 10.1086/190665 .
- ^ Лайнингер, В.; Олбриттон, ДЛ; Фесенфельд, ФК; Шмельтекопф, Алабама; Фергюсон, Э.Э. (1975). «Измерения в проточно-дрейфовой трубке зависимостей от кинетической энергии некоторых констант скорости экзотермического переноса протонов». Дж. Хим. Физ . 62 (9): 3549. Бибкод : 1975ЖЧФ..62.3549Л . дои : 10.1063/1.430946 .
- ^ Смит, Д.; Адамс, Н.Г. (1977). «Реакции CH + н- ИОНЫ с аммиаком при 300 К». Chemical Physics Letters . 47 (1): 145. Bibcode : 1977CPL....47..145S . doi : 10.1016/0009-2614(77)85326-8 .
- ^ Вутен, А.; Бозян, Е.П.; Гарретт, Д.Б. (1980). «Обнаружение C 2 H в холодных темных облаках». Астрофизический журнал . 239 : 844. Бибкод : 1980ApJ...239..844W . дои : 10.1086/158168 .
- ^ Уилсон, ТЛ; Даунс, Д.; Бигинг, Дж. (1979). «Аммиак в Орионе». Астрономия и астрофизика . 71 (3): 275. Бибкод : 1979A&A....71..275W .
- ^ Макдональд, GH; Литтл, LT; Браун, AT; Райли, PW; Мэтисон, Д.Н.; Фелли, М. (1981). «Обнаружение новых источников аммиака» . МНРАС . 195 (2): 387. Бибкод : 1981MNRAS.195..387M . дои : 10.1093/mnras/195.2.387 .
- ^ Моррис, М.; Цукерман, Б.; Палмер, П.; Тернер, Б.Э. (1973). «Межзвездный аммиак». Астрофизический журнал . 186 : 501. Бибкод : 1973ApJ...186..501M . дои : 10.1086/152515 .
- ^ Торреллес, Дж. М.; Хо, ПТП; Родригес, LF; Канто, Дж. (1985). «Наблюдения VLA за аммиаком и континуумом в регионах с высокоскоростными истечениями газов». Астрофизический журнал . 288 : 595. Бибкод : 1985ApJ...288..595T . дои : 10.1086/162825 . S2CID 123014355 .
- ^ Хо, ПТП; Мартин, Р.Н.; Тернер, Дж.Л.; Джексон, Дж. М. (1990). «VLA-изображения внегалактического аммиака - горячий газ в ядре IC 342» . Письма астрофизического журнала . 355 : Л19. Бибкод : 1990ApJ...355L..19H . дои : 10.1086/185728 .
- ^ Чезарони, Р.; Черчвелл, Э.; Хофнер, П.; Уолмсли, CM; Курц, С. (1994). «Горячий аммиак к компактным областям HII». Астрономия и астрофизика . 288 : 903. Бибкод : 1994A&A...288..903C .
- ^ Кнаке, РФ; МакКоркл, С.; Пуэттер, Р.К.; Эриксон, EF; Кречмер, В. (1982). «Наблюдение межзвездного аммиачного льда» . Астрофизический журнал . 260 : 141. Бибкод : 1982ApJ...260..141K . дои : 10.1086/160241 .
- ^ Ортон, Г.С.; Ауманн, Х.Х.; Мартончик, СП; Эпплби, Дж. Ф. (1982). «Аэроспектроскопия Юпитера в диапазоне 100–300 см». −1 регион: Глобальные свойства газообразного аммиака и ледяной дымки». Icarus . 52 (1): 81. Bibcode : 1982Icar...52...81O . doi : 10.1016/0019-1035(82)90170-1 .
- ^ Бенсон, П.Дж.; Майерс, П. (1989). «Обзор плотных ядер в темных облаках» . Серия дополнений к астрофизическому журналу . 71 : 89. Бибкод : 1989ApJS...71...89B . дои : 10.1086/191365 .
- ^ Мебольд, У.; Хайтхаузен, А.; Рейф, К. (1987). «Аммиак в галактическом гало и инфракрасных перистых облаках». Астрономия и астрофизика . 180 : 213. Бибкод : 1987A&A...180..213M .
- ^ Мартин, Р.Н.; Хо, ПТП (1979). «Обнаружение внегалактического аммиака». Астрономия и астрофизика . 74 (1): Л7. Бибкод : 1979A&A....74L...7M .
- ^ Такано, С.; Накаи, Н.; Кавагути, К. (1 апреля 2002 г.). «Наблюдения аммиака во внешних галактиках I. NGC 253 и M 82» . Публикации Астрономического общества Японии . 54 (2): 195–207. Бибкод : 2002PASJ...54..195T . дои : 10.1093/pasj/54.2.195 .
Цитируемые работы
[ редактировать ]- «Аквааммиак» . airgasspecialtyproducts.com. Архивировано из оригинала 19 ноября 2010 года . Проверено 28 ноября 2010 г.
- В эту статью включен текст из публикации, которая сейчас находится в свободном доступе : Чисхолм, Хью , изд. (1911). « Аммиак » энциклопедия Британская Том. 1 (11-е изд.). Издательство Кембриджского университета. стр. 100-1 861–863.
- Кларк, Джим (апрель 2013 г.) [2002]. «Габеровский процесс» . Проверено 15 декабря 2018 г.
Дальнейшее чтение
[ редактировать ]- Бретерик, Л., изд. (1986). Опасности в химической лаборатории (4-е изд.). Лондон: Королевское химическое общество. ISBN 978-0-85186-489-1 . OCLC 16985764 .
- Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . ISBN 978-0-08-037941-8 .
- Хаускрофт, CE; Шарп, AG (2000). Неорганическая химия (1-е изд.). Нью-Йорк: Прентис Холл. ISBN 978-0-582-31080-3 .
- Уэст, RC, изд. (1972). Справочник по химии и физике (53-е изд.). Кливленд, Огайо: Chemical Rubber Co.
Внешние ссылки
[ редактировать ]- Международная карта химической безопасности 0414 (безводный аммиак), ilo.org.
- Международная карта химической безопасности 0215 (водные растворы), ilo.org.
- CID 222 от PubChem
- «Аммиак и водные растворы» (на французском языке). Национальный институт исследований и безопасности. Архивировано из оригинала 11 декабря 2010 года.
- Экстренное реагирование на выбросы (разливы) аммиачных удобрений для Министерства сельского хозяйства Миннесоты.ammoniaspills.org
- Национальный институт охраны труда и здоровья – Страница аммиака , cdc.gov
- Карманный справочник NIOSH по химическим опасностям – аммиак , cdc.gov
- Аммиак, видео









