Трехатомный водород
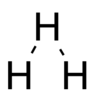 | |
| Идентификаторы | |
|---|---|
3D model ( JSmol ) | |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| HH3 | |
| Молярная масса | 3.024 g·mol −1 |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Трехатомный водород или H 3 представляет собой нестабильную трехатомную молекулу, содержащую только водород . Поскольку эта молекула содержит всего три атома водорода, это простейшая трехатомная молекула. [1] и относительно просто численно решить квантовомеханическое описание частиц. Будучи нестабильной, молекула распадается менее чем за миллионную долю секунды. Его мимолетное время жизни делает его редким, но он довольно часто образуется и разрушается во Вселенной благодаря распространенности триводородного катиона . Инфракрасный спектр H 3 из-за вибрации и вращения очень похож на спектр иона H +
3 . В ранней Вселенной эта способность излучать инфракрасный свет позволяла первичному водороду и гелию охлаждаться и образовывать звезды.
Формирование
[ редактировать ]Нейтральная молекула может образоваться в газоразрядной трубке низкого давления . [2]
Нейтральный пучок H 3 можно сформировать из пучка H +
3 иона проходят через газообразный калий , который отдает электрон иону, образуя K + . [3] Другие газообразные щелочные металлы, такие как цезий , также могут использоваться в качестве донора электронов. [4] ЧАС +
3 иона можно получить в дуоплазматроне , где электрический разряд проходит через молекулярный водород низкого давления. Это приводит к тому, что часть H 2 превращается в H +
2 . Тогда Н 2 + Н +
2 → H +
3 + H. Реакция экзотермическая с энергией 1,7 эВ, поэтому образующиеся ионы горячие и обладают большой колебательной энергией. Они могут остыть за счет столкновений с более холодным газом, если давление достаточно высокое. Это важно, поскольку сильно вибрирующие ионы при нейтрализации в соответствии с принципом Франка-Кондона производят сильно вибрирующие нейтральные молекулы . [3]
Расставаться
[ редактировать ]H 3 может распадаться следующими способами:
- Ч 3 → Ч + 3 + е − [5]
- Ч 3 → Ч + Ч 2
- Ч 3 → 3 Ч
- 2H3 3H2 →
Характеристики
[ редактировать ]Молекула может существовать только в возбужденном состоянии. Различные возбужденные электронные состояния представлены символами внешнего электрона nLΓ, где n — главное квантовое число, L — электронный угловой момент, а Γ — электронная симметрия, выбранная из группы D 3h . Могут быть добавлены дополнительные символы в квадратных скобках, показывающие вибрацию в активной зоне: {s,d л } где s представляет симметричное растяжение, d вырожденную моду и l колебательный угловой момент. Еще один термин может быть вставлен для обозначения молекулярного вращения: (N,G) с N угловым моментом, не считая электронов, проецируемых на ось молекулы, и G - удобное квантовое число Хоугена, определяемое формулой G=l+λ-K. Часто это (1,0), поскольку вращательные состояния ограничены тем, что все составляющие частицы являются фермионами . Примеры таких состояний: [5] 2sA 1 ' 3sA 1 ' 2pA 2 " 3dE' 3DE" 3dA 1 ' 3pe' 3pA 2 ". 2p 2 Состояние 2 " имеет время жизни 700 нс. Если молекула пытается потерять энергию и перейти в отталкивающее основное состояние , она самопроизвольно распадается. Метастабильное состояние с самой низкой энергией, 2sA 1 ', имеет энергию на -3,777 эВ ниже энергии H. +
3 и е − состоянии, но затухает примерно за 1 пс . [5] Нестабильное основное состояние, обозначенное 2p. 2 E' самопроизвольно распадается на молекулу H 2 и атом H. [1] Состояния без вращения имеют более продолжительное время жизни, чем вращающиеся молекулы. [1]
Электронное состояние катиона триводорода с делокализованным вокруг него электроном является ридберговским состоянием . [6]
Внешний электрон может быть повышен до высокого ридберговского состояния и может ионизироваться, если энергия достигнет 29562,6 см-1. −1 выше состояния 2pA 2 ", в этом случае H +
3 формы. [7]
Форма
[ редактировать ]Предполагается, что форма молекулы будет равносторонним треугольником . [1] В молекуле могут возникать колебания двояким образом: во-первых, молекула может расширяться и сжиматься, сохраняя форму равностороннего треугольника (дыхание), либо один атом может перемещаться относительно остальных, искажая треугольник (изгибание). Изгибающая вибрация имеет дипольный момент и, таким образом, связана с инфракрасным излучением. [1]
Спектр
[ редактировать ]Герхард Герцберг был первым, кто обнаружил спектроскопические линии нейтрального H 3 , когда ему было 75 лет в 1979 году. Позже он объявил, что это наблюдение было одним из его любимых открытий. [8] Линии исходили из катодной разрядной трубки. [8] Причина, по которой предыдущие наблюдатели не могли видеть спектральные линии H 3 , заключалась в том, что они были забиты спектром гораздо более распространенного H 2 . Важным достижением было выделение H 3 , чтобы его можно было наблюдать отдельно. При разделении используется масс-спектроскопическое разделение положительных ионов, так что H 3 с массой 3 можно отделить от H 2 с массой 2. Однако все еще существует некоторое загрязнение HD , который также имеет массу 3. [3] Спектр H 3 обусловлен в основном переходами в более долгоживущее состояние 2p 2 А 2 ". Спектр можно измерить двухступенчатым методом фотоионизации. [1]
Переходы опускаются к нижним двойкам 2 На 1' -состояние влияет его очень короткое время жизни, что называется предиссоциацией . Спектральные линии, участвующие в этом процессе, уширены. [3] В спектре присутствуют полосы вращения с ветвями PQ и R. Ветвь R очень слаба у H3 изотопомера , но сильна у D3 ( тридейтерия). [3]
| нижний штат | верхнее электронное состояние | дыхательная вибрация | изгибная вибрация | угловой момент | G=λ+l 2 -К | волновое число см −1 [1] | длина волны Å | частота ТГц | энергия эВ |
|---|---|---|---|---|---|---|---|---|---|
| 2р 2 А 2 " | 3 с 2 А 1 ' | 0 | 0 | 16695 | 5990 | 500.5 | 2.069 | ||
| 3d 2 А" | 0 | 0 | 17297 | 5781 | 518.6 | 2.1446 | |||
| 3d 2 А 1 ' | 0 | 0 | 17742 | 5636 | 531.9 | 2.1997 | |||
| 3р 2 И' | 1 | 1 | 18521 | 5399 | 555.2 | 2.2963 | |||
| 3р 2 А 2 " | 0 | 1 | 19451 | 5141.1 | 583.1 | 2.4116 | |||
| 3d 2 И' | 0 | 1 | 19542 | 5117 | 585.85 | 2.4229 | |||
| 3 с 2 А 1 ' | 1 | 0 | 19907 | 5023.39 | 596.8 | 2.46818 | |||
| 3р 2 И' | 0 | 3 | 19994 | 5001.58 | 599.48 | 2.47898 | |||
| 3d 2 Э" | 1 | 0 | 20465 | 4886.4 | 613.524 | 2.5373 | |||
| 2 с 2 А 1 ' | 3р 2 И' | 14084 | 7100 | 422.2 | 1.746 | ||||
| 3р 2 А 2 " | группа | 17857 | 5600 | 535 | 2.2 | ||||
| 3р 2 2 - дюймовая Q-ветвь | все наложено | группа | 17787 | 5622 | 533 | 2.205 |
Симметричная мода растяжения имеет волновое число 3213,1 см. −1 для 3-х 2 Уровень 1 фут и 3168 см. −1 для 3д 2 Е" и 3254 см. −1 за 2р 2 А 2 ". [1] Частоты деформационных колебаний также весьма схожи с таковыми для H +
3 . [1]
Уровни
[ редактировать ]| электронное государство | примечание | волновое число см −1 [1] | частота ТГц | энергия эВ | жизнь нс [ нужна ссылка ] |
|---|---|---|---|---|---|
| 3d 2 А 1 ' | 18511 | 554.95 | 2.2951 | 12.9 | |
| 3d 2 Э" | 18409 | 551.89 | 2.2824 | 11.9 | |
| 3d 2 И' | 18037 | 540.73 | 2.2363 | 9.4 | |
| 3р 2 А 2 " | 17789 | 533.30 | 2.2055 | 41.3 4.1 | |
| 3 с 2 А 1 ' | 17600 | 527.638 | 2.1821 | 58.1 | |
| 3р 2 И' | 13961 | 418.54 | 1.7309 | 22.6 | |
| 2р 2 А 2 " | самая длинная жизнь | 993 | 29.76 | 0.12311 | 69700 |
| 2р 2 А 2 " | предиссоциация | 0 | 0 | 0 | 21.8 |
| 2р 2 И' | диссоциация | −16674 | −499.87 | −2.0673 | 0 |
Катион
[ редактировать ]Соответствующий H +
3 Ион является наиболее распространенным молекулярным ионом в межзвездном пространстве. Считается, что он сыграл решающую роль в охлаждении ранних звезд в истории Вселенной благодаря своей способности легко поглощать и излучать фотоны. [9] Одна из важнейших химических реакций в межзвездном пространстве — H. +
3+ и − → H 3 и затем → H 2 + H. [6]
Расчеты
[ редактировать ]Поскольку молекула относительно проста, исследователи попытались вычислить свойства молекулы ab-initio на основе квантовой теории. уравнения Хартри –Фока . Использовались [10]
Естественное явление
[ редактировать ]Трехатомный водород образуется при нейтрализации H +
3 . Этот ион будет нейтрализован в присутствии газов, отличных от He или H 2 , поскольку он может оторвать электрон. Так H 3 образуется в полярных сияниях в ионосфере Юпитера и Сатурна. [11]
История
[ редактировать ]
Джей Джей Томсон заметил H +
3, экспериментируя с положительными лучами . он считал, что это ионизированная форма H 3 . Примерно с 1911 года Он считал, что H 3 является стабильной молекулой, писал и читал об этом лекции. Он заявил, что самый простой способ сделать это — воздействовать на гидроксид калия катодными лучами. [8] В 1913 году Йоханнес Старк предположил, что три ядра водорода и электроны могут образовывать стабильное кольцо. В 1919 году Нильс Бор предложил структуру с тремя ядрами, расположенными по прямой линии, с тремя электронами, вращающимися по кругу вокруг центрального ядра. Он считал, что Х. +
3 был бы нестабильным, но реагирующий H −
2 с Н + может дать нейтральный H 3 . Структура Стэнли Аллена имела форму шестиугольника с чередующимися электронами и ядрами. [8]
В 1916 году Артур Демпстер показал, что газ H 3 нестабилен, но в то же время подтвердил и существование катиона. В 1917 году Джеральд Вендт и Уильям Дуэйн обнаружили, что газообразный водород под воздействием альфа-частиц уменьшается в объеме, и предположили, что двухатомный водород превращается в трехатомный. [8] После этого исследователи подумали, что активный водород может быть трехатомной формой. [8] Жозеф Левин зашел так далеко, что предположил, что системы низкого давления на Земле возникли из-за трехатомного водорода, находящегося высоко в атмосфере. [8] В 1920 году Вендт и Ландауэр назвали вещество «гизоном» по аналогии с озоном и его большей реакционной способностью по сравнению с обычным водородом. [12] Ранее Готфрид Вильгельм Осанн считал, что открыл форму водорода, аналогичную озону, которую он назвал «Озонвассерштофф». Его получали электролизом разбавленной серной кислоты. В те времена никто не знал, что озон трехатомен, поэтому он не объявил о трехатомном водороде. [13] Позже было показано, что это смесь диоксида серы, а не новая форма водорода. [12]
В 1930-х годах было обнаружено, что активный водород представляет собой водород с примесью сероводорода , и ученые перестали верить в трехатомный водород. [8] Квантово-механические расчеты показали, что нейтральный H 3 нестабильен, а ионизированный H +
3 могут существовать. [8] Когда появилась концепция изотопов, такие люди, как Бор, подумали, что может существовать эка-водород с атомным весом 3. Позднее эта идея была доказана существованием трития , но это не было объяснением того, почему наблюдалась молекулярная масса 3. в масс-спектрометрах. [8] Дж. Дж. Томсон позже полагал, что молекула с молекулярной массой 3, которую он наблюдал, представляла собой дейтерид водорода . [13] В туманностях Ориона наблюдались линии, приписываемые небулию , который мог быть новым элементом эка-водородом, особенно когда его атомный вес был рассчитан около 3. Позже было показано, что это ионизированные азот и кислород. [8]
Герхард Герцберг был первым, кто действительно наблюдал спектр нейтрального H 3 , и эта трехатомная молекула была первой, кому удалось измерить ридберговский спектр там, где ее собственное основное состояние было нестабильным. [1]
См. также
[ редактировать ]- Ф.М. Девьен , один из первых, кто изучил энергетические свойства трехатомного водорода.
Ссылки
[ редактировать ]- ^ Перейти обратно: а б с д и ж г час я дж к Лембо, LJ; Х. Хелм; Д.Л. Хуэстис (1989). «Измерение частот колебаний молекулы H 3 методом двухступенчатой фотоионизации». Журнал химической физики . 90 (10): 5299. Бибкод : 1989ЖЧФ..90.5299Л . дои : 10.1063/1.456434 . ISSN 0021-9606 .
- ^ Биндер, Дж.Л.; Филби, Э.А.; Грабб, AC (1930). «Трёхатомный водород». Природа . 126 (3166): 11–12. Бибкод : 1930Natur.126...11B . дои : 10.1038/126011c0 . S2CID 4142737 .
- ^ Перейти обратно: а б с д и Фиггер, Х.; В. Кеттерле; Х. Вальтер (1989). «Спектроскопия трехатомного водорода». Журнал физики Д. 13 (2): 129–137. Бибкод : 1989ZPhyD..13..129F . дои : 10.1007/bf01398582 . ISSN 0178-7683 . S2CID 124478004 .
- ^ Лаперл, Кристофер М; Дженнифер Э. Манн; Тодд Дж. Клементс; Роберт Э. Континетти (2005). «Экспериментальное исследование динамики трехчастичной предиссоциации низколежащих ридберговских состояний H 3 и D 3 » . Физический журнал: серия конференций . 4 (1): 111–117. Бибкод : 2005JPhCS...4..111L . дои : 10.1088/1742-6596/4/1/015 . ISSN 1742-6588 .
- ^ Перейти обратно: а б с Хелм Х. и др.: О связанных состояниях с состояниями континуума в нейтральном трехатомном водороде. в: Диссоциативная рекомбинация , под ред. С. Губерман, Kluwer Academic, Plenum Publishers, США, 275-288 (2003) ISBN 0-306-47765-3
- ^ Перейти обратно: а б Таширо, Мотомичи; Сигэки Като (2002). «Исследование квантовой динамики предиссоциации состояний H 3 Ридберга: важность косвенного механизма». Журнал химической физики . 117 (5): 2053. Бибкод : 2002JChPh.117.2053T . дои : 10.1063/1.1490918 . HDL : 2433/50519 . ISSN 0021-9606 .
- ^ Хельм, Ханспетер (1988). «Измерение потенциала ионизации трехатомного водорода». Физический обзор А. 38 (7): 3425–3429. Бибкод : 1988PhRvA..38.3425H . дои : 10.1103/PhysRevA.38.3425 . ISSN 0556-2791 . ПМИД 9900777 .
- ^ Перейти обратно: а б с д и ж г час я дж к Краг, Хельге (2010). «Детство H 3 и H 3 + " . Астрономия и геофизика . 51 (6): 6.25–6.27. Бибкод : 2010A&G....51f..25K . doi : 10.1111/j.1468-4004.2010.51625.x . ISSN 1366-8781 .
- ^ Шелли Литтин (11 апреля 2012 г.). "Ч 3 + Молекула, создавшая Вселенную» . Архивировано из оригинала 12 февраля 2015 года . Проверено 23 июля 2013 года .
{{cite web}}: CS1 maint: неподходящий URL ( ссылка ) - ^ Дефранчески, М.; М. Суард; Г. Бертье (1984). «Численное решение уравнений Хартри – Фока для многоатомной молекулы: линейный H 3 в импульсном пространстве». Международный журнал квантовой химии . 25 (5): 863–867. дои : 10.1002/qua.560250508 . ISSN 0020-7608 .
- ^ Кейлинг, Андреас; Донован, Эрик; Багеналь, Фрэн; Карлссон, Томас (9 мая 2013 г.). Авроральная феноменология и магнитосферные процессы: Земля и другие планеты . Джон Уайли и сыновья. п. 376. ИСБН 978-1-118-67153-5 . Проверено 18 января 2014 г.
- ^ Перейти обратно: а б Вендт, Джеральд Л.; Ландауэр, Роберт С. (1920). «Трёхатомный водород» . Журнал Американского химического общества . 42 (5): 930–946. дои : 10.1021/ja01450a009 .
- ^ Перейти обратно: а б Краг, Хельге (2011). «Спорная молекула: ранняя история трехатомного водорода». Центавр . 53 (4): 257–279. дои : 10.1111/j.1600-0498.2011.00237.x . ISSN 0008-8994 .
Внешние ссылки
[ редактировать ]- К.Г. Грин: « Ридберговские состояния трёхатомного водорода ».
- Неуловимая H 3 молекула GlusteeXD 2009 (юмор)
- Экесан, Солен; Кале, Сейит; Херцфельд, Джудит (5 мая 2014 г.). «Переносные псевдоклассические электроны для ауфбау атомарных ионов» . Журнал вычислительной химии . 35 (15): 1159–1164. дои : 10.1002/jcc.23612 . ПМК 4119322 . ПМИД 24752384 .
- Чакраборти, Ромит; Мацциотти, Дэвид А. (5 октября 2015 г.). «Структура одноэлектронной приведенной матрицы плотности из обобщенного принципа исключения Паули». Международный журнал квантовой химии . 115 (19): 1305–1310. дои : 10.1002/qua.24934 . Выпуклое множество одноэлектронной приведенной матрицы плотности прикреплено к границе чистого N-представимого множества
- Сайкалли, Ричард Дж. (2015). «Воздействие лазера среднего ИК-диапазона в молекуле H 3 Ридберга и некоторые возможные астрофизические последствия» . Материалы конференции AIP . 1642 (1642): 413–415. Бибкод : 2015AIPC.1642..413S . дои : 10.1063/1.4906707 . S2CID 18158497 . предсказывает, что лазеры H 3 могут существовать в ранней Вселенной