Реакция гидроборирования-окисления
Реакция гидроборирования-окисления — это двухстадийная реакция гидратации превращается , в ходе которой алкен в спирт . [1] В результате процесса происходит син-присоединение водорода и гидроксильной группы там, где двойная связь была . Гидроборирование-окисление - это антимарковниковская реакция, при которой гидроксильная группа присоединяется к менее замещенному углероду. Таким образом, реакция обеспечивает более стереоспецифическую и дополнительную региохимическую альтернативу другим реакциям гидратации, таким как катализируемое кислотой присоединение и процесс оксимеркурации-восстановления . Впервые о реакции сообщил Герберт К. Браун в конце 1950-х годов. [2] и это было отмечено получением им Нобелевской премии по химии в 1979 году.
Общий вид реакции следующий:

Тетрагидрофуран (ТГФ) является основным растворителем, используемым для гидроборирования.
Механизм и сфера применения [ править ]
Этап гидроборации [ править ]
На первом этапе боран (BH 3 ) присоединяется к двойной связи , перенося один из атомов водорода на углерод, соседний с тем, который становится связанным с бором . Это гидроборирование повторяется еще два раза, последовательно реагируя на каждую связь B–H так, что к каждой BH 3 присоединяются три алкена . Полученный триалкилборан на втором этапе обрабатывают перекисью водорода. Этот процесс заменяет связи BC облигациями HO-C. Борный реагент превращают в борную кислоту . Реакция была первоначально описана Х. К. Брауном в 1957 году для превращения 1-гексена в 1-гексанол . [3]

Зная, что группа, содержащая бор, будет заменена гидроксильной группой, можно видеть, что начальная стадия гидроборирования определяет региоселективность. Гидроборация протекает антимарковниковским путем. Последовательность реакций также стереоспецифична , что приводит к син-присоединению (на одной и той же стороне алкена): гидроборирование является син-селективным, а окисление заменяет бор гидроксилом, имеющим то же геометрическое положение. Таким образом, 1-метилциклопентен реагирует преимущественно с дибораном с образованием транс -1-гидрокси-2-метилциклопентана. [4] - вновь добавленные H и OH являются цис- по отношению друг к другу.
Пока все атомы водорода, присоединенные к бору, не будут удалены, группа бора BH 2 будет продолжать присоединяться к большему количеству алкенов. Это означает, что один моль гидроборана вступит в реакцию с тремя молями алкена. Более того, гидроборану не обязательно иметь более одного водорода. Например, обычно используются реагенты типа R 2 BH, где R может представлять собой остаток молекулы. Такие модифицированные реагенты гидроборирования включают 9-BBN , катехолборан и дисиамилборан .
Стадия окисления [ править ]
На втором этапе последовательности реакций нуклеофильный гидропероксид -анион атакует атом бора. Миграция алкила к кислороду дает алкилборан с сохранением стереохимии (на самом деле реакция происходит через триалкилборат B (OR) 3 , а не через моноалкилбориновый эфир BH 2 OR).

Атом «H» в реакции происходит из B 2 H 6 , атом «O» происходит из перекиси водорода (H 2 O 2 ), тогда как атом «H», присоединенный к O, происходит из растворителя (см. механизм).
Алкин гидроборирование [ править ]
Реакция гидроборирования протекает и на алкинах . Опять же, механизм действия син , а вторичные продукты реакции представляют собой альдегиды концевых алкинов и кетоны внутренних алкинов. Чтобы предотвратить гидроборирование обеих пи-связей, объемистый боран, такой как дисиамил (ди-втор-изо-амил) боран . используется [5]
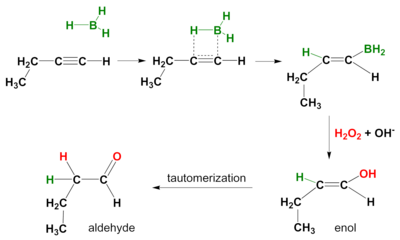
Альтернативные окисления [ править ]
Использование других окислителей вместо перекиси водорода может привести к образованию карбонильных продуктов, а не спиртов из алкенов. N -метилморфолина N -оксид с помощью каталитического перрутената тетрапропиламмония превращает алкилборан в карбонил, то есть в кетон или альдегидный продукт, в зависимости от того, какие другие группы были присоединены к этому углероду в исходном алкене. [6] Различные дихроматы или родственные реагенты хрома (VI) также дают кетоны, но для концевых алкенов дают карбоновые кислоты вместо альдегидов. [7]
окисления Другие субстраты
Помимо боранов, при окислении силанов и дисиланов также могут образовываться гидроксигруппы . Основное отличие состоит в том, что в то время как силильные группы, такие как фенилдиметилсилильная группа, преобразуются в гидроксильную группу после обработки кислотой или другим электрофилом с последующим окислением перекисью водорода, дисиланильные группы преобразуются после обработки TBAF с последующим пероксидным окислением. Это позволяет избирательно окислять любую группу. [8]
Ссылки [ править ]
- ^ Марк Г. Лаудон (2002). «Реакции присоединения алкенов». Органическая химия (четвертое изд.). Нью-Йорк: Издательство Оксфордского университета. стр. 168–172. ISBN 0-19-511999-1 .
- ^ Браун, ХК; Цвайфель, Г. (1959). «Стереспецифичная цис-гидратация двойной связи в циклических производных». Журнал Американского химического общества . 81 : 247. дои : 10.1021/ja01510a059 .
- ^ Браун, Х.; Рао, Британская Колумбия (1957). «Коммуникации - селективное преобразование олефинов в органобораны посредством конкурентного гидроборирования, реакций изомеризации и замещения». Журнал органической химии . 22 (9): 1137. doi : 10.1021/jo01360a626 .
- ^ Хоторн, МФ (1961). «Аминбораны. VIII. Гидроборирование терминальных олефинов, диенов и терминальных ацетиленов триметиламином-т-бутилбораном». Журнал Американского химического общества . 83 (11): 2541–2544. дои : 10.1021/ja01472a027 .
- ^ Браун, ХК; Гупта, СК (1972). «Катехолборан (1,3,2-бензодиоксаорол) как новый универсальный реагент моногидроборирования алкинов. Удобный синтез алкенбороновых эфиров и кислот из алкинов путем гидроборирования». Журнал Американского химического общества . 94 (12): 4370. doi : 10.1021/ja00767a072 .
- ^ Йейтс, Мэтью Х. (1997). «Однореакторное превращение олефинов в карбонильные соединения путем гидроборирования / окисления NMO – TPAP». Тетраэдр Летт . 38 : 2813–2816. дои : 10.1016/S0040-4039(97)00476-0 .
- ^ Браун, Герберт С.; Кулкарни, Шекхар В.; Ханна, Виджай В.; Патил, Вирендра Д.; Рачерла, Удай С. (1992). «Органобораны для синтеза. 14. Удобные методы прямого окисления органоборанов от концевых алкенов до карбоновых кислот». Журнал органической химии . 57 (23): 6173–6177. дои : 10.1021/jo00049a024 .
- ^ Сугиноме, Мичинори; Мацунага, Син-итиро; Ито, Ёсихико (сентябрь 1995 г.). «Дисиланильная группа как синтетический эквивалент гидроксильной группы» . Синлетт . 1995 (09): 941–942. дои : 10.1055/с-1995-5150 .
Внешние ссылки [ править ]
- Портал органической химии. Гидроборирование (включая новейшую литературу). https://www.organic-chemistry.org/namedreactions/brown-гидроборация.shtm