Нитрозил бромид
 | |||
| |||
| Идентификаторы | |||
|---|---|---|---|
3D model ( JSmol ) | |||
| ХимическийПаук | |||
ПабХим CID | |||
Панель управления CompTox ( EPA ) | |||
| Характеристики | |||
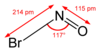
| НОБр | |||
| Молярная масса | 109.910 g/mol | ||
| Появление | Красный газ | ||
| Точка кипения | 14,5 ° C (58,1 ° F; 287,6 К) | ||
Показатель преломления ( n D ) | 1.524 | ||
| Родственные соединения | |||
Родственные соединения | |||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
Нитрозилбромид представляет собой химическое соединение с химической формулой NOBr. Это красный газ с точкой конденсации чуть ниже комнатной температуры. [1] Он реагирует с водой. [1]
Нитрозилбромид может образовываться в результате обратимой реакции оксида азота с бромом . [2] Эта реакция представляет интерес, поскольку является одной из очень немногих гомогенных газовых реакций третьего порядка. NOBr склонен к фотодиссоциации при стандартных давлении и температуре.
- 2 НО + Бр 2 ⇌ 2 НОБр
Другой способ его получения — взаимодействие оксида азота с бромидом калия . [1]
- 2NO 2 + KBr → BrNO + KNO 3
Кинетика диссоциации
[ редактировать ]Разрыв химических связей можно осуществить с помощью фотолиза с использованием света для разделения присутствующих молекул. Другой способ разделения нитрозилбромида на NO и Br или Br2 заключается в наличии избытка NO, который тогда в эксперименте будет следовать кинетике первого порядка. Эта обратная константа скорости была рассчитана как kr = 2,29 ± 0,33 x 10-21 см3/молекул.
При избытке Br2 плюс NO реакция идет по кинетике третьего порядка.
Бр2 + 2НО ↔ 2БрНО
Некоторые из предыдущих экспериментов по определению скорости реакции также были проведены Хистацуне и Зафонте, Хипплером и Годфри. Гистацуне и Зафонте определили константы скорости прямой и обратной реакций. Гиплер исследовал рекомбинацию атомов Br после фотоилза менее 0,3 Торр Br2 при комнатной температуре в диапазоне 1 – 100 атм. Он также изучал 2-рекомбинацию Br и NO в присутствии гелия. Годфри исследовал кинетику образования и разрушения BrNO, используя методы фотолиза с временным разрешением. Он также включил эффекты потери Br2 на внутренние поверхности клетки в расчеты констант скорости реакции. Скорости реакций были определены в диапазоне от 1,32 ± 0,14 до 1,68 ± 0,11 х 10-38 см6/молекула2-с для kf и от 2,09 ± 0,55 до 3,71 х 10-21 см3/молекула-с для kr.
Была найдена константа скорости kf = 1,56 ± 0,20 x 10-38 см6/молекула2 - с при 293 ± 1 К. [3]
Реакция третьего порядка лучше всего показывает образование нитрозилбромида. Реакцию третьего порядка редко можно увидеть в реакциях разрыва связей между стабильными молекулами, но не было проведено экспериментов, доказывающих, что в этом эксперименте нет каких-либо промежуточных стадий, но есть подозрение, что есть две стадии. [3]
Меры предосторожности
[ редактировать ]Нитрозилбромид фотодиссоциирует с образованием токсичных химических веществ ( брома и оксида азота ). Химическое вещество или продукты его разложения не должны попадать на кожу и в глаза. Вдыхание или попадание любого из этих химикатов на себя может поставить под угрозу здоровье.
Физические характеристики
[ редактировать ]Нитрозилбромид — красный газ при комнатной температуре.
Ссылки
[ редактировать ]Сноски
[ редактировать ]- ^ Jump up to: а б с Рэтклифф, Чарльз Т.; Шрив, Жанна М.; Винн, Кеннет Дж. (январь 1968 г.). «Нитрозилгалогениды». Неорганические синтезы . Том. 11. С. 194–200. дои : 10.1002/9780470132425.ch39 . ISBN 9780470131701 .
- ^ Эспости, CD; Тамассия, Ф.; Каццоли, Г.; Кисель, З. (апрель 1995 г.). «Миллиметровый спектр нитрозилбромида в низколежащих возбужденных состояниях: равновесная структура и кубическое силовое поле». Журнал молекулярной спектроскопии . 170 (2): 582–600. Бибкод : 1995JMoSp.170..582E . дои : 10.1006/jmsp.1995.1093 .
- ^ Jump up to: а б Ю. Лиан и др. , Теоретическое исследование структуры и механизма диссоциации электронных возбужденных состояний молекул нитрозилбромида. Журнал физической химии А. 126 , 2936–2941 (2022).
Общие источники
[ редактировать ]- Махони, Лори А., «Кинетика после фотолиза нитрозилбромида» (2004). Тезисы и диссертации. 3719. https://scholar.afit.edu/etd/3719 .
- К.М. Блэр, П.Д. Брасс, Д.М. Йост, Равновесие между оксидом азота, бромом и нитрозилбромидом. Журнал Американского химического общества . 56 , 1916–1918 (1934)
Внешние ссылки
[ редактировать ] СМИ, связанные с нитрозилбромидом, на Викискладе?
СМИ, связанные с нитрозилбромидом, на Викискладе?