Восстановление йодидом самария(II)

Восстановление йодидом самария (II) включает превращение различных классов органических соединений в восстановленные продукты под действием йодида самария (II) , мягкого одноэлектронного восстановителя. [ 2 ] [ 3 ] [ 4 ]
История
[ редактировать ]В 1979 году Каган наблюдал восстановление множества органических функциональных групп йодидом самария (II) в мягких условиях. [ 5 ] С тех пор йодид самария (II) использовался в различных областях органического синтеза как для манипулирования функциональными группами, так и для образования связей углерод-углерод.
Йодид самария (II) является одноэлектронным восстановителем и обычно осуществляет восстановление посредством серии стадий переноса электрона и переноса протона (из протонного растворителя). [ 4 ] [ 3 ] К приводимым функциональным группам относятся:
- α-функционализированные карбонильные соединения
- Кетоны и альдегиды
- Карбоновые кислоты (в сильнокислых или основных условиях)
- Органические галогениды
- Нитросоединения
некоторые примеры функциональности, уменьшенной SmI 2 Ниже приведены .
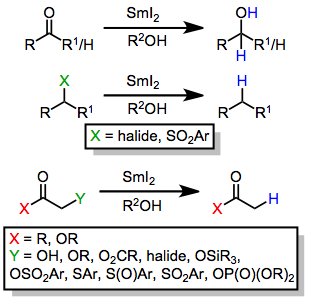 | ( 1 ) |
На реакционную способность SmI 2 существенное влияние оказывает выбор растворителя. Использование гексаметилфосфорамида (ГМФА) в качестве сорастворителя при восстановлении иодида самария(II) позволяет проводить реакцию в гораздо более мягких условиях, чем в его отсутствие. [ 6 ] Недавно было исследовано и установлено, что триамид трипирролидинофосфорной кислоты (TPPA) можно использовать вместо HMPA в качестве активатора снижения SmI 2 , обеспечивая более быстрые реакции и аналогичные выходы, избегая при этом использования известного канцерогена. [ 7 ] В целом полярные растворители усиливают восстановительные свойства йодида самария (II).
Механизм и стереохимия
[ редактировать ]Восстановление органических галогенидов
[ редактировать ]В присутствии иодида самария(II) атом галогена алкил-, алкенил- и арилгалогенидов замещается водородом. В тетрагидрофуране механизм восстановления алкилгалогенидов, вероятно, протекает через радикальные интермедиаты. [ 8 ] Однако восстановление алкилгалогенидов с использованием HMPA в качестве сорастворителя, вероятно, включает большую долю органосамариевых промежуточных продуктов. [ 9 ] Ниже представлена единая механистическая картина. Первоначальный перенос электрона и потеря галогенида приводят к образованию органического радикала, который может соединяться со второй молекулой йодида самария (II) с образованием органосамария. Протонирование этого вида затем дает восстановленный продукт. Альтернативно, промежуточный органический радикал может отрывать атом водорода от растворителя S–H.
| ( 3 ) |
В реакциях арил- и алкенилгалогенидов участвуют только радикальные интермедиаты; Восстановление промежуточных радикалов до органосамария происходит, очевидно, медленнее, чем отрыв атома водорода от растворителя. [ 10 ]
Если в β-положении алкилгалогенида присутствует заместитель, может произойти восстановительная фрагментация до диастереомерной смеси алкенов. β-Устранение промежуточных видов органозамария приводит к наблюдаемым продуктам. [ 11 ]
 | ( 4 ) |
Восстановление альдегидов и кетонов
[ редактировать ]Механизм восстановления альдегидов и кетонов иодидом самария(II) основан прежде всего на механизмах, выясненных для аналогичных одноэлектронных восстановителей. [ 12 ] При одноэлектронном переносе образуется кетильный димер iv . В отсутствие протонного растворителя этот димер разрушается с образованием 1,2-диолов. Однако в присутствии источника протонов димер может подвергнуться либо диспропорционированию с образованием алкоксида самария и карбонильного соединения, либо протонированию с образованием карбинольного радикала ii с последующим вторым восстановлением и протонированием с образованием спирта.
(5)
Восстановление α-функционализированных карбонильных соединений
[ редактировать ]α-Функционализированные карбонильные соединения восстанавливаются до соответствующих нефункционализированных карбонильных соединений в присутствии йодида самария (II). Этот процесс может быть инициирован начальным переносом электрона либо к заместителю в α-положении, либо к карбонильному фрагменту, в зависимости от относительного сродства к электрону функциональных групп. Сразу следует второе восстановление, после которого либо протонирование, либо элиминирование-таутомеризация дают продукт. [ 13 ]
(6)
Восстановление нитросоединений
[ редактировать ]Нитросоединения могут быть восстановлены до уровня окисления гидроксиламина или амина с помощью йодида самария (II), в зависимости от используемых условий. Перенос электрона, за которым следуют перенос и отщепление протона, приводит к образованию промежуточного нитрозосоединения, которое подвергается еще двум циклам переноса электрона и протонированию с образованием гидроксиламина. Дальнейшее восстановление гидроксиламина приводит к амину. [ 14 ]
(7)
Область применения и ограничения
[ редактировать ]Алкилгалогениды восстанавливаются иодидом самария(II) до соответствующих алканов. Условия восстановления совместимы с различными функциональными группами, включая спирты, арены, алкены и сложные эфиры. Арилгалогениды восстанавливаются до соответствующих безгалогеновых ароматических соединений. [ 6 ]
(8)
Восстановительная фрагментация β-замещенных алкилгалогенидов приводит к образованию диастереомерных смесей алкенов. Хорошие уходящие группы для этого процесса включают гидроксиды, алкоксиды, карбоксилаты и еноляты. Легкодоступные циклические исходные материалы могут быть использованы для получения стереоопределенных ациклических продуктов, доступ к которым будет затруднен другими методами. [ 15 ]
(9)
Йодид самария (II) можно использовать для восстановления кетонов и альдегидов до спиртов; однако диастереоселективность низкая, и существует множество более стереоселективных методов. [ 16 ] Альдегиды могут избирательно восстанавливаться в присутствии кетонов. [ 5 ]
(10)
α-Функционализированные карбонильные соединения восстанавливают с получением соответствующих карбонильных соединений. С помощью этого метода ряд функциональных групп можно заменить водородом; Одним из преобразований, относительно уникальных для йодида самария (II), является восстановление α-гидроксикетонов и α-гидроксилактонов. В общем, α,β-дигетерозамещенные лактоны могут элиминироваться с образованием ненасыщенных лактонов при реакции с SmI 2 , хотя использование этиленгликоля в качестве донора протонов сводит этот процесс к минимуму. [ 17 ]
(11)
Некоторые азотсодержащие функциональные группы, особенно нитрогруппы, восстанавливаются йодидом самария (II) до соответствующих гидроксиламинов или аминов. Нитросоединения могут быть избирательно восстановлены до любого продукта, в зависимости от условий и времени реакции. [ 18 ]
(12)
Сравнение с другими методами
[ редактировать ]Йодид самария (II) эффективен для восстановления широкого спектра функциональных групп; однако в определенных контекстах более полезны другие восстановители. SmI 2 вызывает восстановительную димеризацию аллильных или бензилгалогенидов, а хиральные галогениды подвергаются нестереоспецифическому восстановлению. [ 5 ] С другой стороны, совместимость его функциональных групп выше, чем у многих восстановителей - восстановление галогенидов возможно в присутствии сложных эфиров или спиртов. [ 6 ] Восстановительная фрагментация йодидом самария (II) имеет тот недостаток, что она не стереоспецифична; однако стереоселективность в некоторых случаях выше, когда SmI 2 используется вместо других восстановителей. [ 19 ] Восстановление α,β-ненасыщенных карбоновых кислот и их производных до соответствующих насыщенных карбонильных соединений с помощью SmI 2 является полезным преобразованием, опосредованным немногими другими восстановителями. [ 20 ] Мягкие условия реакции, используемые для восстановления йодида самария (II), представляют собой значительное преимущество реакции перед другими одноэлектронными восстановлениями, включая восстановление металла растворением и методы, индуцированные переходными металлами. [ 13 ]
Условия эксперимента
[ редактировать ]Типичные условия
[ редактировать ]Йодид самария (II) удобно получать в результате реакции металлического самария с дииодметаном или дииодэтаном. Использование дииодметана удобно, поскольку окислитель является жидкостью (дииодэтан — твердым веществом). Хотя чистый SmI 2 чувствителен к воздуху, растворами реагента можно манипулировать на воздухе без особых мер предосторожности. SmI 2 очень медленно реагирует с водой и еще медленнее со спиртами. Спирты обычно используются в качестве сорастворителей или источников протонов при восстановлении SmI 2 , поскольку немедленное гашение отрицательно заряженных промежуточных продуктов источником протонов оказалось полезным для выхода реакции. [ 21 ] Важно отметить, что поскольку SmI 2 является одноэлектронным восстановителем, для осуществления двухэлектронного восстановления органических субстратов необходимо использовать несколько эквивалентов. В большинстве случаев достаточно стехиометрического количества реагента или его небольшого избытка.
Полярность растворителя оказывает сильное влияние на ход восстановления SmI 2 . Увеличение полярности реакционной среды обычно делает SmI 2 более сильным восстановителем. Для этой цели можно использовать HMPA; однако HMPA является известным канцерогеном, и с ним следует обращаться с особой осторожностью.
Процедуры обработки могут различаться в зависимости от стабильности продуктов. Если органические продукты реакции устойчивы к водному раствору кислоты, водный раствор соляной кислоты для гашения реакции можно использовать . Для обработки кислотолабильных продуктов можно использовать слабоосновные растворы или буферы с pH 7–8. Соли самария обычно нерастворимы в этих условиях, но образуют в водной фазе суспензию, из которой можно экстрагировать желаемый органический продукт. [ 22 ]
Ссылки
[ редактировать ]- ^ Уильям Дж. Эванс; Тэмми С. Гаммершаймер и Джозеф В. Циллер (1995). «Координационная химия дииодида самария с эфирами, включая кристаллическую структуру сольватированного с тетрагидрофураном дииодида самария, SmI 2 (THF) 5 ». Дж. Ам. хим. Соц. 117 (35): 8999–9002. дои : 10.1021/ja00140a016 .
- ^ Моландер, Гэри А. (2004). «Восстановление йодидом самария (II)». Органические реакции . стр. 211–367. дои : 10.1002/0471264180.или046.03 . ISBN 0471264180 .
- ^ Перейти обратно: а б Гэри А. Моландер; Кристина Р. Харрис; Андре Б. Шаретт (2005). «Иодид самария (II)». Энциклопедия реагентов для органического синтеза . дои : 10.1002/047084289X.rs004.pub2 . ISBN 0471936235 .
- ^ Перейти обратно: а б Моландер, Гэри А.; Харрис, Кристина Р. (1996). «Секвенирование реакций с йодидом самария (II)». Химические обзоры . 96 (1): 307–338. дои : 10.1021/cr950019y . ПМИД 11848755 .
- ^ Перейти обратно: а б с Жирар, П.; Нэми, Дж.Л.; Каган, HB (1980). «Производные двухвалентных лантаноидов в органическом синтезе. 1. Мягкое получение йодида самария (II) и йодида иттербия и их использование в качестве восстановителей или связующих агентов». Журнал Американского химического общества . 102 (8): 2693. doi : 10.1021/ja00528a029 .
- ^ Перейти обратно: а б с Инанага, Дзюнджи; Исикава, Мицухиро; Ямагучи, Масару (1987). «Мягкий и удобный метод восстановления органических галогенидов с использованием раствора SmI2-THF в присутствии триамида гексаметилфосфорной кислоты (HMPA)». Химические письма . 16 (7): 1485–1486. дои : 10.1246/кл.1987.1485 .
- ^ Макдональд, Крисс Э.; Рэмси, Джереми Д.; Сэмпселл, Дэвид Г.; Батлер, Джули А.; Чеккини, Майкл Р. (2010). «Триамид трипирролидинофосфорной кислоты как активатор восстановления дииодида самария». Органические письма . 12 (22): 5178–81. дои : 10.1021/ol102040s . ПМИД 20979412 .
- ^ Каган, Х; Нэми, Дж.Л.; Жирар, П. (1981). «Двухвалентные производные лантаноидов в органическом синтезе - II Механизм smi2, реакции в присутствии кетонов и органических галогенидов». Тетраэдр . 37 : 175. дои : 10.1016/0040-4020(81)85053-3 .
- ^ Валборски, HM; Топольски, Марек (1992). «Реакция хиральных циклопропилгалогенидов с дииодидом самария». Журнал органической химии . 57 : 370–373. дои : 10.1021/jo00027a064 .
- ^ Карран, Деннис П.; Тотлебен, Майкл Дж. (1992). «Реакция Гриньяра самария. Образование in situ и реакции первичных и вторичных реагентов алкилсамария (III)». Журнал Американского химического общества . 114 (15): 6050. doi : 10.1021/ja00041a024 .
- ^ Кюнцер, Х (1991). «Восстановительное десульфонилирование фенилсульфонов йодидом самария (II)-гексаметилфосфорным триамидом». Буквы тетраэдра . 32 (17): 1949–1952. дои : 10.1016/0040-4039(91)85009-T .
- ^ Хаффман, Джон В. (1983). «Металло-аммиачное восстановление циклических алифатических кетонов». Отчеты о химических исследованиях . 16 (11): 399–405. дои : 10.1021/ar00095a002 .
- ^ Перейти обратно: а б Моландер, Гэри А.; Хан, Грегори (1986). «Лантаноиды в органическом синтезе. 2. Восстановление альфа-гетерозамещенных кетонов». Журнал органической химии . 51 (7): 1135. doi : 10.1021/jo00357a040 .
- ^ Кенде, А. (1991). «Контролируемое восстановление нитроалканов до алкилгидроксиламинов или аминов дииодидом самария» . Буквы тетраэдра . 32 (14): 1699–1702. дои : 10.1016/S0040-4039(00)74307-3 .
- ^ Хонда, Т.; Найто, К.; Ямане, С.; Сузуки, Ю. (1992). «Йодид самария (II) способствует восстановительной фрагментации γ-галогенкарбонильных соединений: применение к энантиоспецифическому синтезу (–)-удемансина А». Дж. Хим. Соц., хим. Коммун. (17): 1218. дои : 10.1039/C39920001218 .
- ^ Морокума, Кейджи; Борден, Уэстон Тэтчер; Хроват, Дэвид А. (1988). «Переходные состояния стула и лодки для перегруппировки Коупа. Исследование CASSCF». Журнал Американского химического общества . 110 (13): 4474. doi : 10.1021/ja00221a092 .
- ^ Инанага, Дзюнджи; Кацуки, Джунко; Ямагучи, Масару (1991). «Деацетоксилирование O-ацетилсахарных лактонов, стимулируемое SmI2. Легкий доступ к дезоксисахарным лактонам». Химические письма . 20 (6): 1025–1026. дои : 10.1246/кл.1991.1025 .
- ^ Суппе, Дж (1983). «Некоторые органические реакции, которым способствует дииодид самария». Журнал металлоорганической химии . 250 : 227–236. дои : 10.1016/0022-328X(83)85053-0 .
- ^ Кромби, Л. (1988). «Разрыв кольца циклических β-галогеноэфиров дииодидом самария: синтез (E)- и (Z)-энинолов». Буквы тетраэдра . 29 (49): 6517–6520. дои : 10.1016/S0040-4039(00)82388-6 .
- ^ Кабрера, А. (1992). «Йодид самария (II) - HMPA: очень эффективная система для селективного восстановления α,β-ненасыщенных карбонильных соединений». Буквы тетраэдра . 33 (35): 5007–5008. дои : 10.1016/S0040-4039(00)61174-7 .
- ^ Моландер, Гэри А. (1992). «Применение лантаноидных реагентов в органическом синтезе». Химические обзоры . 92 : 29–68. дои : 10.1021/cr00009a002 .
- ^ Моландер, Гэри А.; Хан, Грегори (1986). «Лантаноиды в органическом синтезе. 4. Восстановление альфа, бета-эпоксидных кетонов дииодидом самария. Путь к хиральным нерацемическим альдолам». Журнал органической химии . 51 (13): 2596. doi : 10.1021/jo00363a038 .
![{\displaystyle {\begin{array}{r}{}\\{\ce {RX->[{\ce {SmI2}}][- {\ce {SmI2X}}][R.]->}} {\begin{Bmatrix}{\ce {->[{\ce {SmI2}}][{\text{R = алкил}}]R-SmI2->[{\ce {HX}}]}}\\{}\\{\ce {->[{\ce {Solv-H}}][{\ce {-Solv^{.}}}]}}\end{Bmatrix }}{\ce {->{RH}+SmI2X}}\\{\text{R = арил, алкенил}}\end{array}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4857b54a4bcaa4d733be1f2ecd77bcec6f2fe6fe)







