Радиолиганд
Радиолиганд и соединения , – это микроскопическая частица, состоящая из терапевтического радиоактивного изотопа нацеленного на клетку – лиганда. Лиганд представляет собой целевой участок связывания, он может находиться на поверхности целевой раковой клетки в терапевтических целях. Радиоизотопы могут встречаться в природе или быть синтезированы и произведены в циклотронном/ядерном реакторе. К различным типам радиоизотопов относятся Y-90, H-3, C-11, Lu-177, Ac-225, Ra-223, In-111, I-131, I-125 и т. д. Таким образом, необходимо производить радиолиганды. в специальных ядерных реакторах, чтобы радиоизотоп оставался стабильным. [1] Радиолиганды можно использовать для анализа/характеристики рецепторов, для проведения анализов связывания, для помощи в диагностической визуализации и для обеспечения таргетной терапии рака. Радиация — это новый метод лечения рака, который эффективен на небольших расстояниях, а также уникален и персонализируется и наносит минимальный вред нормальным окружающим клеткам. Кроме того, связывание радиолиганда может предоставить информацию о взаимодействиях рецептор-лиганд in vitro и in vivo. Важно выбрать правильный радиолиганд для желаемого применения. Радиолиганд должен быть радиохимически чистым, стабильным, демонстрировать высокую степень селективности и высокое сродство к своей мишени. [2]
История
[ редактировать ]
Вильгельму Рентгену приписывают открытие радиоактивности в 1895 году, а многие другие, такие как Антуан Анри Беккерель , Пьер Кюри и Мария Кюри , следовали за ним в дальнейшем развитии области радиоактивности. [3] Джон Лоуренс , физик из Калифорнийского университета в Беркли , впервые применил ядерную медицину на людях в 1936 году после широкого применения радиоактивного фосфора на моделях мышей. Лоуренс, которого часто называют отцом ядерной медицины, лечил пациента с лейкемией радиофосфором, что было первым случаем, когда радиоактивный изотоп использовался для лечения пациентов-людей. [4] Другой пионер в этой области, Сэм Зейдлин, в сотрудничестве с Солом Герцем , лечил случай рака щитовидной железы радиоактивным йодом (I-131) в 1946 году. [5] В 1950-х годах ядерная медицина начала набирать обороты как медицинская специальность: в 1954 году было создано Общество ядерной медицины , которое позже выпустило первый экземпляр Журнала ядерной медицины в 1960 году. [6] Использование радиолигандов и ядерной метки начало набирать популярность в начале 1960-х годов, когда Элвуд Дженсен и Герберт Якобсен (1962), а затем Джек Горкси, Дэвид Тофт, Дж., Шимала, Дональд Смит и Анджело Нотидес (1968) попытались идентифицировать рецептор эстрогена. [7] Американская медицинская ассоциация (АМА) официально признала ядерную медицину медицинской специальностью в 1970 году, а Американский совет ядерной медицины был создан в 1972 году. Прогресс наступил быстро в 1973 году, когда Эдвард Хоффман, Майкл М. Тер-Погоссян и Майкл Э. Фелпс изобрел первую ПЭТ-камеру для использования человеком. [8] В 1980-е годы начались первые исследования радиолигандов нейроэндокринных опухолей (НЭО), которые продолжались до начала 2000-х годов. В 2017 году Европейский Союз (ЕС) одобрил использование радиолигандной терапии при НЭО, а США последовали за ними в 2018 году. [9]
Радиоактивные изотопы, обычно используемые
[ редактировать ]| Радиоизотоп | Период полураспада | Лучевое излучение | Использование |
| Йод-125 | 60 дней | Гамма-лучи | Йод-125 используется в ядерной медицине для биологических анализов, в качестве изо-затравок при локализованном раке простаты и в качестве внутренней лучевой брахитерапии при раке. 10 |
| Йод-123 | 13 часов | Гамма-лучи | Йод-123 предпочтителен для диагностики/визуализации, особенно для щитовидной железы, поскольку он имеет короткий период полураспада (13 часов) и может четко показывать поглощение йода щитовидной железой с более низкой энергией излучения, чем I-131. |
| Йод-131 | 8 дней | Бета-частицы Гамма-лучи | В составе используется йод-131 вместе с лигандом на основе мочевины МИП-1095. 11 который специфически связывается с мембраной простаты, радиолигандной терапии в клинических испытаниях метастатического рака простаты. |
| Фтор-18 | 109,7 минут | Бета-положительный распад Позитронная эмиссия | Фтор-18 используется в ПЭТ-визуализации и радиолигандной диагностике для раннего выявления заболеваний. Кроме того, поскольку F-18 представляет собой небольшую липофильную молекулу, он может легко преодолевать гематоэнцефалический барьер. и использоваться для диагностической визуализации метаболизма глюкозы в головном мозге. 12 Поскольку он может связываться с лигандами ПЭТ-визуализации, его используют для обнаружения агрегации амилоида, которая указывает на прогрессирование болезни Альцгеймера в тканях головного мозга. 13 |
| Иридий-192 | 74 дня | Гамма-лучи | Наиболее распространенными видами применения иридия-192 являются: рак шейки матки, рак головы и шеи и рак простаты. Ir-192 также можно использовать в радионуклидной терапии, называемой высокодозной брахитерапией. 14 |
| Ксенон-133 | 5,2 дня | Бета- и гамма-излучение | Xe-133 представляет собой инертный газ, который вместе с CO2 можно вдыхать для получения диагностической информации о легких у взрослых и новорожденных с помощью ОФЭКТ или ядерной визуализации. 15 |
| Иттрий-90 | 64 часа | чистый бета-излучатель | Итрий-90 можно использовать для внутренней лучевой терапии для диагностики метастазов в печени. Y-90 излучает наибольшее количество энергии бета-излучения и может использоваться в качестве радиолигандной терапии при В-клеточной неходжкинской лимфоме или раке поджелудочной железы. 16 |
| Углерод-11 | 20 минут | Позитронная эмиссия | Углерод-11 можно использовать для обнаружения нейровоспаления с помощью ПЭТ-визуализации конкретного белка-транслокатора, который в случае обнаружения указывает на нейровоспаление. 17 C-11 также можно использовать для радиолигандной ПЭТ-визуализации переносчиков серотонина в корковых областях мозга приматов/свиней. 18 C-11 также очень нестабилен и распадается на стабильный бор-11. |
| Индий-111 | 67 часов | Гамма-излучение - низкая энергия | Индий-111 нестабилен и распадается путем захвата электронов до стабильного кадмия-111. Его можно использовать для планарной ОФЭКТ в диагностических целях и для диагностики наличия рецепторов соматостатина на различных нейроэндокринных опухолях. 19 |
| Водород-3 (H-3) | 12 лет | Бета-излучение | Водород-3 используется для анализа связывания радиолигандов in vitro с тканями головного мозга и анализов связывания радиолигандов конкуренции/насыщения. 20 |
| Стронций-89 (Sr-89) | 50,5 дней | Бета-излучение | Стронций-89 используется в качестве радиолигандной терапии рака костей для облегчения боли в костях, поскольку Sr-89 легко всасывается в костной ткани. 21 |
| Париж-177 | 6,6 дней | Воображаемые гамма-фотоны Бета-частицы | Лютеций-177 используется при метастатическом раке простаты или В-клеточной неходжкинской лимфоме. |
| Радий-223 | 11,4 дня | Альфа-излучатель | Радий-223 представляет собой кальцимиметик, специально используемый при метастатическом раке предстательной железы или В-клеточной неходжкинской лимфоме. |
Лиганды
[ редактировать ]
Лиганд . — это молекула, используемая для передачи сигналов клеткам, которая связывается с тканью-мишенью для клеточной коммуникации Существует много различных типов лигандов, включая: внутренние рецепторы, рецепторы клеточной поверхности , рецепторы ионных каналов , рецепторы, связанные с G-белком (GPCR), и рецепторы, связанные с ферментами . [10] Лиганды можно разделить на две категории: агонисты и антагонисты. Агонисты ведут себя аналогично природным лигандам, тогда как антагонисты являются ингибиторами и блокируют связывание природного лиганда. Существует много различных подтипов агонистов, включая эндогенные агонисты, суперагонисты, полные агонисты, инверсные агонисты и необратимые агонисты. [11]
Радиолиганды состоят из радиоизотопа, линкера и лиганда. Эта структура позволяет соединению идентифицировать и связываться с целевой тканью, сохраняя при этом возможность отслеживания и визуализации в клинических условиях. Когда радиолиганд связывается со своей мишенью, он изменяет микроокружение рецептора и окружающей ткани, частично из-за структуры самого радиолиганда. [12] Без лиганда с высоким сродством и радиоизотопа эффективность этого процесса теряется.
Использование при доставке и высвобождении лекарств.
[ редактировать ]Радиолиганды вводятся четырьмя основными способами: внутривенно, подкожно, внутрибрюшинно и перорально. Хотя внутривенное введение является наиболее часто используемым путем инъекции, этот путь зависит от механизма действия и общей цели связывания. [13] Перед применением лиганда врачи выполняют визуализацию, обычно с помощью позитронно-эмиссионной томографии (ПЭТ) или однофотонной эмиссионной компьютерной томографии (ОФЭКТ) для сравнения исходных показателей после введения радиолиганда. После введения радиолиганда он перемещается к ткани-мишени и избирательно связывается. Структура соединения позволяет врачам легко идентифицировать пройденный путь и пункт назначения с помощью повторных изображений и сигнала, излучаемого радиофармпрепаратом, прикрепленным к лиганду. [14]
Прямая лучевая терапия, проводимая с помощью ионизирующего излучения, может вызвать повреждение тканей и гипоксию тканей, отличных от цели. Хотя этот эффект уменьшается при целевой терапии радиофармпрепаратами с использованием радиолигандов, все же сохраняется воздействие на окружающие ткани, описываемое как радиационно-индуцированный эффект свидетеля (RIBE). Окружающие клетки, измененные радиолигандом и демонстрирующие RIBE, могут проявлять признаки стресса, хромосомные аномалии или даже испытывать клеточную смерть. Однако тип используемого излучения, будь то 𝜶, β или оба, может оказывать совершенно разное воздействие как на целевой участок связывания, так и на окружающие ткани. [15] Изменения в близлежащих тканях — не единственное возможное воздействие лигандной терапии; могут быть иммунологические реакции со стороны ткани-мишени, которые вызывают изменения удаленно. Это было названо «абскопальным эффектом». [16] Хотя этот механизм недостаточно изучен, он объясняет воздействие на другие ткани, как доброкачественные, так и злокачественные, после таргетной лучевой терапии.
Использование в визуализации
[ редактировать ]Визуализация является полезным инструментом для визуализации радиолиганда после инъекции, причем позитронно-эмиссионная томография (ПЭТ) и однофотонная эмиссионная компьютерная томография наиболее распространенными типами визуализации являются (ОФЭКТ). ПЭТ-сканирование часто используется после введения радиолиганда из-за простоты использования, точности изображения и неинвазивности. Хотя ПЭТ и ОФЭКТ-сканирования при визуализации радиолигандов функционируют одинаково, основное различие заключается в типе используемого излучения: при ПЭТ-сканировании используются позитроны, а при ОФЭКТ — гамма-лучи. При сравнении двух методов ПЭТ предлагает гораздо лучшее качество изображения и высокую эффективность диагностики, однако высокая стоимость ограничивает общую доступность, а также короткий период полураспада изотопов, излучающих позитроны. В качестве альтернативы, ОФЭКТ-изображение более динамично из-за более низкой стоимости и более длительного периода полураспада однофотонных излучателей. [17] С развитием технологий появилась гибридная визуализация, которая может сочетать в себе ПЭТ, ОФЭКТ, компьютерную томографию (КТ) и магнитно-резонансную томографию (МРТ). Некоторые гибридные методы визуализации включают: ОФЭКТ/КТ, ПЭТ/КТ и ПЭТ/МРТ. [18] Хотя комбинированная визуализация представляет собой барьер как по стоимости, так и по доступности, эта технология является чрезвычайно полезным диагностическим инструментом. Зачастую для выполнения обоих типов визуализации не требуется перемещать пациента, и врачи получают насыщенные многомерные изображения. [19]
Анализы связывания
[ редактировать ]Измерение степени и кинетики связывания радиолигандов важно для определения информации о сайтах связывания радиолигандов и последующего сродства к потенциальным лекарствам. Для связывания радиолиганда обычно используются три различных анализа связывания; это насыщение, конкуренция и кинетическое связывание.
Привязка насыщенности
[ редактировать ]Связывание по насыщению измеряет специфическое связывание радиолиганда при различных концентрациях в равновесном состоянии. С помощью этого метода можно определить количество рецепторов, а также сродство лиганда к этим рецепторам. Эксперименты по связыванию насыщения часто называют «экспериментами Скэтчарда», поскольку их можно отобразить в виде графика Скэтчарда . [20]

Обязательная конкуренция
[ редактировать ]Эксперименты по конкурентному связыванию направлены на определение связывания меченого радиолиганда в одной конкретной концентрации при воздействии различных концентраций конкурента, обычно немеченого лиганда. Эксперименты по конкурентному связыванию преследуют множество целей, включая возможность подтвердить, что интересующий радиолиганд будет связываться с рецептором с ожидаемым сродством и эффективностью даже в присутствии конкурента. [21] Этот эксперимент также поможет определить, сможет ли радиолиганд распознавать правильный рецептор и связываться с ним. Эксперименты по конкурентному связыванию также служат для изучения связывающей способности лекарственного средства с низким сродством, поскольку его можно использовать в качестве немеченого конкурента. Наконец, с помощью этого эксперимента также можно определить количество и сродство рецепторов. [20]
Кинетическое связывание
[ редактировать ]Эксперименты по кинетическому связыванию отличаются от экспериментов по насыщению и конкуренции тем, что они не проводятся в равновесии. Вместо этого они измеряют ход связывания радиолиганда во время эксперимента, а также диссоциацию для определения расчета Kd и констант скорости связывания и диссоциации. Эксперименты по кинетическому связыванию также называются экспериментами по связыванию диссоциации и могут помочь оценить взаимодействие радиолиганда и целевого рецептора. [20]
Альфа и бета частицы
[ редактировать ]𝜶 и β- частицы используются при лечении рака, в зависимости от размера и местоположения конкретной опухоли. Альфа-частицы содержат в целом более высокую энергию, имеют меньшую длину пути и по этой причине обладают более высокими цитотоксическими свойствами по сравнению с β-частицами. Однако из-за более короткой длины пути этих частиц метод доставки должен быть максимально близким к месту расположения опухоли. В настоящее время существуют методы лечения с использованием альфа-излучателей , которые состоят из альфа-излучателей, прикрепленных к молекулам-носителям. [22] Некоторые примеры альфа-излучающих радиолигандов включают актиний-225, хлорид Ra-223 и свинец-212,36.

β-частицы излучают меньшую энергию по сравнению с α-излучателями, но у них есть то преимущество, что они имеют большую длину пути. Однако из-за их более низкой энергии для повреждения опухолевых клеток требуется больше β-частиц по сравнению с α-излучателями. [22] Некоторые примеры β-излучателей включают Lu-177, Y-90 и I-131. [23]
Онкологические применения
[ редактировать ]Лютатера при нейроэндокринных опухолях
[ редактировать ]Лутатера — это радиолигандная/радионуклидная терапия пептидных рецепторов (одобренная FDA в 2018 году) специально для пациентов с гастроэнтеропанкреатическими нейроэндокринными опухолями (GEP-NET), которые имеют рецепторы гормона соматостатина (SSTR). Радиоизотоп — Lu-177, а лиганд — SSTR на поверхности опухолевых клеток.

Lu-177 производится бомбардировкой нейтронами стабильного изотопа Yb-176 (который содержится в монацитовом песке, а также в рудах, эвксените и ксенотиме). Yb-176 превращается в Yb-177, который нестабилен и имеет период полураспада 1,9 часа, поэтому он быстро распадается на медицинский изотоп Lu-177. [24] Для массового производства Yb-176 лучше производить с помощью реакторов деления. Это косвенный метод производства, требующий тщательной радиохимической сепарации и очистки и приводящий к образованию большого количества радиоактивных отходов. Прямой метод получения Лу-177 заключается в нейтронном облучении Лю-176-Лю-177. Это недорогой и эффективный метод получения Лу-177. [25] В США основным местом производства Лу-177 является исследовательский реактор Университета Миссури.
После производства Lu-177 стабилен в течение 72 часов при хранении при температуре ниже комнатной. Лиофилизированные наборы Лутатеры демонстрируют меньшую эффективность при лучевой терапии, но сохраняют радиохимическую чистоту. [25] Лу-177 требует радиационной защиты при обращении. Лу-177 хранят и транспортируют в готовом к использованию флаконе со свинцово-плексигласовой защитой. Повторное производство, своевременная доставка и быстрое введение важны для того, чтобы терапия оставалась эффективной. [26]
После транспортировки в больницу или онкологический/онкологический центр пациента подготавливают, проводят все необходимые анализы, и пациенту требуются две отдельные точки внутривенного введения для инфузии. Одно место для введения радиоактивного Lu-177 и одно место для введения аминокислот. Инфузия аминокислот необходима для снижения радиационной токсичности для органов, в частности почек. Помещения разделены, чтобы предотвратить радиоактивное загрязнение после терапии. Пациент получает терапию с помощью автоматического шприца, инфузионного насоса или гравитационного метода с использованием длинных/коротких игл, трубок и раствора хлорида натрия. После терапии для облегчения симптомов можно использовать противорвотные препараты (против тошноты) или октреотид короткого/длительного действия (контроль роста рака).
Наиболее распространенные побочные эффекты включают снижение количества клеток крови, повышение уровня ферментов печени, рвоту, тошноту, повышение уровня глюкозы в крови и снижение уровня калия в крови. [27] Лютатеру не назначают беременным и кормящим грудью людям. Терапия уменьшает опухоли в среднем на 30%, замедляет прогрессирование заболевания на 72% и задерживает рост опухолей. [28]
Плювикто и Ксофиго при раке простаты
[ редактировать ]Pluvicto также использует Lu-177 в качестве радиоизотопа (который представляет собой бета-излучатель, который распадается до Hf-177), но его лиганд представляет собой лиганд, нацеленный на простатспецифический мембранный антиген (PSMA), поскольку эта радиолигандная терапия направлена на лечение метастатического рака простаты. [29] Он был одобрен FDA в 2022 году. Разница между Лутатерой и Плювикто показана в химических связях на изображениях выше. Производство, транспортировка и хранение такие же, как и у Лютатеры. Терапию вводят внутривенно с помощью гравитации, шприца или перистальтического инфузионного насоса. [30] Основные предупреждения включают почечную токсичность, бесплодие у мужчин и вред эмбриону/плоду. Общие побочные эффекты терапии радиолигандами включают усталость, тошноту, сухость во рту, анемию, снижение аппетита и запор. После терапии необходимы регулярные анализы крови и визуализация, чтобы увидеть, работает ли радиолигандная терапия и есть ли ее побочные эффекты.

Преимущества Плювикто включают задержку роста опухоли, продление жизни примерно на 20 месяцев, [31] и уничтожение опухолевых клеток путем повреждения ДНК внутри этих клеток.
Ксофиго, радиолигандная терапия, одобренная FDA в 2013 году, использует дихлорид радия-223 в качестве радиоизотопа, но его лиганд отличается от плювикто. Плювикто атакует только раковые клетки, экспрессирующие ПСМА, а Ксофиго атакует все костные метастазы. У квалифицированных пациентов на 30% меньше шансов умереть при лечении Ксофиго, чем при лечении плацебо. [32] Ra-223-хлорид представляет собой альфа-излучающий агент, воздействующий на кости.
Йод-131 тозитумомаб (Бексар) и Зевалин (90Y-ибритумомаб тиуксетан) при неходжкинской лимфоме
[ редактировать ]Bexxar, радиолигандная терапия с использованием радиоизотопа I-131 + тозитумомаб (мышиное моноклональное антитело) и связывания/нацеливания лиганда CD20 на B-клетки человека. [33] CD20 представляет собой трансмембранный белок, обнаруженный на В-клеточных лимфоцитах и являющийся опухолевым маркером, поскольку он находится в более высокой концентрации у больных раком, особенно при лейкозах или лимфомах (например, неходжкинской лимфоме). [34]
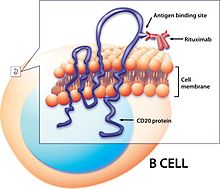
I-131 производится в результате ядерного деления или нейтронного облучения Te-130 для преобразования его в Te-131, который распадается до I-131 (производится в исследовательском реакторе Университета Миссури). [35] И-131 хранят в свинцовозащитных флаконах.
За 24 часа до и через 14 дней после введения вводят тиреопротекторные препараты и таблетки КИ. И-131 и тозитумомаб вводят отдельно в течение 14 дней внутривенно в дозиметрических и терапевтических дозах. [36] Побочные эффекты включают анемию, лихорадку, озноб или озноб, потливость, гипотонию, одышку, бронхоспазм и тошноту. Существует риск радиационного воздействия на других людей (женщин/детей/плода), анафилаксии, нейтропении (низкий уровень нейтрофилов) и тромбоцитопении (низкий уровень тромбоцитов).
Зевалин , еще одна радиолигандная терапия, нацеленная на лиганд CD20 неходжкинской лимфомы , но использующая иттрий-90 в качестве радиоизотопа, была одобрена FDA в 2002 году.
Требования к администрации
[ редактировать ]Право на участие пациента
[ редактировать ]
Каждая терапия радиолигандами требует тщательного тестирования пациентов и требований к приемлемости перед введением. Терапия радиолигандами для лечения рака не является первым курсом действий и обычно требует, чтобы пациент прошел другие предыдущие методы лечения и множество диагностических изображений (т.е. проверка наличия специфических рецепторов/антигенов), чтобы определить пользу и неблагоприятный эффект от прохождения терапии радиолигандами. .
Например, терапия радиолигандом PSMA (Pluvicto) требует, чтобы у пациента была терминальная стадия рака простаты, метастазировавшая в другие органы, лиганд PSMA (подтвержденный с помощью диагностической визуализации), и он прошел гормональную терапию и химиотерапию. [37] Для того, чтобы пациент имел право на получение радиолигандной терапии Lutathera, у пациента должно наблюдаться прогрессирование заболевания, несмотря на получение аналоговой терапии соматостатина (октреотид или ланреотид), местно-распространенное, неоперабельное или метастатическое хорошо дифференцированное заболевание, а также соответствие критериям Восточной кооперативной онкологической группы (ECOG). статус от 0 до 2.
Требования больницы и обучение персонала
[ редактировать ]Поскольку группа пациентов, получающих терапию радиолигандами, узка, многие поставщики медицинских услуг не имеют возможности или не имеют права проводить терапию радиолигандами. [38] Должны быть доступны машины для получения изображений ПЭТ, помещение, защищенное свинцом, и обученные специалисты.
Ограничения
[ редактировать ]При терапии радиолигандами всегда существует риск повреждения нераковых окружающих тканей наряду с токсичностью радиоизотопов, что всегда является проблемой при определении способа введения и создания радиолиганда. Кроме того, флакон с радиолигандом жизнеспособен только в течение ограниченного времени и при определенных условиях, что затрудняет транспортировку и хранение, а также возможность его применения у пациента.
Еще одним ограничением является отсутствие центров, имеющих подготовленный персонал и оборудование для радиолигандной терапии. Более того, индивидуальные характеристики влияют на точную радиочувствительность к терапии (тем самым влияя на дозиметрию) и их трудно предсказать без радиобиологических моделей. 52 .
Будущие потенциальные применения
[ редактировать ]В будущем радиолигандная терапия может расшириться и включать в себя больше методов лечения на основе α-излучателей. В настоящее время в онкологии все чаще применяют терапию β-радиолигандами. Клинические испытания α-излучателей продолжаются из-за их более высокой активности и способности вызывать двухцепочечные разрывы ДНК. В 2024 году будут начаты многочисленные исследования PSMA на основе актиния-225. Если они окажутся успешными, существует потенциал для проведения дальнейших исследований и клинических испытаний с использованием α-излучателей. [39] Кроме того, существует потенциал для будущего использования радиолигандной терапии у пациентов со злокачественными опухолями головного мозга. [40] Наконец, в последнее время произошли разработки в области диагностических индикаторов с использованием радиолигандов, а также методов визуализации на основе радиолигандов и в области тераностики. [41]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ «Радиолигандная терапия» . Новартис . Проверено 23 марта 2024 г.
- ^ Анализы связывания радиолигандов: от опиатных рецепторов к опоре на открытие лекарств . (2023, 30 июня). Блог ПеркинЭлмера. https://blog.perkinelmer.com/posts/radioligand-binding-assays-from-opiate-receptors-to-drug-discovery-mainstay/
- ^ Обальдо Дж.М., Герц Б.Е. Первые годы ядерной медицины: пересказ. Азия Океан J Nucl Med Biol. Весна 2021 г.;9(2):207-219. doi: 10.22038/aojnmb.2021.55514.1385. ПМИД 34250151; PMCID: PMC8255519.
- ^ Даунер, Дж. Б. (2000). Лоуренс, Джон Хандейл (1904–1991), пионер ядерной медицины. Американская национальная биография в Интернете . https://doi.org/10.1093/anb/9780198606697.article.1202060
- ^ СЕЙДЛИН С.М., МАРИНЕЛЛИ Л.Д., ОШРИ Э. РАДИОАКТИВНАЯ ЙОДНАЯ ТЕРАПИЯ: Влияние на функциональные метастазы аденокарциномы щитовидной железы. ДЖАМА. 1946; 132 (14): 838–847. doi:10.1001/jama.1946.02870490016004
- ^ Билунд, Д.Б., и Энна, С. (2018). Анализы связывания рецепторов и открытие лекарств. Достижения в фармакологии , 21-34. https://doi.org/10.1016/bs.apha.2017.08.007
- ^ Горски Дж., Тофт Д., Шьямала Г., Смит Д. и Нотидес А. (1968). Гормональные рецепторы: исследования взаимодействия эстрогена с маткой. Недавний прогресс в исследованиях гормонов (под ред. Э.Б. Аствуда) , 24 , 45-73.
- ^ Министерство энергетики США - Наследие молекулярной ядерной медицины. История ПЭТ и МРТ. Доступно по адресу: https://www.doemedicalsciences.org/historypetmri.shtml [Проверено 18.09.2024]
- ^ Национальный институт рака. FDA одобрило новый метод лечения некоторых нейроэндокринных опухолей. Доступно по адресу: https://www.cancer.gov/news-events/cancer-currents-blog/2018/lutathera-fda-gistration-nets [Проверено 18 марта 2024 г.]
- ^ Миллер Э.Дж., Лаппин С.Л. Физиология, клеточный рецептор. [Обновлено 14 сентября 2022 г.]. В: StatPearls [Интернет]. Остров сокровищ (Флорида): StatPearls Publishing; 2024 янв. Доступно по адресу: https://www.ncbi.nlm.nih.gov/books/NBK554403/.
- ^ Негус СС. Некоторые последствия теории рецепторов для оценки агонистов, антагонистов и обратных агонистов in vivo. Биохим Фармакол. 14 июня 2006 г.;71(12):1663-70. дои: 10.1016/j.bcp.2005.12.038. Электронная публикация, 7 февраля 2006 г. PMID 16460689; PMCID: PMC1866283.
- ^ Эррера Ф.Г., Бурхис Дж., Кукос Г. Возможности комбинированной лучевой терапии для повышения иммунитета для следующей онкологической практики. CA Рак J Clin. Январь 2017 г.;67(1):65-85. дои: 10.3322/caac.21358. Epub, 29 августа 2016 г. PMID 27570942.
- ^ Клозе, Дж. М., Восняк, Дж., Икинг, Дж., Станишевска, М., Заррад, Ф., Трайкович-Арсич, М., Херрманн, К., Коста, П.Ф., Люкерат, К., и Фендлер, В.П. (2022). Пути введения тераноститических радиолигандов, направленных на SSTR-/PSMA- и FAP, мышам. Журнал ядерной медицины , 63 (9), 1357–1363. https://doi.org/10.2967/jnumed.121.263453
- ^ Холдгейт, Г. (2017). Кинетика, термодинамика и показатели эффективности лигандов при открытии лекарств. Комплексная медицинская химия III , 180-211. https://doi.org/10.1016/b978-0-12-409547-2.12318-2
- ^ Хаберкорн У., Гизель Ф., Моргенштерн А. и Краточвил К. (2017). Будущее радиолигандной терапии: α, β или оба? Журнал ядерной медицины , 58 (7), 1017–1018.
- ^ Эррера, Ф.Г., Бурхис, Дж., и Кукос, Г. (2016). Возможности комбинированной лучевой терапии для усиления иммунитета для следующей онкологической практики. CA: Журнал рака для клиницистов , 67 (1), 65-85. https://doi.org/10.3322/caac.21358
- ^ Кришан Г., Молдовян-Чорояну Н.С., Тимару Д.Г., Андрис Г., Кайнап С., Чиш В. Радиофармацевтические препараты для ПЭТ и ОФЭКТ: обзор литературы за последнее десятилетие. Int J Mol Sci. 30 апреля 2022 г.;23(9):5023. doi: 10.3390/ijms23095023. ПМИД 35563414; PMCID: PMC9103893.
- ^ Ван дер Меулен, Н.П., Штробель, К., и Лима, ТВ (2021). Новые радионуклиды и технологические достижения в ОФЭКТ и ПЭТ-сканерах. Раков , 13 (24), 6183. https://doi.org/10.3390/cancers13246183.
- ^ Хофман, М.С., Лау, В.Ф., и Хикс, Р.Дж. (2015). Визуализация рецепторов соматостатина с помощью <sup>68</sup>Ga DOTATATE ПЭТ/КТ: клиническая полезность, нормальные закономерности, жемчужины и подводные камни в интерпретации. РадиоГрафика , 35 (2), 500-516. https://doi.org/10.1148/rg.352140164
- ^ Перейти обратно: а б с Мейлман Р. и Бойер Дж. (31 июля 1997 г.). ХАРАКТЕРИЗАЦИИ ТЕОРИЯ И ПРАКТИКА РЕЦЕПТОРОВ И АНАЛИЗА ЛЕКАРСТВ . Медицинский факультет UNC. http://www.pdg.cnb.uam.es/cursos/Barcelona2002/pages/Farmac/Comput_Lab/Radioligandos/Mailman_Boyer/index.htm
- ^ Мотульский, Х. (nd). Руководство GraphPad по анализу данных о связывании радиолигандов (стр. 4–12) [Обзор руководства GraphPad по анализу данных о связывании радиолигандов ]. GraphPad Software, Inc. Получено 22 марта 2024 г. с https://www.chem.uwec.edu/chem491_w01/Pharmacognosy%20491/%20aaa%20Daily%20Lectures/Lecture%20%202/radiolig.pdf.
- ^ Перейти обратно: а б Использование альфа- и бета-радиоизотопов для уничтожения раковых клеток . (2017, 12 апреля). Что нового в ГУ?; Что нового в ГУ? https://weillcornellgucancer.org/2017/04/12/using-alpha-and-beta-radioisotopes-to-kill-cancer-cells/
- ^ Маккей, Р.Р., и Хоуп, Т.А. (17 августа 2022 г.). Новые системы доставки лекарств для пациентов с распространенным раком простаты: фокус на радиолигандной терапии и ADC . ASCO Daily News. https://dailynews.ascopubs.org/do/novel-drug-delivery-systems-peoples-advanced-prostate-cancer-focus-radioligand-therapy
- ^ Что такое инка лютеций-177 (Lu-177)? (2024, 18 марта). ШАЙН Технологии | Освещая путь к термоядерной энергии. https://www.shinefusion.com/blog/what-is-nca-lutetium-177-lu177#:~:text=To%20produce%20n.ca%20Lu%2D177%2C%20we%20bombard%20highly%20pure %20иттербий,он%20не%2Dноситель%2Dдобавлен
- ^ Перейти обратно: а б Рухи С, Ризви СК, САР Накви. Радионуклидная терапия пептидного рецептора 177Lu-DOTATATE: разработанный местными властями лиофилизированный холодный набор и биологический ответ в моделях In-Vitro и In-Vivo. Доза-ответ. 12 февраля 2021 г.;19(1):1559325821990147. дои: 10.1177/1559325821990147. ПМИД 33628154; PMCID: PMC7883172.
- ^ Лав, К., Десаи, Н.Б., Абрахам, Т., Бэнкс, К.П., Бодей, Л., Бойке, Т., Браун, Р.К., Бушнелл, Д.Л., ДеБланш, Л.Е., Доминелло, М.М., Фрэнсис, Т., Грейди, Э.К., Хоббс, Р.Ф., Хоуп, Т.А., Кемпф, Дж.С., Прима, Д.А., Рул, В., Савир-Барух, Б., Сетхи, И., ... Шехтер, Н.Р. (2022). Практический параметр ACR-ACNM-ASTRO-SNMMI для терапии DOTATATE лютеция-177 (Lu-177). Американский журнал клинической онкологии , 45 (6), 233-242. https://doi.org/10.1097/coc.0000000000000903
- ^ НОВАРТИС (2023, май). Лютатера (лютеция Lu 177 дотат) Побочные эффекты . ЛЮТЕРА (с Лютием Лу 177) | Лечение GEP-NET. https://www.us.lutathera.com/side-effects/understanding-side-effects/#:~:text=The%20most%20common%20and%20most,any%20of%20these%20side%20effects
- ^ НОВАРТИС. (2024, 19 января). Novartis Lutathera значительно снижала риск прогрессирования заболевания или смерти на 72% в качестве лечения первой линии у пациентов с распространенными гастроэнтеропанкреатическими нейроэндокринными опухолями. https://www.google.com/url?q=https://www.novartis.com/news/media-releases/novartis-lutathera-significantly-reduced-risk-disease-progression-or-death-72- первая линия-лечения-пациенты-распространенные-гастроэнтеро-панкреатические-нейроэндокринные-опухоли%23:~:text%3DNovartis%2520Lutathera%25C2%25AE%2520значительно%2520снижение,распространенные%2520гастроэнтеропанкреатические%2520нейроэндокринные%2520опухоли%2520%257 C%2520Novartis&sa=D&source= docs&ust=1711156056791112&usg=AOvVaw3xi8kIkSB6Qy7JxAsCXdIm
- ^ Хенрих, У., и Эдер, М. (2022). [177Lu]Lu-PSMA-617 (PluvictoTM): первый радиотерапевтический препарат, одобренный FDA для лечения рака простаты. Фармацевтика, 15(10), 1292. https://doi.org/10.3390/ph15101292.
- ^ https://www.accessdata.fda.gov/drugsatfda_docs/label/2022/215833s000lbl.pdf .
- ^ FDA. (2022, 23 марта). FDA одобрило Pluvicto для лечения метастатической кастрационной резистентности простаты. Управление по контролю за продуктами и лекарствами США. https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-pluvicto-metastatic-castration-резистентный-простата-рак
- ^ Что лучше, 177Lu-PSMA-617 (Плювикто) или Ксофиго (радий-223) — Азбука рака. (2022, 14 сентября). Азбука рака. https://www.cancerabcs.org/advanced-prostate-cancer-blog/2022/8/29/that-is-better-177lu-psma-617-pluvicto-or-xofigo#:~:text=In%20summary %2C%20Xofigo%20только%20атаки, а не%20все%20опухоли%20экспресс%20ПСМА
- ^ Фридберг, Дж.В., и Фишер, Р.И. (2004). Тозитумомаб йода-131 (Bexxar): радиоиммуноконъюгатная терапия ленивой и трансформированной B-клеточной неходжкинской лимфомы. Экспертный обзор противораковой терапии, 4(1), 18-26. https://doi.org/10.1586/14737140.4.1.18
- ^ Словарь терминов, посвященных раку, NCI. (без даты). Национальный институт рака. https://www.cancer.gov/publications/dictionaries/cancer-terms/def/cd20
- ^ Хаффнер Р., Миллер У.Х. и Моррис С. (2019). Проверка выхода I-131 при нейтронном облучении теллура. Прикладная радиация и изотопы, 151, 52–61. https://doi.org/10.1016/j.apradiso.2019.05.001
- ^ https://www.accessdata.fda.gov/drugsatfda_docs/label/2012/125011s0126lbl.pdf .
- ^ Терапия PSMA с лютецием-177 при раке простаты (Pluvicto). (без даты). Больницы, клиники и врачи в штате Иллинойс — UChicago Medicine. https://www.uchicagomedicine.org/cancer/types-treatments/prostate-cancer/treatment/lutetium-177-psma-therapy-for-prostate-cancer#:~:text=Who%20is%20a%20candidate%20for
- ^ Готовность системы здравоохранения к терапии радиолигандами в США. (2021, ноябрь). Партнерство в области политики здравоохранения. https://www.healthpolicypartnership.com/?s=radioligand
- ^ Моррис М., Дорфф Т., Ю Э. и Маккей Р. (16 ноября 2023 г.). Заглядывая в будущее: какое будущее ждет радиолигандную терапию при раке простаты? . ГУ «Онкология сейчас». https://guoncologynow.com/post/looking-ahead-what-does-the-future-hold-for-radioligand-therapy-in-prostate-cancer
- ^ Прюис, И.Дж., ван Дормал, П.Дж., Балверс, Р.К., ван ден Бент, М.Дж., Хартевельд, А.А., де Йонг, Л.К., Конийненберг, М.В., Сегберс, М., Валкема, Р., Вербург, Ф.А., Смитс, М. ., и Вельдхейзен ван Зантен, SEM (2024). Потенциал терапии радиолигандами, нацеленной на PSMA, при злокачественных первичных и вторичных опухолях головного мозга с использованием суперселективного внутриартериального введения: открытое нерандомизированное проспективное визуализирующее исследование в одном центре. электронная биомедицина , 102 . https://doi.org/10.1016/j.ebiom.2024.105068
- ^ Шах, Х.Дж., Руппелл, Э., Бохари, Р., Аланд, П., Леле, В.Р., Ге, К., и Макинтош, Л.Дж. (2023). Текущие и предстоящие радионуклидные методы лечения в направлении прецизионной онкологии: описательный обзор. Европейский журнал радиологии Open , 10 , 100477. https://doi.org/10.1016/j.ejro.2023.100477.
Дальнейшее чтение
[ редактировать ]- Джон Чарльз Мэтьюз (1993). Основы рецепторной, ферментной и транспортной кинетики . ЦРК Пресс . ISBN 0-8493-4426-3 .