Обратимое уравнение Хилла
Классическая Моно-Ваймана-Шанже модель кооперативности (MWC) обычно публикуется в необратимой форме. То есть в уравнении скорости нет продуктов, которые могут быть проблематичными для тех, кто хочет построить метаболические модели, поскольку нет продуктов ингибирования. [ 1 ] Однако серия публикаций Поповой и Селькова [ 2 ] вывел уравнение скорости MWC для обратимой многосубстратной и многопродуктовой реакции.
Та же проблема относится и к классическому уравнению Хилла , которое почти всегда проявляется в необратимой форме. Хофмейр и Корниш-Боуден впервые опубликовали обратимую форму уравнения Хилла. [ 1 ] С тех пор уравнение обсуждалось в другом месте. [ 3 ] [ 4 ] и эта модель также использовалась в ряде кинетических моделей, таких как модель фосфофруктокиназы и гликолитических колебаний в β-клетках поджелудочной железы. [ 5 ] или модель штамма S. cerevisiae, совместно использующего глюкозу и ксилозу. [ 6 ] Модель также обсуждается в современных учебниках по кинетике ферментов. [ 7 ] [ 8 ]
Вывод
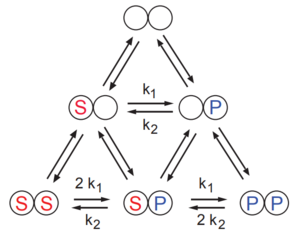
[ редактировать ]Рассмотрим более простой случай, когда имеется два сайта связывания. См. схему, представленную ниже. Предполагается, что каждый сайт связывает либо молекулу субстрата S, либо продукт P. Каталитическая реакция показана двумя реакциями в основании треугольника схемы, то есть S с P и P с S. Модель предполагает, что этапы связывания всегда в равновесии. Скорость реакции определяется выражением:
Применяя предположение о быстром равновесии, мы можем записать различные комплексы в терминах констант равновесия, чтобы получить:
где . и члены представляют собой отношение субстрата и продукта к их соответствующим константам полунасыщения, а именно и и
Используя собственные обозначения автора, если фермент имеет сайтов, которые могут связывать лиганд, можно показать, что в общем случае форма имеет вид:
Некооперативное обратимое уравнение Михаэлиса-Ментена можно увидеть, когда мы устанавливаем коэффициент Хилла равным единице.
Если фермент необратим, уравнение превращается в простое уравнение Михаэлиса-Ментен, которое необратимо. При установке константы равновесия на бесконечность уравнение возвращается к более простому случаю, когда произведение препятствует обратному шагу.
Было проведено сравнение MWC и обратимого уравнения Хилла. [ 9 ]
Модификация обратимого уравнения Хилла была опубликована Вестермарком и др. [ 10 ] где модификаторы вместо этого повлияли на каталитические свойства. Было показано, что этот вариант гораздо лучше подходит для описания кинетики мышечной фосфофруктокиназы .
Ссылки
[ редактировать ]- ^ Jump up to: а б Хофмейр, Ян-Хендрик С.; Корниш-Боуден, Хофмейр (1997). «Обратимое уравнение Хилла: как включить кооперативные ферменты в метаболические модели» . Биоинформатика . 13 (4): 377–385. дои : 10.1093/биоинформатика/13.4.377 .
- ^ Попова С.В.; Сельков Э.Е. (15 мая 1975 г.). «Обобщение модели Моно, Ваймана и Чанже на случай обратимой моносубстратной реакции». Письма ФЭБС . 53 (3): 269–273. дои : 10.1016/0014-5793(75)80034-2 .
- ^ Саа, Педро А.; Нильсен, Ларс К. (декабрь 2017 г.). «Формулирование, построение и анализ кинетических моделей метаболизма: обзор систем моделирования». Достижения биотехнологии . 35 (8): 981–1003. doi : 10.1016/j.biotechadv.2017.09.005 .
- ^ Либермейстер, Вольфрам; Улендорф, Яннис; Клипп, Эдда (15 июня 2010 г.). «Модульные законы скорости ферментативных реакций: термодинамика, эластичность и реализация» . Биоинформатика . 26 (12): 1528–1534. doi : 10.1093/биоинформатика/btq141 .
- ^ Вестермарк, Пол О.; Ланснер, Андерс (июль 2003 г.). «Модель фосфофруктокиназы и гликолитических колебаний в β-клетках поджелудочной железы» . Биофизический журнал . 85 (1): 126–139. дои : 10.1016/S0006-3495(03)74460-9 . ПМК 1303071 . ПМИД 12829470 .
- ^ Мишкович, Любиша; Беал, Йонас; Море, Майкл; Хациманикатис, Василий (20 августа 2019 г.). «Снижение неопределенности в биохимических кинетических моделях: обеспечение желаемых свойств модели» . PLOS Вычислительная биология . 15 (8): e1007242. дои : 10.1371/journal.pcbi.1007242 . ПМК 6716680 . ПМИД 31430276 .
- ^ Корниш-Боуден, Атель (2012). Основы кинетики ферментов (4., полностью переработанное и значительно дополненное изд.). Вайнхайм: Уайли-Блэквелл. ISBN 978-3-527-33074-4 .
- ^ Сауро, Герберт М. (2013). Кинетика ферментов для системной биологии (2-е изд.). Нью-Йорк, штат Нью-Йорк: Издательство Ambrosius. ISBN 978-0982477335 .
- ^ Оливье, Б.Г.; Ровер, Дж. М.; Сноп, Дж.Л.; Хофмейр, Ж.-ХС (2006). «Сравнение регуляторного поведения двух совместных обратимых ферментных механизмов». Труды IEE - Системная биология . 153 (5): 335. doi : 10.1049/ip-syb:20060020 .
- ^ Вестермарк, Пол; Хеллгрен Коталески, Жанетт; Ланснер, Андерс (2004). «Вывод обратимого уравнения Хилла с модификаторами, влияющими на каталитические свойства» . Труды WSEAS по биологии и биомедицине . 1 : 91–98.