Комплекс Крейца-Таубе
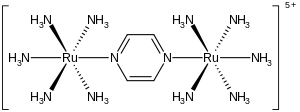
Ион Крейца –Таубе представляет собой металлокомплекс формулы {[ Ru ( NH 3 ) 5 ] 2 (C 4 H 4 N 2 )} 5+ . Этот катионный вид тщательно изучался в попытке понять интимные детали переноса электронов во внутренней сфере , то есть того, как электроны перемещаются от одного металлокомплекса к другому. Ион назван в честь Кэрол Крейц , которая первой подготовила комплекс, и ее научного руководителя Генри Таубе , получившего Нобелевскую премию по химии за это и связанные с ним открытия в области переноса электронов. [1] [2]
Свойства [ править ]
Комплекс состоит из двух пентаминных рутениевых единиц, связанных с атомами азота мостиковым пиразиновым лигандом, который завершает октаэдрическую координационную сферу каждого металла. Важной особенностью соединения является то, что оба металла имеют кажущуюся дробную степень окисления +2,5. Обычно ионы металлов, как и большинство ионов, имеют целые степени окисления. Например, амминные комплексы рутения обычно имеют +2 или +3. Тот факт, что степени окисления полуцелые, указывает на то, что два центра Ru(NH 3 ) 5 эквивалентны по числу электронов. Кристаллографические и теоретические исследования согласуются с этим описанием, то есть два металлоцентра эквивалентны. [3] [4] Характеризуясь комплексом смешанной валентности , этот ион сильно поглощает свет в ближней инфракрасной части электромагнитного спектра . В случае иона Крейца–Таубе максимум поглощения приходится на длину волны 1570 нм . Это поглощение описывается как интервальная полоса переноса заряда .
Синтез [ править ]
Первоначально ион был выделен в виде гидратированной тозилатной соли [Ru(NH 3 ) 5 ] 2 (C 4 H 4 N 2 )(O 3 SC 6 H 4 CH 3 ) 5 ·3H 2 O. Его получают в две стадии путем пиразиновый комплекс Ru(III)-Ru(III):. [3]
- 2 [Ru(NH 3 ) 5 Cl] 2+ + C 4 ЧАС 4 N 2 → {[Ru(NH 3 ) 5 ] 2 (C 4 H 4 N 2 )} 6+ + 2 кл. −
- 2 {[Ru(NH 3 ) 5 ] 2 (C 4 H 4 N 2 )} 6+ + Zn → 2 {Ru(NH 3 ) 5 ] 2 (C 4 H 4 N 2 )} 5+ + Цинк 2+
Ион Крейца-Таубе иллюстрирует преимущества комплексов рутения для изучения окислительно-восстановительных реакций. Ионы Ru(II) и Ru(III) могут взаимно превращаться при слабых окислительно-восстановительных потенциалах . Обе эти степени окисления кинетически инертны. Многие аналоги этого иона были получены с использованием различных мостиковых лигандов.
Ссылки [ править ]
- ^ Крейц, К.; Таубе, Х. (1969). «Прямой подход к измерению барьера Франка – Кондона для переноса электронов между ионами металлов». Журнал Американского химического общества . 91 (14): 3988–3989. дои : 10.1021/ja01042a072 .
- ^ Таубе, Генри (8 декабря 1983 г.). «Перенос электрона между металлокомплексами» . Нобелевская лекция.
- ^ Jump up to: Перейти обратно: а б Фюрхольц, У.; Джосс, С.; Бюрги, HB; Люди, А. (1985). «Возвращение к комплексу Крейца-Таубе: кристаллографическое исследование серии электронного переноса ( μ -пиразин)декаамминдирутения ([(NH 3 ) 5 Ru(Pyz)Ru(NH 3 ) 5 ] п + ( n = 4–6))». Неорганическая химия . 24 (6): 943–948. doi : 10.1021/ic00200a028 .
- ^ Демадис, К.Д.; Хартшорн, СМ; ТиДжей, Мейер (2001). «Переход от локализованного к делокализованному в химии смешанной валентности». Химические обзоры . 101 (9): 2655–2686. дои : 10.1021/cr990413m . ПМИД 11749392 .