Кубический атом
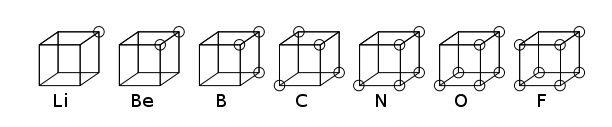
Кубический атом был ранней атомной моделью, в которой электроны располагались в восьми углах куба неполярного атома или молекулы. Эта теория была разработана в 1902 году Гилбертом Н. Льюисом и опубликована в 1916 году в статье «Атом и молекула» и использована для объяснения явления валентности . [1] Теория Льюиса основывалась на правиле Абегга . В 1919 году он был развит Ирвингом Ленгмюром как кубический октетный атом . [2] На рисунке ниже показаны структурные представления для элементов второго ряда таблицы Менделеева .
Хотя от кубической модели атома вскоре отказались в пользу квантово-механической модели, основанной на уравнении Шредингера , и поэтому теперь она представляет преимущественно исторический интерес, она представляет собой важный шаг на пути к пониманию химической связи. Статья Льюиса 1916 года также представила концепцию электронной пары в ковалентной связи , правило октетов и ныне называемую структуру Льюиса .
в модели атома Связь кубического
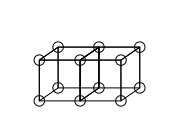
Одиночные ковалентные связи образуются, когда два атома имеют общий край, как в структуре C ниже. Это приводит к совместному использованию двух электронов. Ионные связи образуются путем переноса электрона из одного куба в другой без разделения ребра (структура А ). Промежуточное состояние, в котором общий только один угол (структура B ), также было постулировано Льюисом.
Двойные связи образуются за счет общей грани между двумя кубическими атомами. Это приводит к разделению четырех электронов:
Тройные связи не могут быть учтены моделью кубического атома, поскольку невозможно, чтобы два куба имели три параллельных ребра. Льюис предположил, что электронные пары в атомных связях обладают особым притяжением, в результате чего образуется тетраэдрическая структура, как на рисунке ниже (новое расположение электронов показано пунктирными кружками в середине толстых ребер). Это позволяет образовывать одинарную связь за счет общего угла, двойную связь за счет общего края и тройную связь за счет общей грани. Это также объясняет свободное вращение вокруг одинарных связей и тетраэдрическую геометрию метана.
См. также [ править ]
Ссылки [ править ]
- ^ Льюис, Гилберт Н. (1 апреля 1916 г.). «Атом и молекула» . Журнал Американского химического общества . 38 (4): 762–785. дои : 10.1021/ja02261a002 . S2CID 95865413 .
- ^ Ленгмюр, Ирвинг (1 июня 1919 г.). «Расположение электронов в атомах и молекулах» . Журнал Американского химического общества . 41 (6): 868–934. дои : 10.1021/ja02227a002 .