Валентность (химия)
В химии валентность валентность (американское написание) или соединений (британское написание) атома является мерой его способности объединяться с другими атомами при образовании химических или молекул . Под валентностью обычно понимают количество химических связей , которые обычно образует каждый атом данного химического элемента . Двойные связи считаются двумя, тройные — тремя, четверные — четырьмя, пятерными — пятью, шестикратными — шестью. В большинстве соединений валентность водорода равна 1, кислорода — 2, азота — 3 и углерода — 4. Валентность не следует путать с соответствующими понятиями о координационном числе , степени окисления или числе валентные электроны для данного атома.
Описание
Валентность — это комбинационная способность атома данного элемента, определяемая числом атомов водорода, с которыми он соединяется. В метане углерод имеет валентность 4; в аммиаке азот имеет валентность 3; в воде кислород имеет валентность 2; а в хлористом водороде хлор имеет валентность 1. Хлор, поскольку он имеет валентность равна единице, может заменять водород во многих соединениях. Фосфор имеет валентность 3 в фосфине ( PH 3 ) и валентность 5 у пентахлорида фосфора ( PCl 5 ), что показывает, что элемент может иметь более одной валентности. Структурная формула соединения представляет собой связь атомов, а линии, проведенные между двумя атомами, обозначают связи. [1] В двух таблицах ниже показаны примеры различных соединений, их структурные формулы и валентности каждого элемента соединения.
| Сложный | Ч 2 Водород | СН 4 Метан | C3HC3H8 Пропан | C3HC3H6 Пропилен | С 2 Ч 2 Ацетилен |
|---|---|---|---|---|---|
| Диаграмма |  |  |  | ||
| Валентности |
|
|
|
|
|
| Сложный | NHNH3 Аммиак | NaCN Цианид натрия | PSCl 3 Тиофосфорилхлорид | Ч 2 С Сероводород | Н 2 ТАК 4 Серная кислота | H2S2OH2S2O6 Дитионовая кислота | Cl2OCl2O7 Гептоксид дихлора | КсеО 4 Четырехокись ксенона |
|---|---|---|---|---|---|---|---|---|
| Диаграмма |  |  |  |  |  |  |  | |
| Валентности |
|
|
|
|
|
|
|
|
Определение
Валентность определяется ИЮПАК как : [2]
- Максимальное количество одновалентных атомов (первоначально атомов водорода или хлора), которые могут соединяться с атомом рассматриваемого элемента или с его фрагментом или которые могут быть заменены атомом этого элемента.
Альтернативное современное описание: [3]
- Число атомов водорода, которые могут соединяться с элементом в бинарном гидриде, или в два раза больше числа атомов кислорода, соединяющихся с элементом в его оксиде или оксидах.
Это определение отличается от определения ИЮПАК, поскольку можно сказать, что элемент имеет более одной валентности.
Историческое развитие
Этимология слов валентность валентностей (множественное число валентностей ) и валентность (множественное число ) восходит к 1425 году и означает «экстракт, приготовление», от латинского валентия «сила, способность», от более раннего valor «ценность, ценность», и химического значение, относящееся к «объединяющей силе элемента», записано с 1884 года от немецкого Valenz . [4]

Концепция валентности была разработана во второй половине XIX века и помогла успешно объяснить молекулярное строение неорганических и органических соединений. [1] Поиск основных причин валентности привел к появлению современных теорий химической связи, включая кубический атом (1902 г.), структуры Льюиса (1916 г.), теорию валентной связи (1927 г.), молекулярные орбитали (1928 г.), теорию отталкивания электронных пар валентной оболочки . (1958) и все передовые методы квантовой химии .
В 1789 году Уильям Хиггинс опубликовал взгляды на то, что он назвал комбинациями «предельных» частиц, что предвосхитило концепцию валентных связей . [5] Если бы, например, по Хиггинсу, сила между предельной частицей кислорода и предельной частицей азота была равна 6, то сила силы разделилась бы соответственно, и аналогично для других комбинаций предельных частиц (см. иллюстрацию) .
Однако точное зарождение теории химической валентности можно проследить до статьи Эдварда Франкленда 1852 года , в которой он объединил старую радикальную теорию с мыслями о химическом сродстве, чтобы показать, что некоторые элементы имеют тенденцию объединяться с другими элементами для образуют соединения, содержащие 3, т.е. в 3-атомных группах (например, НЕТ 3 , НХ3 , NI 3 и т.д.) или 5, т.е. в 5-атомных группах (например, НЕТ 5 , NH 4 О , ПО 5 и др.), эквиваленты присоединенных элементов. По его мнению, именно таким образом их близость лучше всего удовлетворяется, и, следуя этим примерам и постулатам, он заявляет, насколько очевидно, что [6]
Тенденция или закон преобладает (здесь), и что, каковы бы ни были свойства соединяющихся атомов, объединяющая сила притягивающего элемента, если мне будет позволен этот термин, всегда удовлетворяется одним и тем же числом этих атомов. .
Эту «объединяющую силу» впоследствии назвали квантивалентностью или валентностью (а американские химики валентностью). [5] В 1857 году Август Кекуле предложил фиксированную валентность для многих элементов, например, 4 для углерода, и использовал их для создания структурных формул для многих органических молекул, которые принимаются до сих пор.
Лотар Мейер в своей книге 1864 года « Die Modernen Theorien der Chemie » содержал раннюю версию таблицы Менделеева, содержащей 28 элементов, впервые классифицировал элементы на шесть семейств по их валентности . Работы по организации элементов по атомному весу до сих пор тормозились из-за широкого использования эквивалентных весов элементов, а не атомных весов. [7]
Большинство химиков XIX века определяли валентность элемента как количество его связей, не различая различные типы валентности или связи. Однако в 1893 году Альфред Вернер описал переходных металлов, координационные комплексы такие как [Co(NH 3 ) 6 ]Cl 3 , в котором он различал главную и вспомогательную валентности (нем. «Hauptvalenz» и «Nebenvalenz»), соответствующие современным представлениям о степени окисления и координационном числе соответственно.
Для элементов основной группы в 1904 году Ричард Абегг рассмотрел положительную и отрицательную валентность (максимальную и минимальную степени окисления) и предложил правило Абегга о том, что их разница часто равна 8.
атома Альтернативное определение валентности, разработанное в 1920-х годах и имеющее современных сторонников, отличается в случаях, когда формальный заряд не равен нулю. Он определяет валентность данного атома в ковалентной молекуле как количество электронов, которые атом использовал для образования связи: [8] [9] [10] [11]
- валентность = количество электронов в валентной оболочке свободного атома - количество несвязывающих электронов на атоме в молекуле ,
или эквивалентно:
- валентность = количество связей + формальный заряд .
Согласно этому соглашению, азот в аммония ионе [НХ 4 ] + связывается с четырьмя атомами водорода, но считается пятивалентным, поскольку в связи участвуют все пять валентных электронов азота. [8]
Электроны и валентность
Модель ядерного атома Резерфорда (1911) показала, что внешняя часть атома занята электронами , что позволяет предположить, что электроны ответственны за взаимодействие атомов и образование химических связей. В 1916 году Гилберт Н. Льюис объяснил валентность и химическую связь с точки зрения тенденции атомов (основной группы) достигать стабильного октета из 8 электронов валентной оболочки. По мнению Льюиса, ковалентная связь приводит к образованию октетов за счет совместного использования электронов, а ионная связь приводит к образованию октетов за счет переноса электронов от одного атома к другому. Термин «ковалентность» приписывается Ирвингу Ленгмюру , который в 1919 году заявил, что «количество пар электронов , которые любой данный атом разделяет с соседними атомами, называется ковалентностью этого атома». [12] Приставка co- означает «вместе», так что ковалентная связь означает, что атомы имеют общую валентность. Вследствие этого теперь чаще говорят о ковалентных связях , а не о валентных , которые вышли из употребления в работах более высокого уровня из-за достижений теории химической связи, но до сих пор широко используются в элементарных исследованиях, где он обеспечивает эвристическое введение в предмет.
В 1930-х годах Лайнус Полинг предположил, что существуют также полярные ковалентные связи , занимающие промежуточное положение между ковалентными и ионными, и что степень ионного характера зависит от разницы электроотрицательности двух связанных атомов.
Полинг также рассматривал гипервалентные молекулы , в которых элементы основной группы имеют кажущуюся валентность, превышающую максимальное значение из 4, разрешенное правилом октетов. Например, в молекуле гексафторида серы ( SF 6 ), Полинг считал, что сера образует 6 истинных двухэлектронных связей с помощью sp 3 д 2 гибридные атомные орбитали , объединяющие одну s, три p и две d-орбитали. Однако совсем недавно квантово-механические расчеты на этой и подобных молекулах показали, что роль d-орбиталей в связи минимальна и что Молекулу SF 6 следует описывать как имеющую 6 полярных ковалентных (частично ионных) связей, образованных только из четырех орбиталей серы (одной s и трех p) в соответствии с правилом октетов, а также шести орбиталей фтора. [13] Аналогичные расчеты на молекулах переходных металлов показывают, что роль p-орбиталей незначительна, так что для описания связи достаточно одной s- и пяти d-орбиталей металла. [14]
Общие валентности
Для элементов основных групп таблицы Менделеева валентность может варьироваться от 1 до 8.
| Группа | Валентность 1 | Валентность 2 | Валентность 3 | Валентность 4 | Валентность 5 | Валентность 6 | Валентность 7 | Валентность 8 | Типичные валентности |
|---|---|---|---|---|---|---|---|---|---|
| 1 (я) | NaCl КСl | 1 | |||||||
| 2 (II) | MgCl 2 СаСl 2 | 2 | |||||||
| 13 (III) | ИнБр ТлИ | БСl 3 AlCl 3 Al2OAl2O3 | 3 | ||||||
| 14 (IV) | СО PbCl 2 | СО 2 СН 4 SiCl 4 | 2 и 4 | ||||||
| 15 (V) | НЕТ | NHNH3 РН 3 As2OAs2O3 | НЕТ 2 | N2ON2O5 ПКл 5 | 3 и 5 | ||||
| 16 (VI) | Н 2 О Ч 2 С СЦл 2 | SOSO2 СФ 4 | SOSO3 СФ 6 Н 2 ТАК 4 | 2, 4 и 6 | |||||
| 17 (VII) | HCl ICl | HClO 2 КлФ 3 | ClO 2 | ЕСЛИ 5 HClO3 | ЕСЛИ 7 Cl2OCl2O7 HClO 4 | 1, 3, 5 и 7 | |||
| 18 (VIII) | КрФ 2 | КсеФ 4 | КсеО 3 | КсеО 4 | 0, 2, 4, 6 и 8 |
Многие элементы имеют общую валентность, связанную с их положением в таблице Менделеева, и в настоящее время это объясняется правилом октетов . Префиксы греческих/латинских цифр (моно-/уни-, ди-/би-, три-/тер- и т. д.) используются для описания ионов в зарядовых состояниях 1, 2, 3 и т. д. соответственно. Поливалентность или многовалентность относится к видам , которые не ограничены определенным количеством валентных связей . Виды с одним зарядом являются унивалентными (моновалентными). Например, Cs + катион представляет собой одновалентный или одновалентный катион, тогда как Что 2+ катион является двухвалентным катионом, а Фе 3+ катион представляет собой трехвалентный катион. В отличие от Cs и Ca, Fe также может существовать в других зарядовых состояниях, особенно 2+ и 4+, и поэтому известен как многовалентный (поливалентный) ион. [15] Переходные металлы и металлы справа обычно многовалентны, но не существует простой закономерности, предсказывающей их валентность. [16]
| Валентность | Более распространенное прилагательное ‡ | Менее распространенное синоним прилагательное ‡§ |
|---|---|---|
| 0-валентный | zerovalent | невалентный |
| 1-валентный | одновалентный | одновалентный |
| 2-валентный | двухвалентный | двухвалентный |
| 3-валентный | трехвалентный | трехвалентный |
| 4-валентный | четырехвалентный | четырехвалентный |
| 5-валентный | пятивалентный | quinquevalentпятивалентный они эквивалентны |
| 6-валентный | шестивалентный | сексивалентный |
| 7-валентный | семивалентный | семивалентный |
| 8-валентный | восьмивалентный | — |
| 9-валентный | невалентный | — |
| 10-валентный | они обесценены | — |
| 11-валентный | недекавалентный | — |
| 12-валентный | двенадцативалентный | — |
| множественный/многие/переменная | поливалентный | многовалентный |
| вместе | ковалентный | — |
| не вместе | нековалентный | — |
† Те же прилагательные используются в медицине для обозначения валентности вакцины, с той небольшой разницей, что в последнем смысле квадри- встречается чаще, чем тетра- .
‡ Как показывают данные по количеству посещений веб-поиска Google и поисковых систем Google Книг (по состоянию на 2017 г.).
§ Несколько других форм можно найти в больших англоязычных корпусах (например, *quintaвалентная, *quintiвалентная, *deciвалентная ), но они не являются общепринятыми формами английского языка и поэтому не вводятся в основные словари.
Валентность в зависимости от степени окисления
Из-за неоднозначности термина валентность, [17] в настоящее время предпочтительны другие обозначения. Помимо лямбда-нотации, используемой в номенклатуре неорганической химии ИЮПАК , [18] Степень окисления является более четким показателем электронного состояния атомов в молекуле.
Степень окисления атома в молекуле определяет количество валентных электронов, которые он приобрел или потерял. [19] В отличие от валентного числа степень окисления может быть положительной (для электроположительного атома) или отрицательной (для электроотрицательного атома).
Элементы в высокой степени окисления имеют степень окисления выше +4, а также элементы в высоковалентном состоянии ( гипервалентные элементы) имеют валентность выше 4. Например, в перхлоратах ClO - 4 , хлор имеет 7 валентных связей (таким образом, он семивалентен, т. е. имеет валентность 7), и имеет степень окисления +7; в четырехокиси рутения RuO 4 , рутений имеет 8 валентных связей (таким образом, он восьмивалентен, иначе говоря, имеет валентность 8), и имеет степень окисления +8.
В некоторых молекулах существует разница между валентностью и степенью окисления для данного атома. Например, в декафторида дисеры молекуле S 2 F 10 , каждый атом серы имеет 6 валентных связей (5 одинарных связей с атомами фтора и 1 одинарную связь с другим атомом серы). Таким образом, каждый атом серы шестивалентен или имеет валентность 6, но имеет степень окисления +5. В дикислорода молекуле O 2 , каждый атом кислорода имеет 2 валентные связи и поэтому является двухвалентным (валентность 2), но имеет степень окисления 0. В ацетилене H-C≡C-H , каждый атом углерода имеет 4 валентные связи (1 одинарную связь с атомом водорода и тройную связь с другим атомом углерода ). Каждый атом углерода четырехвалентен (валентность 4), но имеет степень окисления -1.
Примеры
| Сложный | Формула | Валентность | Степень окисления | Диаграмма |
|---|---|---|---|---|
| Хлороводород | HCl | Н = 1 Кл = 1 | Н = +1 Cl = −1 | H-Cl |
| Хлорная кислота * | HClO 4 | Н = 1 Cl = 7 О = 2 | H = +1 Cl = +7 O = −2 | 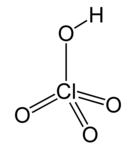 |
| Метан | СН 4 | С = 4 Ч = 1 | С = −4 Ч = +1 |  |
| Дихлорметан ** | СН 2 Cl 2 | С = 4 Н = 1 Cl = 1 | C = 0 H = +1 Cl = −1 |  |
| Оксид железа *** | FeO | Fe = 2 О = 2 | Fe = +2 О = −2 | Fe=O |
| Оксид железа *** | Fe2OFe2O3 | Fe = 3 О = 2 | Fe = +3 О = −2 | О=Fe-O-Fe=O |
| Гидрид натрия | Сейчас | На = 1 Н = 1 | Na = +1 H = −1 | На-Х |
* Перхлорат- ион ClO − 4 одновалентен, другими словами, имеет валентность 1.
** Валентности также могут отличаться от абсолютных значений степеней окисления из-за различной полярности связей. Например, дихлорметане в CH 2 Cl 2 , углерод имеет валентность 4, но степень окисления 0.
*** Оксиды железа появляются в кристаллической структуре , поэтому типичную молекулу идентифицировать невозможно. В оксиде железа Fe имеет степень окисления +2; у оксида железа степень окисления +3.
| Сложный | Формула | Валентность | Степень окисления | Диаграмма |
|---|---|---|---|---|
| Водород | Ч 2 | Ч = 1 | Ч = 0 | Ч-Ч |
| хлор | кл 2 | кл = 1 | кл = 0 | Cl-Cl |
| Перекись водорода | Н 2 О 2 | Ч = 1 О = 2 | Ч = +1 О = −1 |  |
| Гидразин | Н 2 Ч 4 | Н = 1 Н = 3 | Ч = +1 Н = −2 |  |
| Декафторид дисеры | С 2 Ж 10 | С = 6 Ф = 1 | С = +5 Ф = −1 |  |
| Дитионовая кислота | H2S2OH2S2O6 | С = 6 О = 2 Ч = 1 | S = +5 О = −2 H = +1 |  |
| Гексахлорэтан | С 2 Кл 6 | С = 4 Cl = 1 | С = +3 Cl = −1 |  |
| Этилен | С 2 Ч 4 | С = 4 Ч = 1 | С = −2 Ч = +1 |  |
| Ацетилен | С 2 Ч 2 | С = 4 Ч = 1 | С = −1 Ч = +1 | H−C≡C−H |
| Хлорид ртути(I) | Ртуть 2 Cl 2 | Hg = 2 Cl = 1 | Hg = +1 Cl = −1 | Cl-Hg-Hg-Cl |
Определение «Максимального количества облигаций»
Франкленд придерживался мнения, что валентность (он использовал термин «атомность») элемента представляет собой единственную величину, соответствующую максимальному наблюдаемому значению. Число неиспользованных валентностей на атомах того, что сейчас называют элементами p-блока , обычно четное, и Франкленд предположил, что неиспользованные валентности насыщают друг друга. Например, азот имеет максимальную валентность 5, при образовании аммиака две валентности остаются незакрепленными; сера имеет максимальную валентность 6, при образовании сероводорода четыре валентности остаются неприсоединенными. [20] [21]
Международный союз теоретической и прикладной химии (ИЮПАК) предпринял несколько попыток прийти к однозначному определению валентности. Текущая версия, принятая в 1994 году: [22]
- Максимальное количество одновалентных атомов (первоначально атомов водорода или хлора), которые могут соединяться с атомом рассматриваемого элемента или с его фрагментом или которые могут быть заменены атомом этого элемента. [2]
Водород и хлор первоначально использовались в качестве примеров одновалентных атомов, поскольку по своей природе они образуют только одну одинарную связь. Водород имеет только один валентный электрон и может образовывать только одну связь с атомом, имеющим неполную внешнюю оболочку . Хлор имеет семь валентных электронов и может образовывать только одну связь с атомом, который отдает валентный электрон для завершения внешней оболочки хлора. Однако хлор также может иметь степени окисления от +1 до +7 и может образовывать более одной связи, отдавая валентные электроны .
Водород имеет только один валентный электрон, но может образовывать связи более чем с одним атомом. В бифторид- ионе ( [ВЧ 2 ] − ), например, образует трехцентровую четырехэлектронную связь с двумя атомами фторида:
- [F-HF − ↔ Ф − Ч-Ф]
Другой пример - трехцентровая двухэлектронная связь в диборане ( Б 2 Ч 6 ).
Максимальные валентности элементов
Максимальные валентности элементов основаны на данных списка степеней окисления элементов . Они обозначены цветовым кодом внизу таблицы.
| Максимальные валентности элементов | |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||
| Группа → | |||||||||||||||||||||
| ↓ Период | |||||||||||||||||||||
| 1 | 1 ЧАС | 2 Он | |||||||||||||||||||
| 2 | 3 Что | 4 Быть | 5 Б | 6 С | 7 Н | 8 ТО | 9 Ф | 10 Ne | |||||||||||||
| 3 | 11 Уже | 12 мг | 13 Ал | 14 И | 15 П | 16 С | 17 кл. | 18 С | |||||||||||||
| 4 | 19 К | 20 Что | 21 наук | 22 Из | 23 V | 24 Кр | 25 Мин. | 26 Фе | 27 Ко | 28 В | 29 С | 30 Зн | 31 Здесь | 32 Ге | 33 Как | 34 Се | 35 Бр | 36 НОК | |||
| 5 | 37 руб. | 38 старший | 39 И | 40 Зр | 41 Нб | 42 Мо | 43 Тс | 44 Ру | 45 резус | 46 ПД | 47 В | 48 компакт-диск | 49 В | 50 Сн | 51 Сб | 52 Te | 53 я | 54 Машина | |||
| 6 | 55 Cs | 56 Нет | 71 Лу | 72 хф | 73 Облицовка | 74 В | 75 Ре | 76 Ты | 77 И | 78 Пт | 79 В | 80 ртуть | 81 Тл | 82 Pb | 83 С | 84 Po | 85 В | 86 Рн | |||
| 7 | 87 Пт | 88 Солнце | 103 лр | 104 РФ | 105 ДБ | 106 Сг | 107 Бх | 108 Хс | 109 гора | 110 Дс | 111 Рг | 112 Сп | 113 Нх | 114 В | 115 Мак | 116 Лев | 117 Ц | 118 И | |||
| 57 La | 58 Этот | 59 Пр | 60 Нд | 61 вечера | 62 см | 63 Евросоюз | 64 Б-г | 65 Тб | 66 Те | 67 К | 68 Является | 69 Тм | 70 Ыб | ||||||||
| 89 И | 90 че | 91 Хорошо | 92 В | 93 Например | 94 Мог | 95 Являюсь | 96 См | 97 Бк | 98 См. | 99 Является | 100 Фм | 101 Мэриленд | 102 Нет | ||||||||
| Максимальные валентности основаны на Списке степеней окисления элементов. | |||||||||||||||||||||
0 1 2 3 4 5 6 7 8 9 Неизвестно Цвет фона показывает максимальную валентность химического элемента. | |||||||||||||||||||||
См. также
Ссылки
- ^ Jump up to: а б Партингтон, Джеймс Риддик (1921). Учебник неорганической химии для студентов вузов (1-е изд.). ОЛ 7221486М .
- ^ Jump up to: а б Определение Золотой книги ИЮПАК : валентность
- ^ Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . ISBN 978-0-08-037941-8 .
- ^ Харпер, Дуглас. «валентность» . Интернет-словарь этимологии .
- ^ Jump up to: а б Партингтон, младший (1989). Краткая история химии . Dover Publications, Inc. ISBN 0-486-65977-1 .
- ^ Франкленд, Э. (1852 г.). «О новой серии органических тел, содержащих металлы». Философские труды Лондонского королевского общества . 142 : 417–444. дои : 10.1098/rstl.1852.0020 . S2CID 186210604 .
- ^ Алан Дж. Рок (1984). Химический атомизм в девятнадцатом веке: от Дальтона до Канниццаро . Издательство Университета штата Огайо.
- ^ Jump up to: а б Паркин, Джерард (май 2006 г.). «Валентность, степень окисления и формальный заряд: три связанных, но принципиально разных понятия». Журнал химического образования . 83 (5): 791. doi : 10.1021/ed083p791 . ISSN 0021-9584 .
Хотя концепции и определения валентности с годами уточнялись, определение, описанное Сиджвиком, остается наиболее полезным и простым определением для ковалентных молекул: валентность атома в ковалентной молекуле — это просто количество электронов, которые атом использовал в склеивание.
- ^ Сиджвик, Невада (1927). Электронная теория валентности . Лондон: Издательство Оксфордского университета (Clarendon Press). п. 199.
В целом, по-видимому, лучшим определением абсолютной валентности является то, которое было принято Гриммом и Зоммерфельдом: оно численно равно числу электронов атома, «участвующих» (beansprucht) в присоединении других атомов.
- ^ Гримм, Х.Г.; Зоммерфельд, А (1926). «О связи замыкания электронных групп в атоме с химическими валентными числами». Журнал физики . 36 (1): 36–59. Бибкод : 1926ZPhy...36...36G . дои : 10.1007/bf01383924 . S2CID 120248399 .
- ^ Смит, Дерек В. (2005). «Валентность, ковалентность, гипервалентность, степень окисления и координационное число». Журнал химического образования . 82 (8): 1202. doi : 10.1021/ed082p1202 . ISSN 0021-9584 .
- ^ Ленгмюр, Ирвинг (1919). «Расположение электронов в атомах и молекулах» . Журнал Американского химического общества . 41 (6): 868–934. дои : 10.1021/ja02227a002 .
- ^ Магнуссон, Эрик (1990). «Гиперкоординированные молекулы элементов второго ряда: d-функции или d-орбитали?». Дж. Ам. хим. Соц . 112 (22): 7940–7951. дои : 10.1021/ja00178a014 .
- ^ Фрекинг, Гернот; Шайк, Сасон, ред. (май 2014 г.). «Глава 7: Химическая связь в соединениях переходных металлов». Химическая связь: химическая связь в периодической таблице . Вайли – ВЧ. ISBN 978-3-527-33315-8 .
- ^ Merriam-Webster , Полный словарь Merriam-Webster , Merriam-Webster, заархивировано из оригинала 25 мая 2020 г. , получено 11 мая 2017 г.
- ^ «Урок 7: Ионы и их названия» . Общественный колледж Клакамаса . Архивировано из оригинала 21 января 2019 года . Проверено 5 февраля 2019 г.
- ^ Бесплатный словарь: валентность
- ^ ИЮПАК , Сборник химической терминологии , 2-е изд. («Золотая книга») (1997). Интернет-исправленная версия: (2006–) « Лямбда ». дои : 10.1351/goldbook.L03418
- ^ ИЮПАК , Сборник химической терминологии , 2-е изд. («Золотая книга») (1997). Интернет-исправленная версия: (2006–) « Статус окисления ». два : 10.1351/goldbook.O04365
- ^ Франкленд, Э. (1870). Конспекты лекций для студентов-химиков (электронная книга Google) (2-е изд.). Дж. Ван Ворст. п. 21.
- ^ Франкленд, Э .; Джепп, Франция (1885 г.). Неорганическая химия (1-е изд.). стр. 75–85. ОЛ 6994182М .
- ^ Мюллер, П. (1994). «Словарь терминов, используемых в физической органической химии (Рекомендации ИЮПАК 1994 г.)» . Чистая и прикладная химия . 66 (5): 1077–1184. дои : 10.1351/pac199466051077 . S2CID 195819485 .