История атомной теории

Атомная теория — это научная теория, согласно которой материя состоит из частиц, называемых атомами . Определение слова «атом» менялось с годами в ответ на научные открытия. Первоначально оно относилось к гипотетической концепции существования некой фундаментальной частицы материи, слишком маленькой, чтобы ее можно было увидеть невооруженным глазом, и которую невозможно разделить. Затем определение было уточнено до основных частиц химических элементов, когда химики заметили, что элементы, по-видимому, объединяются друг с другом в соотношениях небольших целых чисел. Затем физики обнаружили, что эти частицы имеют собственную внутреннюю структуру и поэтому, возможно, не заслуживают названия «атомы», но переименование атомов к тому моменту было бы непрактично.
Теория атома является одним из наиболее важных научных достижений в истории. В начале «Фейнмановских лекций по физике» физик и нобелевский лауреат Ричард Фейнман предлагает атомную гипотезу как единственную наиболее плодотворную научную концепцию. [1]
Философский атомизм
Основная идея о том, что материя состоит из мельчайших неделимых частиц, — старая идея, появившаяся во многих древних культурах. Слово атом происходит от древнегреческого слова атомос , [а] что означает «неразрезаемый». Эта древняя идея была основана на философских рассуждениях, а не на научных рассуждениях. Современная теория атома не основана на этих старых концепциях. [2] [3] В начале 19 века учёный Джон Дальтон заметил, что химические вещества, по-видимому, соединяются друг с другом посредством дискретных и последовательных единиц веса, и он решил использовать слово «атом» для обозначения этих единиц. [4]
Основы
Ближе к концу XVIII века произошел ряд важных достижений в химии, не связанных с понятием атомной теории. Первым был Антуан Лавуазье, давший новое определение элементу как веществу, которое ученые не могли разложить на более простые вещества экспериментальным путем. Это положило конец древней идее о том, что элементами материи являются огонь, земля, воздух и вода, которая не имела экспериментального подтверждения. Лавуазье показал, что воду можно разложить на водород и кислород , которые в свою очередь он не смог разложить ни на что более простое, доказав тем самым, что это элементы. [5] Лавуазье также сформулировал закон сохранения массы , который гласит, что в химической реакции материя не появляется и не исчезает в воздухе; общая масса остается неизменной, даже если участвующие вещества были преобразованы. Наконец, существовал закон определенных пропорций , установленный французским химиком Жозефом Прустом в 1797 году, который гласит, что если соединение разложить на составляющие его химические элементы, то массы этих составляющих всегда будут иметь одинаковые весовые пропорции, независимо от количества или источника исходного соединения. Это определение отличало соединения от смесей. [6]
Закон кратных пропорций Дальтона

Джон Далтон изучал данные, собранные им самим и другими учеными. Он заметил закономерность, которая позже стала известна как закон множественных пропорций : в соединениях, которые содержат два отдельных элемента, количество элемента А на меру элемента B будет различаться в этих соединениях на долю небольших целых чисел. Это предполагало, что каждый элемент объединяется с другими элементами в количествах, кратных базовому количеству.
В 1804 году Дальтон объяснил свою атомную теорию своему другу и коллеге-химику Томасу Томсону , который опубликовал объяснение теории Дальтона в своей книге «Система химии» в 1807 году. По словам Томсона, идея Дальтона впервые пришла ему в голову во время экспериментов с «олефиантным газом». ( этилен ) и «карбюраторный водород» ( метан ). Дальтон обнаружил, что «карбюраторный газообразный водород» содержит в два раза больше водорода на меру углерода, чем «олефиантный газ», и пришел к выводу, что молекула «карбюраторного газообразного водорода» состоит из одного атома углерода и одного атома водорода, а молекула «карбюраторного газообразного водорода» "-один атом углерода и два атома водорода. [7] В действительности молекула этилена имеет два атома углерода и четыре атома водорода (C 2 H 4 ), а молекула метана – один атом углерода и четыре атома водорода (CH 4 ). В данном конкретном случае Дальтон ошибся в формулах этих соединений, и это была не единственная его ошибка. Но в других случаях он правильно понял их формулы. Следующие примеры взяты из собственных книг Дальтона «Новая система химической философии» (в двух томах, 1808 и 1817 гг.):
Пример 1 — оксиды олова: Дальтон выделил два типа оксида олова . Один из них представляет собой серый порошок, который Дальтон назвал «закисью олова», который на 88,1% состоит из олова и на 11,9% из кислорода. Другой представляет собой белый порошок, который Дальтон назвал «деоксидом олова», который состоит из 78,7% олова и 21,3% кислорода. Поправляя эти цифры, в сером порошке на каждые 100 г олова приходится около 13,5 г кислорода, а в белом порошке — около 27 г кислорода на каждые 100 г олова. 13,5 и 27 образуют соотношение 1:2. Эти соединения известны сегодня как оксид олова(II) (SnO) и оксид олова(IV) (SnO 2 ). В терминологии Дальтона «прооксид» — это молекула, содержащая один атом кислорода, а молекула «дейоксид» — два. [8] [9] Современные эквиваленты его терминов — моноксид и диоксид , но они не используются для обозначения оксидов олова, поскольку на самом деле они являются кристаллами; они не существуют в молекулярной форме.
Пример 2 — оксиды железа: Дальтон идентифицировал два оксида железа. Существует один тип оксида железа, представляющий собой черный порошок, который Дальтон назвал «прооксидом железа», который состоит из 78,1% железа и 21,9% кислорода. Другой оксид железа представляет собой красный порошок, который Дальтон назвал «промежуточным или красным оксидом железа», который состоит из 70,4% железа и 29,6% кислорода. Поправляя эти цифры, в черном порохе на каждые 100 г железа приходится около 28 г кислорода, а в красном порохе — около 42 г кислорода на каждые 100 г железа. 28 и 42 образуют соотношение 2:3. Этими соединениями являются оксид железа(II) и оксид железа(III) , их формулы Fe 2 O 2 и Fe 2 O 3 соответственно (формула оксида железа(II) обычно пишется как FeO, но здесь она пишется как Fe 2 O). 2, чтобы противопоставить его другому оксиду). Дальтон описал «промежуточный оксид» как «2 атома прооксида и 1 атома кислорода», что в сумме составляет два атома железа и три атома кислорода. В среднем это составляет полтора атома кислорода на каждый атом железа, что ставит его на полпути между «закисью» и «деуоксидом». [10] [11]
Пример 3 — оксиды азота: Дальтону были известны три оксида азота: «закись азота», «азотистый газ» и «азотная кислота». [12] Эти соединения известны сегодня как закись азота , оксид азота и диоксид азота соответственно. «Закись азота» состоит из 63,3% азота и 36,7% кислорода, что означает, что на каждые 140 г азота приходится 80 г кислорода. «Азотистый газ» состоит из 44,05% азота и 55,95% кислорода, что означает, что на каждые 140 г азота приходится 160 г кислорода. «Азотная кислота» состоит из 29,5% азота и 70,5% кислорода, что означает, что на каждые 140 г азота приходится 320 г кислорода. 80 г, 160 г и 320 г составляют соотношение 1:2:4. Формулы этих соединений: N 2 O, NO и NO 2 . [13] [14]
Дальтон определил атом как «первичную частицу» химического вещества и использовал термин «сложный атом» для обозначения «конечных частиц», которые содержат два или более элементов. Это противоречит современному определению, согласно которому атом — это основная частица химического элемента, а молекула — это скопление атомов. Термин «составной атом» сбивал с толку некоторых современников Дальтона, поскольку слово «атом» подразумевает неделимость, но он ответил, что если «атом» углекислого газа разделить, он перестает быть углекислым газом. «Атом» углекислого газа неделим в том смысле, что его нельзя разделить на более мелкие частицы углекислого газа. [4] [15]
Дальтон сделал следующие предположения о том, как «элементарные атомы» объединялись, образуя «сложные атомы» (то, что мы сегодня называем молекулами ). Когда два элемента могут образовывать только одно соединение, он предположил, что это один атом каждого, который он назвал «бинарным соединением». Если два элемента могут образовывать два соединения, первое соединение является бинарным соединением, а второе — «тройным соединением», состоящим из одного атома первого элемента и двух атомов второго. Если два элемента могут образовывать между собой три соединения, то третье соединение является «четвертичным» соединением, содержащим один атом первого элемента и три атома второго. [16] Дальтон считал воду «бинарным соединением», то есть одним атомом водорода и одним атомом кислорода. Дальтон не знал, что в естественном газообразном состоянии первичные частицы кислорода, азота и водорода существуют парами (O 2 , N 2 и H 2 ). Он также не знал о валентностях. Эти свойства атомов были открыты позднее, в XIX веке.
Поскольку атомы были слишком малы, чтобы их можно было непосредственно взвесить методами XIX века, Дальтон вместо этого выразил вес множества атомов как кратный весу атома водорода, который, как знал Дальтон, был самым легким элементом. По его измерениям, 7 граммов кислорода соединятся с 1 граммом водорода, образуя 8 граммов воды без остатка, и, предположив, что молекула воды состоит из одного атома кислорода и одного атома водорода, он пришел к выводу, что атомный вес кислорода равен 7. На самом деле это 16. Помимо несовершенства измерительных инструментов начала 19-го века, основной причиной этой ошибки было то, что Дальтон не знал, что молекула воды на самом деле имеет два атома водорода, а не один. Если бы он знал, он бы удвоил свою оценку до более точных 14. Эту ошибку исправил в 1811 году Амедео Авогадро . Авогадро предположил, что равные объемы любых двух газов при одинаковой температуре и давлении содержат одинаковое количество молекул (другими словами, масса частиц газа не влияет на объем, который он занимает). [17] Гипотеза Авогадро, которую сейчас обычно называют законом Авогадро , предоставила метод определения относительных весов молекул газообразных элементов, поскольку, если гипотеза верна, относительные плотности газов непосредственно указывают на относительные массы частиц, из которых состоят газы. Такой образ мышления непосредственно привел ко второй гипотезе: частицы некоторых элементарных газов представляли собой пары атомов, и при химической реакции эти молекулы часто расщеплялись надвое. Например, тот факт, что два литра водорода вступят в реакцию всего лишь с одним литром кислорода с образованием двух литров водяного пара (при постоянном давлении и температуре), предполагает, что одна молекула кислорода расщепляется надвое, образуя две молекулы воды. Формула воды H 2 O, а не HO. Авогадро измерил атомный вес кислорода, равный 15,074. [18]
Оппозиция атомной теории
Атомная теория Дальтона вызвала широкий интерес, но поначалу не все ее приняли. Было показано, что закон кратных пропорций не является универсальным законом, когда речь идет об органических веществах, молекулы которых могут быть довольно большими. Например, в олеиновой кислоте на каждые 216 г углерода приходится 34 г водорода, а на каждые 216 г углерода — 72 г водорода. 34 и 72 образуют соотношение 17:36, которое не является соотношением маленьких целых чисел. Теперь мы знаем, что вещества на основе углерода могут иметь очень большие молекулы, большие, чем любые другие элементы. Формула олеиновой кислоты — C 18 H 34 O 2 , а метана — CH 4 . [19] Закон кратных пропорций сам по себе не был полным доказательством, а атомная теория не была общепринятой до конца XIX века.
Одной из проблем было отсутствие единой номенклатуры. Слово «атом» подразумевало неделимость, но Дальтон определял атом как конечную частицу любого химического вещества , а не только элементов или даже материи как таковой. Это означало, что «сложные атомы», такие как углекислый газ, можно было разделить, в отличие от «элементарных атомов». Дальтон не любил слово «молекула», считая его «уменьшительным». [4] [20] Амадео Авогадро поступал наоборот: он использовал в своих трудах исключительно слово «молекула», избегая слова «атом», вместо этого используя термин «элементарная молекула». [21] Йенс Якоб Берцелиус использовал термин «органические атомы» для обозначения частиц, содержащих три или более элементов, поскольку он думал, что они существуют только в органических соединениях. Жан-Батист Дюма использовал термины «физические атомы» и «химические атомы»; «физический атом» представлял собой частицу, которую нельзя разделить физическими средствами, такими как температура и давление, а «химический атом» представлял собой частицу, которую нельзя было разделить с помощью химических реакций. [22]
Современные определения атома и молекулы — атом — основная частица элемента, а молекула — совокупность атомов — сложились во второй половине XIX века. Ключевым событием стал Конгресс в Карлсруэ в Германии в 1860 году. Это был первый международный конгресс химиков, целью которого было установление некоторых стандартов в обществе. Основным сторонником современного различия между атомами и молекулами был Станислао Канниццаро .
Различные количества того или иного элемента, участвующие в составе различных молекул, являются целыми кратными фундаментальной величины, которая всегда проявляется как неделимая сущность и которую следует правильно назвать атомом.
- Станислао Канниццаро , 1860 г. [23]
Канниццаро критиковал химиков прошлого, таких как Берцелиус, за то, что они не признавали, что частицы некоторых газообразных элементов на самом деле представляют собой пары атомов, что приводило к ошибкам в формулировках некоторых соединений. Берцелиус считал, что частицы газообразного водорода и хлора представляют собой одиночные атомы. Но он заметил, что когда один литр водорода реагирует с одним литром хлора, образуется два литра хлористого водорода вместо одного. Берцелиус решил, что закон Авогадро неприменим к соединениям. Канниццаро проповедовал, что если бы ученые просто признали существование одноэлементных молекул, такие расхождения в их открытиях были бы легко разрешены. Но у Берцелиуса для этого не нашлось даже слова. Берцелиус использовал термин «элементарный атом» для частицы газа, которая содержала только один элемент, и «составной атом» для частиц, содержащих два или более элементов, но не было ничего, что отличало бы H 2 от H, поскольку Берцелиус не верил в H 2 . Поэтому Канниццаро призвал к переопределению, чтобы ученые могли понять, что водород Молекула может расщепиться на два атома в ходе химической реакции. [24]
Второе возражение против атомной теории было философским. Учёные XIX века не имели возможности непосредственно наблюдать атомы. Они пришли к выводу о существовании атомов посредством косвенных наблюдений, таких как закон множественных пропорций Дальтона. Некоторые ученые, особенно те, кто принадлежал к школе позитивизма , утверждали, что ученые не должны пытаться вывести более глубокую реальность Вселенной, а только систематизировать те закономерности, которые они могут непосредственно наблюдать. Антиатомисты утверждали, что, хотя атомы могут быть полезной абстракцией для предсказания реакции элементов, они не отражают конкретную реальность.
Таких ученых иногда называли «эквивалентистами», поскольку они предпочитали теорию эквивалентных весов , которая является обобщением закона Пруста об определенных пропорциях. Например, 1 грамм водорода соединится с 8 граммами кислорода, образуя 9 граммов воды, следовательно, «эквивалентный вес» кислорода равен 8 граммам. Эта позиция была в конечном итоге опровергнута двумя важными достижениями, произошедшими позднее в XIX веке: разработкой таблицы Менделеева и открытием того, что молекулы имеют внутреннюю архитектуру, определяющую их свойства. [25]
Изомерия
Ученые обнаружили, что некоторые вещества имеют одинаковый химический состав, но разные свойства. Например, в 1827 году Фридрих Вёлер обнаружил, что гремучее серебро и цианат серебра состоят из 107 частей серебра, 12 частей углерода, 14 частей азота и 16 частей кислорода (теперь мы знаем их формулы как AgCNO). В 1830 году Йенс Якоб Берцелиус термин изомерия ввел для описания этого явления . В 1860 году Луи Пастер выдвинул гипотезу, что молекулы изомеров могут иметь один и тот же набор атомов, но в разном расположении. [26]
В 1874 году Якобус Хенрикус ван 'т Хофф предположил, что атом углерода связан с другими атомами в тетраэдрическом расположении. Основываясь на этом, он объяснил структуру органических молекул таким образом, что мог предсказать, сколько изомеров может иметь соединение. Рассмотрим, например, пентан (C 5 H 12 ). В методе моделирования молекул Ван 'т Хоффа существуют три возможные конфигурации пентана, и ученые все же открыли три и только три изомера пентана. [27] [28]
Изомерию нельзя было полностью объяснить с помощью теорий, альтернативных теории атома, таких как радикальная теория и теория типов. [29] [30]
периодическая таблица Менделеева
Дмитрий Менделеев заметил, что когда он располагал элементы в ряд по их атомному весу, в них наблюдалась определенная периодичность. [31] : 117 Например, второй элемент, литий , имел сходные свойства с девятым элементом, натрием , и шестнадцатым элементом, калием — период семь. Точно так же бериллий , магний и кальций были похожи и все они находились на семи позициях друг от друга в таблице Менделеева. Используя эти закономерности, Менделеев предсказал существование и свойства новых элементов, которые позже были открыты в природе: скандия , галлия и германия . [31] : 118 Более того, таблица Менделеева может предсказать, со сколькими атомами других элементов может связаться атом — например, германий и углерод находятся в одной группе в таблице , и их атомы оба соединяются с двумя атомами кислорода каждый (GeO 2 и CO 2 ). . Менделеев обнаружил, что эти закономерности подтверждают теорию атома, поскольку они показывают, что элементы можно классифицировать по их атомному весу. Вставка нового элемента в середину периода нарушит параллель между этим периодом и следующим, а также нарушит закон множественных пропорций Дальтона. [32]
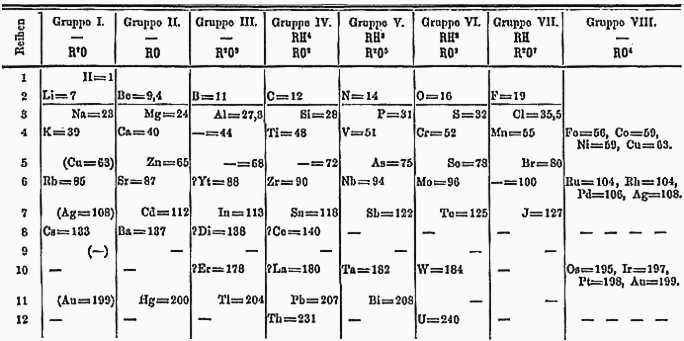
В современной таблице Менделеева периодичность упомянутых выше элементов равна восьми, а не семи, потому что благородные газы не были известны тогда, когда Менделеев разработал свою таблицу. Строки теперь также имеют разную длину (2, 8, 18 и 32), что соответствует квантовой теории.
Элементы в таблице Менделеева обычно располагались в порядке возрастания атомного веса. Однако в ряде мест химики решили поменять местами некоторые соседние элементы так, чтобы они оказались в группе с другими элементами со схожими свойствами. Например, теллур стоит перед йодом , хотя теллур тяжелее (127,6 против 126,9), поэтому йод может находиться в том же столбце, что и другие галогены . В 1913 году Генри Мозли обнаружил, что атомы каждого элемента при возбуждении испускают рентгеновские лучи с частотой, пропорциональной положению элемента в скорректированной таблице Менделеева, что подтвердило эти корректировки.
Статистическая механика
Чтобы ввести закон идеального газа и статистические формы физики, необходимо было постулировать существование атомов. В 1738 году швейцарский физик и математик Даниэль Бернулли предположил, что давление газов и тепло вызваны основным движением молекул.
В 1860 году Джеймс Клерк Максвелл , ярый сторонник атомизма, первым применил статистическую механику в физике. [33] Людвиг Больцман и Рудольф Клаузиус расширили его работы по газам и законам термодинамики, особенно второму закону, касающемуся энтропии. В 1870-х годах Джозайя Уиллард Гиббс расширил законы энтропии и термодинамики и ввёл термин «статистическая механика».
В начале 20-го века Альберт Эйнштейн независимо заново изобрел законы Гиббса, поскольку они были напечатаны только в малоизвестном американском журнале. [34] Позже Эйнштейн заметил, что если бы он знал о работе Гиббса, он бы «вообще не опубликовал эти статьи, а ограничился бы рассмотрением некоторых [которые отличались друг от друга] моментов». [35] Вся статистическая механика и законы тепла, газа и энтропии считали существование атомов необходимым постулатом.
Броуновское движение
В 1827 году британский ботаник Роберт Браун заметил, что частицы пыли внутри пыльцевых зерен, плавающих в воде, постоянно покачиваются без видимой причины. В 1905 году Эйнштейн предположил, что это броуновское движение вызвано тем, что молекулы воды постоянно сбивают зерна, и разработал математическую модель для его описания. Эта модель была экспериментально подтверждена в 1908 году французским физиком Жаном Перреном , который использовал уравнения Эйнштейна для измерения размера атомов. [36]
| Молекула | Измерения Перрина [37] | Современные измерения |
|---|---|---|
| Гелий | 1.7 × 10 −10 м | 2.6 × 10 −10 м |
| Аргон | 2.7 × 10 −10 м | 3.4 × 10 −10 м |
| Меркурий | 2.8 × 10 −10 м | 3 × 10 −10 м |
| Водород | 2 × 10 −10 м | 2.89 × 10 −10 м |
| Кислород | 2.6 × 10 −10 м | 3.46 × 10 −10 м |
| Азот | 2.7 × 10 −10 м | 3.64 × 10 −10 м |
| хлор | 4 × 10 −10 м | 3.20 × 10 −10 м |
| Молекула | Измерения Перрина [38] | Современные измерения |
|---|---|---|
| Водород | 1.43 × 10 −27 кг | 1.66 × 10 −27 кг |
| Кислород | 22.7 × 10 −27 кг | 22.8 × 10 −27 кг |
Открытие электрона
Атомы считались наименьшим возможным подразделением материи до 1897 года, когда Дж. Дж. Томсон открыл электрон в своей работе по катодным лучам .
Трубка Крукса представляет собой герметичный стеклянный контейнер, в котором два электрода разделены вакуумом. Когда на электроды подается напряжение , генерируются катодные лучи, образующие светящееся пятно, попадающее на стекло на противоположном конце трубки. Путем экспериментов Томсон обнаружил, что лучи могут отклоняться электрическими и магнитными полями , а это означало, что эти лучи не были формой света, а состояли из очень легких заряженных частиц, и их заряд был отрицательным. Томсон назвал эти частицы «тельцами». Он измерил, что их отношение массы к заряду на несколько порядков меньше, чем у атома водорода, самого маленького атома. Это соотношение было одинаковым независимо от того, из чего были изготовлены электроды и какой примесный газ находился в трубке. [39]
В отличие от этих корпускул, положительные ионы, созданные электролизом или рентгеновским излучением, имели соотношение массы к заряду, которое варьировалось в зависимости от материала электродов и типа газа в реакционной камере, что указывает на то, что это были разные типы частиц.
В 1898 году Томсон измерил заряд ионов примерно 6 × 10. -10 электростатические блоки (2 × 10 -19 Кулоны). [40] : 85 [41] В 1899 году он показал, что отрицательное электричество, создаваемое ультрафиолетовым светом, падающим на металл (известное теперь как фотоэлектрический эффект ), имеет то же соотношение массы к заряду, что и катодные лучи; затем он применил свой предыдущий метод определения заряда ионов к отрицательным электрическим частицам, созданным ультрафиолетовым светом. [40] : 86 С помощью этой комбинации он показал, что масса электрона в 0,0014 раза больше массы ионов водорода. [42] Эти «тельца» были настолько легкими, но при этом несли такой большой заряд, что Томсон пришел к выводу, что они, должно быть, являются основными частицами электричества, и по этой причине другие ученые решили, что эти «тельца» вместо этого следует называть электронами, следуя предложению Джорджа Джонстона Стоуни в 1894 году. назвав основную единицу электрического заряда. [43]
В 1904 году Томсон опубликовал статью, описывающую новую модель атома. [44] Электроны находятся внутри атомов и пересаживаются от одного атома к другому по цепочке под действием электрического тока. Когда электроны не текут, их отрицательный заряд логически должен быть уравновешен каким-то источником положительного заряда внутри атома, чтобы сделать атом электрически нейтральным. Не имея понятия об источнике этого положительного заряда, Томсон предварительно предположил, что положительный заряд находится повсюду в атоме, причем атом имеет форму сферы. [45] Баланс электростатических сил распределил бы электроны по этой сфере более или менее равномерно. Томсон далее объяснил, что ионы — это атомы, у которых есть избыток или недостаток электронов. [46]
Модель Томсона, широко известная как модель сливового пудинга , основана на идее, что электроны распределены по сфере положительного заряда с той же плотностью, что и изюм в сливовом пудинге . Ни Томсон, ни его коллеги никогда не использовали эту аналогию. Похоже, это было тщеславием научно-популярных писателей. Аналогия предполагает, что положительная сфера подобна твердому телу, но Томсон сравнил ее с жидкостью, поскольку он предположил, что электроны движутся в ней по закономерностям, управляемым электростатическими силами. [47] [48] Модель Томсона была неполной, она не могла предсказать ни одно из известных свойств атома, таких как спектры излучения или валентности.
В 1906 году Роберт А. Милликен и Харви Флетчер провели эксперимент с каплей масла , в ходе которого они измерили заряд электрона примерно -1,6 × 10. -19 , значение теперь определяется как -1 e . Поскольку было известно, что ион водорода и электрон неделимы, а атом водорода нейтрален по заряду, то отсюда следовало, что положительный заряд в водороде был равен этой величине, т. е. 1 e .
Открытие ядра
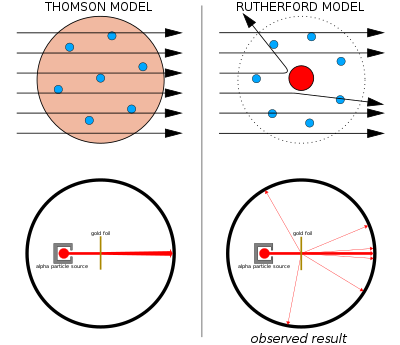
Слева: Ожидаемые результаты: альфа-частицы, проходящие через модель атома сливового пудинга с незначительным отклонением.
Справа: наблюдаемые результаты: небольшая часть частиц отклонялась концентрированным положительным зарядом ядра.
Томсона Модель сливового пудинга была вытеснена в 1911 году одним из его бывших учеников, Эрнестом Резерфордом , который обнаружил, что положительный заряд и большая часть массы атома сосредоточены в очень малой части его объема, которая, как он предполагал, находится на уровне самый центр.
Эрнест Резерфорд и его коллеги Ганс Гейгер и Эрнест Марсден усомнились в модели Томсона после того, как столкнулись с трудностями при попытке создать прибор для измерения отношения заряда к массе альфа-частиц (это положительно заряженные частицы, испускаемые некоторые радиоактивные вещества, такие как радий ). Альфа-частицы рассеивались воздухом в камере обнаружения, что делало измерения ненадежными. Томсон столкнулся с подобной проблемой в своей работе по катодным лучам, которую он решил, создав в своих приборах почти идеальный вакуум. Резерфорд не думал, что столкнется с такой же проблемой, поскольку альфа-частицы намного тяжелее электронов. Согласно модели атома Томсона, положительный заряд в атоме недостаточно сконцентрирован, чтобы создать достаточно сильное электрическое поле, чтобы отклонить альфа-частицу, а электроны настолько легки, что их должны легко отталкивать гораздо более тяжелые альфа-частицы. Однако рассеяние имело место, поэтому Резерфорд и его коллеги решили тщательно изучить это рассеяние. [49]
Между 1908 и 1913 годами Резерфорд и его коллеги провели серию экспериментов, в которых они бомбардировали тонкую металлическую фольгу пучком альфа-частиц. Они заметили, что альфа-частицы отклоняются на углы более 90°. Согласно модели Томсона, все альфа-частицы должны были пройти с незначительным отклонением. Резерфорд пришел к выводу, что положительный заряд атома не распределен по объему атома, как считал Томсон, а сконцентрирован в крошечном ядре в центре, и что ядро также имеет большую часть массы атома. Только такая интенсивная концентрация заряда, закрепленная его большой массой, могла создать достаточно сильное электрическое поле, чтобы отклонить альфа-частицы, как это наблюдалось. [49] Модель Резерфорда иногда называют «планетарной моделью». [50]
Модель Бора
Планетарная модель атома имела два существенных недостатка. Во-первых, в отличие от планет, вращающихся вокруг Солнца, электроны являются заряженными частицами. ускоряющийся электрический заряд Известно, что излучает электромагнитные волны по формуле Лармора в классическом электромагнетизме . Орбитальный заряд должен постепенно терять энергию и двигаться по спирали к ядру, сталкиваясь с ним за небольшую долю секунды. высокопиковые спектры излучения и поглощения Вторая проблема заключалась в том, что планетарная модель не могла объяснить наблюдавшиеся атомов.

Квантовая теория произвела революцию в физике в начале 20-го века, когда Макс Планк и Альберт Эйнштейн постулировали, что световая энергия излучается или поглощается в дискретных количествах, известных как кванты (сингулярные, квантовые ). Это привело к созданию ряда квантово-атомных моделей, таких как квантовая модель Артура Эриха Хааса 1912 года в 1910 году и квантово-атомная модель Джона Уильяма Николсона , которая квантовала угловой момент как h /2 π . [51] [52] В 1913 году Нильс Бор включил эту идею в свою модель атома Бора, в которой электрон мог вращаться вокруг ядра только по определенным круговым орбитам с фиксированными угловым моментом и энергией, причем его расстояние от ядра (т. е. их радиусы) было пропорционально его энергия. [53] Согласно этой модели электрон не мог спирально проникнуть в ядро, потому что он не мог терять энергию непрерывно; вместо этого он мог совершать только мгновенные « квантовые скачки » между фиксированными уровнями энергии . [53] Когда это происходило, свет излучался или поглощался с частотой, пропорциональной изменению энергии (отсюда и поглощение и излучение света в дискретных спектрах). [53]
Модель Бора не была идеальной. Он мог предсказать только спектральные линии водорода, но не многоэлектронных атомов. [54] Хуже того, он даже не мог объяснить все особенности спектра водорода: по мере совершенствования спектрографической технологии было обнаружено, что применение магнитного поля вызывает умножение спектральных линий таким образом, который не могла объяснить модель Бора. В 1916 году Арнольд Зоммерфельд добавил к модели Бора эллиптические орбиты, чтобы объяснить дополнительные эмиссионные линии, но это сделало модель очень сложной в использовании, и она по-прежнему не могла объяснить более сложные атомы. [55] [56]
Открытие изотопов
Экспериментируя с продуктами радиоактивного распада , в 1913 году радиохимик Фредерик Содди обнаружил, что существует более одной разновидности некоторых элементов. [57] Термин «изотоп» был придуман Маргарет Тодд как подходящее название для этих разновидностей. [58]
В том же году Дж. Дж. Томсон провел эксперимент, в ходе которого он пропускал поток неона ионов через магнитные и электрические поля, ударяя другим концом по фотографической пластинке. Он заметил на пластине два светящихся пятна, что свидетельствовало о двух разных траекториях отклонения. Томсон пришел к выводу, что это произошло потому, что некоторые ионы неона имели разную массу. [59] Природа этой различной массы позже будет объяснена открытием нейтронов в 1932 году: все атомы одного и того же элемента содержат одинаковое количество протонов, в то время как разные изотопы имеют разное количество нейтронов. [60]
Открытие протона
Еще в 1815 году Уильям Праут заметил, что атомный вес элементов кратен атомному весу водорода, поэтому он выдвинул гипотезу, что все атомы представляют собой скопления водорода, частицы, которую он назвал «протилом». Гипотеза Праута была поставлена под сомнение, когда было обнаружено, что некоторые элементы отклоняются от этой закономерности (например, атомы хлора в среднем весят 35,45 дальтон ), но когда в 1913 году были открыты изотопы , наблюдения Праута вновь привлекли внимание.
В статье, опубликованной в апреле 1911 года, посвященной его исследованиям рассеяния альфа-частиц , Эрнест Резерфорд подсчитал, что заряд атомного ядра, выраженный как множитель заряда ядра водорода ( e атома ), составляет примерно половину атомного веса . [61]
В июне 1911 года голландский физик Антониус ван ден Брук заметил, что в таблице Менделеева атомный вес каждого последующего химического элемента увеличился в среднем на 2, что, в свою очередь, предположило, что заряд ядра каждого последующего элемента увеличился на 1 е . [62]
В 1913 году Генри Мозли измерил рентгеновское излучение всех элементов таблицы Менделеева и обнаружил, что частота рентгеновского излучения зависит от атомного номера элемента и заряда ядра водорода (см. Закон Мозли ). .
В 1917 году Резерфорд бомбардировал газообразный азот и альфа-частицами наблюдал водорода выделение ионов из газа. Резерфорд пришел к выводу, что альфа-частицы ударяются о ядра атомов азота, заставляя ионы водорода откалываться. [63]
Эти наблюдения привели Резерфорда к выводу, что ядро водорода представляет собой особую частицу с положительным зарядом, равным отрицательному заряду электрона. Название «протон» было предложено Резерфордом на неформальной встрече коллег-физиков в Кардиффе в 1920 году. [64] Все атомные ядра содержат количество протонов, равное атомному номеру соответствующего элемента. До этого момента атомный номер определялся как положение элемента в таблице Менделеева .
Открытие нейтрона
Физики 1920-х годов считали, что атомное ядро содержит протоны плюс несколько «ядерных электронов», которые уменьшают общий заряд. Эти «ядерные электроны» отличались от электронов, вращающихся вокруг ядра. Эта неверная гипотеза объяснила бы, почему атомные номера элементов были меньше их атомных весов и почему радиоактивные элементы испускают электроны ( бета-излучение ) в процессе ядерного распада. Резерфорд даже предположил, что протон и электрон могут прочно связываться друг с другом, образуя «нейтральный дублет». Резерфорд писал, что существование таких «нейтральных дублетов», свободно перемещающихся в пространстве, могло бы обеспечить более правдоподобное объяснение того, как более тяжелые элементы могли образоваться при зарождении Вселенной, учитывая, что одиночному протону трудно слиться с большим атомное ядро из-за отталкивающего электрического поля. [65]
В 1928 году Уолтер Боте заметил, что бериллий испускает высокопроникающее электрически нейтральное излучение при бомбардировке альфа-частицами. Позже было обнаружено, что это излучение может выбивать атомы водорода из парафина . Первоначально считалось, что это высокоэнергетическое гамма-излучение , поскольку гамма-излучение оказывает аналогичное воздействие на электроны в металлах, но Джеймс Чедвик обнаружил, что эффект ионизации слишком силен, чтобы его можно было объяснить электромагнитным излучением, пока энергия и импульс сохранялись при взаимодействии. В 1932 году Чедвик подверг различные элементы, такие как водород и азот, таинственному «бериллиевому излучению» и, измерив энергию отталкивающихся заряженных частиц, пришел к выводу, что это излучение на самом деле состоит из электрически нейтральных частиц, которые не могут быть безмассовыми. как гамма-лучи, но вместо этого они должны были иметь массу, подобную массе протона. Чедвик назвал эту новую частицу «нейтроном» и считал, что это слитые вместе протон и электрон, поскольку нейтрон имел примерно ту же массу, что и протон, а масса электрона по сравнению с ней пренебрежимо мала. [66] Нейтроны на самом деле не представляют собой синтез протона и электрона.
Современные квантово-механические модели

В 1924 году Луи де Бройль предположил, что все частицы, особенно субатомные частицы, такие как электроны, имеют связанную с ними волну. Эрвин Шредингер , увлеченный этой идеей, разработал уравнение [67] которое описывает электрон как волновую функцию, а не точку. Этот подход предсказал многие спектральные явления, которые модель Бора не смогла объяснить, но их было трудно визуализировать, и он столкнулся с сопротивлением. [68] Один из ее критиков, Макс Борн , вместо этого предположил, что волновая функция Шредингера не описывает физическую протяженность электрона (как распределение заряда в классическом электромагнетизме), а скорее дает вероятность того, что электрон при измерении будет обнаружен на конкретный момент. [69] Это примирило идеи о волновых и корпускулярных электронах: поведение электрона или любого другого субатомного объекта имеет как волновой, так и корпускулярный аспекты , и то, будет ли наблюдаться тот или иной аспект, зависит от эксперимент. [70]
Следствием описания частиц как волновых форм, а не точек, является то, что математически невозможно точно рассчитать положение и импульс частицы в данный момент времени. Это стало известно как принцип неопределенности — концепция, впервые предложенная Вернером Гейзенбергом в 1927 году.
Волновая модель водорода Шредингера заменила модель Бора с ее аккуратными, четко определенными круговыми орбитами. Современная модель атома описывает положения электронов в атоме с точки зрения вероятностей. Электрон потенциально можно найти на любом расстоянии от ядра, но, в зависимости от его энергетического уровня и углового момента , он чаще существует в определенных областях вокруг ядра, чем в других; эта структура называется атомной орбиталью . Орбитали бывают самых разных форм — сфера , гантель , тор и т. д. — с ядром посередине. [71] Формы атомных орбиталей находятся путем решения уравнения Шрёдингера. [72] Аналитические решения уравнения Шредингера известны для очень небольшого числа относительно простых модельных гамильтонианов, включая атом водорода и молекулярный ион водорода . [73] Начиная с атома гелия , который содержит всего два электрона, для решения уравнения Шрёдингера используются численные методы. [74]
Качественно форма атомных орбиталей многоэлектронных атомов напоминает состояния атома водорода. Принцип Паули требует такого распределения этих электронов внутри атомных орбиталей, чтобы на одной орбитали было закреплено не более двух электронов; это требование глубоко влияет на атомные свойства и, в конечном итоге, на соединение атомов в молекулы. [75] : 182
См. также
Сноски
- ^ комбинация отрицательного термина «a-» и «τομή», термина, обозначающего «вырезать».
- ^ Фейнман, Лейтон и Сэндс, 1963 , стр. I-2 «Если бы в результате какого-то катаклизма все [] научные знания были бы уничтожены [за исключением] одного предложения [...], какое утверждение содержало бы больше всего информации в наименьшем количестве слов? Я считаю, что это [...] что все вещи состоят из атомов – маленьких частиц, которые движутся в постоянном движении, притягивая друг друга, когда они находятся на небольшом расстоянии друг от друга, но отталкиваясь, когда они сжимаются друг в друге ...»
- ^ Пуллман, Бернард (1998). Атом в истории человеческого мышления . Оксфорд, Англия: Издательство Оксфордского университета. стр. 31–33. ISBN 978-0-19-515040-7 . Архивировано из оригинала 5 февраля 2021 года . Проверено 25 октября 2020 г.
- ^ Мельсен (1952). От Атомоса к Атому , стр. 18–19.
- ↑ Перейти обратно: Перейти обратно: а б с Пуллман (1998). Атом в истории человеческой мысли , с. 201
- ^ Пуллман (1998). Атом в истории человеческого мышления . п. 197
- ^ «Закон определенных пропорций | химия» . Британская энциклопедия . Проверено 3 сентября 2020 г.
- ^ Томас Томсон (1831). История химии, Том 2 . п. 291
- ^ Далтон (1817). Новая система химической философии, том. 2, с. 36
- ^ Мельсен (1952). От Атомоса к Атому . п. 137
- ^ Далтон (1817). Новая система химической философии, том. 2. С. 28-34: «Промежуточный или красный оксид состоит из 2 атомов закиси и 1 атома кислорода»
- ^ Миллингтон (1906). Джон Далтон , с. 113
- ^ Далтон (1808). Новая система химической философии, том. 1, стр. 316–319.
- ^ Далтон (1808). Новая система химической философии, том. 1. стр. 316–319.
- ^ Холброу и др. (2010). Современная вводная физика , стр. 65–66.
- ^ Дальтон, цитируется у Фрейнда (1904). Исследование химического состава . п. 288: «Я выбрал слово «атом» для обозначения этих первичных частиц, а не частицу, молекулу или любой другой уменьшительный термин, потому что я считаю, что оно гораздо более выразительно; оно включает в себя понятие неделимого, что и другие термины. Нет, возможно, можно сказать, что я слишком далеко расширяю применение этого понятия, когда говорю о сложных атомах; например, я называю элементарную частицу угольной кислоты составным атомом. он перестает превращаться в угольную кислоту, распадаясь в результате такого разделения на древесный уголь и кислород. Поэтому я полагаю, что нет противоречия в разговорах о сложных атомах и что мой смысл не может быть понят неправильно».
- ^ Далтон (1817). Новая система химической философии, том. 1, стр. 213–214.
- ^ Авогадро, Амедео (1811). «Очерк способа определения относительных масс элементарных молекул тел и пропорций, в которых они входят в эти соединения» . Журнал де Физический . 73 : 58–76.
- ^ Авогадро, Амедео (1811). «Проверка способа определения относительных масс элементарных молекул тел и пропорций, в которых они входят в эти соединения» . Журнал физики . 73 :58–76. английский перевод
- ^ Доверенное (1999). Тайна материи , с. 73
- ^ Фрейнд (1904). Исследование химического состава . п. 288
- ^ Пуллман (1998). Атом в истории человеческой мысли , с. 202
- ^ Жан-Батист Дюма (1836). философии химической Уроки . 285–287
- ^ Пуллман (1998). Атом в истории человеческого мышления . п. 207
- ^ Канниццаро (1858). Очерк курса химической философии . стр. 2–4
- ^ Пуллман (1998). Атом в истории человеческой мысли , с. 226 : «Первое событие — это создание периодической классификации элементов, знаменующее успешную кульминацию согласованных усилий по упорядочению химических свойств элементов в соответствии с их атомным весом. Второе — это появление структурной химии, которая вытеснила то, что было простое и примитивное словесное описание элементного состава, атомного или эквивалентистского, веществ и заменило его систематическим определением их внутренней архитектуры».
- ^ Пуллман (1998). Атом в истории человеческой мысли , с. 230
- ^ Мельсен (1952). От Атомоса к Атому , стр. 147–148.
- ^ Генри Энфилд Роско, Карл Шорлеммер (1895). Трактат по химии , том 3, часть 1, стр. 121–122.
- ^ Генри Энфилд Роско, Карл Шорлеммер (1895). «Трактат о химии» , том 3, часть 1, стр. 121 : «Радикальная теория и теория типов способны объяснить многие случаи изомерии, но только после того, как было установлено учение о соединении атомов, было ясно был пролит свет на эту тему».
- ^ Адольф Вюрц (1880). Атомная теория , с. 291 : «Именно таким образом теория атомарности предсказывает, интерпретирует и ограничивает число изомеров; она предоставила элементы одного из величайших достижений, которых наука достигла за последние двадцать лет. [...] Теория атомарности успешно подошла к решению этой проблемы, введя в обсуждение точные данные, которые во многих случаях были подтверждены экспериментом».
- ↑ Перейти обратно: Перейти обратно: а б Шерри, Эрик Р. (2020). Таблица Менделеева, ее история и значение (2-е изд.). Нью-Йорк: Издательство Оксфордского университета. ISBN 978-0-190-91436-3 .
- ^ Брито, Ангмари; Родригес, Мария А.; Нияз, Мансур (2005). «Реконструкция развития таблицы Менделеева на основе истории и философии науки и ее значение для учебников по общей химии». Журнал исследований в области преподавания естественных наук . 42 (1): 84–111. Бибкод : 2005JRScT..42...84B . дои : 10.1002/tea.20044 .
- ^ См.:
- Максвелл, Дж. К. (1860) «Иллюстрации динамической теории газов. Часть I. О движении и столкновениях совершенно упругих сфер», Философский журнал , 4-я серия, 19 : 19–32.
- Максвелл, Дж. К. (1860) «Иллюстрации динамической теории газов. Часть II. О процессе диффузии двух или более видов движущихся частиц между собой», Philosophical Magazine , 4-я серия, 20 : 21–37.
- ^ Наварро, Луис. «Гиббс, Эйнштейн и основы статистической механики». Архив истории точных наук, вып. 53, нет. 2, Springer, 1998, стр. 147–80, http://www.jstor.org/stable/41134058 .
- ^ Стоун, А. Дуглас, Эйнштейн и квант: поиски доблестного шваба, Princeton University Press, (2013). ISBN 978-0-691-13968-5, цитата из Фолсинга, Альберта Эйнштейна, 110.
- ^ «Нобелевская премия по физике 1926 года» . NobelPrize.org . Проверено 8 февраля 2023 г.
- ^ Перрен (1909). Броуновское движение и молекулярная реальность , с. 50
- ^ Перрен (1909). Броуновское движение и молекулярная реальность , с. 50
- ^ Джей Джей Томсон (1897). «Катодные лучи» (PDF) . Философский журнал . 44 (269): 293–316. дои : 10.1080/14786449708621070 .
«Из этих определений мы видим, что значение m/e не зависит от природы газа и что его значение 10 -7 очень мало по сравнению со значением 10 -4 , что представляет собой наименьшее значение этой величины, известное ранее, и которое является значением иона водорода при электролизе». - ↑ Перейти обратно: Перейти обратно: а б Паис, Авраам (2002). Внутренняя граница: материи и сил в физическом мире (Переиздание). Оксфорд: Clarendon Press [ua] ISBN 978-0-19-851997-3 .
- ^ Джей Джей Томсон (1898). «О заряде электричества, переносимом ионами, производимыми рентгеновскими лучами» . Лондонский, Эдинбургский и Дублинский философский журнал и научный журнал . 5. 46 (283): 528–545.
- ^ Джей Джей Томсон (1899). «О массах ионов в газах при низких давлениях» . Философский журнал . 5. 48 (295): 547–567.
«...величина этого отрицательного заряда составляет около 6 × 10 -10 электростатических единиц и равен положительному заряду, переносимому атомом водорода при электролизе растворов. [...] В газах при низких давлениях эти единицы отрицательного электрического заряда всегда связаны с носителями определенной массы. Эта масса чрезвычайно мала и составляет всего около 1,4 × 10 -3 иона водорода, наименьшей массы, до сих пор признанной способной к отдельному существованию. Таким образом, возникновение отрицательной электризации включает в себя расщепление атома, поскольку из совокупности атомов отделяется нечто, чья масса меньше массы отдельного атома». - ^ Оленик, Ричард П.; Апостол, Том М.; Гудштейн, Дэвид Л. (26 декабря 1986 г.). За пределами механической вселенной: от электричества к современной физике . Издательство Кембриджского университета. п. 435. ИСБН 978-0-521-30430-6 .
- ^ Джей Джей Томсон (март 1904 г.). «О строении атома: исследование стабильности и периодов колебаний ряда корпускул, расположенных через равные промежутки по окружности круга; с применением результатов к теории атомного строения» . Философский журнал . Шестая серия. 7 (39): 237–265. дои : 10.1080/14786440409463107 . Архивировано (PDF) из оригинала 9 октября 2022 г.
- ^ Джей Джей Томсон (1907). Корпускулярная теория материи , с. 103: «При отсутствии точного знания природы того, как положительное электричество возникает в атоме, мы рассмотрим случай, когда положительное электричество распределяется способом, наиболее поддающимся математическим расчетам, т. е. когда оно возникает как сфера однородной плотности, по которой распределены корпускулы».
- ^ Джей Джей Томсон (1907). О корпускулярной теории материи , с. 26: «Самая простая интерпретация этих результатов заключается в том, что положительные ионы — это атомы или группы атомов различных элементов, из которых были удалены одна или несколько корпускул. Фактически, корпускулы являются проводниками, с помощью которых электричество переносится от одно тело к другому, положительно наэлектризованное тело отличается от того же самого тела, когда оно не наэлектризовано, тем, что оно потеряло некоторые из своих телец, в то время как отрицательно наэлектризованное тело имеет больше телец, чем неэлектрифицированное».
- ^ Гиора Хон; Бернард Р. Гольдштейн (2013). «Атомная модель сливового пудинга Дж. Дж. Томсона: создание научного мифа» . Аннален дер Физик . 525 (8–9): А129–А133. Бибкод : 2013АнП...525А.129Х . дои : 10.1002/andp.201300732 .
- ^ Дж. Дж. Томсон, в письме Оливеру Лоджу от 11 апреля 1904 г., цитируется в Davis & Falconer (1997):
«Что касается положительной электрификации, я имел привычку использовать грубую аналогию с жидкостью с определенной степенью сцепления, достаточной для того, чтобы удержать ее от разлета на куски под действием собственного отталкивания. Однако я всегда старался придерживаться физической концепции положительного электричества на заднем плане, потому что у меня всегда были надежды (еще не реализованные) на то, что я смогу обойтись без положительной электризации как отдельной сущности и заменить ее каким-то свойством корпускул». - ↑ Перейти обратно: Перейти обратно: а б Хейлброн (2003). Эрнест Резерфорд и взрыв атомов , стр. 64–68.
- ^ «Модель Резерфорда | Определение и факты» . Британская энциклопедия . Проверено 23 августа 2021 г.
- ^ Дж. В. Николсон, Месяц. Нет. Рой. Астр. Соц. lxxxii. стр. 49,130, 677, 693, 729 (1912).
- ^ Атомная теория Джона Уильяма Николсона, Рассела МакКормака, Архив истории точных наук, Том. 3, № 2 (25 августа 1966 г.), стр. 160–184 (25 страниц), Springer.
- ↑ Перейти обратно: Перейти обратно: а б с Бор, Нильс (1913). «О строении атомов и молекул» (PDF) . Философский журнал . 26 (153): 476–502. Бибкод : 1913PMag...26..476B . дои : 10.1080/14786441308634993 . Архивировано (PDF) из оригинала 9 октября 2022 г.
- ^ Краг, Хельге (1979). «Вторая атомная теория Нильса Бора» . Исторические исследования в физических науках . 10 : 123–186. дои : 10.2307/27757389 . ISSN 0073-2672 . JSTOR 27757389 .
- ^ Хентшель, Клаус (2009). «Эффект Зеемана» . В Гринбергере, Дэниел; Хентшель, Клаус; Вайнерт, Фридель (ред.). Сборник квантовой физики . Берлин, Гейдельберг: Springer Berlin Heidelberg. стр. 862–864. дои : 10.1007/978-3-540-70626-7_241 . ISBN 978-3-540-70622-9 . Проверено 8 февраля 2023 г.
- ^ Экерт, Майкл (апрель 2014 г.). «Как Зоммерфельд расширил модель атома Бора (1913–1916)» . Европейский физический журнал H . 39 (2): 141–156. Бибкод : 2014EPJH...39..141E . дои : 10.1140/epjh/e2013-40052-4 . ISSN 2102-6459 . S2CID 256006474 .
- ^ «Фредерик Содди, Нобелевская премия по химии 1921 года» . Нобелевский фонд . Проверено 18 января 2008 г.
- ^ Флек, Александр (1957). «Фредерик Содди» . Биографические мемуары членов Королевского общества . 3 : 203–216. дои : 10.1098/rsbm.1957.0014 .
п. 208: До 1913 года мы использовали фразу «радиоэлементы, химически неразделимые», и в то время слово «изотоп» было предложено в дискуссии в гостиной с доктором Маргарет Тодд в доме тестя Содди, сэра Джорджа. Бейлби .
- ^ Томсон, Джей-Джей (1913). «Лучи положительного электричества» . Труды Королевского общества . А 89 (607): 1–20. Бибкод : 1913RSPSA..89....1T . дои : 10.1098/rspa.1913.0057 . S2CID 124295244 . [выдержки из книги Генри А. Бурса и Ллойда Моца, «Мир атома» , Vol. 1 (Нью-Йорк: Basic Books, 1966)]. Проверено 29 августа 2007 г.
- ^ Цветы, Пол; и др. (2022). Химия 2е . ОпенСтакс. стр. 70–71. ISBN 978-1-947172-61-6 .
- ^ Эрнест Резерфорд (1911). «Рассеяние α и β частиц веществом и строение атома» . Философский журнал . Серия 6. 21 (125): 669–688. дои : 10.1080/14786440508637080 .
- ^ Антониус ван ден Брук (23 июня 1911 г.). «Число возможных элементов и «кубическая» периодическая система Менделеева» . Природа . 87 (2177): 78. Бибкод : 1911Природа..87...78В . дои : 10.1038/087078b0 .
«Следовательно, если эта кубическая периодическая система окажется правильной, то число возможных элементов будет равно числу возможных постоянных зарядов каждого знака на атом, или каждому возможному постоянному заряду (оба знаков) на атом принадлежит возможный элемент». - ^ Резерфорд, Эрнест (1919). «Столкновения альфа-частиц с легкими атомами. IV. Аномальный эффект в азоте» . Философский журнал . 37 (222): 581. дои : 10.1080/14786440608635919 .
- ^ Орм Массон (1921). «Конституция атомов» . Лондонский, Эдинбургский и Дублинский философский журнал и научный журнал . 41 (242): 281–285. дои : 10.1080/14786442108636219 .
Сноска Эрнеста Резерфорда: «Во время написания этой статьи в Австралии профессор Орм Массон не знал, что название «протон» уже было предложено как подходящее название для единицы массы, близкой к 1, в пересчете на кислород 16, это, по-видимому, входит в ядерную структуру атомов. Вопрос о подходящем названии для этого подразделения обсуждался на неформальной встрече ряда членов Секции А Британской ассоциации [по развитию науки] в Кардиффе в этом году. Имя «барон», предложенное профессором Массоном, было упомянуто, но было сочтено неподходящим из-за существующего разнообразия значений. Наконец, название «протон» встретило всеобщее одобрение, особенно потому, что оно предполагает первоначальный термин «протил», данный Праутом в его известной гипотезе о том, что все атомы состоят из водорода. На необходимость специального названия для ядерной единицы массы 1 обратил внимание сэр Оливер Лодж на заседании секции, и тогда автор предложил название «протон». - ^ Сэр Э. Резерфорд (1920). «Бейкеровская лекция: Ядерное строение атомов» . Труды Лондонского королевского общества. Серия А. 97 : 374–400. : «Однако при некоторых условиях электрон может более тесно объединиться с ядром H, образуя своего рода нейтральный дублет. [...] Существование таких атомов кажется почти необходимым для объяснения образования ядер тяжелых элементов; ибо, если мы не предположим образование заряженных частиц с очень высокими скоростями, трудно понять, как какая-либо положительно заряженная частица может достичь ядра тяжелого атома, преодолевая его интенсивное отталкивающее поле».
- ^ Чедвик, Джеймс (1932). «Возможное существование нейтрона» (PDF) . Природа . 129 (3252): 312. Бибкод : 1932Natur.129Q.312C . дои : 10.1038/129312a0 . S2CID 4076465 . Архивировано (PDF) из оригинала 9 октября 2022 г.
- ^ Шрёдингер, Эрвин (1926). «Квантование как проблема собственных значений». Аннален дер Физик . 81 (18): 109–139. Бибкод : 1926АнП...386..109С . дои : 10.1002/andp.19263861802 .
- ^ Маханти, Субодх. «Эрвин Шредингер: основатель квантовой волновой механики» . Архивировано из оригинала 17 апреля 2009 г. Проверено 1 августа 2009 г.
- ^ Маханти, Субодх. «Макс Борн: основатель Lattice Dynamics» . Архивировано из оригинала 22 января 2009 г. Проверено 1 августа 2009 г.
- ^ Грейнер, Уолтер (4 октября 2000 г.). «Квантовая механика: Введение» . Спрингер. ISBN 9783540674580 . Проверено 14 июня 2010 г.
- ^ Милтон Орчин; Роджер Макомбер; Аллан Пинхас; Р. Уилсон. «Словарь и понятия органической химии, второе издание» (PDF) . Архивировано (PDF) из оригинала 9 октября 2022 г. Проверено 14 июня 2010 г.
- ^ Цвибах, Бартон (2022). Освоение основ, теории и приложений квантовой механики . Кембридж: MIT Press. стр. 281–305. ISBN 978-0-262-36689-2 . OCLC 1306066387 .
- ^ Гриве, Жан-Филипп (январь 2002 г.). «Возвращение к молекулярному иону водорода» . Журнал химического образования . 79 (1): 127. Бибкод : 2002ЖЧЭд..79..127Г . дои : 10.1021/ed079p127 . ISSN 0021-9584 .
- ^ Левин, Ф.С.; Шерцер, Дж. (1 декабря 1985 г.). «Конечно-элементное решение уравнения Шрёдингера для основного состояния гелия» . Физический обзор А. 32 (6): 3285–3290. Бибкод : 1985PhRvA..32.3285L . дои : 10.1103/PhysRevA.32.3285 . ISSN 0556-2791 . ПМИД 9896495 .
- ^ Карплюс, Мартин и Ричард Нидэм Портер. «Атомы и молекулы; введение для студентов, изучающих физическую химию». Атомы и молекулы; введение для студентов-физиков-химиков (1970).
Библиография
- Фейнман, Р.П .; Лейтон, РБ; Сэндс, М. (1963). Фейнмановские лекции по физике . Том. 1. ISBN 978-0-201-02116-5 .
- Эндрю Г. ван Мельсен (1960) [Впервые опубликовано в 1952 году]. От атома к атому: история понятия атома . Перевод Генри Дж. Корена. Дуврские публикации. ISBN 0-486-49584-1 .
- Дж. П. Миллингтон (1906). Джон Далтон . JM Dent & Co. (Лондон); EP Dutton & Co. (Нью-Йорк).
- Хауме Наварро (2012). История электрона: Дж. Дж. и Г. П. Томсоны . Издательство Кембриджского университета. ISBN 978-1-107-00522-8 .
- Дженнифер Доверенная (1999). Тайна материи . Макмиллан. ISBN 0-333-76002-6 .
- Бернард Пуллман (1998). Атом в истории человеческого мышления . Перевод Акселя Райзингера. Издательство Оксфордского университета. ISBN 0-19-511447-7 .
- Жан Перрен (1910) [1909]. Броуновское движение и молекулярная реальность . Перевод Ф. Содди. Тейлор и Фрэнсис.
- Ида Фройнд (1904). Исследование химического состава . Издательство Кембриджского университета.
- Томас Томсон (1807 г.). Система химии: В пяти томах, Том 3 . Джон Браун.
- Томас Томсон (1831 г.). История химии, Том 2 . Х. Колберн и Р. Бентли.
- Джон Далтон (1808 г.). Новая система химической философии, том. 1 .
- Джон Далтон (1817). Новая система химической философии, том. 2 .
- Станислао Канниццаро (1858). Очерк курса химической философии . Клуб Аламбик.
Дальнейшее чтение
- Чарльз Адольф Вюрц (1881) Атомная теория , Д. Эпплтон и компания, Нью-Йорк.
- Алан Дж. Рок (1984) Химический атомизм в девятнадцатом веке: от Дальтона до Канниццаро , Издательство Университета штата Огайо, Колумбус (полный текст в открытом доступе по адресу http://digital.case.edu/islandora/object/ksl%3Ax633gj985 ).
Внешние ссылки
- Атомизм С. Марка Коэна.
- Теория атома - подробная информация по теории атома в отношении электронов и электричества.
- Фейнмановские лекции по физике Vol. Я Ч. 1: Атомы в движении