Углекислый газ (страница данных)
На этой странице представлены дополнительные химические данные по диоксиду углерода .
Паспорт безопасности материала
[ редактировать ]При обращении с этим химическим веществом могут потребоваться особые меры предосторожности. Настоятельно рекомендуется получить паспорт безопасности материала ( MSDS ) для этого химического вещества у надежного источника, такого как SIRI , и следовать его указаниям. Паспорт безопасности для твердого диоксида углерода можно получить у компании Pacific Dry Ice, Inc.
Структура и свойства
[ редактировать ]| Структура и свойства | |
|---|---|
| Показатель преломления , n D | 1,000449 при 589,3 нм и 0 °C [1] |
| Диэлектрическая проницаемость , ε r | 1,60 ε 0 при 0 °C, 50 атм. |
| Средняя энергия на связь C=O | 804,4 кДж/моль при 298 К (25 °С) [2] |
| Длина связи | C=O 116,21 пм (1,1621 Å) [3] |
| Угол связи | О–С–О: 180° [3] |
| Магнитная восприимчивость | -0,49×10^-6 см^3/моль |
| Поверхностное натяжение | 4,34 дин/см при 20 °C и равновесное давление |
| Вязкость [4] жидкости при равновесном давлении | 0,0925 мПа·с при 5 °C 0,0852 мПа·с при 10 °C 0,0712 мПа·с при 20 °C 0,0625 мПа·с при 25 °C 0,0321 мПа·с при 31,1 °C |
Термодинамические свойства
[ редактировать ]| Фазовое поведение | |
|---|---|
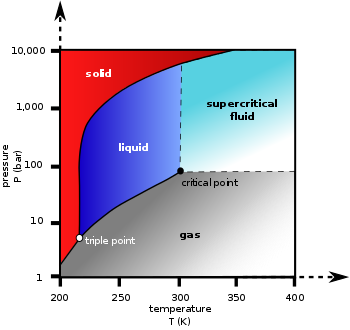
| Тройная точка | 216,58 К (-56,57 ° С), 518,5 кПа |
| Критическая точка | 304,18 К (31,03 °С), 7,38 МПа |
| Стандартное изменение энтальпии плавления , Δ fus H | 9,019 кДж/моль в тройной точке [5] |
| Изменение энтропии плавления , Δ fus S | 40 Дж/(моль·К) в тройной точке |
| Стандартное изменение энтальпии испарения , [6] [7] Δ пар H | 15,326 кДж/моль при 215,7 К (-57,5 ° C) (348 Дж/г) |
| Стандартное изменение энтропии испарения , Δ пар S | 70,8 Дж/(моль·К) |
| Твердые свойства | |
| Стандартное изменение энтальпии образования , Δ f H | −427,4 кДж/моль |
| Стандартная молярная энтропия , [8] С | 51,07 Дж/(моль·К) |
| Теплоемкость , [8] с п | 2,534 Дж/(моль · К) при 15,52 К (-257,63 ° С) |
| Свойства жидкости | |
| Стандартное изменение энтальпии образования , Δ f H | −393,5 кДж/моль |
| Стандартная молярная энтропия , С | 213,7 Дж/(моль К) |
| Теплоемкость , [9] с п | 80—150 Дж/(моль·К) при 220—290 К. |
| Свойства газа | |
| Стандартное изменение энтальпии образования , Δ f H | −393,52 кДж/моль |
| Стандартная молярная энтропия , С | 213,79 Дж/(моль·К) |
| Теплоемкость , [10] [11] с п | 33,89 Дж/(моль К) при –75 °C |
| Коэффициент теплоемкости [10] γ = c p / c v | 1,37 при –75 °С |
| константы Ван дер Ваальса [12] | а = 363,96 л 2 кПа/моль 2 b = 0,04267 литр на моль |
| Равновесие с окисью углерода [13] СО + 1 / 2 О 2 → СО 2 К = pK = log 10 К | pK = 45,0438 при Т = 298,16 К |
Он используется для эффектов курения в разных сценах.
Растворимость в воде при различных температурах
[ редактировать ]| Растворимость CO 2 101,3 кПа (1 атм ). в воде при парциальном давлении [14] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
- ‡ Во втором столбце таблицы указана растворимость при каждой заданной температуре в объеме CO 2 , которая измеряется при 101,3 кПа и 0 °C на объем воды.
- Растворимость указана для «чистой воды», т.е. воды, содержащей только CO 2 . Эта вода будет кислой. Например, при 25 °C pH ожидается 3,9 (см. Угольная кислота ). При менее кислых значениях pH растворимость будет увеличиваться из-за зависимого от pH образования CO 2 .
Давление паров твердых и жидких веществ
[ редактировать ]| P в мм рт.ст. | 1 | 10 | 40 | 100 | 400 | 760 | 1520 | 3800 | 7600 | 15200 | 30400 | 45600 | |
| P в атм (2 фут, получено из мм рт. ст.) | 0.0013 | 0.013 | 0.053 | 0.13 | 0.53 | 1.0 | 2.0 | 5.0 | 10 | 20 | 40 | 60 | |
| P в кПа (выводится из мм рт. ст./атм) | 0.13 | 1.3 | 5.3 | 13 | 53 | 101.325 | 202.65 | 506.625 | 1013.25 | 2026.5 | 4053 | 6079.5 | |
| Т в °С | −134,3 (с) | −119,5 (с) | −108,6 (с) | −100,2 (с) | −85,7 (с) | −78,2 (с) | −69,1 (с) | −56.7 | −39.5 | −18.9 | 5.9 | 22.4 | |
Данные таблицы получены из Справочника CRC по химии и физике, 44-е изд. Аннотация «(s)» указывает на равновесную температуру пара над твердым веществом. В противном случае температура — это равновесие пара над жидкостью. Для значений кПа, где исходной точкой являются целые числа атмосфер, даны точные значения кПа, в других местах 2 значащие цифры получены из данных в мм рт. ст.

Фазовая диаграмма
[ редактировать ]Термодинамические данные о равновесии жидкость/пар
[ редактировать ]В таблице ниже приведены термодинамические данные жидкого CO 2 в равновесии с его парами при различных температурах. Данные о теплосодержании, теплоте парообразования и значениях энтропии относятся к жидкому состоянию при температуре 0 °C и давлении 3483 кПа. Чтобы преобразовать значения теплоты в значения джоулей на моль, умножьте это значение на 44,095 г/моль. Чтобы перевести плотность в моли на литр, умножьте ее на 22,678 см. 3 моль/(л·г). Данные получены из Справочника CRC по химии и физике , 44-е изд. страницы 2560–2561, за исключением линии критической температуры (31,1 °C) и температур -30 °C и ниже, которые взяты из «Справочника химии Ланге» , 10-е изд. страница 1463.
| Термодинамические данные о равновесии жидкости и пара углекислого газа | ||||||||
| Темп. °С | П вап пар давление кПа | H жидкость Нагревать содержание жидкость Дж /г | Н вап Нагревать содержание пар Дж /г | Δ пар H Тепло пар- изация Дж /г | ρ вап Плотность пара г/см 3 | ρ жидкость Плотность жидкости г/см 3 | С жидкость Энтропия жидкость Дж / моль -°С | С вап Энтропия пар Дж / моль -°С |
|---|---|---|---|---|---|---|---|---|
| −56.6 | 518.3 | 1.179 | ||||||
| −56.0 | 531.8 | 1.177 | ||||||
| −54.0 | 579.1 | 1.169 | ||||||
| −52.0 | 629.6 | 1.162 | ||||||
| −50.0 | 683.4 | 1.155 | ||||||
| −48.0 | 740.6 | 1.147 | ||||||
| −46.0 | 801.3 | 1.139 | ||||||
| −44.0 | 865.6 | 1.131 | ||||||
| −42.0 | 933.8 | 1.124 | ||||||
| −40.0 | 1005.7 | 1.116 | ||||||
| −38.0 | 1081.9 | 1.108 | ||||||
| −36.0 | 1161.8 | 1.100 | ||||||
| −34.0 | 1246.2 | 1.092 | ||||||
| −32.0 | 1335.1 | 1.084 | ||||||
| −30.0 | 1428.6 | 1.075 | ||||||
| −28.89 | 1521 | −55.69 | 237.1 | 292.9 | 0.03846 | 1.0306 | −9.48 | 43.41 |
| −27.78 | 1575 | −53.76 | 237.3 | 291.0 | 0.03987 | 1.0276 | −9.13 | 43.21 |
| −26.67 | 1630 | −51.84 | 237.6 | 289.4 | 0.04133 | 1.0242 | −8.78 | 43.01 |
| −25.56 | 1686 | −49.87 | 237.6 | 287.5 | 0.04283 | 1.0209 | −8.45 | 42.78 |
| −24.44 | 1744 | −47.91 | 237.8 | 285.7 | 0.04440 | 1.0170 | −8.10 | 42.56 |
| −23.33 | 1804 | −45.94 | 237.8 | 283.6 | 0.04600 | 1.0132 | −7.75 | 42.36 |
| −22.22 | 1866 | −43.93 | 237.8 | 281.7 | 0.04767 | 1.0093 | −7.40 | 42.14 |
| −21.11 | 1928 | −41.92 | 237.8 | 279.6 | 0.04938 | 1.0053 | −7.05 | 41.94 |
| −20.00 | 1993 | −39.91 | 237.8 | 277.8 | 0.05116 | 1.0011 | −6.68 | 41.71 |
| −18.89 | 2059 | −37.86 | 237.8 | 275.7 | 0.05300 | 0.9968 | −6.31 | 41.49 |
| −17.78 | 2114 | −35.82 | 237.6 | 273.6 | 0.05489 | 0.9923 | −5.98 | 41.27 |
| −16.67 | 2197 | −33.73 | 237.6 | 271.2 | 0.05686 | 0.9875 | −5.61 | 41.05 |
| −15.56 | 2269 | −31.64 | 237.3 | 269.2 | 0.05888 | 0.9829 | −5.26 | 40.83 |
| −14.44 | 2343 | −29.54 | 237.3 | 266.9 | 0.06098 | 0.9782 | −4.91 | 40.61 |
| −13.33 | 2418 | −27.41 | 237.1 | 264.5 | 0.06314 | 0.9734 | −4.54 | 40.39 |
| −12.22 | 2495 | −25.27 | 236.9 | 262.2 | 0.06539 | 0.9665 | −4.17 | 40.15 |
| −11.11 | 2574 | −23.09 | 236.7 | 259.7 | 0.06771 | 0.9639 | −3.80 | 39.92 |
| −10.00 | 2654 | −20.90 | 236.4 | 257.3 | 0.07011 | 0.9592 | −3.43 | 39.68 |
| −8.89 | 2738 | −18.69 | 235.9 | 254.8 | 0.07259 | 0.9543 | −3.06 | 39.46 |
| −7.78 | 2823 | −16.45 | 235.7 | 252.2 | 0.07516 | 0.9494 | −2.69 | 39.22 |
| −6.67 | 2910 | −14.18 | 235.2 | 249.4 | 0.07783 | 0.9443 | −2.32 | 38.98 |
| −5.56 | 2999 | −11.90 | 234.8 | 246.6 | 0.08059 | 0.9393 | −1.94 | 38.74 |
| −4.44 | 3090 | −9.977 | 234.3 | 243.8 | 0.08347 | 0.9340 | −1.57 | 38.50 |
| −3.89 | 3136 | −8.410 | 234.1 | 242.4 | 0.08494 | 0.9313 | −1.37 | 38.37 |
| −2.78 | 3230 | −6.046 | 233.6 | 239.7 | 0.08797 | 0.9260 | −0.98 | 38.12 |
| −1.67 | 3327 | −3.648 | 232.9 | 236.6 | 0.09111 | 0.9206 | −0.59 | 37.88 |
| −0.56 | 3425 | −1.222 | 232.4 | 233.6 | 0.09438 | 0.9150 | −0.20 | 37.62 |
| 0.56 | 3526 | 1.234 | 231.7 | 230.5 | 0.09776 | 0.9094 | 0.20 | 37.36 |
| 1.67 | 3629 | 3.728 | 231.0 | 227.3 | 0.1013 | 0.9036 | 0.61 | 37.08 |
| 2.78 | 3735 | 6.268 | 230.4 | 224.0 | 0.1050 | 0.8975 | 1.01 | 36.83 |
| 3.89 | 3843 | 8.445 | 229.4 | 220.5 | 0.1088 | 0.8914 | 1.42 | 36.55 |
| 5.00 | 3953 | 11.46 | 228.5 | 217.0 | 0.1128 | 0.8850 | 1.83 | 36.25 |
| 6.11 | 4067 | 14.13 | 227.6 | 213.4 | 0.1169 | 0.8784 | 2.25 | 35.98 |
| 7.22 | 4182 | 16.85 | 226.5 | 209.7 | 0.1213 | 0.8716 | 2.69 | 35.68 |
| 8.33 | 4300 | 19.63 | 225.4 | 205.8 | 0.1258 | 0.8645 | 3.12 | 35.39 |
| 9.44 | 4420 | 22.46 | 224.3 | 201.8 | 0.1306 | 0.8571 | 3.56 | 35.07 |
| 10.56 | 4544 | 25.36 | 223.1 | 197.7 | 0.1355 | 0.8496 | 4.02 | 34.76 |
| 11.67 | 4670 | 28.33 | 221.8 | 193.4 | 0.1408 | 0.8418 | 4.48 | 34.45 |
| 12.78 | 4798 | 31.35 | 220.3 | 188.9 | 0.1463 | 0.8338 | 4.94 | 34.11 |
| 13.89 | 4929 | 34.49 | 218.8 | 184.3 | 0.1521 | 0.8254 | 5.42 | 33.76 |
| 15.00 | 5063 | 37.30 | 217.2 | 179.5 | 0.1583 | 0.8168 | 5.92 | 33.41 |
| 16.11 | 5200 | 41.03 | 215.1 | 174.4 | 0.1648 | 0.8076 | 6.42 | 33.02 |
| 17.22 | 5340 | 44.48 | 213.6 | 169.1 | 0.1717 | 0.7977 | 6.96 | 32.66 |
| 18.33 | 5482 | 48.03 | 211.5 | 163.5 | 0.1791 | 0.7871 | 7.49 | 32.25 |
| 19.44 | 5628 | 51.71 | 209.4 | 157.6 | 0.1869 | 0.7759 | 8.04 | 31.83 |
| 20.56 | 5776 | 55.61 | 207.0 | 151.4 | 0.1956 | 0.7639 | 8.63 | 31.38 |
| 21.67 | 5928 | 59.66 | 204.3 | 144.7 | 0.2054 | 0.7508 | 9.24 | 30.90 |
| 22.78 | 6083 | 63.97 | 201.5 | 137.5 | 0.2151 | 0.7367 | 9.89 | 30.39 |
| 23.89 | 6240 | 68.58 | 198.4 | 129.8 | 0.2263 | 0.7216 | 10.57 | 29.85 |
| 25.00 | 6401 | 73.51 | 194.8 | 121.3 | 0.2387 | 0.7058 | 11.31 | 29.24 |
| 26.11 | 6565 | 78.91 | 190.7 | 111.8 | 0.2532 | 0.6894 | 12.10 | 28.60 |
| 27.22 | 6733 | 84.94 | 186.0 | 101.1 | 0.2707 | 0.6720 | 12.99 | 27.84 |
| 28.33 | 6902 | 91.88 | 180.4 | 88.49 | 0.2923 | 0.6507 | 14.00 | 26.95 |
| 29.44 | 7081 | 100.4 | 173.1 | 72.72 | 0.3204 | 0.6209 | 15.24 | 25.85 |
| 30.00 | 7164 | 105.6 | 168.4 | 62.76 | 0.3378 | 0.5992 | 16.01 | 25.15 |
| 30.56 | 7253 | 112.3 | 162.3 | 50.04 | 0.3581 | 0.5661 | 16.99 | 24.24 |
| 31.1 | 7391 | 0.00 | 0.4641 | 0.4641 | ||||
| Темп. °С | П вап пар давление кПа | H жидкость Нагревать содержание жидкость Дж /г | Н вап Нагревать содержание пар Дж /г | Δ пар H Тепло пар- изация Дж /г | ρ вап Плотность пара г/см 3 | ρ жидкость Плотность жидкости г/см 3 | С жидкость Энтропия жидкость Дж / моль -°С | С вап Энтропия пар Дж / моль -°С |
Спектральные данные
[ редактировать ]| УФ-Вид | |
|---|---|
| λλмакс | ? нм |
| Коэффициент экстинкции , ε | ? |
| И [а] | |
| Основные полосы поглощения [15] [16] [17] | 2347 и 667 см. −1 (4,26 и 14,99 мкм) |
| ЯМР | |
| Протонный ЯМР | непригодный |
| ЯМР углерода-13 | 125.0 [18] |
| РС | |
| Массы основных фрагментов | |
Примечания
[ редактировать ]- ^ Поскольку азот и кислород симметричны, а углекислый газ и водяной пар — нет, воздух в инфракрасном спектрофотометре может показывать поглощение CO 2 и воды. Это легко преодолеть, вычитая пустой спектр из экспериментального спектра, а инструменты часто также продувают сухим азотом.
Ссылки
[ редактировать ]- ^ «Показатель преломления газов» . НПЛ. Архивировано из оригинала 7 октября 2010 года . Проверено 7 апреля 2010 г.
- ^ Дарвент, Б. деБ. (1970). «Энергия диссоциации связи в простых молекулах» Nat. Стоять. Ссылка. Серия данных, Nat. Бур. Стоять. (США) 31, 52 страницы.
- ^ Jump up to: а б «Список экспериментальных данных CCCBDB, страница 2» . cccbdb.nist.gov . Проверено 1 декабря 2018 г.
- ^ Справочник Ланге по химии , 10-е изд. стр. 1669–1674.
- ^ «Газовая энциклопедия» . Эйр Ликид. Архивировано из оригинала 23 ноября 2016 года . Проверено 1 июня 2007 г.
- ^ Jump up to: а б «Свойства чистого компонента» (запрашиваемая база данных) . Информационный центр химико-технологических исследований . Проверено 8 мая 2007 г.
- ^ «Центр исследований и информации по химико-технологическим материалам углекислого газа (CHERIC) | Исследовательская информация | KDB | Свойства чистых компонентов» . www.cheric.org .
- ^ Jump up to: а б Джауке, ВФ; Иган, CJ (1937). «Двуокись углерода. Теплоемкость и давление пара твердого тела. Теплота сублимации. Термодинамические и спектроскопические значения энтропии». Журнал химической физики . 5 (1): 45–54. Бибкод : 1937ЖЧФ...5...45Г . дои : 10.1063/1.1749929 .
- ^ «Научно-информационный центр химико-технологических материалов по жидкостной теплоемкости диоксида углерода (CHERIC) | Исследовательская информация | KDB | Свойства чистых компонентов» . www.cheric.org .
- ^ Jump up to: а б Справочник Ланге по химии , 10-е изд., стр. 1525–1528.
- ^ «Идеальная теплоемкость газа углекислого газа Исследовательский и информационный центр химико-технологических материалов (CHERIC) | Исследовательская информация | KDB | Свойства чистых компонентов» . www.cheric.org .
- ^ Справочник Ланге по химии , 10-е изд., стр. 1522–1524.
- ^ Справочник Ланге по химии , 10-е изд. стр. 1573–1576.
- ^ Справочник Ланге по химии , 10-е изд., стр. 1100
- ^ Мартин, ЧП; Баркер, Э.Ф. (1932). «Инфракрасный спектр поглощения углекислого газа». Физический обзор . 41 (3): 291–303. Бибкод : 1932PhRv...41..291M . дои : 10.1103/PhysRev.41.291 . ISSN 0031-899X .
- ^ Оттонелло-Бриано, Флория; Эррандо-Эрранс, Карлос; Рёджегорд, Хенрик; Мартин, Ганс; Зольстрём, Ганс; Гилфасон, Кристинн Б. (2019). «Спектроскопия поглощения углекислого газа с кремниевым фотонным волноводом среднего инфракрасного диапазона» . Оптические письма . 45 (1): 109. arXiv : 1907.06967 . дои : 10.1364/OL.45.000109 . ISSN 0146-9592 . S2CID 196831810 .
- ^ Райхл, Генри Г. (май 1969 г.), Влияние нескольких прозрачных расширяющих инфракрасное излучение газов на поглощение инфракрасного излучения в диапазоне 15 мкм углекислого газа (PDF) , Высотная инженерная лаборатория, стр. 43, 19690019487
{{citation}}: CS1 maint: дата и год ( ссылка ) - ^ Райх, HJ «Химические сдвиги C-13» . Информация об органической химии . Университет Висконсина. Архивировано из оригинала 2 марта 2015 года . Проверено 31 мая 2015 г.
- Линстрем, Питер Дж.; Маллард, Уильям Г. (ред.); Интернет-книга NIST по химии , Справочная база данных стандартов NIST № 69 , Национальный институт стандартов и технологий, Гейтерсбург (Мэриленд)
- Если не указано иное, данные относятся к стандартной температуре и давлению .
- Общие сведения о достоверности данных .
![{\displaystyle {\frac {[{\ce {CO2}}]}{[{\ce {CO}}][{\ce {O2}}]^{1/2}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/68e0ac469da9090ce82b0809b5419cda523617c8)