Диджиндин

Дидинины представляют собой циклические депсипептидных соединения соединений , выделенных из туниката ( асцидий или моря) рода Trididemnum ( Family of Didemanidæ ), которые были собраны в Карибском море . Они были впервые изолированы в 1978 году в Университете Иллинойса . [ 1 ]
Хотя более чем девять динаминов (Didemanins AE, G, X и Y) были изолированы из экстракта Trididemnum Solidum , Didemanin B - это тот, который обладает наиболее сильной биологической деятельностью . [ 2 ] Это сильный противовирусный агент ДНК, так и РНК, как против вирусов таких как вирус простого герпеса типа 1 , сильный иммуносупрессант , который демонстрирует некоторый потенциал в кожном трансплантате [ 3 ] и также очень цитотоксичен . Это показывает сильную активность против мышиного лейкоза клеток . [ 4 ] Большое количество динамина B было химически синтезировано в клинических испытаниях был продвинут в клинических испытаниях , и национальный институт рака . Он завершил фазу II испытания человека против аденокарциномы почки , клинические [ 5 ] продвинутый эпителиального рак яичника , [ 6 ] и метастатический рак молочной железы. [ 7 ] К сожалению, соединение демонстрировало высокую токсичность за счет высокой частоты анафилактических реакций у пациентов и исследований. [ 8 ]
Дидлинна Аналоговый плитидпсин проводился в клинических испытаниях II фазы по состоянию на 2003 год. [ 9 ]
Биосинтез
[ редактировать ]Биосинтез дидименона депсипептида определяется гибридным нерибосомным пептид-синтетазой-поликетад-синтетазой (NRPS-PKS). Мега-синтетаза Дидлиннин состоит из 10 белков, из которых 8 NRP и 2 PK, охватывающих 13 модулей. [ 10 ]
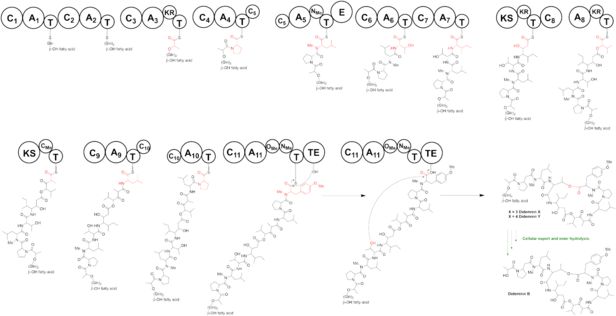
Предлагаемый путь биосинтеза динамина B начинается с DID A. Модули 1 и 2, оба включают глицин на β-о-о-жирной кислоте. На DIDB домен аденилирования (A) загружается пируватом и впоследствии снижается в его конформации CIS доменом кеторедуктазы (KR), давая лактат, связанный с доменом тиолирования (T). Мономодулярный DIDC включает пролин, прежде чем Tridomain Didd удлиняет пептидную цепь 3 аминокислотами. Домен аденилирования (A) DIDD загружается лейцином и впоследствии N-метилируется доменом метилтрансферазы (MT) и превращается в N-метилированный D-лейцин с помощью домена эпимеразы (E). N-метилированный лейцин является единственной D-аминокислотой в дидлинне B. Второй модуль на DIDD включает треонин и третий модуль на прикрепленном домене изолецин, собирая тетрапептид (Pro)-(N-ME-D-Leu)- (Thr)-(Ile). Покрытие - это PKS, но не хватает домена ацилтрансферазы (AT). Модуль 8 на DIDE прикрепляет кетид-увеличенный β-гидрокси-γ-изостатин. Предполагается, что Didemanin PK мобилизуются в доменной FABD из синтазы жирной кислоты (FAS), поскольку в домене нет в домене, присутствующем в геноме Didemin. Домен Didf A загружается 2-оксозоизолловой кислотой и включает в себя α-гидрокси кислоту 2-гидроксизолловой кислоты. Модуль 10 на PKS Didg добавляет второй раунд расширения Malonate. Домен MT на DIDG добавляет α-метильную группу в этот остаток. Мономодулярные домены Didh, Didi и DidJ удлиняют цепь с соответственно лейцином, пролина и тирозина. Два два домена MT на DIDJ Метилизируют тирозин дважды, чтобы получить N-метил-O-метил-тирозин, завершая сборку линейного дидлинна B. Домен тиоэстеразы (TE) на модуле DIDJ выпускает продукт в своем циклизованном виде.
Смотрите также
[ редактировать ]Ссылки
[ редактировать ]- ^ Rinehart L., K. et al. Полем J. Am. Химический Соц 1981 , 103 , 1857-1859.
- ^ Rinehart L., K. et al. Полем J. Nat Продлевать 1988 , 51 , 1-21.
- ^ Montgomery, D.; Zukoshi, CF Transplantation 1985 , 40 , 49.
- ^ Белуф, Дж. (2006). «Обзор дидемлинцев: класс натуральных продуктов для депсипептидов с перспективными биомедицинскими применениями». arxiv : Q-bio/0612040 .
- ^ Тейлор, SA; Гудман, П.; Stuckey, WJ Stephens, RL; Gaynor, ER Invest. Новые лекарства 1992 , 10 , 55.
- ^ Каин, JM; Лю, Пи; Альберта, де; Галлион, JJ; Laufman, L.; О'Салливан, J.; Вайс, Г.; Bickers, JN Invest. Новые лекарства 1992 , 10 , 113.
- ^ Montgomery, D.; Zukoshi, CF Transplantation 1985 , 40 , 49.
- ^ Nuijen, B.; Bouma, M.; Манада, C.; Jimeno, JM; Schellens, JHM; Bult, A.; Beijnen, JH Anti-Cancer Drugs 2000 , 11 , 793.
- ^ Cárdenas, F. et al . Журнал органической химии 2003 , 68 (25), 9554-9562.
- ^ Xu Y., et al. Дж. А. Ткань SOC 2012 , 20 , 8625–8632. htts: //doi.org/101735