Каптодативный эффект

Каптодативный эффект представляет собой стабилизацию радикалов электронодонорного за счет синергического действия электроноакцепторного и . заместителя [ 2 ] [ 3 ] Название происходит от того, что электроноакцепторную группу (EWG) иногда называют «захватывающей» группой, тогда как электронодонорную группу (EDG) называют «дативным» заместителем. [ 3 ] Олефины с такой структурой заместителей иногда называют каптодативными. [ 2 ] Радикальные реакции играют важную роль в ряде химических реакций, а также важны для науки о полимерах . [ 4 ]
Когда ЭДГ и ЭВГ находятся вблизи радикального центра, стабильность радикального центра увеличивается. [ 1 ] Заместители могут кинетически стабилизировать радикальные центры, предотвращая реакцию молекул и других радикальных центров с центром. [ 3 ] Заместители термодинамически стабилизируют центр путем делокализации ион-радикала посредством резонанса . [ 1 ] [ 3 ] Эти механизмы стабилизации приводят к увеличению скорости свободнорадикальных реакций. [ 5 ] На рисунке справа радикал делокализован между захватывающим нитрилом (-CN) и дативным вторичным амином (-N(CH 3 ) 2 ), тем самым стабилизируя радикальный центр. [ 3 ]
Влияние заместителя на скорость реакции
[ редактировать ]Некоторые заместители лучше стабилизируют радикальные центры, чем другие. [ 6 ] На это влияет способность заместителя делокализовать ион-радикал в структуре переходного состояния . [ 3 ] Делокализация ион-радикала стабилизирует структуру переходного состояния. В результате энергия активации снижается, увеличивая скорость общей реакции. Согласно каптодативному эффекту, скорость реакции наибольшая, когда и ЭДГ, и ЭВГ способны делокализовать ион-радикал в структуре переходного состояния. [ 7 ]
Ито и его коллеги наблюдали скорость реакций присоединения арилтиолового радикала к дизамещенным олефинам. [ 6 ] Олефины содержали нитрильную группу EWG и различные EDG, и наблюдалось влияние различных EDG на скорость реакций присоединения. Изучаемый процесс заключался в следующем:
Скорость реакции присоединения ускоряли следующие ЭДГ в порядке возрастания: H < CH 3 < OCH 2 CH 3 . Когда R = OCH 2 CH 3 , скорость реакции самая высокая, поскольку реакция имеет наименьшую энергию активации (ΔG ‡ ). Этокси- и цианогруппы способны делокализовать ион-радикал в переходном состоянии, стабилизируя тем самым радикальный центр. Повышение скорости обусловлено каптодативным эффектом. Когда R = H, реакция имеет наибольшую энергию активации, поскольку радикальный центр не стабилизируется за счет каптодативного эффекта. Атом водорода не способен делокализовать ион-радикал. Таким образом, реакция протекает медленно по сравнению со случаем R = OCH 2 CH 3 . Когда R = CH 3 , скорость реакции выше, чем когда R = H, поскольку метильные группы обладают большей способностью отдавать электроны. [ 6 ] Однако скорость реакции медленнее по сравнению со случаем R = OCH 2 CH 3 , поскольку ион-радикал не делокализован по метильной группе. Таким образом, каптодатив не влияет на скорость реакции, если ион-радикал не делокализован как на заместителях EWG, так и на EDG. Каждый из этих случаев проиллюстрирован ниже:
Использование в синтезе
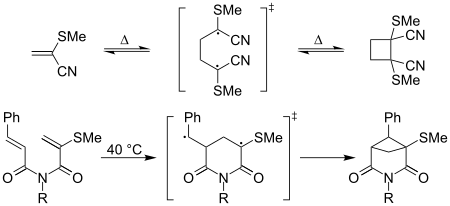
[ редактировать ]Термин «каптодативные этилены» использовался в контексте реакций циклоприсоединения с участием каптодативных радикальных промежуточных продуктов - например, термическая [2 + 2] прямая димеризация 2-метилтиоакрилонитрила легко происходит при комнатной температуре; образование эквивалентного циклобутанового производного акрилонитрила происходит «вяло». [ 8 ] Сообщалось также, что внутримолекулярная [2+2] циклизация усиливается за счет каптодативного эффекта. [ 8 ] как показано ниже:
Подобные эффекты обсуждались и для других циклоприсоединений, таких как [3+2], [4+2] и [3+4] для каптодативных этиленов. [ 9 ] Также сообщалось о таких эффектах, как реакции Дильса-Альдера и Фриделя-Крафтса , когда нуклеофильные олефины реагируют неэффективно, что объясняется тем, что переходное состояние близко к бирадикалу и, таким образом, стабилизировано. [ 8 ] [ 10 ] Эти исследования выявили прямую зависимость от Δω, различия в электрофильности и полярности реакции. Их использовали из-за их высокореактивной, стереоселективной и региоселективной природы в этих реакциях. [ 9 ] [ 11 ]
Каптодативные олефины в реакциях также проявляют мешающие эффекты с типичным кинетическим изотопным эффектом , позволяя протекать атипичным реакциям с молекулами, меченными изотопами. [ 12 ] и демонстрация влияния на механизмы и переходные состояния этих реакций.
Применение науки о полимерах
[ редактировать ]Свободнорадикальная полимеризация , при которой радикалы являются носителями цепи в распространении процесса, составила 40 миллиардов из 110 миллиардов фунтов полимеров, произведенных в Соединенных Штатах в 2001 году. [ 13 ] Каптодативные олефины имеют особое преимущество, заключающееся в том, что они чувствительны к воздействию растворителей без эффекта дестабилизации радикала. [ 4 ] Также было показано, что они самопроизвольно подвергаются радикальной трансформации, что позволяет им быть полезными для выяснения механизма полимеризации и лучшего понимания с помощью ЯМР-исследований . Кроме того, каптодативные этаны являются инициаторами с уникальными свойствами, обеспечивающими более высокое молекулярно-массовое распределение и образующими блок -сополимеры по известным радикальным механизмам. Полимеры, полученные из каптодативно замещенных исходных материалов, проявляют «желательные» свойства, такие как оптическая активность, различия в полярности, сродство к растворителю , термическая и механическая стабильность.


- Известно, что полимеры с полярными заместителями имеют интересные применения, в том числе в электрических и оптических материалах .
- Эти полимеры обычно прозрачны.
- Т ди (начальное разложение) этих полимеров относительно низкие по сравнению с их аналогами, но имеют относительно более высокие Т дм (максимальная скорость изменения температуры). Это означает, что, хотя они начнут таять быстрее, им потребуется больше времени, чтобы полностью изменить фазу.
- Полимеры с большой степенью каптотивной стабилизации исходных материалов могут быстро «распаковываться» до исходного мономера при нагревании.
- Бифункциональные полимеры с двумя разными функциональными группами в каждой мономерной единице обычно образуются из каптодативных мономеров.
- Дативные группы существенно изменяют растворимость за счет водородных связей в определенных бифункциональных полимерах (см. рисунок выше). Однако на данный момент четкой корреляции не выявлено, поскольку не все комбинации заместителей и растворимости исследованы.
- Каптодативный полимер обладает высокой функциональностью в хелатах с некоторыми металлами. [ 4 ]
Ссылки
[ редактировать ]- ^ Jump up to: а б с Анслин, Э.В.; Догерти, Д.А. (2006). Современная физико-органическая химия (ред. Додр.). Саусалито, Калифорния: Университетские научные книги. ISBN 9781891389313 .
- ^ Jump up to: а б Краткий химический словарь . Издательство V&S. 2012. с. 51. ИСБН 9789381588628 .
- ^ Jump up to: а б с д и ж Вихе, Х.Г.; Янусек, З.; Мереньи, Р.; Стелла, Л. (1985). «Каптодативный эффект». Отчеты о химических исследованиях . 18 (5): 148–154. дои : 10.1021/ar00113a004 .
- ^ Jump up to: а б с Танака, Х. (2003). «Каптодативная модификация в науке о полимерах». Прогресс в науке о полимерах . 28 (7): 1171–1203. дои : 10.1016/S0079-6700(03)00013-3 .
- ^ Сустманн, Р.; Корт, Х.-Г. (1990). Достижения физико-органической химии . Сан-Диего, Калифорния: Academic Press. стр. 131–172. ISBN 0120335263 .
- ^ Jump up to: а б с Ито, Осаму; Арито, Ю.; Мацуда, М. (1988). «Каптодативное влияние на скорость реакций присоединения арилтиильного радикала к дизамещенным олефинам». Журнал Химического общества, Perkin Transactions 2 (6): 869–873. дои : 10.1039/P29880000869 .
- ^ Крири, X.; Мехришейх-Мохаммади, Мэн (1985). «Повышение скорости каптодативной перегруппировки метиленциклопропана». Журнал органической химии . 51 (14): 2664–2668. дои : 10.1021/jo00364a009 .
- ^ Jump up to: а б с Стелла, Л. (1986). «Эффекты каптодативного заместителя в реакциях циклоприсоединения» . В Виехе, ХГ; Янусек, З.; Мереньи, Р. (ред.). Эффекты заместителей в радикальной химии . Спрингер. стр. 361–370. ISBN 9789027723406 .
- ^ Jump up to: а б Эррера, Р.; Хименес-Васкес, ХА; Дельгадо, Ф.; Содерберг, BCG; Тамарис, Дж. (2005). «1-Ацетивинилакрилаты: новые каптодативные олефины, несущие и внутренний зонд для оценки относительной реакционной способности каптодатива против электронодефицитной двойной связи в реакциях Дильса-Альдерса и Фриделя-Крафтса» . Журнал Бразильского химического общества . 16 (3А): 456–466. дои : 10.1590/S0103-50532005000300021 .
- ^ Стелла, Л.; Буше, Ж.-Л. (1982). «Эффекты каптодативного заместителя. 12». 1 - Новые кетенные эквиваленты циклоприсоединения Дильса-Альдера». Tetrahedron Letters . 22 (9): 953–956. doi : 10.1016/S0040-4039(00)86992-0 .
- ^ Доминго, Л.; Чаморро, Э.; Перес, П. (2008). «Понимание реакционной способности каптодативных этиленов в реакциях полярного циклоприсоединения. Теоретическое исследование». Журнал органической химии . 73 (12): 4615–4624. дои : 10.1021/jo800572a . hdl : 10533/139635 . ПМИД 18484771 .
- ^ Вуд, М.; Биссириу, С.; Лоу, К.; Виндетт, К.М. (2013). «Синтетическое использование первичного кинетического изотопного эффекта при переносе атома водорода 2: генерация каптодативно стабилизированных радикалов». Органическая и биомолекулярная химия . 11 (16): 2712–23. дои : 10.1039/C3OB40275D . ПМИД 23479029 .
- ^ Одиан, Г. (2004). Принципы полимеризации (4-е изд.). Нью-Йорк: Wiley-Interscience. ISBN 9780471274001 .