Металл-катализируемые циклопропанации
Циклопропанирование, катализируемое металлами, представляет собой химические реакции , которые приводят к образованию циклопропанового кольца металлов из карбеноидов и алкена . [1] В реакции Симмонса-Смита участвует цинк. Разновидности металлических карбеноидов могут быть получены в результате реакции диазосоединения с переходным металлом). О внутримолекулярном варианте этой реакции впервые сообщалось в 1961 году. [2] Комплексы карбоксилата родия, такие как тетраацетат диродия , являются обычными катализаторами. Разработаны энантиоселективные циклопропанации. [3]
 | ( 1 ) |
Механизм и стереохимия
[ редактировать ]Точные механистические исследования циклопропанирования, катализируемого родием, отсутствуют. Однако этот механизм был рационализирован на основе распределения продуктов и стереоселективности. [4] Атака диазосоединения на металлцентр приводит к образованию цвиттер-ионного металлалкильного комплекса, который вытесняет газообразный азот с образованием промежуточного металлического карбена. Согласованное добавление карбена металла к олефину (без прямой координации олефина с металлом) приводит к образованию наблюдаемого циклопропанового продукта. [5] Конфигурация олефина сохраняется на протяжении всего процесса; [6] однако карбены металлов с гетеротопными гранями могут образовывать смесь диастереомеров, как показано в правой части уравнения. (2).
(2)
Конфигурация продукта определяется траекторией приближения олефина к металлическому карбену. В реакциях монозамещенных карбенов металлов с концевыми олефинами олефин, вероятно, приближается к «концу» (при этом двойная связь углерод-углерод олефина почти параллельна двойной связи металл-углерод карбена) с направленной назад группой R олефина. от заместителя карбена. [7] Вторая модель переходного состояния была предложена для реакций винилзамещенных карбенов. В этой модели олефин приближается «сбоку» (с двойной связью углерод-углерод олефина, перпендикулярной двойной связи металл-углерод карбена), при этом группа R олефина находится далеко от винильной группы. [8]
Стереоселективные варианты
[ редактировать ]Методы стереоселективного синтеза циклопропанов из диазокарбонильных соединений и олефинов основываются либо на использовании предварительно полученных хиральных родиевых катализаторов, либо на использовании хиральных вспомогательных веществ на диазокарбонильном соединении. Например, Rh 2 [ S -DOSP] 4 является высокоэффективным катализатором энантиоселективного циклопропанирования алкенов. [9]
(3)
Хиральные вспомогательные вещества, полученные из легкодоступных хиральных спиртов (таких как пантолактон), можно использовать для диастереоселективного циклопропанирования диазоэфирами. [10]
(4)
Область применения и ограничения
[ редактировать ]Циклопропанирование олефинов диазокарбонильными соединениями обычно осуществляется с использованием комплексов карбоксилата родия, хотя первоначально использовалась медь. [11] Область применения олефинов, как правило, довольно широка: богатые электронами, [12] нейтральный, [13] и бедные электронами [14] Все олефины были эффективно циклопропанированы с использованием каталитических систем на основе родия. В этом разделе описаны различные классы диазокарбонильных соединений, которые реагируют с олефинами под действием родия с образованием циклопропанов.
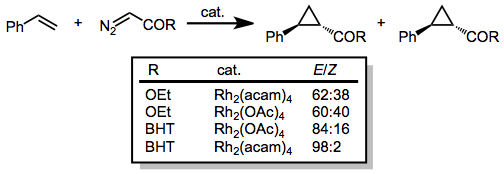
Диазоацетаты, которые имеют единственный карбонильный заместитель, присоединенный к диазоуглероду, использовались для циклопропанирования широкого спектра олефинов. Диастереоселективность по ( E ) циклопропану увеличивается с увеличением размера сложноэфирной группы. Кроме того, добавление электронной плотности к катализатору (например, путем замены ацетатных лигандов ацетамидом, акамом) увеличивает диастереоселективность реакции. [15]
(5)
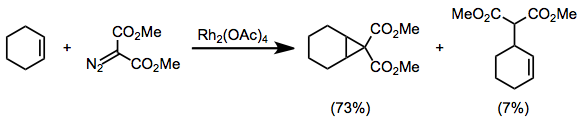
Диазокарбонильные соединения, замещенные двумя электроноакцепторными группами, такие как диазомалонаты, склонны к побочным реакциям в условиях циклопропанирования. [3+2] Циклоприсоединение [16] и вставка CH [17] наблюдались побочные продукты.
(6)
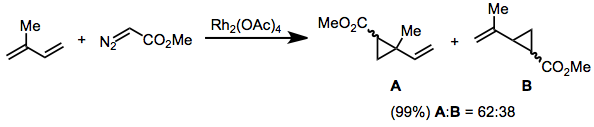
Диазоацетаты, замещенные винильной или арильной группой на диазоуглероде, нереакционноспособны по отношению к транс -алкенам. Этот результат был объяснен с помощью модели переходного состояния в уравнении. (2). Реакции этих субстратов высокоселективны в отношении изомера ( E ) циклопропана. [18]
(7)
Винилдиазоацетаты реагируют с диенами с образованием дивинилциклопропанов, которые подвергаются перегруппировке Коупа с образованием циклогептадиенов. [19] Более замещенная двойная связь диена вступает в реакцию преимущественно. [20]
(8)
(9)
Аналогично фураны реагируют с винилдиазоацетатами, хотя промежуточный циклопропан может превращаться либо в продукт перегруппировки Коупа, либо в открытое ненасыщенное карбонильное соединение. Распределение этих продуктов во многом зависит от характера замещения фурана. [21]
(10)
Пирролы реагируют с винилдиазоацетатами с образованием циклогептадиенов с азотистыми мостиками. Использование метиллактата в качестве хирального вспомогательного вещества винилдиазоацетата привело к умеренной диастереоселективности в тандемной циклопропанации/копе-перегруппировке Вос-защищенного пиррола. [22]
(11)
Энантиоселективность асимметричных циклопропанаций может сильно зависеть от растворителя. [23]
Синтетические приложения
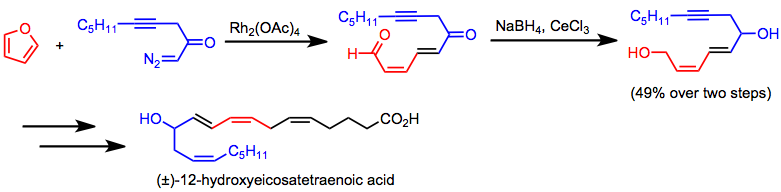
[ редактировать ]Энантиоселективное межмолекулярное циклопропанирование применено для синтеза хирального циклопропанового антибиотика циластатина. [24] (12) Тандемное циклопропанирование/фрагментация является ключевым этапом синтеза 12-гидроксиэйкозатетраеновой кислоты. [25]
(12)
Сравнение с другими методами
[ редактировать ]Циклопропанирование Симмонса-Смита , в котором используются карбены, полученные из дииодметана, является популярной альтернативой циклопропанированию, катализируемому родием. В присутствии хирального диамина циклопропанирование Симмонса-Смита является энантиоселективным; однако селективность не так высока, как у соответствующих реакций, катализируемых родием. [26]
(13)
Замещенные карбеноиды цинка можно получить из соответствующих кетонов или альдегидов последовательностью, аналогичной механизму восстановления Клемменсена . Циклопропанирование олефинов этими интермедиатами протекает с умеренной диастереоселективностью и выходом. [27]
(14)
Помимо диазокарбонильных соединений, для катализируемого родием циклопропанирования использовались и другие диазосоединения; [28] однако с этими субстратами гораздо сложнее обращаться, и они нестабильны, чем диазокарбонильные соединения. Таким образом, они не нашли широкого применения в органическом синтезе.
(15)
Ссылки
[ редактировать ]- ^ Дэвис, HML; Антулинакис, EG Org. Реагировать. 2001 , 57 , 1. два : 10.1002/0471264180.или057.01
- ^ Берк, SD; Грико, Пенсильвания Орг. Реагировать. 1979 , 26 , 361.
- ^ Singh, V. K.; Arpita, D.; Sekar, G. Synthesis 1997 , 137. два : 10,1055/с-1997-1172
- ^ Дойл, член парламента Acc. хим. Рез. 1986 , 19 , 348.
- ^ Дойл, член парламента; МакКерви, Массачусетс; Е, Т. В книге « Современные каталитические методы органического синтеза с диазосоединениями: от циклопропанов к илидам »; Уайли: Нью-Йорк, 1998, стр. 163–220.
- ^ Дойл, член парламента по химии. Ред. 1986 , 86 , 919.
- ^ Дойл, член парламента; Гриффин, Дж. Х.; Багери, В.; Дороу, Р.Л. Металлоорганические соединения , 1984 , 3 , 53.
- ^ Дэвис, HML Curr. Орг. хим. 1998 , 2 , 463.
- ^ Дэвис, HML; Брузинский, PR; Озеро, ДХ; Конг, Н.; Фолл, MJ J. Am. хим. Соц. 1996 , 118 , 6897.
- ^ Дэвис, HML; Хьюби, штат Нью-Джерси; Кантрелл, В.Р.-младший; Олив, JL J. Am. хим. Соц. 1993 , 115 , 9468.
- ^ Дэйв, В.; Варнхофф, E. Org. Реагировать. 1970 , 18 , 217.
- ^ Ye, T.; McKervey, M. Chem. Rev. 1994 , 94 , 1091.
- ^ Маас, Г. Топ. Курс. хим. 1987 , 137 , 75.
- ^ Дойл, М.; Дороу, Р.; Буро, В.; Гриффин, Дж.; Тэмблин, В.; Труделл, М. Металлоорганика , 1984 , 3 , 44.
- ^ Дойл, М.; Багери, В.; Уэндлесс, Т.; Харн, Северная Каролина; Бринкер, Д.А.; Игл, К.; Ло, KJ Am. хим. Соц. 1990 , 112 , 1906.
- ^ Пиррунг, MC; Чжан, Дж.; Лакей, К.; Штернбах, Д.Д.; Браун, FJ Org. хим. 1995 , 60 , 2112.
- ^ Мир, BW; Вульфман, DS Synthesis 1973 , 137.
- ^ Дэвис, HML; Кларк, Ти Джей; Церковь, Лос-Анджелес Tetrahedron Lett. 1989 , 30 , 5057.
- ^ Дэвис, Х.; Смит, Х.; Коркор, О. Tetrahedron Lett. 1987 , 28 , 1853.
- ^ Дойл, М.; Дороу, Р.; Тэмблин, В.; Буро, В. Тетраэдр Летт. 1982 , 23 , 2261.
- ^ Венкерт, Э. В «Новых тенденциях в химии натуральных продуктов», исследованиях в области органической химии ; Рахман А., Кен П.В., ред.; Эльзевир: Амстердам, 1986; Том. 26, стр. 557–563.
- ^ Дэвис, HML; Хьюби, NJS Tetrahedron Lett. 1992 , 33 , 6935.
- ^ Дойл, член парламента; Чжоу, К.-Л.; Чарнсангавей, К.; Лонгория, Массачусетс; МакКерви, Массачусетс; Гарсия, CF Tetrahedron Lett. 1996 , 37 , 4129.
- ^ Aratani, T. Pure Appl. Chem. 1985 , 57 , 1839.
- ^ ЛеБлан, Ю.; Фицсиммонс, Би Джей; Адамс, Дж.; Перес, Ф.; Рокач, JJ Org. Ткань. 1986 , 51 , 789.
- ^ Дания, ЮВ; О'Коннор, SP J. Org. хим. 1997 , 62 , 3390.
- ^ Мазервелл, WB; Робертс, LRJ Chem. Соц., хим. Коммун. 1992 , 1582.
- ^ Де Мейере, А.; Шульц, Ти Джей; Костиков Р.Р.; Граупнер, Ф.; Мурр, Т.; Билфельдт, Т. Синтез 1991 , 547.