Реакция Симмонса-Смита
| Реакция Симмонса-Смита | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Назван в честь | Говард Энсайн Симмонс-младший Рональд Д. Смит | ||||||||
| Тип реакции | Реакция образования кольца | ||||||||
| Реакция | |||||||||
| |||||||||
| Условия | |||||||||
| Идентификаторы | |||||||||
| Портал органической химии | Симмонс-Смит-реакция | ||||||||
| RSC Идентификатор онтологии | RXNO: 0000258 | ||||||||
Реакция Симмонса-Смита представляет собой органическую хелетропную реакцию с участием цинкорганического карбеноида , который реагирует с алкеном (или алкином ) с образованием циклопропана . [ 1 ] [ 2 ] [ 3 ] Он назван в честь Говарда Энсина Симмонса-младшего и Рональда Д. Смита . В нем используется метиленовый свободнорадикальный интермедиат, который доставляется к обоим атомам углерода алкена одновременно, поэтому конфигурация двойной связи в продукте сохраняется и реакция стереоспецифична. [ 4 ]

Механизм
[ редактировать ] Реакция Симмонса-Смита в процессе |
Примеры
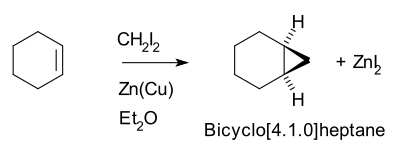
[ редактировать ]Так, циклогексен , дийодметан и пара цинк-медь (в виде йодида иодметилцинка , ICH 2 ZnI) дают норкаран (бицикло[4.1.0]гептан). [ 5 ] [ 6 ]
Реакция Симмонса-Смита обычно предпочтительнее других методов циклопропанирования. [ 7 ] однако это может быть дорого из-за высокой стоимости дииодметана. Были разработаны модификации, включающие более дешевые альтернативы, такие как дибромметан. [ 8 ] или диазометан и йодид цинка . [ 9 ] Повысить реакционную способность системы можно также, применив модификацию Фурукавы, заменив пару цинк-медь на диэтилцинк . [ 10 ]
Реакция Симмонса-Смита обычно подвержена стерическим эффектам , поэтому циклопропанирование обычно происходит на менее затрудненной стороне. [ 11 ] [ 12 ] Однако, когда гидрокси-заместитель присутствует в субстрате вблизи двойной связи, цинк координируется с гидрокси-заместителем, направляя цис -циклопропанацию к гидроксильной группе (что может не соответствовать циклопропанированию стерически наиболее доступной стороны двойной связи). ): [ 13 ] Интерактивную 3D-модель этой реакции можно увидеть на ChemTube3D .
Асимметричная реакция Симмонса – Смита
[ редактировать ]Хотя методы асимметричного циклопропанирования на основе диазосоединений ( циклопропанирование, катализируемое металлами ) существуют с 1966 года, асимметричная реакция Симмонса-Смита была введена в 1992 году. [ 14 ] реакцией коричного спирта с диэтилцинком , дииодметаном и хиральным дисульфонамидом в дихлорметане :
Гидроксильная группа является обязательным условием , служащим якорем для цинка. Интерактивная 3D-модель аналогичной реакции. [ 15 ] можно увидеть здесь (требуется Java). В другом варианте этой реакции лиганд основан на салене и кислота Льюиса ДИБАЛ : добавляется [ 16 ]
Область применения и ограничения
[ редактировать ]Ахиральные алкены
[ редактировать ]Реакцию Симмонса-Смита можно без осложнений использовать для циклопропанирования простых алкенов . Нефункционализированные ахиральные алкены лучше всего циклопропанировать с модификацией Фурукавы (см. ниже), используя Et 2 Zn и CH 2 I 2 в 1,2-дихлорэтане . [ 17 ] Циклопропанирование алкенов, активированных электронодонорными группами, протекает быстро и легко. Например, простые эфиры енолов , такие как триметилсилилоксизамещенные олефины. из-за высоких выходов часто используются [ 18 ]

Несмотря на электроноакцепторную природу галогенидов , многие винилгалогениды также легко циклопропанируются с образованием фтор-, бром- и йодзамещенных циклопропанов. [ 19 ] [ 20 ]

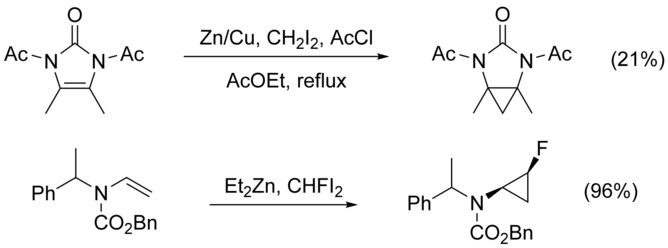
Циклопропанирование N -замещенных алкенов осложняется N -алкилированием как конкурирующим путем. Этого можно обойти, добавив к азоту защитную группу , однако добавление электроноакцепторных групп снижает нуклеофильность алкена, снижая выход. Было показано, что использование высокоэлектрофильных реагентов , таких как CHFI 2 , вместо CH 2 I 2 , увеличивает выход в этих случаях. [ 21 ]
Полиены
[ редактировать ]Без присутствия направляющей группы в олефине очень незначительная хемоселективность . наблюдается [ 22 ] Однако предпочтение будет отдано алкену, который значительно более нуклеофильен, чем любой другой. Например, циклопропанирование происходит высокоселективно по эфирам енолов . [ 23 ]
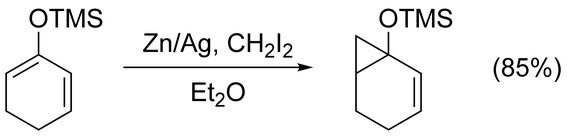
Совместимость функциональных групп
[ редактировать ]Важным аспектом реакции Симмонса-Смита, способствующим ее широкому использованию, является ее способность использовать в присутствии многих функциональных групп. Среди прочего, реакция, опосредованная галоалкилцинком, совместима с алкинами , спиртами , простыми эфирами , альдегидами , кетонами , карбоновыми кислотами и их производными, карбонатами , сульфонами , сульфонатами , силанами и станнанами . Однако обычно наблюдаются некоторые побочные реакции.
Большинство побочных реакций происходит из-за кислотности по Льюису побочного продукта ZnI 2 . В реакциях, в которых образуются чувствительные к кислоте продукты, избыток Et 2 Zn можно добавлять ZnI 2 , чтобы удалить образующийся , образуя менее кислый EtZnI. Реакцию также можно погасить пиридином , который будет удалять ZnI 2 и избыток реагентов. [ 24 ]
Метилирование гетероатомов наблюдается также в реакции Симмонса-Смита из-за электрофильности карбеноидов цинка. Например, использование избытка реагента при длительном времени реакции почти всегда приводит к метилированию спиртов. [ 25 ] Кроме того, Et 2 Zn и CH 2 I 2 реагируют с аллильными тиоэфирами с образованием серы илидов , которые впоследствии могут подвергаться 2,3-сигматропной перегруппировке и не будут циклопропанировать алкен в той же молекуле, если не используется избыток реагента Симмонса-Смита. [ 26 ]

Модификации
[ редактировать ]Реакция Симмонса-Смита редко используется в исходной форме, и был разработан ряд модификаций как цинкового реагента, так и предшественника карбеноида, которые используются чаще.
модификация Фурукавы
[ редактировать ]Модификация Фурукавы предполагает замену пары цинк-медь на диалкилцинк, наиболее активным из которых оказался Et 2 Zn . Модификация была предложена в 1968 году как способ превратить катионно полимеризуемые олефины, такие как виниловые эфиры, в соответствующие циклопропаны. [ 27 ] Также было обнаружено, что он особенно полезен для циклопропанирования углеводов, поскольку его воспроизводимость гораздо выше, чем у других методов. [ 28 ] Как и немодифицированная реакция, реакция, модифицированная Фурукавой, является стереоспецифичной и часто протекает намного быстрее, чем немодифицированная реакция. Однако реагент Et 2 Zn пирофорен , поэтому с ним следует обращаться осторожно. [ 29 ]
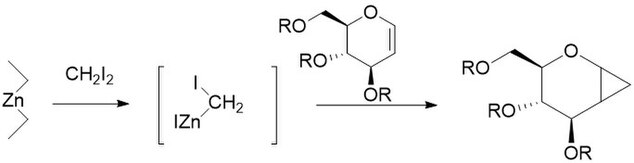
Модификация корзины
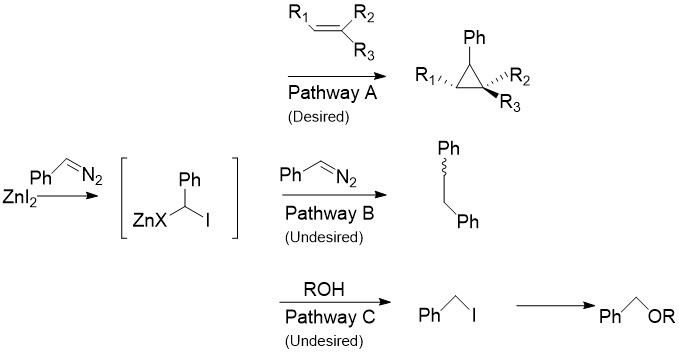
[ редактировать ]Модификация Шаретта заменяет CH 2 I 2 , обычно присутствующий в реакции Симмонса-Смита, на арилдиазосоединения, такие как фенилдиазометан , на пути А. [ 30 ] При обработке стехиометрическими количествами галогенида цинка цинкорганическое соединение образуется , подобное карбеноиду, рассмотренному выше. Он может реагировать практически со всеми алкенами и алкинами, включая стиролы и спирты. Это особенно полезно, поскольку известно, что немодифицированный препарат Симмонса-Смита депротонирует спирты. К сожалению, как показано на пути B, промежуточное соединение также может реагировать с исходным диазосоединением, давая цис- или транс -1,2-дифенилэтен. Кроме того, промежуточное соединение может реагировать со спиртами с образованием йодфенилметана, который в дальнейшем может подвергаться реакции S N 2 с образованием ROCHPh, как на пути C.
Модификация Ши
[ редактировать ]Высокая электрофильная природа карбеноида цинка сужает область применения циклопропанирования Симмонса-Смита до богатых электронами алкенов и алкенов, несущих боковые координационные группы, чаще всего спиртов. В 1998 году группа Ши идентифицировала новый карбеноид цинка, образованный из , трифторуксусной кислоты и дииодметана формы CF 3 CO 2 ZnCH 2 I. диэтилцинка [ 31 ] Этот карбеноид цинка гораздо более нуклеофильен и допускает реакцию с нефункционализированными и электронодефицитными алкенами, такими как винилборонаты . [ 32 ] Ряд кислотных модификаторов имеют аналогичный эффект, но наиболее часто используется трифторуксусная кислота. Ши-модификация циклопропанирования также стереоспецифична . Дальнейшие исследования аминокислот привели к разработке асимметричного варианта этого циклопропанирования. [ 33 ]

Безцинковые реагенты
[ редактировать ]Реактивы Симмонса-Смита, которые проявляют реакционные свойства, подобные свойствам цинка, хотя и не используются широко, были приготовлены из соединений алюминия и самария в присутствии CH 2 IX. [ 34 ] С использованием этих реагентов аллиловые спирты и выделенные олефины можно селективно циклопропанировать в присутствии друг друга. Йодо- или хлорметилсамарий йодид в ТГФ является отличным реагентом для селективного циклопропанирования аллилового спирта, предположительно направляемого путем хелатирования к гидроксильной группе. [ 35 ] Напротив, использование реагентов диалкил(иодметил)алюминия в CH 2 Cl 2 будет избирательно циклопропанировать выделенный олефин. [ 36 ] Специфичность этих реагентов позволяет помещать циклопропаны в полиненасыщенные системы, которые реагенты на основе цинка будут циклопропанировать полностью и неселективно. Например, i -Bu 3 Al будет циклопропанировать гераниол в положении 6, тогда как Sm/Hg будет циклопропанировать в положении 2, как показано ниже.

Однако обе реакции требуют почти стехиометрических количеств исходного соединения металла, а Sm/Hg необходимо активировать высокотоксичной HgCl 2 .
Использование в синтезе
[ редактировать ]В большинстве современных применений реакции Симмонса-Смита используется модификация Фурукавы. Ниже перечислены особо актуальные и надежные приложения.
Вставка с образованием γ-кетоэфиров
[ редактировать ]Модифицированный Фурукавой циклопропановый промежуточный продукт Симмонса-Смита образуется при синтезе γ-кетоэфиров из β-кетоэфиров. Реагент Симмонса-Смита сначала связывается с карбонильной группой , а затем с α- углеродом псевдоенола , образующегося в результате первой реакции. Этот второй реагент образует промежуточный циклопропил, который быстро фрагментируется с образованием продукта. [ 37 ] [ 38 ]

Образование амидо-спиро[2.2]пентанов из алленамидов
[ редактировать ]Модифицированная Фурукавой реакция Симмонса-Смита циклопропанирует обе двойные связи в алленамиде с образованием амидо-спиро [2.2] циклопентанов с двумя циклопропильными кольцами , имеющими один общий атом углерода. Также образуется продукт моноциклопропанирования. [ 39 ] [ 40 ]

Синтез натуральных продуктов
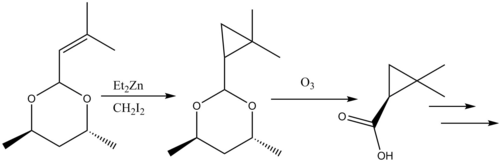
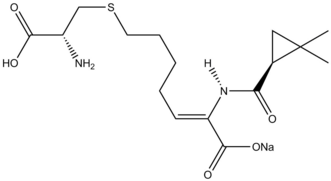
[ редактировать ]реакции циклопропанирования в природных продуктов . синтезе Рассмотрены [ 41 ] Ингибитор β-лактамаз циластатин представляет собой поучительный пример реактивности Симмонса-Смита в синтезе натуральных продуктов. Аллильный карбоновой заместитель в исходном материале циклопропанирован по Симмонсу-Смиту, а затем с снимают кислоты защиту посредством озонолиза с образованием предшественника .
Фармацевтический синтез
[ редактировать ]Реакция Симмонса-Смита используется при синтезе GSK1360707F. [ 42 ] , ропаникант [ 43 ] и Онглиза (Саксаглиптан) [ 44 ] .
Ссылки
[ редактировать ]- ^ Говард Энсайн Симмонс младший ; Смит, Р.Д. (1958). «Новый синтез циклопропанов из олефинов». Дж. Ам. хим. Соц. 80 (19): 5323–5324. дои : 10.1021/ja01552a080 .
- ^ Симмонс, HE; Смит, Р.Д. (1959). «Новый синтез циклопропанов». Дж. Ам. хим. Соц . 81 (16): 4256–4264. дои : 10.1021/ja01525a036 .
- ^ Денис, Дж. М.; Жирар, Ж.М.; Кония, Дж. М. (1972). «Улучшенные реакции Симмонса – Смита». Синтез . 1972 (10): 549–551. дои : 10.1055/s-1972-21919 .
- ^ Шаретт, AB; Бошемен, А. (2001). «Реакция циклопропанирования Симмонса-Смита». Орг. Реагировать. 58 : 1. doi : 10.1002/0471264180.or058.01 . ISBN 978-0-471-26418-7 .
- ^ Смит, Р.Д.; Симмонс, ОН «Норкаран» . Органические синтезы
{{cite journal}}: CS1 maint: multiple names: authors list (link); Сборник томов , т. 5, с. 855 . - ^ Ито, Ю.; Фуджи, С.; Накатуска, М.; Кавамото, Ф.; Саэгуса, Т. (1988). «Расширение одноуглеродного кольца циклоалканонов до сопряженных циклоалкенонов: 2-циклогептен-1-он» . Органические синтезы
{{cite journal}}: CS1 maint: multiple names: authors list (link); Сборник томов , т. 6, с. 327 . - ^ Клейден, Джонатан ; Гривз, Ник; Уоррен, Стюарт ; Уотерс, Питер (2001). Органическая химия (1-е изд.). Издательство Оксфордского университета. ISBN 978-0-19-850346-0 . Страница 1067
- ^ Фабиш, Бодо; Митчелл, Теренс Н. (1984). «Недорогая модификация реакции Симмонса-Смита: образование бромида бромметилцинка, изученное методом ЯМР-спектроскопии». Журнал металлоорганической химии . 269 (3): 219–221. дои : 10.1016/0022-328X(84)80305-8 .
- ^ Виттиг, Джордж; Винглер, Франк (1 августа 1964 г.). «О метиленированных галогенидах металлов, IV. Образование циклопропана из олефинов с бис-галогенметилцинком». Химические отчеты . 97 (8): 2146–2164. дои : 10.1002/cber.19640970808 .
- ^ Фурукава, Дж.; Кавабата, Н.; Нисимура, Дж. (1968). «Синтез циклопропанов реакцией олефинов с диалкилцинком и иодидом метилена». Тетраэдр . 24 (1): 53–58. дои : 10.1016/0040-4020(68)89007-6 .
- ^ Симмонс, Ховард Э.; Кэрнс, Теодор Л.; Владучик, Сьюзен А.; Хойнесс, Конни М. (15 марта 2011 г.), «Циклопропаны из ненасыщенных соединений, йодистого метилена и пары цинк-медь» , Organic Reactions , Хобокен, Нью-Джерси, США: John Wiley & Sons, Inc., стр. 1– 131, дои : 10.1002/0471264180.или020.01 , ISBN 978-0-471-26418-7 , получено 28 февраля 2022 г.
- ^ Жирар, К.; Кония, Дж. М. (1978). Журнал химических исследований, краткие обзоры (обзор): 182–.
{{cite journal}}: Отсутствует или пусто|title=( помощь ) - ^ Пол А. Грек; Томей Огури; Чиа-Лин Дж. Ван и Эрик Уильямс (1977). «Стереохимия и полный синтез (±)-ивангулина». Дж. Орг. хим. 42 (25): 4113–4118. дои : 10.1021/jo00445a027 .
- ^ Хидэё Такахаси, Масато Ёсиока, Масаджи Оно и Сусуму Кобаяши (1992). «Каталитическая энантиоселективная реакция с использованием C2-симметричного дисульфонамида в качестве хирального лиганда: циклопропанирование аллиловых спиртов системой Et2Zn-CH2I2-дисульфонамид». Буквы тетраэдра . 33 (18): 2575–2578. дои : 10.1016/S0040-4039(00)92246-9 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Ван, Тао; Лян, Юн; Ю, Чжи-Сян (2011). «Исследование механизма и причин стереоселективности в асимметричном циклопропанировании Симмонса-Смита с использованием шареттового хирального диоксабороланового лиганда в рамках теории функционала плотности». Журнал Американского химического общества . 133 (24): 9343–9353. дои : 10.1021/ja111330z . ПМИД 21627114 .
- ^ Хироаки Ситама и Цутому Кацуки (2008). «Асимметричная реакция Симмонса-Смита аллиловых спиртов с бифункциональным катализатором Al (салален) кислотой Льюиса / основанием Льюиса». Энджью. хим. Межд. Эд. 47 (13): 2450–2453. дои : 10.1002/anie.200705641 . ПМИД 18288666 .
- ^ Дания, ЮВ; Эдвардс, JP (1991). «Сравнение реагентов циклопропанирования (хлорметил) и (йодометил) цинка». Дж. Орг. Хим . 56 (25): 6974–6981. дои : 10.1021/jo00025a007 .
- ^ Руботтом, генеральный директор; Лопес, Мичиган (1973). «Реакция эфиров триметилсилиленола с реагентом Симмонса-Смита. Простой синтез триметилсилилциклопропиловых эфиров и циклопропанолов». Дж. Орг. Хим . 38 (11): 2097–2099. дои : 10.1021/jo00951a032 .
- ^ Морикава, Т.; Сасаки, Х.; Мори, К.; Широ, М.; Тагучи, Т.; Морикава, Т.; Сасаки, Х.; Мори, К.; Широ, М.; Тагучи, Т. Реакции Симмонса-Смита производных фтораллилового спирта. хим. Фарм. Бык. (Токио) 1992, 40 (12), 3189.
- ^ Пирс, Э.; Койш, П.Д. Получение и циклопропанирование 2- и 3-йодалк-2-ен-1-ола: синтез функционализированных стереоопределенных йодциклопропанов. Синтез 1995, 1995 (1), 47–55.
- ^ Ганьон, JL; Младший, WWZ Синтез цис-1,5-диметил-2,4-динитро-2,4-диазабицикло[3.1.0]гексан-3-она и цис-1,5-диметил-2,4-динитро-2 ,4-диазабицикло[3.2.0]гептан-3-он. Синтез. Коммун. 1996, 26 (4), 837–845.
- ^ Фридрих, ЕС; Нияти-Ширходаи, Ф. (1991). «Региоселективность и эффекты растворителя при циклопропанировании алкадиенов». Дж. Орг. Химия 56 (6): 2202–2205. дои : 10.1021/jo00006a044 .
- ^ Ли, Дж.; Ким, Х.; Ча, Дж. К. (1995). «Диастереоселективный синтез цис-1,2-диалкенилциклопропанолов и последующая окси-коповая перегруппировка». Дж. Ам. хим. Соц . 117 (39): 9919–9920. дои : 10.1021/ja00144a022 .
- ^ Денис, Дж. М.; Жирар, К.; Кониа, Дж. М. Улучшение реакций Симмонса-Смита. Синтез 1972, 1972 (10), 549–551.
- ^ Такакис, И.М.; Родс, Ю. (1978). «Циклопропанирование некоторых простых олефиновых соединений. Образование побочных продуктов в избытке реагента Симмонса-Смита». Дж. Орг. Хим . 43 (18): 3496–3500. дои : 10.1021/jo00412a017 .
- ^ Коэн, Т.; Косарыч З. (1982). «Полная регио- и стереоспецифичность в реакциях Дильса-Альдера, катализируемых кислотой Льюиса, (Z)-2-метокси-1-(фенилтио)-1,3-бутадиенов. Превращение CS-конфигурации аддукта в CC-конфигурацию при аллильное положение путем [2,3] сигматропной перегруппировки». Дж. Орг. хим. 47 (20): 4005–4008. дои : 10.1021/jo00141a047 .
- ^ Фурукава, Дж; Кавабата, Н.; Нисимура, Дж (1968). «Синтез циклопропанов реакцией олефинов с диалкилцинком и иодидом метилена». Тетраэдр . 24 (1): 53–58. дои : 10.1016/0040-4020(68)89007-6 .
- ^ Хэлтон, Б. (2000). Достижения в области напряженных и интересных органических молекул, Том 8 . Стэмфорд, Коннектикут: Press Inc., с. 115. ИСБН 978-0-7623-0631-2 .
- ^ «Паспорт безопасности диэтилцинка» (PDF) . Проверено 10 мая 2017 г.
- ^ Левеск, Эрик; Гудро, Себастьен Р.; Б. Шаретт, Андре Б. (2014). «Улучшенная реакция Симмонса-Смита, катализируемая цинком: доступ к различным 1,2,3-тризамещенным циклопропанам». Органические письма . 16 (5): 1490–1493. дои : 10.1021/ol500267w . ПМИД 24555697 .
- ^ Корнуолл, Ричард Г.; Вонг, О. Андреа; Ду, Хайфэн; Рамирес, Томас А.; Ши, Ян (4 июля 2012 г.). «Новый класс настраиваемых реагентов циклопропанирования (RXZnCH2Y) и их синтетические применения» . Органическая и биомолекулярная химия . 10 (29): 5498–5513. дои : 10.1039/C2OB25481F . ISSN 1477-0539 .
- ^ Бассан, Ефрем М.; Бакстер, Карл А.; Бютнер, Грегори Л.; Эмерсон, Хатита М.; Флейтц, Фред Дж.; Джонсон, Саймон; Кин, Стивен; Ким, Мэри М.; Кете, Джеффри Т.; Леонард, Уильям Р.; Малленс, Питер Р.; Муццио, Дэниел Дж.; Роберж, Кристофер; Ясуда, Нобуёси (20 января 2012 г.). «Многокилограммовый синтез хирального циклопропанола и исследование безопасного использования комплекса ацетилида лития и этилендиамина» . Исследования и разработки органических процессов . 16 (1): 87–95. дои : 10.1021/op2002497 . ISSN 1083-6160 .
- ^ Ду, Хайфэн; Лонг, Цзян; Ши, Ян (1 июня 2006 г.). «Каталитическое асимметричное циклопропанирование Симмонса-Смита эфиров силиленолов. Эффективный синтез оптически активных производных циклопропанола» . Органические письма . 8 (13): 2827–2829. дои : 10.1021/ol0609659 . ISSN 1523-7060 .
- ^ Роджер, Адамс (2001). Органические реакции Том 58 . Нью-Йорк: Wiley, J. стр. 9–10. ISBN 978-0-471-10590-9 .
- ^ Моландер, Джорджия; Харринг, Л.С. (1989). «Циклоппропанирование аллиловых спиртов, промотируемое самарием». Дж. Орг. Хим . 54 (15): 3525–3532. дои : 10.1021/jo00276a008 .
- ^ Маруока, К.; Фукутани, Ю.; Ямамото, Х. (1985). «Триалкилалюминий-алкилиденйодид. Мощный агент циклопропанирования с уникальной селективностью». Дж. Орг. Хим . 50 (22): 4412–4414. дои : 10.1021/jo00222a051 .
- ^ Бхогадхи, Яшода; Зерчер, Чарльз (2014). «Дополнение к обсуждению: Образование γ-кетоэфиров из β-кетоэфиров: метил 5,5-диметил-4-оксогексаноат». Органические синтезы . 91 : 248–259. дои : 10.15227/orgsyn.091.0248 .
- ^ Ронсхайм, Мэтью; Хильгенкамп, Рамона; Зерчер, Чарльз (2002). «Образование γ-кетоэфиров из β-кетоэфиров: метил 5,5-диметил-4-оксогексаноат» . Органические синтезы . 79 : 146. дои : 10.1002/0471264180.os079.18 .
- ^ Тео, Юн-Чуа; Хсунг, Ричард (2014). «Дополнение к обсуждению: Практический синтез новых хиральных алленамидов: (R)-4-фенил-3-(1,2-пропадиенил)оксазолидин-2-он». Органические синтезы . 91 : 12–26. дои : 10.15227/orgsyn.091.0012 .
- ^ Сюн, Х; Трейси, М; Гребе, Т; Малдер, Дж; Хсунг, Р. (2005). «ПРАКТИЧЕСКИЙ СИНТЕЗ НОВЫХ ХИРАЛЬНЫХ АЛЛЕНАМИДОВ: (R)-4-ФЕНИЛ-3-(1,2-ПРОПАДИЕНИЛ)ОКСАЗОЛИДИН-2-ОН (2-Оксазолидинон, 4-фенил-3-(1,2-пропадиенил)–, (4Р)–)» . Органические синтезы . 81 : 147–156. дои : 10.15227/orgsyn.081.0147 .
- ^ Дональдсон, Уильям (8 октября 2001 г.). «Синтез циклопропансодержащих природных продуктов» . Тетраэдр . 57 (41): 8589. doi : 10.1016/s0040-4020(01)00777-3 .
- ^ Елицин Василий Игоревич; Харви, Кимберли А.; Ким, Хёнджон; Салмонс, Мэтью; Шарп, Мэтью Дж.; Табет, Эли А.; Точко, Мэтью А. (16 июля 2010 г.). «Разработка нового синтеза для крупномасштабного получения ингибитора тройного обратного захвата (-)-GSK1360707» . Исследования и разработки органических процессов . 14 (4): 912–917. дои : 10.1021/op100139f . ISSN 1083-6160 .
- ^ «Синтез СУВН-911». Синфакты . 16 (6): 0626. 2020. doi : 10.1055/s-0040-1707534 . ISSN 1861-1958 . S2CID 219767881 .
- ^ Рамирес, Антонио; Трук, Ву Чи; Лоулер, Майкл; Йе, Юн К.; Ван, Цзяньцзи; Ван, Ченчи; Чен, Стивен; Лапорт, Томас; Лю, Нянь; Колотучин Сергей; Джонс, Скотт; Бордавекар, Шайлендра; Туммала, Шринивас; Уолтермайр, Роберт Э.; Кроненталь, Дэвид (3 июля 2014 г.). «Влияние добавок на циклопропанирование дигидропиррола, опосредованное карбеноидом цинка» . Журнал органической химии . 79 (13): 6233–6243. дои : 10.1021/jo500966m . ISSN 0022-3263 .
Внешние ссылки
[ редактировать ]