Atg1
| Серин/треонин-протеинкиназа ATG1 | |||
|---|---|---|---|
| Идентификаторы | |||
| Организм | |||
| Символ | АТГ1 | ||
| Альт. символы | АПГ1; АВТО3; вариатор 10 | ||
| Входить | 852695 | ||
| RefSeq (мРНК) | НМ_001181045 | ||
| RefSeq (защита) | НП_011335 | ||
| ЮниПрот | P53104 | ||
| Другие данные | |||
| Номер ЕС | 2.7.11.1 | ||
| хромосома | VII: 0,16 – 0,16 Мб | ||
| |||
Родственная AuTophaGy 1 (Atg1) представляет собой серин/треониновую киназу массой 101,7 кДа в S.cerevisiae , кодируемую геном ATG1. [ 1 ] Это важно для первоначального построения аутофагосом и везикул Cvt . В некиназной роли он - посредством образования комплекса с Atg13 и Atg17 - напрямую контролируется киназой TOR , сенсором доступности питательных веществ.
Введение
[ редактировать ]Atg1 может связываться с рядом других белков семейства Atg, образуя комплекс, который участвует в формировании аутофагосом или пузырьков Cvt. Инициация аутофагии включает в себя создание преаутофагосомной структуры (PAS). Большинство белков Atg накапливаются в PAS и генерируют либо везикулы Cvt при нормальных условиях выращивания, либо аутофагосомы при голодании. [ 2 ] На сегодняшний день существует 31 ген ATG, которые можно разделить на несколько различных групп в зависимости от их функций на разных этапах пути. 17 из этих генов работают только на пути Cvt.
Структура
[ редактировать ]Ген Atg1 расположен на VII хромосоме S. cerevisiae . Кодируемый белок массой 101,7 кДа имеет длину 897 аминокислот и включает на своем N-конце протеинсерин/треонинкиназный домен из 302 аминокислот. На С-конце имеется участок длиной из 7 аминокислот, который необходим для транспортировки Cvt. Белок также модифицируется посттрансляционно путем фосфорилирования по меньшей мере 9 остатков серина. [ 3 ] До сих пор из Atg1 не была создана кристаллическая структура.
Функция
[ редактировать ]Atg1 имеет две различные функции у дрожжей (о высших эукариотах см. ниже): независимое от киназы рекрутирование нижестоящих белков Atg (т.е. организация PAS) и киназозависимая функция в образовании аутофагосом, вероятно, опосредованная фосфорилированием нижестоящих субстратов.
Партнеры по взаимодействию
[ редактировать ]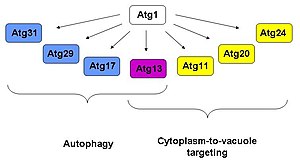
Было показано, что Atg1 взаимодействует по крайней мере с шестью другими белками Atg, а именно с Atg 29, 31, 11, 20 и 24. Было показано, что из всех них Atg13 играет роль как в аутофагии, так и в функциях Cvt; Atg17, 29 и 31 выполняют только функции аутофагии. [ 4 ] [ 5 ] [ 6 ] в то время как Atg11, 20 и 24 принимают участие только в пути Cvt. [ 7 ] [ 8 ] На основании данных о двухгибридных дрожжах и аффинной изоляции обнаружено, что Atg1 находится в комплексе с Atg13 и Atg17. [ 9 ] Наблюдение, что Atg17 взаимодействует с Atg13 в отсутствие Atg1, но не наоборот, позволяет предположить, что Atg13 опосредует взаимодействие между Atg1 и Atg17.
Регулирование
[ редактировать ]
Механизм аутофагии активируется при наличии нескольких стимулов, таких как питательное голодание, инфекция, механизм восстановления или запрограммированная гибель клеток . Роль Atg1 и его регуляция лучше всего изучена в условиях питательного голодания и соответствующей остановки роста. Ключевым ферментом сигнального пути доступности питательных веществ является TOR , две изоформы которого существуют у дрожжей (Tor1 и Tor2). Эти белки образуют два отдельных комплекса, названных TORC1 и TORC2, из которых TORC1 очень чувствителен к условиям клеточного питания. В условиях богатых питательными веществами TORC1 активен и фосфорилирует Atg13 во многих местах, тем самым ингибируя образование комплекса с Atg1. Это приводит к снижению активности киназы Atg1 и снижению аутофагии. При голодании Atg13 быстро дефосфорилируется и образует комплекс с Atg1, тем самым активируя его, что приводит к последующей сборке PAS посредством рекрутирования других белков Atg.

Помимо TORC1, протеинкиназа А (PKA) ингибирует аутофагию посредством фосфорилирования Atg1 и Atg13. PKA фосфорилирует Atg1 по двум различным остаткам серина; было показано, что эти модификации необходимы для правильной диссоциации Atg1 от PAS. [ 10 ] Нижестоящий субстрат киназы Atg1 еще не описан, и до сих пор остается предметом споров относительно того, действует ли Atg1 в первую очередь на аутофагию посредством своей киназной активности или посредством структурной роли во время формирования аутофагического комплекса. Возможно, что киназная активность Atg1 имеет решающее значение для величины аутофагии, но не для ее инициации. По крайней мере, крупномасштабные скрининги привели к составлению списка кандидатов возможных субстратов Atg1, включая Atg8 и Atg18. [ 11 ] В заключение, Atg1 сначала выполняет структурную или каркасную функцию на начальных этапах создания PAS, за которой затем следует киназо-зависимая фаза, которая содержит динамику белков в PAS. [ 12 ]
Гомологи
[ редактировать ]Существует много доказательств того, что гомологи Atg1 из других многоклеточных организмов также необходимы для аутофагии, но недавние работы, однако, также показали, что существуют различия и дополнительные функции по сравнению с дрожжевой моделью.
Ценорабдитис элегантный
[ редактировать ]Соответствующим гомологом Atg1 у C. elegans является unc-51 (некоординированный-51). Unc-51 также участвует в правильном наведении аксонов и развитии нейронов. [ 13 ]
Дрозофила меланогастер
[ редактировать ]Гомолог Atg1 у D. melanogaster также важен для развития нейронов. [ 14 ] и нейрональный трафик. Кроме того, существует механизм обратной связи с TOR, который может блокировать функцию TOR, которая фактически находится выше Atg1. [ 15 ] У D.melanogaster и позвоночных Atg1 и Atg13 всегда находятся в одном комплексе. У D.melanogaster Atg13 фосфорилируется при голодании, что прямо противоположно тому, как в дрожжевой модели.
Позвоночные животные
[ редактировать ]На данный момент существует пять потенциальных ортологов Atg1 у позвоночных. ULK1 и ULK2 (unc-51-подобная киназа) выполняют дополнительную функцию в развитии нейронов, например, регуляцию роста нейронов мыши. Сообщалось, что [ 16 ] ULK1 и 2 также демонстрируют регуляцию отрицательной обратной связи с mTOR.
Ссылки
[ редактировать ]- ^ «Резюме ATG1» . YeastGenome.org . Проверено 4 января 2012 г.
- ^ Мизушима Н. (январь 2010 г.). «Роль комплекса Atg1/ULK1 в регуляции аутофагии». Curr Opin Cell Biol . 22 (2): 132–139. дои : 10.1016/j.ceb.2009.12.004 . ПМИД 20056399 .
- ^ «UniProt P53104 (ATG1_YEAST)» . ЮниПротКБ . 2 марта 2010 года . Проверено 17 марта 2010 г.
- ^ Кавамата Т., Камада Ю., Сузуки К. и др. (декабрь 2005 г.). «Характеристика нового гена, специфичного для аутофагии, ATG29». Биохим. Биофиз. Рез. Коммун . 338 (4): 1884–9. дои : 10.1016/j.bbrc.2005.10.163 . ПМИД 16289106 . S2CID 41257431 .
- ^ Кабея Ю., Кавамата Т., Сузуки К., Осуми Ю. (май 2007 г.). «Цис1/Atg31 необходим для образования аутофагосом у Saccharomyces cerevisiae». Биохим. Биофиз. Рез. Коммун . 356 (2): 405–10. дои : 10.1016/j.bbrc.2007.02.150 . ПМИД 17362880 .
- ^ Кавамата Т., Камада Ю., Кабея Ю., Секито Т., Осуми Ю. (май 2008 г.). «Организация преаутофагосомной структуры, ответственной за образование аутофагосом» . Мол. Биол. Клетка . 19 (5): 2039–50. дои : 10.1091/mbc.E07-10-1048 . ПМК 2366851 . ПМИД 18287526 .
- ^ Ким Дж., Камада Ю., Стромхауг П.Е. и др. (апрель 2001 г.). «Функция Cvt9/Gsa9 заключается в секвестрировании селективного цитозольного груза, предназначенного для вакуоли» . Дж. Клеточная Биол . 153 (2): 381–96. дои : 10.1083/jcb.153.2.381 . ПМК 2169458 . ПМИД 11309418 .
- ^ Ницца, округ Колумбия, Сато Т.К., Стромхауг П.Е., Эмр С.Д., Клионский DJ (август 2002 г.). «Для селективной аутофагии необходимо кооперативное связывание цитоплазмы с белками пути, нацеленными на вакуоли, Cvt13 и Cvt20, с фосфатидилинозитол-3-фосфатом в преаутофагосомной структуре» . Ж. Биол. Хим . 277 (33): 30198–207. дои : 10.1074/jbc.M204736200 . ПМЦ 2754692 . ПМИД 12048214 .
- ^ Кабея Ю., Камада Ю., Баба М., Такикава Х., Сасаки М., Осуми Ю. (май 2005 г.). «Atg17 функционирует совместно с Atg1 и Atg13 при аутофагии дрожжей» . Мол. Биол. Клетка . 16 (5): 2544–53. дои : 10.1091/mbc.E04-08-0669 . ПМК 1087256 . ПМИД 15743910 . Камада Ю, Фунакоси Т, Синтани Т, Нагано К, Осуми М, Осуми Ю (сентябрь 2000 г.). «Tor-опосредованная индукция аутофагии посредством протеинкиназного комплекса Apg1» . Дж. Клеточная Биол . 150 (6): 1507–13. дои : 10.1083/jcb.150.6.1507 . ПМК 2150712 . ПМИД 10995454 .
- ^ Будовская Ю.В., Стефан Ю.С., Деминов С.Ю., Герман П.К. (сентябрь 2005 г.). «Эволюционный подход к протеомике идентифицирует субстраты цАМФ-зависимой протеинкиназы» . Учеб. Натл. акад. наук. США . 102 (39): 13933–8. Бибкод : 2005PNAS..10213933B . дои : 10.1073/pnas.0501046102 . ПМЦ 1236527 . ПМИД 16172400 .
- ^ Птачек Дж., Девган Г., Мишо Дж. и др. (декабрь 2005 г.). «Глобальный анализ фосфорилирования белков у дрожжей» (PDF) . Природа . 438 (7068): 679–84. Бибкод : 2005Natur.438..679P . дои : 10.1038/nature04187 . ПМИД 16319894 . S2CID 4332381 .
- ^ Чан Э.Ю., Туз С.А. (август 2009 г.). «Эволюция функции и регуляции Atg1» . Аутофагия . 5 (6): 758–65. дои : 10.4161/auto.8709 . ПМИД 19411825 .
- ^ Огура К., Вики Дж., Магненат Л. и др. (октябрь 1994 г.). «Ген Caenorhabditis elegans unc-51, необходимый для удлинения аксонов, кодирует новую серин/треониновую киназу» . Генс Дев . 8 (20): 2389–400. дои : 10.1101/gad.8.20.2389 . ПМИД 7958904 .
- ^ Тода Х., Мочизуки Х., Флорес Р. и др. (декабрь 2008 г.). «Киназа UNC-51/ATG1 регулирует аксональный транспорт, опосредуя сборку моторного груза» . Генс Дев . 22 (23): 3292–307. дои : 10.1101/gad.1734608 . ПМК 2600757 . ПМИД 19056884 .
- ^ Скотт Р.К., Юхас Г., Нойфельд Т.П. (январь 2007 г.). «Прямая индукция аутофагии с помощью Atg1 ингибирует рост клеток и вызывает апоптотическую гибель клеток» . Курс. Биол . 17 (1): 1–11. дои : 10.1016/j.cub.2006.10.053 . ПМК 1865528 . ПМИД 17208179 .
- ^ Томода Т., Бхатт Р.С., Куроянаги Х., Ширасава Т., Хаттен М.Э. (декабрь 1999 г.). «Мышиная серин/треониновая киназа, гомологичная C. elegans UNC51, участвует в формировании параллельных волокон нейронов мозжечковых гранул» . Нейрон . 24 (4): 833–46. дои : 10.1016/S0896-6273(00)81031-4 . ПМИД 10624947 .