Низкокогерентная интерферометрия с угловым разрешением
Низкокогерентная интерферометрия с угловым разрешением ( a/LCI ) является новым направлением. [ когда? ] технология биомедицинской визуализации , которая использует свойства рассеянного света для измерения среднего размера клеточных структур, включая ядра клеток . Эта технология перспективна в качестве клинического инструмента для тканей in situ обнаружения диспластических или предраковых .
Введение
[ редактировать ]A/LCI сочетает в себе интерферометрию низкой когерентности с рассеянием с угловым разрешением для решения обратной задачи определения геометрии рассеивателя на основе в дальней зоне дифракционных картин . Подобно оптической рефлектометрии домена когерентности (OCDR) и оптической когерентной томографии (OCT), a/LCI использует широкополосный источник света в схеме интерферометрии для достижения оптического сечения с разрешением по глубине, устанавливаемым длиной когерентности источника. Измерения рассеяния с угловым разрешением фиксируют свет как функцию угла рассеяния и инвертируют углы, чтобы определить средний размер рассеивающих объектов с помощью вычислительной модели рассеяния света, такой как теория Ми , которая прогнозирует углы на основе размера сферы рассеяния. . Сочетание этих методов позволяет создать систему, которая может измерять средний размер рассеяния на различной глубине в образце ткани .
В настоящее время наиболее значимым медицинским применением технологии является определение состояния здоровья тканей на основе измерений среднего размера ядер клеток. Было обнаружено, что по мере изменения ткани от нормальной к раковой средний размер ядер клеток увеличивается. [1] Несколько недавних исследований [2] показали, что с помощью измерений ядер клеток a/LCI может обнаруживать наличие дисплазии низкой и высокой степени с чувствительностью 91% и различать нормальную и диспластическую со специфичностью 97%.
История
[ редактировать ]С 2000 года системы светорассеяния используются в биомедицинских целях, таких как изучение морфологии клеток. [3] а также диагностика дисплазии . [4] Вариации в распределении рассеяния в зависимости от угла или длины волны использовались для получения информации о размере клеток и субклеточных объектов, таких как ядра и органеллы . Эти измерения размера затем можно использовать в диагностических целях для выявления изменений тканей, включая неопластические изменения (приводящие к раку).
Спектроскопия светорассеяния использовалась для обнаружения дисплазии в толстой кишке , мочевом пузыре , шейке матки и пищеводе у пациентов-людей. [2] Рассеяние света также использовалось для обнаружения пищевода Барретта — метапластического состояния, которое с высокой вероятностью приводит к дисплазии. [5]
Однако, в отличие от a/LCI, все эти методы основаны на измерениях на основе общей интенсивности, которые не позволяют получить результаты в зависимости от глубины проникновения в ткань.
Ранние модели a/LCI
[ редактировать ]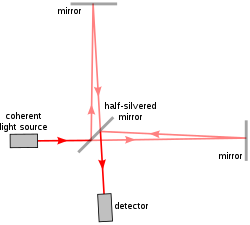
Первая реализация a/LCI [6] использовал интерферометр Майкельсона , ту же модель, что и в знаменитом эксперименте Майкельсона-Морли . Интерферометр Майкельсона разделяет один луч света на два пути: один опорный путь и один путь выборки, и снова объединяет их, чтобы создать форму волны, возникающую в результате интерференции . Таким образом, разница между опорным лучом и лучом отбора проб показывает свойства образца в том, как он рассеивает свет.
Раннее устройство a/LCI использовало подвижное зеркало и линзу в опорном плече, чтобы исследователи могли воспроизводить различные углы и глубины опорного луча по мере того, как они возникают в собранном обратно рассеянном свете. Это позволило изолировать обратно рассеянный свет при различной глубине отражения в образце. Чтобы преобразовать данные в измерения клеточной структуры, распределения углового рассеяния затем сравниваются с предсказаниями теории Ми , которая вычисляет размер сфер относительно их моделей рассеяния света.
Метод a/LCI был впервые апробирован при исследовании полистироловых микросфер. [6] размеры которых были известны и относительно однородны. Более позднее исследование расширило метод обработки сигналов, чтобы компенсировать несферическую и неоднородную природу клеточных ядер. [7]
Этой ранней системе требовалось до 40 минут для сбора данных для точки образца площадью 1 мм², но она доказала осуществимость идеи.
Реализация в области Фурье
[ редактировать ]Как и OCT, ранние реализации a/LCI основывались на физическом изменении длины оптического пути (OPL) для управления глубиной образца, из которого собираются данные. Однако было продемонстрировано [8] что можно использовать реализацию области Фурье для получения разрешения по глубине за один сбор данных. Широкополосный источник света используется для одновременного создания спектра длин волн, а обратно рассеянный свет собирается когерентным оптическим волокном на обратном пути для одновременного захвата различных углов рассеяния. [9] Затем интенсивность измеряется с помощью спектрометра : один кадр спектрометра содержит интенсивность рассеяния как функцию длины волны и угла. Наконец, данные преобразуются Фурье построчно для определения интенсивности рассеяния как функции OPL и угла. На полученном изображении ось x представляет OPL, а ось y — угол отражения, что дает двумерную карту интенсивностей отражений.
При использовании этого метода скорость сбора данных ограничивается только временем интегрирования спектрометра и может составлять всего 20 мс. Те же данные, для получения которых первоначально требовались десятки минут, можно получить ~10 5 раз быстрее. [9]
Схематическое описание
[ редактировать ]
В Фурье-версии системы a/LCI в качестве источника света используется суперлюминесцентный диод (SLD) с выходом по оптоволокну. Оптоволоконный разветвитель разделяет путь сигнала с интенсивностью 90 % и опорный путь с интенсивностью 10 %.
Свет от SLD проходит через оптический изолятор , а затем через контроллер поляризации . Было показано, что контроль поляризации света важен для максимизации оптического сигнала и сравнения углового рассеяния с моделью рассеяния Ми. [10] Для передачи осветительного света к образцу используется волокно, сохраняющее поляризацию. Второй контроллер поляризации аналогичным образом используется для управления поляризацией света, проходящего через опорный путь.
Выход волокна справа коллимируется с помощью линзы L1 и освещает ткань. Но поскольку волокно доставки смещено от оптической оси линзы, луч доставляется к образцу под косым углом. Затем обратно рассеянный свет коллимируется той же линзой и собирается пучком волокон. Волокна находятся на одном фокусном расстоянии от линзы, а образец — на одном фокусном расстоянии с другой стороны. Эта конфигурация улавливает свет под максимальным углом и минимизирует световой шум из-за зеркальных отражений.
На дистальном конце пучка волокон свет от каждого волокна отображается на спектрометре. Свет от образца и эталонного плеча смешивается светоделительным кубом (BS) и падает на входную щель визуализирующего спектрометра. Данные с визуализирующего спектрометра передаются на компьютер через интерфейс USB для обработки сигналов и отображения результатов. Компьютер также обеспечивает управление спектрометром формирования изображения.
Прототип клинического устройства
[ редактировать ]
Система a/LCI недавно была усовершенствована и теперь позволяет работать в клинических условиях с добавлением портативного зонда. [11] Тщательно контролируя поляризацию в волокне доставки, используя волокна, поддерживающие поляризацию, и встроенные поляризаторы, новая система позволяет манипулировать портативной палочкой без ухудшения сигнала из-за эффектов двойного лучепреломления. Кроме того, в новой системе в наконечнике зонда используется с антибликовым покрытием шариковая линза , которая уменьшает отражения, которые в противном случае ограничивают диапазон глубины системы.
размером 2 на 2 фута В качестве основы портативной системы используется оптический макет , на макетной плате установлены источник, оптоволоконные компоненты, линза, светоделитель и спектрометр формирования изображения. Алюминиевая крышка защищает оптику. Волоконный зонд с ручным зондом обеспечивает легкий доступ к образцам тканей для тестирования. С левой стороны находится белая платформа для образцов, куда помещается ткань для тестирования. Ручной зонд используется оператором для выбора определенных участков ткани, с которых собираются показания a/LCI.
См. также
[ редактировать ]- Прикладная спектроскопия
- Длина когерентности
- Преобразование Фурье
- Оптическая интерферометрия
- Оптическая когерентная томография
Ссылки
[ редактировать ]- ^ Пыхтила, Дж; Чалут, К; Бойер, Дж; Кинер, Дж; Дамико, Т; Готфрид, М; Гресс, Ф; Вакс, А (2007). «Обнаружение ядерной атипии in situ в пищеводе Барретта с помощью низкокогерентной интерферометрии с угловым разрешением». Желудочно-кишечная эндоскопия . 65 (3): 487–91. дои : 10.1016/j.gie.2006.10.016 . ПМИД 17321252 .
- ^ Jump up to: а б Вакс, Адам; Пыхтила, Джон В.; Граф, Роберт Н.; Девятки, Рональд; Бун, Чарльз В.; Дасари, Рамачандра Р.; Фельд, Майкл С.; Стил, Вернон Э.; Стоунер, Гэри Д. (2005). «Проспективная оценка неопластических изменений в эпителии пищевода крыс с использованием низкокогерентной интерферометрии с угловым разрешением». Журнал биомедицинской оптики . 10 (5): 051604. Бибкод : 2005JBO....10e1604W . дои : 10.1117/1.2102767 . hdl : 1721.1/87657 . ПМИД 16292952 .
- ^ Бэкман, В.; Гопал, В.; Калашников М.; Бадизадеган, К.; Гурджар, Р.; Вакс, А.; Георгакуди, И.; Мюллер, М.; и др. (2001). «Измерение клеточной структуры в субмикрометровом масштабе с помощью спектроскопии светорассеяния». Журнал IEEE по избранным темам квантовой электроники . 7 (6): 887–893. Бибкод : 2001IJSTQ...7..887B . дои : 10.1109/2944.983289 .
- ^ Уоллес, М; Перельман, LT; Бэкман, В.; Кроуфорд, Дж. М.; Фицморис, М; Зайлер, М; Бадизадеган, К; Шилдс, С.Дж.; и др. (2000). «Эндоскопическое выявление дисплазии у пациентов с пищеводом Барретта с использованием светорассеивающей спектроскопии». Гастроэнтерология . 119 (3): 677–82. дои : 10.1053/gast.2000.16511 . ПМИД 10982761 .
- ^ Ловат, Лоуренс Б.; Пикард, Дэвид; Новелли, Марко; Рипли, Пол М.; Фрэнсис, Хелен; Биджио, Ирвинг Дж.; Баун, Стивен Г. (1 апреля 2000 г.). «4919 Новый метод оптической биопсии с использованием спектроскопии упругого рассеяния при дисплазии и раке пищевода Барретта» . Желудочно-кишечная эндоскопия . 51 (4): AB227. дои : 10.1016/S0016-5107(00)14616-4 . ISSN 0016-5107 .
- ^ Jump up to: а б Воск, А; Ян, С; Бэкман, В.; Калашников М; Дасари, РР; Фельд, М.С. (2002). «Определение размера частиц с использованием углового распределения обратно рассеянного света, измеренного с помощью низкокогерентной интерферометрии» (PDF) . Журнал Оптического общества Америки А. 19 (4): 737–44. Бибкод : 2002JOSAA..19..737W . дои : 10.1364/JOSAA.19.000737 . ПМИД 11934166 . S2CID 15388301 .
- ^ Воск, А; Ян, С; Бэкман, В.; Бадизадеган, К; Бун, CW; Дасари, РР; Фельд, М.С. (2002). «Клеточная организация и субструктура измерены с помощью низкокогерентной интерферометрии с угловым разрешением» . Биофизический журнал . 82 (4): 2256–64. Бибкод : 2002BpJ....82.2256W . дои : 10.1016/S0006-3495(02)75571-9 . ПМК 1302018 . ПМИД 11916880 .
- ^ Чома, М; Саруник, М; Ян, С; Изатт, Дж (2003). «Преимущество чувствительности качающегося источника и оптической когерентной томографии в области Фурье» (PDF) . Оптика Экспресс . 11 (18): 2183–9. Бибкод : 2003OExpr..11.2183C . дои : 10.1364/OE.11.002183 . ПМИД 19466106 .
- ^ Jump up to: а б Пыхтила, Джон В.; Бойер, Джеффри Д.; Чалут, Кевин Дж.; Вакс, Адам (2006). «Интерферометрия низкой когерентности с угловым разрешением в области Фурье через эндоскопический пучок волокон для спектроскопии светорассеяния». Оптические письма . 31 (6): 772–4. Бибкод : 2006OptL...31..772P . дои : 10.1364/OL.31.000772 . ПМИД 16544619 .
- ^ Пыхтила, Джон В.; Вакс, Адам (2007). «Влияние поляризации на точность определения размеров рассеивателя, проанализированное с помощью низкокогерентной интерферометрии с угловым разрешением в частотной области». Прикладная оптика . 46 (10): 1735–41. Бибкод : 2007ApOpt..46.1735P . дои : 10.1364/AO.46.001735 . ПМИД 17356616 .
- ^ «Онкоскоп» .