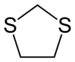
1,3-дитиолан
| |||
| Имена | |||
|---|---|---|---|
| Название ИЮПАК
1,3-дитиолан
| |||
| Идентификаторы | |||
3D model ( JSmol )
|
|||
| 102455 | |||
| КЭБ | |||
| 82036 | |||
ПабХим CID
|
|||
| НЕКОТОРЫЙ | |||
Панель управления CompTox ( EPA )
|
|||
| Характеристики | |||
| C3H6SC3H6S2 | |||
| Молярная масса | 106.20 g·mol −1 | ||
| Родственные соединения | |||
Родственные соединения
|
Этан-1,2-дитиол | ||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |||
1,3-Дитиолан представляет собой сероорганическое соединение формулы СН 2 С 2 С 2 Н 4 . Также классифицируется как гетероциклу, , родственный циклопентан путем замены двух метиленовых мостиков (- CH
2 - звенья) с тиоэфирными группами. Это изомер 1,2-дитиолана . [ 1 ] 1,3-Дитиоланы представляют собой соединения, в которых один или несколько атомов H исходного 1,3-дитиолана заменены другими группами. Эти виды более широко изучены.
Синтез
[ редактировать ]Обычное семейство 1,3-дитиоланов имеет формулу РЧС 2 С 2 Н 4 . Их получают обработкой альдегида этандитиолом 1,2- . [ 2 ] Родственные соединения с формулой R 2 CS 2 C 2 H 4 получают конденсацией 1,2-этандитиола с кетонами . [ 3 ] Защищенные дитиоланом альдегиды и кетоны вступают во многие реакции без нарушения дитиоланового кольца. [ 4 ]

Дитиоланы часто можно ревертировать, т.е. снять защиту . [ 5 ] к исходному альдегиду и кетону. Для этой цели были разработаны различные реагенты. [ 6 ]
Реакции
[ редактировать ]1,3-Дитиоланы, полученные из альдегидов, можно депротонировать:
- RCHS 2 C 2 H 4 + BuLi → RCLiS 2 C 2 H 4 + BuH
Эти литийорганические соединения разлагаются с потерей этилена с образованием дтиокарбоксилата :
- RCLiS 2 C 2 H 4 → RCS 2 Li + C 2 H 4
Напротив, 2-литио-1,3-дитианы ( RCLiS 2 C 3 H 6 ) долгоживущие.
1,3-Дитиоланы подвержены множеству процессов разложения с участием металлоорганических реагентов, приводящих к образованию других сераорганических соединений. [ 2 ] [ 3 ]
Ссылки
[ редактировать ]- ^ Тойбер, Лене (1990). «Природные 1,2-дитиоланы и 1,2,3-тритианы. Химические и биологические свойства». Отчеты о сере . 9 (4): 257–333. дои : 10.1080/01961779008048732 .
- ^ Jump up to: а б Ни, Чжи-Цзе; Лух, Тянь-Яу (1992). «Никель-катализируемое силилолефинирование аллильных дитиоацеталей: (E,E)-триметил(4-фенил-1,3-бутадиенил)силан». Органические синтезы . 70 : 240. дои : 10.15227/orgsyn.070.0240 .
- ^ Jump up to: а б Уилсон, СР; Георгиадис, генеральный менеджер (1983). «Меркаптаны из тиокеталей: циклододецилмеркаптан». Органические синтезы . 61 : 74. дои : 10.15227/orgsyn.061.0074 .
- ^ Данке, Карл Р.; Пакетт, Лео А. (1993). «2-Метилен-1,3-Дитиолан». Органические синтезы . 71 : 175. дои : 10.15227/orgsyn.071.0175 .
- ^ Вутс, PGM; Грин, ТВ (2006). Защитные группы Грина в органическом синтезе . Нью-Йорк: Дж. Уайли. дои : 10.1002/0470053488 . ISBN 9780470053485 . S2CID 83393227 .
- ^ Банерджи, Аджой К.; Лайя, М.С. (2000). «Реагенты для получения и расщепления 1,3-дитиоланов». Российское химическое обозрение . 69 (11): 947–955. Бибкод : 2000RuCRv..69..947B . дои : 10.1070/rc2000v069n11abeh000583 . S2CID 250918297 .