Белок, индуцирующий сборку актина
| Белок, индуцирующий сборку актина | |||
|---|---|---|---|
 Комплекс домен EVH1-пептид ActA | |||
| Идентификаторы | |||
| Символ | АктА | ||
| ген NCBI | 2798121 | ||
| ЮниПрот | P33379 | ||
| |||
Белок , индуцирующий сборку актина ( ActA ), представляет собой белок, кодируемый и используемый Listeria monocytogenes для продвижения через клетку-хозяина млекопитающего. ActA представляет собой бактериальный поверхностный белок, содержащий трансмембранную область. [ 1 ] В клетках млекопитающих бактериальный ActA взаимодействует с комплексом Arp2/3 и мономерами актина , вызывая полимеризацию актина на поверхности бактерий, образуя хвост актиновой кометы. Ген, кодирующий ActA, называется actA или prtB. [ 2 ]
Введение
[ редактировать ]Как только бактерии L. monocytogenes попадают в организм человека, они интернализуются в клетки кишечного эпителия и быстро пытаются покинуть свою вакуоль интернализации. [ 3 ] [ 4 ] В цитозоле они начинают полимеризовать актин на своей поверхности с помощью белка ActA. Показано, что ActA не только необходим, но и достаточен для индукции подвижности бактерий в отсутствие других бактериальных факторов. [ 5 ]
Открытие
[ редактировать ]ActA был обнаружен путем анализа лецитиназо -отрицательных мутантов Listeria Tn 917-lac из-за фенотипа, согласно которому они не могли распространяться от клетки к клетке. Эти мутантные бактерии по-прежнему выходили из фагосом так же эффективно, как бактерии дикого типа, и размножались внутри инфицированных клеток, но они не были окружены актином, как бактерии дикого типа. Дальнейший анализ показал, что Tn 917-lac вставлен в actA , второй ген оперона. Третий ген этого оперона, plcB , кодирует лецитиназу L. monocytogenes . Чтобы определить, участвуют ли в сборке актина сам actA , plcB или другие совместно транскрибируемые нижестоящие области, были созданы мутации в соответствующих генах. Все мутанты, за исключением мутантов actA, были подобны мутантам дикого типа в отношении ассоциации с F-актином и межклеточного распространения. Комплементация actA восстанавливала фенотип дикого типа у мутантов actA . [ 1 ]
Функция
[ редактировать ]
ActA представляет собой белок, который действует как имитатор белка синдрома Вискотта-Олдрича (WASP), фактора, способствующего нуклеации (NPF), присутствующего в клетках-хозяевах. NPF в клетках млекопитающих рекрутируют и связываются с уже существующим комплексом актин-родственных белков 2 и 3 (комплекс Arp2/3) и индуцируют активирующее конформационное изменение комплекса Arp2/3. [ 6 ] Благодаря этому конформационному изменению NPF инициируют полимеризацию новой актиновой нити под углом 70°, что приводит к образованию характерных Y-разветвленных актиновых структур на переднем крае подвижных клеток. ActA локализуется на старом полюсе бактерии и охватывает как мембрану бактериальной клетки, так и клеточную стенку, латеральная диффузия ингибируется; таким образом, ActA локализуется поляризованно и закрепляется на бактериальной поверхности. Следовательно, полимеризация актина начинается только в этой области поверхности бактерии. [ 7 ] Экспрессия ActA индуцируется только после попадания в клетку-хозяина млекопитающего. [ 8 ]
Сборка актиновых нитей создает силу, которая толкает бактерию в цитоплазму хозяина-млекопитающего вперед. Непрерывной полимеризации актина достаточно для подвижности цитоплазмы и даже для заражения соседних клеток. [ 9 ]
Исследовать
[ редактировать ]Новые данные показывают, что ActA также играет роль в разрушении вакуолей. Делеционный мутант ActA был дефектен в проницаемости вакуоли. Было показано, что участок из 11 аминокислот N-конца кислой области (32-42) важен для разрушения фагосомы . [ 10 ]
Структура
[ редактировать ]Первичный белковый продукт гена actA состоит из 639 аминокислот и включает сигнальный пептид (первые N-концевые 29 аминокислот) и цепь ActA (С-концевые 610 аминокислот). Следовательно, последовательность зрелого белка ActA состоит из 610 аминокислот. ActA имеет молекулярную массу 70 349 Да и представляет собой поверхностный белок. [ 1 ] [ 2 ]
ActA представляет собой нативно развернутый белок, который можно разделить на три функциональных домена (рис. 2): [ 1 ] [ 11 ] [ 12 ]
- N-концевой домен с высоким зарядом: аминокислотные остатки 1–234.
- центральный домен с богатыми пролином повторами: аминокислотные остатки 235-394
- С-концевой домен с трансмембранным доменом: аминокислотные остатки 395-610.
N-концевой домен
[ редактировать ]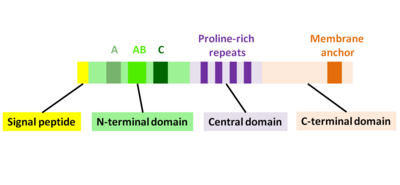
Первые 156 аминокислот N-концевого домена состоят из трех участков. [ 10 ] [ 13 ] (рис. 2):
- А-область с участком кислотных остатков: 32-45
- AB-область, область связывания мономера актина: 59-102.
- C-область, гомологичная последовательность кофилина: 145-156.
N-концевая часть ActA играет важную роль в полимеризации актина. [ 14 ] Домен отображает консенсусные элементы, присутствующие в эукариотических NPF семейства WASP, которые включают область связывания мономера актина, а также область связывания Arp2/3 C (центральную или гомологию кофилина) и A (кислотную) область. [ 7 ] Связывающая мономер актина область ActA имеет функциональные свойства, подобные домену WASP-Homology-2 (WH2) или V, но отличается последовательностью. [ 15 ] Таким образом, в NPF семейства WASP домены имеют следующий порядок: WH2, за которым следует C, а затем A, чего нет в ActA.
Центральный домен
[ редактировать ]Центральная богатая пролином область ActA имеет решающее значение для обеспечения эффективной подвижности бактерий. Существует четыре богатых пролином повторов, содержащих мотивы FPPPP или FPPIP. Эти области имитируют области цитоскелетного белка зиксина , винкулина и палладина клетки-хозяина , которые, как известно, связаны с фокальными спайками или стрессовыми волокнами. [ 16 ] Стимулируемый сосудорасширяющими средствами фосфопротеин ( VASP ) может связываться через свой домен гомологии Ena/VASP 1 ( домен EVH1 ) с центральной богатой пролином областью и рекрутировать профилин , белок, связывающий мономер актина, который сам по себе способствует полимеризации на зазубренных концах актиновых нитей. Более того, VASP, по-видимому, взаимодействует с F-актином через свой карбокси-концевой домен EVH2, который обеспечивает связь бактерии с хвостом. [ 17 ] Это утверждение подтверждается тем фактом, что ActA может связывать несколько белков Ena/VASP одновременно и имеет высокое сродство между ActA и Ena/VASP. Было показано, что VASP снижает частоту актин-Y-ветвей in vitro и, таким образом, увеличивает долю филаментов, которые организованы параллельно в хвостах комет. [ 18 ] [ 19 ]
С-концевой домен
[ редактировать ]С-концевой домен ActA имеет гидрофобную область, которая закрепляет белок в бактериальной мембране. [ 20 ] [ 21 ] [ 22 ]
Подводя итог, кроме того
- отсутствие гомологии последовательностей в актин-связывающей области и
- изменение последовательности активирующих доменов ARP2/3, типичное для NPF семейства WASP (V(WH2)-CA),
- Основное различие между ActA и NPF хозяина заключается в том, что ActA не имеет элементов, которые связываются с регуляторными белками, такими как GTPases семейства Rho. Это структурное различие между ActA и NPF хозяина может быть полезным для L. monocytogenes и его патогенеза, поскольку активность нуклеации актина L. monocytogenes не зависит от регуляции хозяина. [ 7 ]
Аналоги
[ редактировать ]WASP/N-WASP, функционально имитирующий ActA, высоко консервативен у эукариот. Он является важным организатором актин-цитоскелета и имеет решающее значение для таких процессов, как эндоцитоз и подвижность клеток. Активируемый Cdc42 , небольшой ГТФазой семейства Rho, WASP/N-WASP активирует комплекс Arp2/3, что приводит к быстрой полимеризации актина. [ 23 ]
Актиновая подвижность других патогенов
[ редактировать ]У шигелл белок IcsA активирует N-WASP , который в неинфицированных клетках млекопитающих активируется ГТФазой Cdc42. Активный N-WASP/WASP приводит к полимеризации актина путем активации комплекса Arp2/3. Напротив, белок Listeria ActA взаимодействует и непосредственно активирует комплекс Arp2/3. [ 7 ]
Белок Rickettsia RickA также способен активировать комплекс Arp2/3 аналогично WASP. В отличие от Listeria актиновые нити организованы в длинные неразветвленные параллельные пучки. Комплекс Arp2/3 локализован только вблизи бактериальной поверхности, поэтому предполагается, что происходит более частое независимое от комплекса Arp2/3 удлинение. [ 16 ]
У Burkholderia pseudomallei BimA инициирует полимеризацию актина in vitro. Предполагается, что внутриклеточная миграция этой бактерии осуществляется независимо от комплекса Arp2/3. [ 16 ]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б с д Кокс К., Гуэн Э., Табуре М., Берш П., Охайон Х., Коссарт П. (февраль 1992 г.). «Сборка актина, индуцированная L. monocytogenes, требует продукта гена actA, поверхностного белка». Клетка . 68 (3): 521–31. дои : 10.1016/0092-8674(92)90188-I . ПМИД 1739966 . S2CID 27231730 .
- ^ Jump up to: а б Юнипрот P33379
- ^ Коссарт П., Сансонетти П.Дж. (апрель 2004 г.). «Бактериальная инвазия: парадигмы энтероинвазивных патогенов». Наука . 304 (5668): 242–8. Бибкод : 2004Sci...304..242C . дои : 10.1126/science.1090124 . ПМИД 15073367 . S2CID 34536253 .
- ^ Коссарт П., Писарро-Серда Х., Лекуит М. (январь 2003 г.). «Инвазия Listeria monocytogenes в клетки млекопитающих: функциональная мимикрия для подрыва клеточных функций». Тенденции в клеточной биологии . 13 (1): 23–31. дои : 10.1016/S0962-8924(02)00006-5 . ПМИД 12480337 .
- ^ Зигмонд С.Х. (февраль 2004 г.). «Формин-индуцированное зарождение актиновых нитей». Современное мнение в области клеточной биологии . 16 (1): 99–105. дои : 10.1016/j.ceb.2003.10.019 . ПМИД 15037312 .
- ^ Голи Э.Д., Роденбуш С.Е., Мартин А.К., Уэлч, доктор медицинских наук (октябрь 2004 г.). «Критические конформационные изменения в комплексе Arp2/3 индуцируются нуклеотидом и фактором, способствующим нуклеации» . Молекулярная клетка . 16 (2): 269–79. doi : 10.1016/j.molcel.2004.09.018 . ПМИД 15494313 .
- ^ Jump up to: а б с д Гуэн Э., Уэлч, доктор медицинских наук, Коссарт П. (февраль 2005 г.). «Актиновая подвижность внутриклеточных патогенов». Современное мнение в микробиологии . 8 (1): 35–45. дои : 10.1016/j.mib.2004.12.013 . ПМИД 15694855 .
- ^ Рафельски С.М., Териот Дж.А. (февраль 2006 г.). «Механизм поляризации поверхностного белка ActA Listeria monocytogenes» . Молекулярная микробиология . 59 (4): 1262–79. дои : 10.1111/j.1365-2958.2006.05025.x . ПМЦ 1413586 . ПМИД 16430699 .
- ^ Гольдберг М.Б. (декабрь 2001 г.). «Актиновая подвижность внутриклеточных микробных патогенов» . Обзоры микробиологии и молекулярной биологии . 65 (4): 595–626. дои : 10.1128/MMBR.65.4.595-626.2001 . ПМК 99042 . ПМИД 11729265 .
- ^ Jump up to: а б Пуссен М.А., Голдфайн Х. (январь 2010 г.). «Доказательства участия ActA в созревании фагосомы Listeria monocytogenes» . Клеточные исследования . 20 (1): 109–12. дои : 10.1038/cr.2009.142 . ПМК 2802179 . ПМИД 20029388 .
- ^ Иретон К., Коссарт П. (1997). «Взаимодействие хозяина и патогена во время проникновения и актинового движения Listeria monocytogenes». Ежегодный обзор генетики . 31 : 113–38. дои : 10.1146/annurev.genet.31.1.113 . ПМИД 9442892 .
- ^ Нижний колонтитул MJ, Лио Дж.К., Териот Дж.А. (29 августа 2008 г.). «Тесная упаковка Listeria monocytogenes ActA, нативного развернутого белка, усиливает сборку F-актина без димеризации» . Журнал биологической химии . 283 (35): 23852–23862. дои : 10.1074/jbc.M803448200 . ISSN 0021-9258 . ПМК 2527104 . ПМИД 18577520 .
- ^ Уэлч, доктор медицины (2007). «Актиновая подвижность и межклеточное распространение Listeria monocytogenes». В Goldfine H, Shen H (ред.). Listeria monocytogenes: Патогенез и реакция хозяина . Нью-Йорк: Спрингер. стр. 197–223. дои : 10.1007/978-0-387-49376-3_10 . ISBN 978-0-387-49373-2 .
- ^ Уэлч, доктор медицинских наук, Розенблатт Дж., Скобл Дж., Портной Д.А., Митчисон Т.Дж. (июль 1998 г.). «Взаимодействие комплекса Arp2/3 человека и белка ActA Listeria monocytogenes при зарождении актиновых филаментов». Наука . 281 (5373): 105–8. Бибкод : 1998Sci...281..105W . дои : 10.1126/science.281.5373.105 . ПМИД 9651243 .
- ^ Залевский Дж., Григорова И., Маллинз Р.Д. (февраль 2001 г.). «Активация комплекса Arp2/3 белком Listeria acta. Acta связывает два мономера актина и три субъединицы комплекса Arp2/3» . Журнал биологической химии . 276 (5): 3468–75. дои : 10.1074/jbc.M006407200 . ПМИД 11029465 .
- ^ Jump up to: а б с Ламбрехтс А., Геварт К., Коссарт П., Вандекеркхове Дж., Ван Тройс М. (май 2008 г.). «Хвосты комет Listeria: механизм движения на основе актина в действии». Тенденции в клеточной биологии . 18 (5): 220–7. дои : 10.1016/j.tcb.2008.03.001 . ПМИД 18396046 .
- ^ Лоран В., Луазель Т.П., Харбек Б. и др. (март 1999 г.). «Роль белков семейства Ena/VASP в актиновой подвижности Listeria monocytogenes» . Журнал клеточной биологии . 144 (6): 1245–58. дои : 10.1083/jcb.144.6.1245 . ПМК 2150578 . ПМИД 10087267 .
- ^ Скобл Дж., Ауэрбух В., Голи Э.Д., Уэлч М.Д., Портной Д.А. (октябрь 2001 г.). «Основная роль VASP в опосредованном комплексом Arp2/3 нуклеации актина, формировании актиновых ветвей и подвижности Listeria monocytogenes» . Журнал клеточной биологии . 155 (1): 89–100. дои : 10.1083/jcb.200106061 . ПМК 2150787 . ПМИД 11581288 .
- ^ Беар Дж.Э., Свиткина Т.М., Краузе М. и др. (май 2002 г.). «Антагонизм между белками Ena/VASP и покрытием актиновых нитей регулирует подвижность фибробластов». Клетка . 109 (4): 509–21. дои : 10.1016/S0092-8674(02)00731-6 . hdl : 1721.1/83477 . ПМИД 12086607 . S2CID 2848293 .
- ^ Васкес-Боланд Дж.А., Кокс С., Драмси С. и др. (январь 1992 г.). «Нуклеотидная последовательность лецитиназного оперона Listeria monocytogenes и возможная роль лецитиназы в распространении от клетки к клетке» . Инфекция и иммунитет . 60 (1): 219–30. дои : 10.1128/iai.60.1.219-230.1992 . ПМК 257526 . ПМИД 1309513 .
- ^ Доманн Э., Веланд Дж., Роде М. и др. (май 1992 г.). «Новый ген бактериальной вирулентности в Listeria monocytogenes, необходимый для взаимодействия микрофиламентов клеток-хозяев, гомологичен богатому пролином участку винкулина» . Журнал ЭМБО . 11 (5): 1981–90. дои : 10.1002/j.1460-2075.1992.tb05252.x . ПМК 556658 . ПМИД 1582425 .
- ^ Кокс К., Хеллио Р., Гунон П., Охайон Х., Коссарт П. (июль 1993 г.). «Поляризованное распределение поверхностного белка ActA Listeria monocytogenes в месте направленной сборки актина» . Журнал клеточной науки . 105 (3): 699–710. дои : 10.1242/jcs.105.3.699 . ПМИД 8408297 .
- ^ Курису С., Такенава Т. (2009). «Белки семейства WASP и WAVE» . Геномная биология . 10 (6): 226. doi : 10.1186/gb-2009-10-6-226 . ПМК 2718491 . ПМИД 19589182 .
Внешние ссылки
[ редактировать ]- Видео на YouTube от Nature , Listeria monocytogenes [2:00–4:12]